Оптимизация среды культивирования амидазосодержащих бактерий
Автор: Максимова Ю.Г., Гарина А.А., Васильев Д.М., Максимов А.Ю.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Изучены ростовые характеристики грамотрицательных амидазосодержащих бактерий штаммов Acineto-bacter guillouiae llh, Pseudomonas monteilii 5, Alcaligenes faecalis 2 при культивировании на среде с различными концентрациями глюкозы, сахарозы, ацетамида и ацетата натрия в качестве источника углерода. Цель работы - оптимизация синтетической минеральной среды по источнику углерода. Определено, что наилучшим субстратом роста для проявления амидазной активности штаммов является ацетамид, причем по совокупности таких характеристик, как урожай биомассы, экономический коэффициент потребления субстрата и ферментативная активность; оптимальной концентрацией ацетамида для A. guillouiae llh является 0.025 М, для A. faecalis 2 - 0.1М. Изучена динамика роста A. faecalis 2 на ацета-миде в различных концентрациях. Показано, что концентрация ацетамида 0.025 М была недостаточной для интенсивного роста бактерий, а 0.5 М - ингибирующей.
Амидазная активность, урожай биомассы, экономический коэффициент потребления субстрата, культивирование
Короткий адрес: https://sciup.org/147204824
IDR: 147204824 | УДК: 579.24
Текст научной статьи Оптимизация среды культивирования амидазосодержащих бактерий
ем R -продукта [Nojiri, Taoka, Yasohara, 2014]. Ацилтрансферазная активность амидаз требуется главным образом для синтеза востребованных в фармацевтической промышленности гидроксамовых кислот [Fournand, Bigey, Arnaud, 1998; Bhatia et al., 2014].
Одним из путей получения больших количеств высокоактивной амидазы является клонирование и сверхэкспрессия гена этого фермента, как это было сделано для гена энантиоселективной амидазы из Klebsiella oxytoca KCTC 1686, клонированного в Escherichia coli [Guo et al., 2015], для трех амидаз семейства сигнатурных амидаз ("signature amidase" ) из Delftia tsuruhatensis ZJB-05174, гены которых были клонированы в E. coli JM109 [Wu, Zheng, Zheng, 2016], для гена амидазы Parvibaculum lavamentivorans ZJB14001, клонированного в E. coli BL21 [Wu, Zheng, Zheng, 2017], однако до сих пор наиболее распространенной остается традиционная технология скрининга природных источников с последующей селекцией активных штаммов микроорганизмов и подбором условий их выращивания. Для получения активного биокатализатора необходима разработка и оптимизация сред культивирования. В случае минеральной синтетической среды важен обоснованный выбор предпочтительных источников углерода и азота, при введении которых в среду будет получена максимально возможная биомасса с требуемой ферментативной активностью. Для Alcaligenes de-nitrificans – нитрилутилизирующих бактерий с нитрилазной активностью, оптимизированная среда культивирования включала 10 г/л ацетата аммония в качестве источника углерода и азота и кукурузный экстракт в качестве питательной добавки [Полтавская и др., 2004]. При промышленном производстве штамма-продуцента высокоактивной нитрилгидратазы Rhodococcus rhodochrous M33 двустадийная система культивирования на глюкозе и ацетате позволила получить биокатализатор с активностью свыше 5000 ед/мл [Дебабов, Яненко, 2011]. Бактериальные клетки с активной амидазой также являются перспективным биокатализатором, что обусловливает интерес к поиску новых штаммов и интенсификации процесса их выращивания.
В связи с вышеизложенным, целью настоящей работы явилась оптимизация по углеродному субстрату минеральной среды культивирования штаммов грамотрицательных бактерий, обладающих амидазной активностью.
Материалы и методы исследования
Штаммы грамотрицательных бактерий A. guillouiae 11h, P. monteilii 5, A. faecalis 2, изолированные из активного ила биологических очистных сооружений г. Перми [Демаков и др., 2015], культивировали на жидкой минеральной среде, содержащей (г/л): KH 2 PO 4 – 1.0; K 2 HPO 4 ×3H 2 O – 1.6; NaCl – 0.5; MgSO 4 ×7H 2 O – 0.5, CaCl 2 – 0.005; FeSO 4 ×7H 2 O – 0.01;
FeSO 4 ×7H 2 O – 0.01; CoCl 2 ×6H 2 O – 0.01, рН 7.2±0.2. Оптимизацию ростовой среды проводили по источнику углерода. В среду асептически добавляли один из источников углерода: глюкозу, сахарозу, ацетамид, ацетат натрия в концентрации 0.025, 0.05, 0.1, 0.5, 1 М. Ацетамид являлся также и источником азота, в остальных случаях таковым служил 0.01 М хлорид аммония.
Культивирование проводили в колбах Эрлен-мейера объемом 100 мл в 20 мл минеральной среды в течение 7 дней при температуре 25ºС на шейкере со скоростью перемешивания 140 об/мин.
Биомассу центрифугировали 10 мин при 13 000 об/мин, высушивали до постоянного веса, взвешивали на аналитических весах и определяли урожай клеток, который выражали в мг АСБ/мл.
Реакцию трансформации 100 мМ раствора акриламида проводили в калий-фосфатном буфере (рН 7.2±0.2) в течение 1 ч при 25ºС, реакцию останавливали добавлением концентрированной HCl до конечной концентрации 5%. Концентрацию акриловой кислоты в реакционной смеси определяли методом ВЭЖХ [Максимова и др., 2015]. Амидазную активность выражали в мкмоль/мг/мин.
Экономический коэффициент потребления субстрата рассчитывали по формуле: Y = X/C, где Y – экономический коэффициент, X – количество образовавшейся биомассы (масса сухих клеток в мг), C – количество потребленного субстрата в мг [Ждан-Пушкина, 1983].
Кривую роста A. faecalis 2 снимали на планшетном ридере Tecan Infinite M1000 (Tecan, Швейцария) при культивировании на жидкой минеральной среде с 0.025, 0.05, 0.1, 0.5 М ацетамидом в 24-луночном полистероловом планшете (Eppendorf) в течение 76 ч.
Статистическая обработка результатов выполнена с помощью пакета программ Microsoft Excel 2008. Результаты представлены как среднее значение не менее чем трех независимых экспериментов ± стандартная ошибка среднего (M±m, n=3–4).
Результаты и их обсуждение
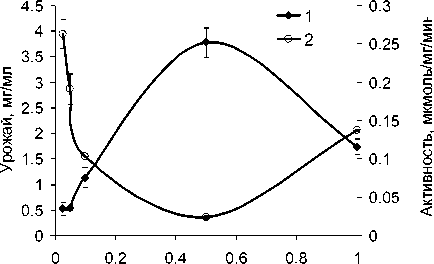
Рост A. guillouiae 11h и A. faecalis 2 наблюдали только на среде с ацетамидом и ацетатом натрия, на глюкозе и сахарозе данные штаммы не росли. Определены урожай, амидазная активность и экономический коэффициент потребления субстрата при росте A. guillouiae 11h и A. faecalis 2 на ацетамиде как наилучшем субстрате роста для этих штаммов (таблица). Показано, что наибольшая активность наблюдается у клеток A. guillouiae 11h, выращенных на 0.025 М ацетамиде (рис. 1) и у A. faecalis 2 на 0.1 М ацетамиде (рис. 2). При этом максимальный урожай был получен при росте A. guillouiae 11h и A. faecalis 2 на среде с 0.5 М ацетамидом. Однако экономический коэффициент потребления субстрата при росте на 0.5 М ацетамиде был невысок и составлял 13 и 22% для A. guillouiae 11h и A. faecalis 2 соответственно.
Нами была показана обратная зависимость между урожаем и амидазной активностью A. guillouiae 11h и A. faecalis 2, что может быть связано со снижением экспрессии оперона, кодирующего нитрилгидратазу и амидазу, в условиях активного роста. Эти данные согласуются с результатами, полученными при оптимизации среды культивирования амидазосодержащего штамма Geobacillus subterraneus RL-2a, когда при росте на сахарозе, крахмале, фруктозе, мальтозе, галактозе, маннитоле повышенный урожай биомассы сочетался со снижением амидазной активности, а арабиноза, ацетат и цитрат натрия в среде культивирования приводили к повышению амидазной активности штамма в сочетании с низким урожаем [Mehta et al., 2016].
P. monteilii 5 использовал как источник энергии простые сахара, ацетамид и ацетат натрия. Показано, что в данном случае оптимальным источником углерода являлась глюкоза в концентрации 0.025 М, при которой урожай и активность были сопоставимы, а экономический коэффициент наибольший (рис. 3). Только при росте P. monteilii 5 на 0.5 и 1 М ацетамиде наблюдали амидазную активность, на порядок и более превышающую таковую при росте на глюкозе, но в данном случае экономический коэффициент потребления субстрата был очень мал (таблица).
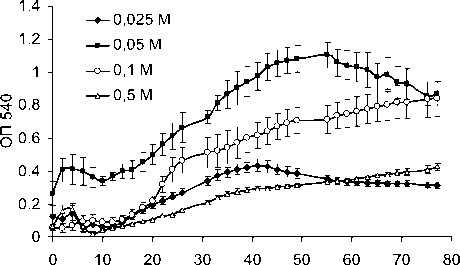
Изучали динамику роста A. faecalis 2 на ацетамиде в различных концентрациях. Было показано, что 0.05 М ацетамид обеспечивал наибольший прирост биомассы с лаг-фазой, составляющей 10 ч, и длительной логарифмической фазой, наблюдавшейся до 50 ч роста, после чего происходило постепенное снижение оптической плотности (рис. 4). Скорость роста в лог-фазе составляла 0.019 ч-1. При росте на 0.1 М ацетамиде лог-фаза была более короткая – 10 ч со скоростью роста 0.033 ч-1. После 26 ч роста оптическая плотность медленно нарастала, при этом скорость роста составила 0.007
ч-1. Концентрация ацетамида 0.025 М была недостаточной для интенсивного роста бактерий, а 0.5 М – ингибирующей.
Концентрация ацетамида, М
Рис. 1 . Зависимость урожая биомассы (1) и амидазной активности (2) A. guillouiae 11h от концентрации ацетамида в среде культивирования
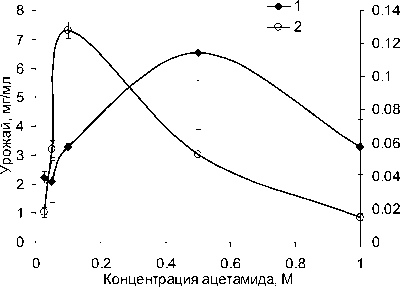
Рис. 2 . Зависимость урожая биомассы (1) и амидазной активности (2) A. faecalis 2 от концентрации ацетамида в среде культивирования
Ростовые характеристики и амидазная активность штаммов в зависимости от источника углерода в среде культивирования
|
Источник углерода, М |
Урожай, мг/мл |
Экономический коэффициент потребления субстрата, % |
Амидазная активность, мкмоль/мг/мин |
A. guillouiae 11h, рост на ацетамиде
|
0.025 |
0.52±0.13 |
38.3±15.9 |
0.263±0.019 |
|
0.050 |
0.54±0.05 |
19.0±3.1 |
0.191±0.020 |
|
0.100 |
1.14±0.19 |
20.5±5.8 |
0.103±0.000 |
|
0.500 |
3.78±0.29 |
13.1±1.2 |
0.024±0.002 |
|
1.000 |
1.74±0.15 |
2.9±0.4 |
0.138±0.001 |
P. monteilii 5, рост на глюкозе
|
0.025 |
0.98±0.33 |
21.7±7.2 |
0.060±0.030 |
|
0.050 |
0.70±0.20 |
7.8±2.2 |
0.041±0.006 |
|
0.100 |
0.65±0.10 |
3.6±0.6 |
0.031±0.002 |
|
0.500 |
1.63±0.08 |
1.8±0.1 |
0.040±0.003 |
|
1.000 |
1.63±0.08 |
0.9±0.0 |
0.041±0.004 |
Окончание таблицы
|
Источник углерода, М |
Урожай, мг/мл |
Экономический коэффициент потребления субстрата, % |
Амидазная активность, мкмоль/мг/мин |
P. monteilii 5, рост на ацетамиде
|
0.500 |
0.45±0.15 |
1.5±0.5 |
1.041±0.022 |
|
1.000 |
1.63±0.03 |
2.8±0.0 |
0.608±0.050 |
A. faecalis 2, рост на ацетамиде
|
0.025 |
2.23±0.20 |
150.8±13.4 |
0.018±0.003 |
|
0.050 |
2.08±0.72 |
70.3±24.4 |
0.056±0.005 |
|
0.100 |
3.28±0.11 |
55.5±1.9 |
0.128±0.005 |
|
0.500 |
6.53±0.97 |
22.1±3.3 |
0.053±0.015 |
|
1.000 |
3.28±0.96 |
5.6±1.6 |
0.015±0.002 |
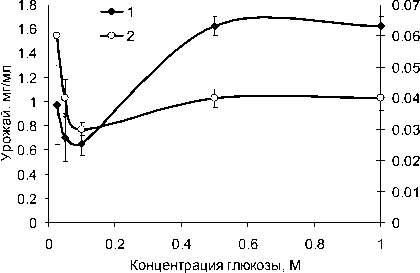
Рис. 3 . Зависимость урожая биомассы (1) и амидазной активности (2) P. monteilii 5 от концентрации глюкозы в среде культивирования
Время, ч
Рис. 4 . Рост A. faecalis 2 на жидкой минеральной среде с ацетамидом
По данным научной литературы, амидазы могут быть как конститутивными [Egorova et al., 2004; Prasad, Sharma, Bhalla, 2005], так и индуци-бельными ферментами [Sharma, Sharma, Bhalla, 2009], причем в качестве индукторов могут выступать акриламид, ацетамид, изобутирамид, кето-профенамид, пропионамид и некоторые нитрилы. Нами было показано, что для проявления амидазной активности штаммов A. faecalis 2, A. guillouiae 11h и P. monteilii 5 необходимо присутствие ацетамида в ростовой среде, который является одновременно и субстратом роста, и индуктором. Данный факт подтверждает индуцибельный характер амидазной активности изученных штаммов. По совокупности ростовых характеристик, включающих урожай, активность амидазы и экономический коэффициент потребления субстрата, оптимальной концентрацией ацетамида для A. guillouiae 11h является 0.025 М, для A. faecalis 2 – 0.1М.
Заключение
Таким образом, максимальная биомасса (2.08– 6.53 мг/мл) была получена при росте A. faecalis 2 на 0.025–1 М ацетамиде, максимальная амидазная активность (0.6–1 мкмоль/мг/мин) при росте P. monteilii 5 на 0.5–1 М ацетамиде, наилучшие показатели экономического коэффициента (55.5– 150.8%) при росте A. faecalis 2 на 0.025–0.1 М ацетамиде. По литературным данным, активность ациламидазы из Rhodococcus erythropolis ТА37 по акриламиду составляла 0.35 мкмоль/мг/мин [Лавров и др., 2010], максимальная амидазная активность G. subterraneus RL-2a на оптимизированной среде – 0.6 мкмоль/мг/мин [Mehta et al., 2016], амидазная активность рекомбинантного штамма E. coli JM109 по акриламиду – 3.7 мкмоль/мг/мин [Wu, Zheng, Zheng, 2016]. Следовательно, изученные нами штаммы не уступают описанным аналогам и имеют перспективу использования как для биокаталитических целей, так и для целей биодеградации и очистки окружающей среды.
A. guillouiae и A. faecalis по российской классификации (СП 1.3.3118-13) не входят в группу опасных патогенов, но по европейской классификации (2000/54/ЕС) относятся к группе риска 2, что накладывает некоторые ограничения на практическое использование этих штаммов и требует в дальнейшем проведения тестов, доказывающих отсутствие у них вирулентности.
Список литературы Оптимизация среды культивирования амидазосодержащих бактерий
- Дебабов В.Г., Яненко А.С. Биокаталитический гидролиз нитрилов//Обзорный журнал по химии. 2011. Т. 1, № 4. С. 376-394
- Демаков В.А. и др. Бактерии активного ила биологических очистных сооружений, трансформирующие цианопиридины и амиды пиридинкарбоновых кислот//Микробиология. 20l5. Т. 84, № 3. С. 369-378.
- Ждан-Пушкина С.М. Основы роста культур микроорганизмов: учеб. пособие/под ред. В.П. Гончаровой. Л.: Изд-во Ленингр. ун-та, l983. l88 с
- Лавров К.В. и др. Новая ациламидаза из Rhodococ-cus erythropolis ТА37, способная гидролизовать N-замещенные амиды//Биохимия. 2010. Т. 75, вып. 8. С. 1111-1119.
- Максимова Ю.Г. и др. Трансформация амидов ад-гезированными клетками родококков, обладающими амидазной активностью//Прикладная биохимия и микробиология. 20l5. Т. 5l, № l. С. 53-58
- Перцович С.И. и др. Алифатическая амидаза из Rhodococcus rhodochrous -представитель семейства нитрилаз/цианидгидратаз//Биохимия. 2005. Т. 70, № ll. С. l556-l565
- Полтавская С.В. и др. Разработка и внедрение биокаталитического способа получения акриловой кислоты. I. Выделение штамма Alcaligenes denitrificans, трансформирующего акрилонит-рил в акрилат аммония. Оптимизация среды культивирования//Биотехнология. 2004. № l. С. 62-70
- Banerjee A., Sharma R., Banerjee U.C. The nitrile degrading enzymes: current status and future prospects//Applied Microbiology and Biotechnology. 2002. Vol. 60. P. 33-44
- Bhatia R.K. et al. Biotransformation of nicotinamide to nicotinyl hydroxamic acid at bench scale by amidase acyl transfer activity of Pseudomonas putida BR-l//Journal of Molecular Catalysis B: Enzymatic. 20l4. Vol. l08. P. 89-95
- Cantarella M. et al. Amidase-catalyzed production of nicotinic acid in batch and continuous stirred membrane reactors//Enzyme and Microbial Technology. 2008. Vol. 42. P. 222-229
- Egorova K. et al. Purification and properties of an enantioselective and thermoactive amidase from the thermophilic actinomycete Pseudonocardia thermophila//Applied Microbiology and Biotechnology. 2004. Vol. 65. P. 38-45
- Fournand D., Bigey F., Arnaud A. Acyl transfer activity of an amidase from Rhodococcus sp. strain R3l2: formation of a wide range of hydroxamic acids//Applied and Environmental Microbiology. l998. Vol. 64. P. 2844-2852
- Guo F.-M. et al. Soluble and functional expression of a recombinant enantioselective amidase from Klebsiella oxytoca KCTC l686 in Escherichia coli and its biochemical characterization//Process Biochemistry. 20l5. Vol. 50. P. l264-l27l
- Jebasingh S.E.J. et al. Biodegradation of acrylamide and purification of acrylamidase from newly isolated bacterium Moraxella osloensis MSUll//International Biodeterioration & Biodegradation. 20l3. Vol. 85. P. l20-l25
- Jin L.-Q. et al. Efficient biocatalytic hydrolysis of 2-chloronicotinamide for production of 2chloronicotinic acid by recombinant amidase//Catalysis Communications. 20l3. Vol. 38. P. 6-9
- Mehta P.K. et al. Thermostable amidase catalyzed production of isonicotinic acid from isonicotina-mide//Process Biochemistry. 20l5. Vol. 50. P. l400-l404
- Mehta P.K. et al. Enhanced production of thermostable amidase from Geobacillus subterraneus RL-2a MTCC ll502 via optimization of physicochemi-cal parameters using Taguchi DOE methodology//3 Biotech. 20l6. Vol. 6. P. 66
- Nojiri M., Taoka N., Yasohara Y. Characterization of an enantioselective amidase from Cupriavidus sp. KNK-J9l5 (FERM BP-l0739) useful for enzymatic resolution of racemic 3-piperi-dinecarboxamide//Journal of Molecular Catalysis B: Enzymatic. 20l4. Vol. l09. P. l36-l42
- Prasad S., Sharma D.R., Bhalla T.C. Nitrile-and amide hydrolysing activity in Kluyveromyces thermo-tolerans MGBY 37//World Journal of Microbiology and Biotechnology. 2005. Vol. 2l. P. l447-l450
- Ruan L.-T. et al. Purification and characterization of R-stereospecific amidase from Brevibacterium epidermidis ZJB-0702l//International Journal of Biological Macromolecules. 20l6. Vol. 86. P. 893-900
- Sharma M., Sharma N.N., Bhalla T.C. Amidases: versatile enzymes in nature//Reviews in Environmental Science and Bio/Technology. 2009. Vol. 8. P. 343-366
- Wu Z.-M., Zheng R.-C., Zheng Y.-G. Exploitation and characterization of three versatile amidase super-family members from Delftia tsuruhatensis ZJB-05l74//Enzyme and Microbial Technology. 20l6. Vol. 86. P. 93-l02
- Wu Z.-M., Zheng R.-C., Zheng Y.-G. Identification and characterization of a novel amidase signature family amidase from Parvibaculum lavamen-tivorans ZJBl400l//Protein Expression and Purification. 20l7. Vol. l29. P. 60-68
- Zheng R.-C. et al. Industrial production of chiral intermediate of cilastatin by nitrile hydratase and amidase catalyzed one-pot, two-step biotransfor-mation//Journal of Molecular Catalysis B: Enzymatic. 20l4. Vol. l02. P. l6l-l66


