Оптимизация условий проведения металл-аффинной хроматографии для выделения фосфонилированных пептидов
Автор: Дубровский Ярослав Александрович, Мурашко Е.А., Подольская Е.П., Бабаков В.Н., Краснов Н.В., Радилов А.С.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Использование и методики высокотехнологичных измерений
Статья в выпуске: 3 т.23, 2013 года.
Бесплатный доступ
В статье представлена оптимизация процедуры проведения металл-аффинной хроматографии на сорбенте, содержащем ионы Ti (IV) (Supel-Tips Ti) для выделения фосфонилированных пептидов из гидролизата сывороточного альбумина, инкубированного с зарином. Показано, что изменение условий, рекомендованных производителем, а именно: сорбции из щелочной среды вместо кислой и элюировании 0.1 % ТФУ в 60 % ацетонитриле вместо 0.5 % водного раствора пиперидина, приводит к более эффективному выделению фосфонилированных пептидов из образцов.
Малди, ионная ловушка, сывороточный альбумин, фосфопротеомика, зарин, фосфорорганические вещества
Короткий адрес: https://sciup.org/14264869
IDR: 14264869 | УДК: 621.384.668.8:
Текст научной статьи Оптимизация условий проведения металл-аффинной хроматографии для выделения фосфонилированных пептидов
ВВЕДЕНИЕ Хроматографию off-line с использованием ок-
Определение сайтов фосфорилирования белков является основной задачей фосфопротеомики. Для решения поставленной задачи наиболее мощным инструментом является масс-спектрометрия с мягкими методами ионизации в тандеме с различными видами хроматографии.
В процессе подготовки образцов для масс-спектрометрического анализа чаще всего используют метод обращенно-фазовой хроматографии, позволяющий очистить образец от солей и других мешающих компонентов. К сожалению, такой подход не является специфичным и не позволяет выделить в отдельную фракцию пептиды с определенными посттрансляционными модификациями, например фосфорилированные пептиды. В последнее время альтернативой для выделения таких пептидов становится металл-аффинная хроматография. Выделяют два основных вида: хроматография на стационарных фазах с иммобилизированными ионами металлов (Immobilized Metal Affinity Chromatography, IMAC) и хроматография на кристаллических оксидах металлов (Metal Oxide Affinity Chromatography, MOAC) [1]. И в последнее время именно MOAC вытесняет другие методы пробоподготовки при целенаправленном анализе фосфорилированных пептидов. В качестве сорбента в большинстве работ используют оксид титана (IV) [2]. Наиболее часто MOAC используют в off-line режиме. Такой подход позволяет проводить последующий анализ как с помощью метода ВЭЖХ-МС так и МАЛДИ масс-спектрометрии.
сидов металлов можно реализовать в нескольких вариантах [3].
-
• Сорбент (оксид металла) помещают в наконечник от автоматического дозатора, в результате получается микроколонка. После этого с помощью автодозатора производится промывка, сорбция и элюирование. В настоящий момент на рынке доступно большое количество коммерческих сорбентов.
-
• Использование batch хроматографии. В таком случае сорбент помещают в микропробирку и инкубируют после внесении образца. С помощью центрифугирования сорбент отделяют от супернатанта.
В области медицинского обеспечения процесса уничтожения химического оружия, актуальной является проблема выявления воздействия отравляющих веществ. Значение данной проблемы усиливается масштабностью процесса уничтожения химического оружия, что предполагает вовлечение большого контингента лиц, профессионально задействованных в обеспечении работ на объектах хранения и уничтожения химического оружия.
Взаимодействие ФОВ с макромолекулами в организме сопровождается быстрым образованием ковалентной связи между атомом фосфора молекулы ФОВ и активным сайтом серина холинэстераз и целым рядом других белков крови. Установление факта воздействия ФОВ на организм человека при ретроспективном химико-токсикологическом анализе может быть ориентировано на следующий ряд мишеней: ингибирован-ная/фосфонилированная ацетилхолинэстераза (АХЭ); ингибированная/фосфонилированная бути-рилхолинэстераза (БХЭ); свободные ФОВ; продукты гидролиза ФОВ; фосфонилированный сывороточный альбумин [4].
Нами ранее был предложен способ последовательного обогащения сывороточного альбумина из плазмы или сыворотки крови и пептидов, модифицированных фосфорорганическим соединением параоксоном с использованием метода металл-аффинной хроматографии и последующей масс-спектрометрической идентификации пептида [5].
Цель данной работы — адаптация методов фосфопротеомики для обогащения и дальнейшей идентификации ковалентного аддукта зарина с сывороточным альбумином человека из образцов плазмы или сыворотки крови человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и материалы . Ацетонитрил, трифторуксусная кислота, муравьиная кислота, пепсин (proteomic grade), бикарбонат аммония, α -циано-4-гидроксикоричная кислота, этилацетат ( Sigma-Aldrich, США) , соляная кислота (Вектон, Санкт-Петербург), деионизированная вода (18.2 МОм, Millipore, США).
Аппаратура. Времяпролетный масс-спектрометр MALDI-TOF-TOF Axima Perfomance ( Shimadzu/Kratos Analytical , Великобритания), жидкостный хроматограф Infinity 1290 ( Agilent Technologies , США), ионная ловушка amaZon ETD ( Bruker Daltonik GmbH , Германия) твердотельный термостат ( Eppendorf, Германия ).
Выделение сывороточного альбумина из плазмы крови человека. Для ингибирования протеаз к 100 мл донорской плазмы крови прилили 0.8 мл 0.25 М раствора ЭДТА. Далее к 100 мл плазмы крови при активном перемешивании добавили 16.6 г сульфата аммония, массовая концентрация соли в плазме составила 30 %. Осаждение белков проводили при 4 °С в течение 4 ч. Осадок отделили центрифугированием при 4000 g в течение 20 мин, а к супернатанату для достижения 70 % насыщения постепенно при активном перемешивании добавили еще 25.3 г сульфата аммония. Осадок получили центрифугированием при 4000 g в течение 20 мин. Для осаждения альбумина к супернатанту добавили шестикратный объем холодного этанола. Образец оставили на ночь при 4 °С для полного выпадения осадка, надосадочную жидкость слили. Полученный альбумин промыли небольшим объемом холодного этанола и высушили с помощью лиофильной сушки.
Инкубирование выделенного сывороточного альбумина с зарином. К 1 мл раствора белка (1 мг/мл) в 25 мМ аммоний-бикарбонатном буфере добавляли in vitro раствор зарина до конечной концентрации 1, 10 и 100 мкг/мл. Смесь инкубировали в течение 24 ч при 37 °С для полного связывания GB и его частичного гидролиза. Для удаления остатков зарина белок осаждали тройным объемом холодного ацетонитрила. Осадок промывали и перерастворяли в 0.1 % растворе трифторуксусной кислоты (ТФУ) в воде.
Получение пептических гидролизатов сывороточного альбумина . К 100 мкл раствора модифицированного белка (1 мг/мл) добавляли 10 мкл раствора пепсина (0.1 мг/мл) в 0.1 % ТФУ и оставляли в термостате на ночь при 37 °С.
Металл-аффинная хроматография на сорбенте, содержащем ионы титана (IV) Supel-Tips Ti. Применяли для обогащения образца фосфони-лированными пептидами (модифицированными остатком зарина). Микроколонку, содержащую сорбент, промывали водой для уравновешивания микроколонки, наносили образец и промывали водой для удаления остатков солей. Элюирование проводили 60 % раствором ацетонитрила в 0.1 % ТФУ.
Нанесение образцов на масс-спектрометрическую мишень. На поверхность мишени смешивали 0.5 мкл раствора матрицы CHCA (5мг/мл, альфа-циано-4-гидроксикоричная кислота) с 0.5 мкл гидролизата и высушивали на воздухе до образования кристаллов.
Масс-спектрометрический анализ проводили с помощью времяпролетного масс-спектрометра Axima Perfomance с источником МАЛДИ, оснащенного УФ-лазером (337 нм), в режиме детектирования положительных ионов с использованием рефлектрона при следующих настройках ионного источника: напряжение — 20 кВ, напряжение на линзах (lens) 6.5 кВ, напряжения на рефлектроне (Ref) — 24.38 кВ. Ионы детектировали в диапазоне m / z от 700 до 5000 Да. Масс-спектры регистрировали при помощи программы Launchpad 2.8.4 MALDI-MS Shimadzu Biotech ( Shimadzu , Япония). Калибровку проводили по масс-спектру смеси пептидов: ангиотензин 2 ( М Н+ 1046.542 Да), ангиотензин 1 ( М Н+ 2296.685 Да), N-ацетил ренин ( М Н+ 1800.943 Да), адренокортикотропный гормон (1-17) ( М Н+ 2093.086 Да).
Обработку полученных МАЛДИ-масс-спектров проводили с помощью программ Launchpad 2.8.4 MALDI-MS Shimadzu Biotech ( Shimadzu , Япония) и MASCOT Distiller ( Matrix Science , Великобритания).
Условия хроматографического разделения . Объем вводимого образца 10 мкл. Колонка Zorbax SB-C18 2.1×150 мм, 3.5 мкм (Agilent, 830990-902). Разделение смеси пептидов гидролизатов белков проводили в градиентном режиме:
0–30 мин от 95 % А : 5 % Б до 50 % А : 50 % Б; 30–50 мин от 50 % А : 50 % Б до 10 % А : 90 % Б; 50–55 мин от 10 % А : 90 % Б до 95 % А : 5 % Б; 55–60 мин 95 % А : 5 % Б.
Скорость потока подвижной фазы 0.2 мл/мин.
Условия масс-спектрометрического детектирования. Выход с колонки был подсоединен к электроспрэйному источнику ионизации. Напряжение на капилляре –4000 В, давление на небу-лайзере 30 psi, скорость осушающего газа 9 л/мин, температура 250 °С. Масс-спектрометр Amazon ETD (Bruker) функционировал в режиме AutoMS(2) — автоматической фрагментации ионов. Данный режим предполагает циклическую работу: на первой стадии цикла происходит получение общего MS-спектра с последующим получением фрагментных спектров наиболее интенсивных родительских ионов. Общий спектр снимался в диапазоне m / z 300–1200 Да. Спектры дочерних ионов снимались для 2 наиболее интенсивных родительских ионов в диапазоне масс от 100 до 1400 Да. Масс-спектры регистрировали при помощи программы trapControl V 7.0 ( Bruker Daltonik GmbH , Германия). Последующую первичную обработку проводили в программе Data-Analysis V 4.0 ( Bruker Daltonik GmbH , Германия)
Идентификацию белков и пептидов проводили с помощью программы MASCOT Distiller ( Matrix Science , Великобритания) и BioTools V 3.2 ( Bruker Daltonik GmbH , Германия) в базах данных SwissProt с использованием стационарного сервера. При этом использовали следующие параметры поиска в программе Mascot MS/MS Ion Search при обработке спектров гидролизата: точность определения массы — 0.1 Да, точность определения фрагментных ионов — 0.8 Да, возможные модификации — GB (Δ М = 120.04 Да).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сывороточный альбумин человека способен образовывать ковалентные аддукты с различными фосфорорганическими отравляющими веществами [6–8]. На первом этапе нашей работы был проведен поиск фосфонилированных пептидов в пептическом гидролизате. В результате было выявлено два сигнала с массами M H+ 1525.8 и 1638.9 Да, отсутствующих в контрольных образцах. С использованием тандемной МАЛДИ-масс-спектрометрии были восстановлены аминокислотные последовательности выявленных пептидов
VRY GB TKKVPQVST и LVRY GB TKKVPQVST (409–420 и 408–420 фрагменты сывороточного альбумина человека соответственно) и установлено, что остаток зарина присоединяется по Y-411.
Следующим этапом стало проведение металл-аффинной хроматографии на сорбенте Supelco Su-pel-Tips Ti для выделения фосфонилированных пептидов в отдельную фракцию по методике, рекомендованной производителем, из пептического гидролизата сывороточного альбумина, инкубированного с зарином, концентрация последнего 0.1 мг/мл. Стандартной методикой для выделения фосфорилированных пептидов является сорбция из кислой среды (чаще всего pH 2) и последующая десорбция щелочными растворами (водным раствором аммиака или пиперидина).
Производитель рекомендует следующие условия проведения анализа [9].
-
• С помощью автодозатора пропустить через микроколонку 10 мкл 3.3 % раствора муравьиной кислоты. Процедуру повторить 3 раза.
-
• В микропробирку поместить 20 мкл раствора, содержащего фосфорилированные пептиды в 3.3 % муравьиной кислоте. Через микроколонку отобрать 10 мкл образца и пропустить обратно; процедуру повторить 9 раз (общее количество циклов 10).
-
• В микропробирку поместить 10 или 20 мкл элюента (0.5 % пиперидина, pH 11.5) и пропустить через колонку 2 раза.
Был проведен эксперимент по рекомендованной методике. Выяснилось, что такой подход имеет ряд недостатков: низкая интенсивность интересующих нас сигналов, необходимость использования большой энергии лазера, наличие мешающих сигналов с массами M H+ более 3000 Да.
Также следует отметить, что 0.5 % пиперидин мешает нормальной сокристаллизации матрицы с аналитом. В результате для проведения удачного МАЛДИ-масс-спектрометрического анализа необходимо провести дополнительную стадию твердофазной экстракции на микроколонке с обращенно-фазовым сорбентом С-18 (Zip-Tip), что приводит к увеличению времени и стоимости анализа.
Возникает необходимость в подборе другого элюента. В работе для элюирования пептидов, модифицированных остатком параоксона, с сорбента, содержащего ионы Fe (III), использовали 0.4 М водный аммиака [5]. Поэтому была проведена металл-аффинная хроматография наших образцов в данных условиях. В элюате 0.4 М гидроксида аммония сигналов с массами M H+ 1525.8 Да и 1638.9 Да обнаружить не удалось.
В ряде работ в качестве элюенте для десорбции фосфорилированных пептидов был использован ацетонитрил [10]. Поэтому для элюирования фос-фонилированных пептидов мы попробовали ис- пользовать 0.1% ТФУ в 60 % ацетонитриле. В результате интересующие нас сигналы фосфонили-рованных пептидов надежно детектируются.
Особый интерес вызвал тот факт, что при элюировании 0.4 М водным раствором аммиака не происходит десорбции фосфонилированных пептидов, но происходит удаление мешающих сигналов с массами M H+ более 3000 Да. Поэтому мы попробовали провести сорбцию из 0.4 М водного раствора аммиака и 3.3 % муравьиной кислоты параллельно. Результат представлен в Приложении на рис. 1. После проведения металл-аффинной хроматографии из щелочной среды количество мешающих сигналов значительно уменьшилось, а интенсивность сигналов интересующих нас пептидов значительно возросла.
Поскольку ферментативный гидролиз чаще всего проводят с использованием фермента трипсина в 25 мМ растворе бикарбоната аммония или в 6 М мочевине, эксперимент повторили и на стадии сорбции использовали данные растворы. В результате было показано, что МАЛДИ-масс-спектры образцов после проведения металл-аффинной хроматографии сопоставимы.
Так как использование МАЛДИ-масс-спектро-метрии для количественной оценки требует изотопных методов, количественная оценка связывания модифицированного пептида с сорбентом была проведена с использованием ВЭЖХ-МС-МС. Площади хроматографических пиков пептидов VRYGBTKKVPQVST и LVRYGBTKKVPQVST после проведения металл-аффинной хроматографии и сорбции в кислой среде взяты за 1. На диаграммах (Приложение, рис. 2) видно, что при сорбции в щелочных условиях площадь хроматографических пиков существенно увеличивается. Так, при сорбции из бикарбоната аммония площадь хроматографического пика пептида LVRYGBTKKVPQVST увеличивается в 4.5 раза, а для пептида VRYGBTKKVPQVST — примерно на порядок.
Заключительным этапом стало определение минимальной концентрации зарина, при которой возможно детектировать аддукт с использованием МАЛДИ-масс-спектрометрии. Металл-аффинную хроматографию на сорбенте, содержащем ионы Ti (IV), провели для пептических гидролизатов сывороточного альбумина человека, инкубированного с зарином; концентрации последнего — 1, 10 и 100 мкг/мл. Сорбцию проводили из 3.3 % муравьиной кислоты и 0.4 М водного аммиака. Элюаты 0.1 % ТФУ в 60 % ацетонитриле были проанализированы с использованием МАЛДИ-масс-спектрометра. Результаты представлены в Приложении на рис. 3. При сорбции из кислой среды аддукт можно детектировать при концентрации зарина 10 мкг/мл. Если сорбцию проводить из щелочных условий, сигнал с массой MH+ 1638.9 Да может быть надежно детектирован в пептическом гидролизате сывороточного альбумина человека, инкубированного с зарином, при понижении концентрации токсиканта на порядок.
ЗАКЛЮЧЕНИЕ
В результате работы в масс-спектрах после проведения металл-аффинной хроматографии на микроколонках Supel-Tips Ti удалось обнаружить фосфонилированные пептиды с M H+ 1525.8 и 1638.9 Да в элюате 0.1 % ТФУ в 60 % ацетонитриле. С помощью обогащения в масс-спектре удалось значительно уменьшить дополнительные мешающие сигналы от других пептидов сывороточного альбумина.
Разработана следующая методика проведения хроматографического анализа.
-
• С помощью автодозатора пропустить через микроколонку 10 мкл дистиллированную воду. Процедуру повторить 3 раза.
-
• В микропробирку поместить 20 мкл раствора, содержащего фосфорилированные пептиды в 0.4 М водном аммиаке. Через микроколонку отобрать 10 мкл образца и пропустить обратно, процедуру повторить 9 раз (общее количество циклов 10).
-
• В микропробирку поместить 5 мкл элюента (0.5 % ТФУ в 60 % ацетонитриле) и пропустить через колонку 3 раза.
Таким образом, в нашей работе была показана возможность использования методов фосфопротеомики для обогащения пептидов сывороточного альбумина, модифицированных зарином. Этот подход позволит значительно усилить доказательную базу и надежность анализа при ретроспективном химико-токсикологическом анализе при отравлении веществом зарин
ОЗХО рекомендует в отношении идентификации ФОВ определение в биопробах как их свободных метаболитов, так и аддуктов с белками. Ковалентные аддукты белков крови и с другими опасными токсичными химикатами, например сернистым ипритом [11] и цианидами [12], являются долгоживущими и надежными биомаркерами интоксикаций, и разработка методов идентификации нестандартных посттрансляционных модификаций белков крови является важным направлением в ретроспективной диагностике интоксикаций.
ПРИЛОЖЕНИЕ
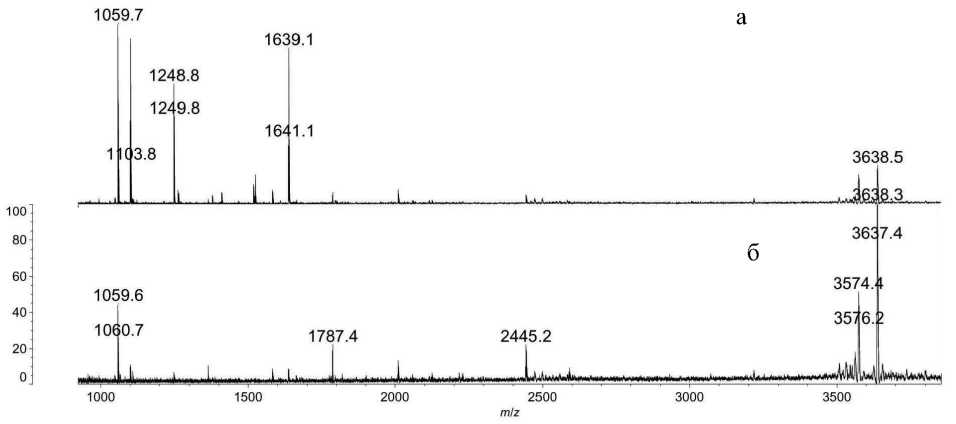
Рис. 1. МАЛДИ-масс-спектры пептических гидролизатов сывороточного альбумина человека, инкубированного с зарином.
Концентрация ОВ в среде инкубирования 100 мкг/мл. После металл-аффинной хроматографии на сорбенте, содержащем ионы Ti(IV). а — сорбция из кислой среды, б — сорбция из щелочной среды
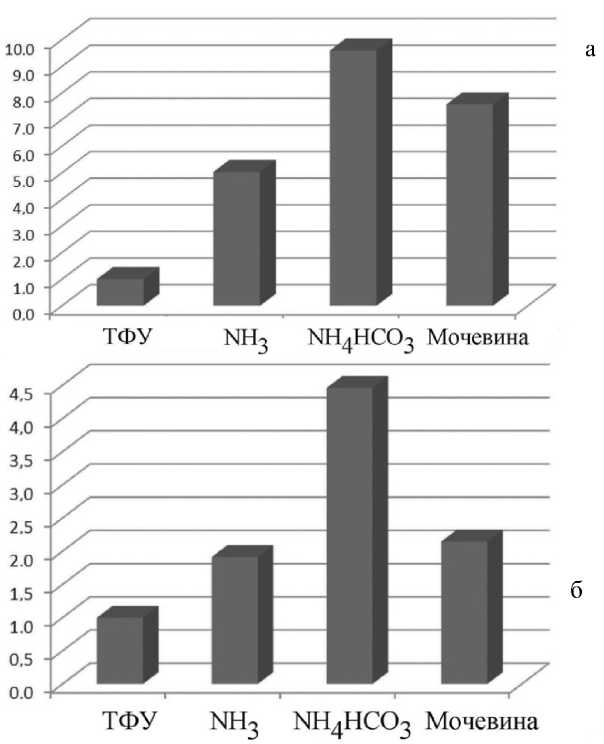
Рис. 2. Диаграммы нормированных площадей хроматографических пиков. а — пептид VRY GB TKKVPQVST, б — пептид LVRY GB TKKVPQVST
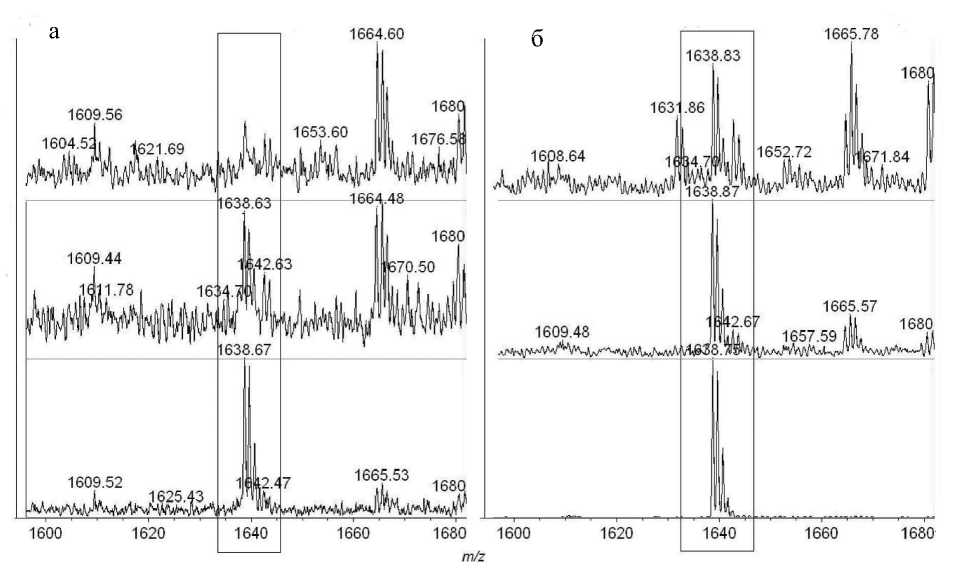
Рис. 3. Фрагменты МАЛДИ-масс-спектров пептических гидролизатов сывороточного альбумина человека, модифицированного зарином, после металл-аффинной хроматографии на сорбенте, содержащем ионы Ti(IV). Концентрация ОВ в среде инкубирования 1 мкг/мл — нижний ряд; 10, 100 мкг/мл — средний и верхний ряды. Выделена (прямоугольником) область, содержащая сигналы пептида LVRYGBTKKVPQVST. а — сорбция из кислой среды, б — сорбция из щелочной среды


