Оптимизированная техника интраоперационной верификации трансплантата с помощью ультразвуковой флоуметрии во время коронарного шунтирования
Автор: Затолокин В.В., Вечерский Ю.Ю., Манвелян Д.В., Афанасьева Н.Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.36, 2021 года.
Бесплатный доступ
Цель: определить роль трехэтапной ультразвуковой флоуметрии коронарных шунтов с целью ранней верификации технических ошибок при операции коронарного шунтирования.Материал и методы. Выполнен анализ 214 шунтов. Первый этап флоуметрии проводили на остановленном сердце спроксимальной петлевой пробой и без нее; второй этап - после отлучения от аппарата искусственного кровообращения (ИК); третий этап - после инактивации гепарина до закрытия раны грудной клетки.Результаты. Среди 214 трансплантатов при флоуметрии в 4,2% (n = 9) случаев был выявлен недостаточный кровоток.Техническая хирургическая погрешность была подтверждена в этих шунтах во время их ревизии. В 2,8% (n = 6) случаев были отмечены неоптимальные параметры флоуметрии во время первого измерения, где в 2,3% (n = 5) случаев неоптимальный кровоток верифицирован с использованием проксимальной петлевой пробы на целевой коронарной артерии и в 0,47% (n = 1) наблюдений - без пробы. В 0,47% (n = 1) случаев обнаружен неадекватный кровоток во время второго измерения, что подтвердило технические ошибки в проксимальных анастомозах. В 0,93% (n = 2) случаев обнаружены низкие параметры кровотока во время третьего измерения, что было связано с перегибами шунтов из-за их чрезмерной длины. Все хирургические погрешности были исправлены сразу на этапе их верификации.Выводы. Стратегия трехэтапной оценки флоуметрии дает возможность обеспечить и документировать адекватнуюфункциональность коронарных шунтов на всех этапах операции. Это позволяет вовремя верифицировать и сразуисправить любые технические проблемы с коронарными шунтами.
Ультразвуковая флоуметрия, функциональность шунтов, коронарное шунтирование
Короткий адрес: https://sciup.org/149136644
IDR: 149136644 | УДК: 616.132.2-089.86- | DOI: 10.29001/2073-8552-2021-36-1-92-100
Текст научной статьи Оптимизированная техника интраоперационной верификации трансплантата с помощью ультразвуковой флоуметрии во время коронарного шунтирования
Недостаточность трансплантатов после коронарного шунтирования является основной причиной рецидивирующей стенокардии и может возникать в различные сроки послеоперационного периода. По данным литературы, дисфункция коронарных шунтов может достигать 20% в течение первого года наблюдения после операции [1]. Снижение функциональности коронарных шунтов приводит к повышению заболеваемости и смертности после коронарного шунтирования [2–5]. Нефункционирующие шунты могут иметь место без каких-либо клинических или инструментальных маркеров в разные сроки послеоперационного наблюдения [6–8]. Все случаи дисфункции шунтов могут быть вызваны такими сложностями, как коронарное несоответствие, конкурентный кровоток, феномен «no-reflow» и хирургические погрешности. Измере- ние транзитного времени кровотока по шунтам (ультразвуковая флоуметрия) является наиболее современным и надежным методом диагностики функциональности шунтов во время операции [7]. Известно, что флоуметрия коронарных шунтов является наиболее распространенным методом оценки кровотока через трансплантаты, тесно коррелирующим с данными ранней послеоперационной ангиографии [8–11]. Основными параметрами оптимальной функциональности коронарных шунтов являются величина средней объемной скорости кровотока (MGF – mean graft flow) более 15 мл/мин, величина пуль-сативного индекса (PI – pulsatility index) менее 5 единиц и диастолического наполнения (DF – diastolic filling) более 50% [7]. В литературе имеются данные об ультразвуковой флоуметрии коронарных шунтов на остановленном сердце [7–9, 12, 13]. Во время такого измерения кровоток становится полностью ламинарным, и очень низкий
PI отражает артефакт роликового насоса аппарата искусственного кровообращения (ИК). Это значение PI может варьировать в зависимости от используемого аппарата ИК (роликового насоса), что обеспечивает степень максимального и минимального кровотока, из которого рассчитывается MGF и PI. Некоторые исследователи считают, что PI менее 1 единицы с потоком более 20 мл/мин является приемлемым значением для оценки адекватной функциональности дистальных анастомозов на остановленном сердце [9]. Однако такая практика все еще носит спорадический характер.
В настоящее время не существует конкретных рекомендаций относительно времени выполнения ультразвуковой флоуметрии во время операции коронарного шунтирования. Скудные флоуметрические данные, полученные на остановленном сердце, в настоящее время не систематизированы [9].
Цель исследования: оценить эффективность трехэтапного измерения транзитного времени потока по коронарным шунтам с целью ранней верификации технических ошибок при операциях коронарного шунтирования.
Материал и методы
В исследование включены 68 пациентов (214 коронарных шунтов), которым в период с 2018 по 2019 г. была проведена операция коронарного шунтирования в НИИ кардиологии Томского НИМЦ. Демографические и клинические данные пациентов приведены в таблице 1.
(ВГА) использовались «на ножке», а большая подкожная вена (БПВ) – в качестве линейного аортокоронарного шунта. Измерение кровотока по коронарным шунтам (ультразвуковая флоуметрия) в исследовании проводили трижды во время операции для каждого трансплантата. Все измерения были выполнены с использованием ультразвуковой флоуметрии (VeriQ System, Medistim, Oslo, Norway). Параметры кровотока включали в себя MGF, PI и DF. Параметры потока регистрировали после того, как форма волны кровотока становилась стабильной.
Трехэтапный подход в оценке ультразвуковой флоуметрии включал в себя первым этапом измерение кровотока после формирования всех дистальных анастомозов на остановленном сердце с проксимальной петлевой пробой и без нее. Во время такого измерения перфузионный кровоток в маммарокоронарных шунтах создавался путем снятия атравматической клеммы «ДеБейки», а все свободные графты последовательно соединялись с контуром аппарата ИК через артериальную канюлю с поочередной регистрацией параметров ультразвуковой флоуметрии для каждого шунта отдельно. Во время всех этих измерений мы использовали аппарат ИК Stockert S5 с роликовым насосом S5 150. Проксимальная петлевая проба на каждой целевой коронарной артерии представляла собой пережатие шунтированной коронарной артерии выше дистального анастомоза с целью оценки функциональности шунтов в дистальное русло целевых коронарных артерий (рис. 1).
Таблица 1. Демографические и клинические данные пациентов (n = 68)
Table 1. Patient demographic and clinical data ( n = 68)
|
Средний возраст, лет Mean age, years |
63,6 ± 6,9 |
|
Мужчины, n (%) Men, n (%) |
56 (82,3) |
|
Женщины, n (%) Women, n (%) |
12 (17,6) |
|
NYHA класс II, n (%) NYHA class II, n (%) |
27 (39,7) |
|
NYHA класс III, n (%) NYHA class III, n (%) |
37 (54,4) |
|
NYHA класс IV, n (%) NYHA class IV, n (%) |
3 (4,4) |
|
ФВ, % EF, % |
61 ± 7 |
|
Гиперлипидемия, n (%) Hyperlipidemia, n (%) |
54 (79,4) |
|
Гипертензия, n (%) Hypertension, n (%) |
45 (66,1) |
|
Площадь поверхности тела, м2 Body surface area, m2 |
1,92 ± 0,08 |
|
Параметры ИК, л/мин CPB options , l/min |
5,18 ± 0,08 |
Примечание: NYHA – Нью-Йоркская кардиологическая ассоциация, ФВ – фракция выброса, ИК – искусственное кровообращение.
Note: NYHA – New York Heart Association; EF – ejection fraction;
CPB – cardio-pulmonary bypass.
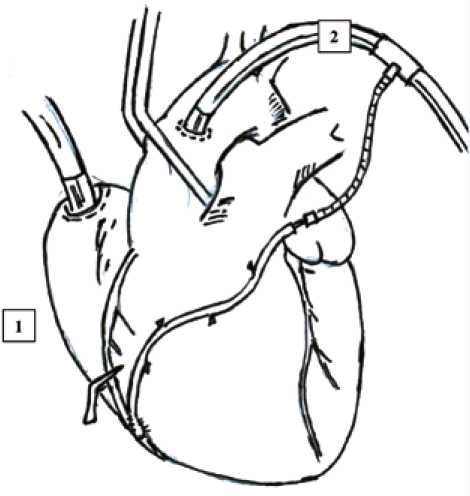
Рис. 1. Ультразвуковая флоуметрия на остановленном сердце в большой подкожной вене, подключенной к контуру аппарата искусственного кровообращения, и с проксимальной петлевой пробой на целевой коронарной артерии: 1 – проксимальная петлевая проба на коронарной артерии, 2 – аортальная канюля
Fig 1. Ultrasonic flowmetry on arrested heart in the great saphenous vein graft connected to the circuit of the cardio-pulmonary bypass and with a proximal loop snare on the target coronary artery: 1 – proximal loop snare on the coronary artery, 2 – aortic cannula
Все операции выполнялись через срединную стернотомию в условиях ИК и холодовой кардиоплегии раствором «Кустодиол». Все внутренние грудные артерии
В таких условиях имеет место возможность оценить функциональность коронарных шунтов в дистальном направлении и сразу устранить любые хирургические ошибки в дистальном анастомозе во время кардиоплегического этапа операции. Второе измерение выполняли после завершения всех проксимальных анастомозов и после отлучения от аппарата ИК. Третье измерение проводили после инактивации гепарина и удаления ранорасширите-ля (до закрытия раны грудной клетки).
Показанием к ревизии дистальных анастомозов при измерении на остановленном сердце на первом этапе флоуметрии была нестабильная «пикообразная» форма волны. Показаниями к ревизии шунтов на втором и третьем этапах флоуметрии являлись параметры PI более 5 единиц и нестабильная «пикообразная» форма волны [3].
Нормальность распределения показателей проверяли с помощью критерия Колмогорова – Смирнова. Показатели, имевшие нормальное распределение, описывали средним значением и стандартным отклонением. Показатели, у которых отсутствовало нормальное распределение, представляли медианой и межквартильным интервалом. Статистическое сравнение показателей на разных этапах флоуметрии выполняли с помощью критерия Манна – Уитни. Статистический анализ проводили с использованием пакета STATISTICA 10.0. Критическим считали уровень значимости р = 0,05.
Результаты
Исследованию подверглось 214 шунтов у 68 пациентов. Левая ВГА использовалась у всех пациентов как трансплантат «на ножке» ( n = 68). Результаты периопера-ционного периода представлены в таблице 2.
На первом этапе измерения было выявлено значительное снижение MGF при использовании проксимальной петлевой пробы на целевой коронарной артерии по сравнению с отсутствием данной пробы во всех бассейнах коронарного русла: маммарокоронарное шунтирование ПНА (МКШ–ПНА) (50 (44; 120,5) и 77 (54; 171) мл/мин, р < 0,001), аортокоронарное шунтирование БПВ ветви тупого края (АКШ (БПВ)–ВТК) (59 (38; 72,5) и 73 (51,5; 102), р < 0,001) и аортокоронарное шунтирование БПВ правой коронарной артерии (АКШ (БПВ)–ПКА) (47,5 (33,5; 61) и 81,5 (61; 97), р < 0,001). Данные представлены в таблице 3.
Таблица 2. Показатели периоперационного периода Table 2. Perioperative characteristics
|
Параметры Parameters |
Значения |
|
Характеристика коронарного русла Characteristics of the coronary bed Трехсосудистое поражение КА, n (%) Three-vessel CA lesion, n (%) |
68 (100) |
|
Стеноз проксимального отдела ПНА ≥ 75%, n (%) Proximal LAD stenosis ≥ 75%, n (%) |
51 (75) |
|
Диаметр КА более 1,5 мм, n (%) CA diameter more than 1.5 mm, n (%) |
68 (100) |
|
Шкала Syntrax score, баллы Syntrax score, points |
29 ± 3 |
|
Время ИК, мин CPB time, min |
89 ± 11 |
|
Время пережатия аорты, мин Cross clamp time, min |
56 ± 9 |
|
Продолжительность искусственной вентиляции легких, ч Duration of artificial lung ventilation, hours |
15 ± 9 |
|
Время пребывания в отделении реанимации, ч Time spent in intensive care unit, hours |
65 ± 23 |
|
Время пребывания в стационаре, дни Hospital stay, days |
9 ± 3 |
|
Периоперационный ИМ Perioperative MI |
0 |
|
Летальность Mortality |
0 |
Примечание: КА – коронарная артерия, ПНА – передняя нисходящая артерия, ИК – искусственное кровообращение, ИМ – инфаркт миокарда.
Note: CA – coronary artery, LAD – left anterior descending, CPB – cardiopulmonary bypass, MI – myocardial infarction.
Таблица 3. Средняя объемная скорость кровотока (мл/мин) при ультразвуковой флоуметрии ( n = 214)
Table 3. Mean graft flow (mL/min) in ultrasonic flowmetry ( n = 214)
|
Шунты Grafts |
Первый этап флоуметрии (петлевая проба) First step flowmetry (proximal snare) |
Первый этап флоуметрии First step flowmetry |
p |
Второой этап флоуметрии Second step flowmetry |
Третий этап флоуметрии Third step flowmetry |
p |
|
МКШ-ПНА LIMA-LAD |
50 (44; 120,5)* |
77 (54; 171)* |
< 0,001 |
35 (23; 42) |
35 (27; 46,5) |
0,26 |
|
АКШ (БПВ-ВТК) SVG-OM |
59 (38; 72,5)* |
73 (51,5; 102)* |
< 0,001 |
45,5 (35,5; 65) |
54 (36,5; 76) |
0,19 |
|
АКШ (БПВ-ПКА) SVG-RCA |
47,5 (33,5; 61)* |
81,5 (61; 97)* |
< 0,001 |
52 (39,5; 67) |
45 (27; 67) |
0,59 |
Примечание: здесь и далее в таблицах 4, 5, 7: МКШ – маммарокоронарный шунт, ПНА – передняя нисходящая артерия, АКШ – аортокоронарный шунт, БПВ – большая подкожная вена, ПКА – правая коронарная артерия, ВТК – ветвь тупого края. * - статистически значимые различия.
Note: here and in Tables 4, 5, and 7: LIMA – left internal mammary artery, LAD – left anterior descending artery, SVG – saphenous vein graft, OM – obtuse marginal, RCA – right coronary artery, MGF – mean graft flow, PI – pulsatility index, DF – diastolic filling, CPB – cardio-pulmonary bypass.
Также на первом этапе измерения был обнаружен значительно высокий показатель PI при использовании проксимальной петлевой пробы на целевой коронарной артерии по сравнению с отсутствием данной пробы на
МКШ–ПНА (0,8 (0,5; 1,2) и 0,4 (0,3; 0,7), р < 0,001), АКШ (БПВ)–ВТК (1,4 (1,05; 1,7) и 0,85 (0,6; 1,3), р < 0,001) и АКШ (БПВ)–ПКА (1,3 (1; 1,9) и 0,85 (0,7; 1,1), р < 0,001). Данные продемонстрированы в таблице 4.
Таблица 4. Пульсативный индекс при ультразвуковой флоуметрии ( n = 214)
Table 4. Pulsatility index by ultrasonic flowmetry ( n = 214)
|
Шунты Grafts |
Первый этап флоуметрии (петлевая проба) First step flowmetry (proximal snare) |
Первый этап флоуметрии First step flowmetry |
p |
Второй этап флоуметрии Second step flowmetry |
Третий этап флоуметрии Third step flowmetry |
p |
|
МКШ-ПНА LIMA-LAD |
0,8 (0,5; 1,2)* |
0,4 (0,3; 0,7)* |
< 0,001 |
2,9 (2,4; 4,1) |
3 (2; 4,25) |
0,69 |
|
АКШ (БПВ-ВТК) SVG-OM |
1,4 (1,05; 1,7)* |
0,85 (0,6; 1,3)* |
< 0,001 |
2,5 (1,7; 3,3) |
2,4 (2,05; 3) |
0,87 |
|
АКШ (БПВ-ПКА) SVG-RCA |
1,3 (1; 1,9)* |
0,85 (0,7; 1,1)* |
< 0,001 |
2,2 (1,7; 3,85) |
2,2 (1,9; 4,05) |
0,72 |
Мы не обнаружили каких-либо различий в MGF и PI во время измерений на втором и третьем этапах ультразвуковой флоуметрии (см. табл. 2, 3). Но DF имел небольшую, но статистически значимую тенденцию к увеличению на третьем этапе измерения по сравнению со вторым этапом на АКШ (БПВ)–ВТК (67 (55; 72) и 69,5 (64; 76), p = 0,026) и на АКШ (БПВ)-ПКА (62 (53; 70) и 65 (60; 72,5), p = 0,009). Данные представлены в таблице 5.
Таблица 5. Диастолическое наполнение при ультразвуковой флоуметрии ( n = 214)
Table 5. Diastolic filling by ultrasonic flowmetry ( n = 214)
|
Шунты Graft |
Второй этап флоуметрии Second step flowmetry |
Третий этап флоуметрии Third step flow-metry |
p |
|
МКШ–ПНА LIMA–LAD |
70,5 (66,5; 76) |
71,5 (64,5; 75,5) |
0,69 |
|
АКШ (БПВ–ВТК) SVG–OM |
67 (55; 72)* |
69,5 (64; 76)* |
0,026 |
|
АКШ (БПВ–ПКА) SVG–RCA |
62 (53; 70)* |
65 (60; 72,5)* |
0,009 |
В 4,2% (n = 9) случаев коронарные шунты были подвергнуты интраоперационной хирургической ревизии (табл. 6). Это были 4 маммарокоронарных и 5 аорто- коронарных шунтов с низким MGF, высоким PI и нестабильной «пикообразной» формой волны (табл. 7). В 6 (2,8%) наблюдениях решение о ревизии трансплантата было принято во время ультразвуковой флоуметрии на остановленном сердце (на первом этапе измерения). В 5 (2,3%) из этих наблюдений все параметры аномального кровотока были зарегистрированы с помощью проксимальной петлевой пробы на целевой коронарной артерии. При ревизии таких шунтов был обнаружен стеноз в «носке» дистальных анастомозов. В 1 (0,47%) наблюдении аномальный кровоток в дистальном анастомозе был обнаружен без проксимальной петлевой пробы – при ревизии проблемы были выявлены в «пятке» и «носке» дистального анастомоза. Все эти ревизии были выполнены в течение одного периода кардиоплегии. На флоуметрии шунтов на остановленном сердце после ревизии форма волны и параметры PI и MGF стабилизировались.
В 1 (0,47%) случае решение о ревизии шунта было принято во время второго этапа ультразвуковой флоу-метрии, где была найдена техническая погрешность в проксимальном анастомозе. В 2 (0,93%) наблюдениях решение о ревизии было принято во время третьего этапа ультразвуковой флоуметрии, где были обнаружены перегибы коронарных шунтов. Такие перегибы были вызваны чрезмерной длиной и проявились только после удаления ретрактора. После репозиции шунтов параметры MGF, PI и DF нормализовались, а форма волны стабилизировалась во время повторных измерений.
Таблица 6. Технические проблемы с шунтами, обнаруженные при ревизии ( n = 9; 4,2%)
Table 6. Technical problems with shunts detected during revision ( n = 9; 4.2%)
|
Техническая проблема в структуре шунта Technical problem in the graft structure |
Количество шунтов ( n = 214) Number of grafts |
Этап флоуметрии Step of flowmetry |
Выполненная процедура Procedure performed |
|
Дистальный анастомоз, n (%) – с петлевой пробой – без петлевой пробы Distal anastomosis, n (%) – with proximal snare – without proximal snare |
6 (2,8) 5 (2,3) 1 (0,47) |
На остановленном сердце (первый этап) On arrested heart (first step) |
Ревизия дистального анастомоза Revision of the distal anastomosis |
|
Проксимальный анастомоз, n (%) Proximal anastomosis, n (%) |
1 (0,47) |
После отлучения от ИК (второй этап) After CPB weaning (second step) |
Ревизия проксимального анастомоза Revision of the proximal anastomosis |
|
Перегиб, n (%) Kink, n (%) |
2 (0,93) |
Перед закрытием грудной клетки (третий этап) Before wound closure (third step) |
Коррекция длины шунта Graft length correction |
|
Всего, n (%) Total, n (%) |
9 (4,2) |
Таблица 7. Параметры ультразвуковой флоуметрии коронарных шунтов, подвергшихся ревизии
Table 7. Ultrasonic flowmetry parameters of revised coronary bypass grafts
|
Шунты, этапы флоуметрии Grafts, flowmetry steps |
Средняя объемная скорость кровотока, мл/мин Mean graft flow, mL/min |
Пульсативный индекс, ед. Pulsatile index, Un. |
Диастолическое наполнение, % Diastolic filling, % |
Форма волны Wave form |
Техническая проблема Technical problem |
|
МКШ–ПНА Первый этап с петлевой пробой LIMA–LAD First step with proximal snare |
0 |
15 |
– |
Нестабильная Unstable |
Стеноз дистального анастомоза в области «носка» Stenosis in distal anastomosis in the toe area |
|
МКШ–ПНА Первый этап с петлевой пробой LIMA–LAD First step with proximal snare |
3 |
9 |
– |
Нестабильная Unstable |
Стеноз дистального анастомоза в области «носка» Stenosis in distal anastomosis in the toe area |
|
МКШ–ПНА Первый этап с петлевой пробой LIMA–LAD First step with proximal snare |
5 |
7 |
– |
Нестабильная Unstable |
Стеноз дистального анастомоза в области «носка» Stenosis in distal anastomosis in the toe area |
|
АКШ (БПВ–ВТК) Первый этап с петлевой пробой SVG–OM First step with proximal snare |
8 |
10,2 |
– |
Нестабильная Unstable |
Стеноз дистального анастомоза в области «носка» Stenosis in distal anastomosis in the toe area |
|
АКШ (БПВ–ВТК) Первый этап с петлевой пробой SVG–OM First step with proximal snare |
2 |
13 |
– |
Нестабильная Unstable |
Стеноз дистального анастомоза в области «носка» Stenosis in distal anastomosis in the toe area |
|
АКШ (БПВ–ВТК) Первый этап без петлевой пробы SVG–OM First step without proximal snare |
12 |
16 |
– |
Нестабильная Unstable |
Стеноз дистального анастомоза в области «носка» и «пятки» Stenosis in distal anastomosis in the toe and heel areas |
|
АКШ (БПВ–ПКА) Второй этап SVG–RCA Second step |
13 |
7,4 |
11 |
Нестабильная Unstable |
Стеноз проксимального анастомоза Stenosis in proximal anastomosis |
|
МКШ–ПНА Третий этап LIMA–LAD Third step |
16 |
8 |
23 |
Нестабильная Unstable |
Перегиб шунта Graft kinking |
|
АКШ (БПВ–ВТК) Третий этап SVG–OM Third step |
9 |
5,8 |
34 |
Нестабильная Unstable |
Перегиб шунта Graft kinking |
Обсуждение
Несостоятельность коронарных шунтов, по данным литературы, может достигать 20%, и некоторая часть этих дисфункций связана с техническими погрешностями, которые могут быть выявлены и исправлены во время операции [14]. Наиболее часто используемыми методами для оценки проходимости трансплантатов в операционной являются эмпирические методы, такие как пальпация. Выполнение интраоперационной флоу-метрии коронарных шунтов является наиболее современным методом оценки качества операции коронарного шунтирования [15–17]. В большинстве исследований по ультразвуковой флоуметрии показанием для ревизии коронарных шунтов считается MGF менее 15 мл/мин и PI более 3 единиц [6, 7]. Однако многие хирурги принимают решение о ревизии шунтов только в том случае, если имеют место другие интраоперационные признаки недостаточности коронарного кровотока, такие как изменения на электрокардиограмме, или при нестабильной гемо- динамике [7]. Также стоит отметить, что в большинстве случаев ультразвуковая флоуметрия проводится один раз во время операции после отлучения от аппарата ИК, и только единицы повторяют еще раз измерение после введения протамина и до закрытия раны грудной клетки [14, 18–20]. Такая стратегия однократной ультразвуковой флоуметрии при дисфункции коронарных шунтов во время операции обрекает пациентов на необходимость в повторной кардиоплегии и наложении поперечного зажима на аорту, что увеличивает риск возникновения послеоперационных сердечно-сосудистых и мозговых осложнений, особенно в условиях нестабильной гемодинамики [21, 22].
В нашей работе мы использовали трехэтапную ультразвуковую флоуметрию во время коронарного шунтирования, позволяющую вовремя выявить техническую погрешность и сразу же ее исправить. Мы обнаружили, что флоуметрические измерения на остановленном сердце с использованием проксимальной петлевой пробы на целевой коронарной артерии являются полезной процедурой.
Это позволяет ориентировать кровоток в дистальное направление, подтверждая функциональность шунта в дистальное русло целевой коронарной артерии, тем самым исключая какие-либо технические погрешности в «носке» дистального анастомоза. Диагностика хирургических ошибок на этом этапе флоуметрии позволяет выполнить ревизию дистального анастомоза сразу же, до снятия зажима с аорты. В нашей работе мы обнаружили 6 (2,8%) технических ошибок в дистальных анастомозах на первом этапе ультразвуковой флоуметрии, где в 5 (2,3%) наблюдениях погрешности были выявлены при использовании проксимальной петлевой пробы на целевой коронарной артерии. Целью второго этапа флоуметрии стало устранение всех хирургических ошибок в проксимальных анастомозах, так как все технические погрешности дистальных анастомозов уже были исключены на первом этапе измерения. Был обнаружен 1 (0,47%) случай, требующий технической коррекции в проксимальном анастомозе на втором этапе ультразвуковой флоуметрии. На третьем этапе измерения мы исключали тромбоз и перегиб трансплантатов после удаления ранорасширителя. На этом этапе измерения в 2 (0,93%) случаях были выявлены перегибы трансплантата, вызванные его чрезмерной длиной.
Мы обнаружили, что на первом этапе измерения MGF значительно снижается при использовании проксимальной петлевой пробы на целевой коронарной артерии по сравнению с отсутствием такой пробы во всех бассейнах коронарного русла. Также параметр PI значимо увеличивается при использовании проксимальной петлевой пробы на целевой коронарной артерии во всех бассейнах коронарного русла. Это означает, что проксимальная петлевая проба, исключая поступление кровотока по шунту в проксимальное направление, позволяет нам оценить не только проходимость анастомозов в дистальное русло коронарных артерий, но и резерв микроциркуляторного русла шунтированных коронарных артерий с целью дальнейшего прогноза лечения пациентов с ишемической болезнью сердца.
Список литературы Оптимизированная техника интраоперационной верификации трансплантата с помощью ультразвуковой флоуметрии во время коронарного шунтирования
- Thuijs D.J.F.M., Bekker M.W.A., Taggart D.P., Kappetein A.P., Kieser T.M., Wendt D. et al. Improving coronary artery bypass grafting: a systematic review and meta-analysis on the impact of adopting transit-time flow measurement. Eur. J. Cardiothorac. Surg. 2019;56(4):654-663. DOI: 10.1093/ejcts/ezz075.
- Head S.J., Milojevic M., Daemen J., Ahn J.-M., Boersma E., Christiansen E.H.et al. Mortality after coronary artery bypass grafting versus percutaneous coronary intervention with stenting for coronary artery disease: A pooled analysis of individual patient data. Lancet. 2018;391(10124):939-948. DOI: 10.1016/S0140-6736(18)30423-9.
- Kieser T.M., Rose S., Kowalewski R., Belenkie I. Transit-time flow predicts outcomes in coronary artery bypass graft patients: A series of 1000 consecutive arterial grafts. Eur. J. Cardiothorac. Surg. 2010;38(2):155-162. DOI: 10.1016/j.ejcts.2010.01.026.
- Вечерский Ю.Ю., Затолокин В.В., Андреев С.Л., Шипулин В.М. Бимаммарное коронарное шунтирование с сохранением кровоснабжения грудины. Кардиология. 2016;56(1):31-33.
- Вечерский Ю.Ю., Затолокин В.В., Петлин К.А., Ахмедов Ш.Д., Шипулин В.М. Новый метод эндоскопического выделения большой подкожной вены в открытой системе. Ангиология и сосудистая хирургия. 2017;23(2):131-135.
- Jokinen J.J., Werkkala K., Vainikka T., Perakyla T., Simpanen J., Ihlberg L. Clinical value of intra-operative transit-time flow measurement for coronary artery bypass grafting: A prospective angiography-controlled study. Eur. J. Cardiothorac. Surg. 2011;39:918-923. DOI: 10.1016/j. ejcts.2010.10.006.
- Kieser T.M., Taggart D.P. The use of intraoperative graft assessment in guiding graft revision. Ann. Cardiothorac. Surg. 2018;7(5):652-662. DOI: 10.21037/acs.2018.07.06.
- Kieser T.M. Graft quality verification in coronary artery bypass graft surgery: How, when and why? Curr. Opin. Cardiol. 2017;32(6):722-736. DOI: 10.1097/H03.0000000000000452.
- Hashim S.A., Amin M.A., Nair A.A., Mokhtar R.A.R., Krishnasamy S., Cheng K. Flowmeter technique to exclude internal mammary artery anastomosis error in an arrested heart. Heart Lung Circ. 2018;27(5):59-63. DOI: 10.1016/j.hlc.2017.11.011.
- Hiraoka A., Fukushima S., Miyagawa S., Yoshikawa Y., Saito S., Do-mae K. et al. Quantity and quality of graft flow in coronary artery bypass grafting is associated with cardiac computed tomography study-based anatomical and functional parameters. Eur. J. Cardiothorac. Surg. 2017;52:909-916. DOI: 10.1093/ejcts/ezx210.
- Neumann F-J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur. Heart J. 2019;40(2):87-165. DOI: 10.1093/eurheartj/ ehy394.
- Kieser T.M., Taggart D.P. Current status of intra-operative graft assessment: Should it be the standard of care for coronary artery bypass graft surgery? J. Card. Surg. 2018;33(5):219-228. DOI: 10.1111/jocs.13546.
- Базылев В.В., Россейкин Е.В., Микуляк А.И., Карпунькин О.А. Ультразвуковая допплеровская флоуметрия в интраоперационной диагностике несостоятельности коронарных шунтов. Ангиология и сосудистая хирургия. 2014;20(1):45-55.
- Di Giammarco G., Canosa C., Foschi M., Rabozzi R., Marinelli D., Ma-suyama S. et al. Intraoperative graft verification in coronary surgery: increased diagnostic accuracy adding high-resolution epicardial ultraso-nography to transit-time flow measurement. Eur. J. Cardiothorac. Surg. 2014;45(3):41-45. DOI: 10.1093/ejcts/ezt580.
- Une D., Deb S., Chikazawa G., Kommaraju K., Tsuneyoshi H., Karkhanis R. et al. Cut-off values for transit time flowmetry: Are the revision criteria appropriate? J. Card. Surg. 2013;28(1):3-7. DOI: 10.1111/jocs.12036.
- Lehnert M., Moller C., Damgard S., Gerds T.A., Steinbruchel D.A. Transit-time flow measurement as a predictor of coronary bypass graft failure at one year angiographic follow-up. J. Card. Surg. 2015;30(1):47-52. DOI: 10.1111/jocs.12471.
- Wijns W., Kolh P., Danchin N., Di Mario C., Falk V., Folliguet T. et al. Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur. J. Cardiothorac. Surg. 2010;31(20):2501-2555. DOI: 10.1093/eurheartj/ ehq277.
- Niclauss L. Techniques and standards in intraoperative graft verification by transit time flow measurement after coronary artery bypass graft surgery: A critical review. Eur. J. Cardiothorac. Surg. 2017;51(1):26-33. DOI: 10.1093/ejcts/ezw203.
- Oshima H., Tokuda Y., Araki Y., Ishii H., Murohara T., Ozaki Y. et al. Predictors of early graft failure after coronary artery bypass grafting for chronic total occlusion. Interact. Cardiovasc. Thorac. Surg. 2016;23(1):142-149. DOI: 10.1093/icvts/ivw084.
- Hatada A., Okamura Y., Kaneko M., Hisaoka T., Yamamoto S., Hiramat-su T. et al. Comparison of the waveforms of transit-time flowmetry and intraoperative fluorescence imaging for assessing coronary artery bypass graft patency. Gen. Thorac. Cardiovasc. Surg. 2011;59(1):14-18. DOI: 10.1007/s11748-010-0611-1.
- Daniel W.T., Kilgo P., Puskas J.D., Thourani V.H., Lattouf O.M., Guyton R.A. et al. Trends in aortic clamp use during coronary artery bypass surgery: effect of aortic clamping strategies on neurologic outcomes. J. Thorac. Cardiovasc. Surg. 2014;147(2):652-657. DOI: 10.1016/j. jtcvs.2013.02.021.
- Сидоров Р.В., Талалаев Е.П., Щетко В.Н., Поспелов Д.Ю., Шлык И.Ф. Анализ флоуметрических показателей кровотока коронарных шунтов у пациентов высокого хирургического риска. Ангиология и сосудистая хирургия. 2019;25(1):53-57.


