Опыт калибровки бесконтактного лазерного допплеровского флоуметра
Автор: Мареев Г.О., Мареев О.В., Капралов С.В., Клименко Г.А., Калюта Т.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Оториноларингология
Статья в выпуске: 3 т.21, 2025 года.
Бесплатный доступ
Цель: провести калибровку бесконтактного лазерного допплеровского флоуметра (ЛДФ) с обоснованием последующего его использования в модельных опытах и клинических экспериментах. Материал и методы. Описан экспериментальный стенд для воспроизведения заданной скорости кровотока путем моделирования капилляра; представлены методики калибровки флоуметра в перфузионных единицах (tpu) посредством калибровочной эмульсионной жидкости с определением зависимости показаний прибора от концентрации перемещающихся частиц, приведена методика измерения уровня «биологического нуля» тканевой перфузии слизистой оболочки органов желудочно-кишечного тракта. Результаты. Установлены ключевые параметры обработки сигналов бесконтактного ЛДФ и их взаимосвязь с характеристиками потока калибровочного раствора и скоростью движения микрочастиц в нем. Среднее значение показателя «биологический ноль» для слизистой стенки желудка составляет 0,07±0,014 tpu. Заключение. В результате проведенной работы по калибровке экспериментальной установки ЛДФ, реализующей измерение микроциркуляторного кровотока бесконтактным способом, подтверждена пригодность для проведения измерений микроциркуляторного русла тканей человека, получены основные зависимости параметров обработки сигнала ЛДФ от объема протекающей калибровочной эмульсии, ее скорости и количества движущихся в ней микрочастиц.
Лазерная допплеровская флоуметрия, калибровка датчика флоуметра, локальная микроциркуляция, ишемия кишечника, резекция кишечника
Короткий адрес: https://sciup.org/149149421
IDR: 149149421 | УДК: 616.34-005.1+ 617.5-089.84+ 615.47:612.135 | DOI: 10.15275/ssmj2103249
Текст научной статьи Опыт калибровки бесконтактного лазерного допплеровского флоуметра
EDN: KFXAUS
Введение. Метод лазерной допплеровской фло-уметрии (ЛДФ) для измерения показателей тканевой микроциркуляции известен достаточно давно [1]. Принцип работы этого метода основан на эффекте Допплера: при проникновении лазерного луча в ткани организма он рассеивается на перемещающихся эритроцитах, вызывая изменение частоты возвращаемого светового сигнала, пропорциональное скорости движения клеток крови, что дает возможность провести измерение объемной скорости кровотока и общего состояния мелких кровеносных сосудов [2].
Современные модификации прибора позволяют проводить одновременный мониторинг основной зоны исследования и контрольной точки, выполняют тесты с варьированием локального кровообращения и используют разные методы обработки сигналов, получаемых методом ЛДФ [3]. Таким образом, методика обеспечивает оценку уровня кровоснабжения тканей, колебания потока крови и частотные характеристики сосудистого русла, а также определяет функциональные возможности и адаптационные реакции капиллярной сети организма человека [4].
В последнее десятилетие метод ЛДФ зарекомендовал себя как многообещающая технология для интраоперационного мониторинга кровоснабжения кишечника, особенно в случаях его ишемии и установления пределов резекции [5, 6]. Научные работы указанного периода подтверждают высокую диагностическую значимость данного метода, подчеркивая его роль в клинической практике и возможности повышения эффективности хирургических вмешательств [7–9].
Однако обычно исследование осуществляется контактными датчиками или внедренными внутрь тканей. Подобное исследование микроциркулятор-ного русла не может быть достаточно точным ввиду раздражения тканей и их реакции на давление или внедрение датчика. При применении подобных датчиков во время хирургического вмешательства возникают вопросы стерилизации, а также срока их службы при проведении частой стерилизации. Работа дополнительным прибором в хирургической ране и касание им внутренних органов в брюшной полости весьма нежелательны. Описанные ограничения мешают широкому распространению методики ЛДФ, несмотря на доказанность важности его применения при оценке статуса ишемии кишечника интраоперационно и определения границ хирургической резекции органа [9]. Для преодоления этих ограничений нами была разработана экспериментальная установка, реализующая бесконтактную методику ЛДФ [10]. Учитывая принципы построения оптической системы бесконтактного флоуметра, отличные от общепринятых контактных датчиков, является уместным рассмотреть вопросы калибровки этого прибора с целью получения точных результатов оценки микроцирку-ляторного русла, исследования его применимости для измерения микроциркуляции тканей человека [11–13].
Цель – провести калибровку бесконтактного ЛДФ с обоснованием последующего его использования в модельных опытах и клинических экспериментах.
Материал и методы. Существуют разные методы калибровки флоуметров [10], среди которых чаще всего используются методики с вращающимися
дисками либо с использованием броуновского движения частиц стандартной суспензии или эмульсии заданного размера в фиксированном объеме жидкости при определенной температуре.
Мы выбрали второй метод ввиду его простоты и доступности. Для проведения калибровки использовали стерильную жировую эмульсию «Липовеноз» производства компании Fresenius Kabi (Австрия) в оригинальной герметичной таре (стеклянный прозрачный флакон объемом 300 мл). Эта эмульсия содержит мелкие капли жира диаметром от 5 до 10 мкм (далее применяется термин «калибровочная эмульсия»).
Параметры сигнала бесконтактного допплеровского флоуметра отображаются в режиме реального времени на мониторе компьютера в виде графиков (так называемых ЛДФ-грамм). По завершении измерений эти графики можно подробно изучить, дополнительно рассчитывая некоторые важные показатели, включая среднее значение перфузии и среднеквадратичную ошибку. Во время регистрации данных флоуметром производится расчет спектра входящего сигнала методом быстрого преобразования Фурье (FFT). Она определяет 0-й (M0), 1-й (M1) и 1-й нормированный спектральный моменты (Mn) путем обработки спектра сигнала и использования для сглаживания кривой скользящего среднего с заданным временным окном. Для калибровки бесконтактный ЛДФ направляли на емкость с калибровочной эмульсией и проводили процедуру измерения. После настройки в течение 2–3 мин обрабатывали полученный сигнал. Абсолютные значения спектральных моментов записывались в ЛДФ-грамму, далее усреднялись за весь период калибровки и принимали за 1 условную перфузионную единицу (tissue perfusion unit – tpu).
Обнуление прибора для учета внутренних помех производилось аналогично процессу калибровки путем фокусировки прибора на специальный серый матовый брусок из фторопласта.
При изучении функционирования ЛДФ в условиях эксперимента in vitro выявлена взаимосвязь характеристик ЛДФ с объемной скоростью течения жидкости, насыщенной микрочастицами, непосредственно перед датчиком устройства. Использованная экспериментальная система включала инфузомат модели «ВЭДА-5», 2 шприца по 5 мл, трубку с установленным внутри приборным сенсором. Диаметр экспериментального капилляра определяли при помощи измерительного окуляра к микроскопу МБС при нескольких увеличениях. Средний диаметр капилляра, определенный таким образом, составил 201 мкм. Данная конструкция обеспечивает создание направленного потока жидкости заданной интенсивности, регулируемой характеристиками работы инфузомата. В роли исследуемого вещества применяли калибровочную эмульсию.
Все последующие измерения проводили исключительно после предварительной калибровки каждого отдельного эксперимента с учетом практически постоянной температуры воздуха в помещении (фиксировалась отдельно с помощью бытового термометра) и отображались в пересчете на относительные перфузионные единицы (tpu).
Для обработки данных и статистического сравнения использовали метод линейной регрессии. При приведении средних значений приводили стандартную ошибку среднего арифметического. Для изучения зависимости между рядами данных использовался корреляционный анализ (коэффициент корреляции Пирсона, r).
Результаты. В первую очередь для определения границ области применения ЛДФ экспериментально определена зависимость показаний прибора от концентрации движущихся рассеивающих частиц в исследуемом объекте (таблица).
Эксперимент произведен при регистрации сигнала флоуметра в калибровочной эмульсии различной концентрации. Производилась калибровка прибора обычным образом. Исходный препарат калибровочной эмульсии принимался за 100%.
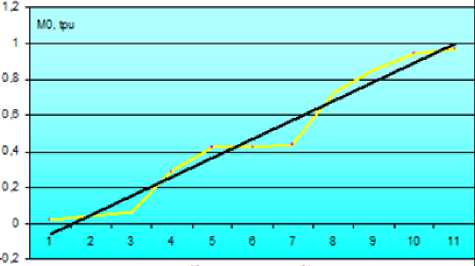
Регистрировалась ЛДФ-грамма путем фокусировки прибора на емкость с дистиллированной водой, что принималось за 0% препарат. Приготовляли растворы калибровочной эмульсии различной концентрации, для которых последовательно регистрировалась ЛДФ-грамма. Линейный регрессионный анализ показателей ЛДФ показал наличие зависимости изменения М0 от концентрации калибровочной эмульсии in vitro . Уравнение регрессии: концентрация = (0,07 + 0,91 × М0) × 100%; аппроксимация регрессии составила 0,96 (рис. 1).
Зависимость изменения М1 от концентрации калибровочной эмульсии также носила регрессионный
Изменение основных показателей ЛДФ-граммы в зависимости от концентрации калибровочной эмульсии
|
Концентрация калибровочной эмульсии, % |
Спектральный момент, tpu |
||
|
М 0 |
М 1 |
М n |
|
|
0 |
0,024 |
0,001 |
1,712 |
|
10 |
0,036 |
0,018 |
0,041 |
|
2 |
0,064 |
0,044 |
0,523 |
|
30 |
0,289 |
0,162 |
0,558 |
|
40 |
0,426 |
0,253 |
0,592 |
|
50 |
0,427 |
0,278 |
0,65 |
|
60 |
0,437 |
0,289 |
0,665 |
|
70 |
0,726 |
0,505 |
0,696 |
|
80 |
0,844 |
0,594 |
0,704 |
|
90 |
0,945 |
0,671 |
0,711 |
|
100 |
0,972 |
0,623 |
0,715 |
Концентрация, %
Рис. 1. Зависимость параметра лазерного допплеровского флоуметра М0от концентрации калибровочной эмульсии
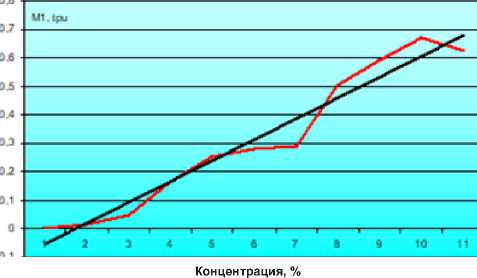
Рис. 2. Зависимость параметра лазерного допплеровского флоуметра М1 от концентрации калибровочной эмульсии
Следует указать на статистически значимую корреляцию М0 и М1, отмеченную в ходе эксперимента ( r =0,99 при р <0,001). В то же время не отмечено какой-либо зависимости между изменением концентрации экспериментальной эмульсии и нормированным спектральным моментом ЛДФ-граммы ( R 2 = 0,011).
По итогам выполненного линейного регрессионного анализа экспериментальных данных установлено, что изменения концентрации в растворе подвижных микрочастиц приводят к соответствующим изменениям M0 и M1 на ЛДФ-грамме, причем эта взаимосвязь имеет линейную природу, что соответствует данным литературы [2].
При исследовании работы ЛДФ в эксперименте in vitro определена зависимость параметров ЛДФ от объемной скорости протекающий перед ним жидкости, содержащей микрочастицы. По результатам этого эксперимента был составлен график зависимости параметров ЛДФ-граммы от скорости движения потока частиц, приведенный на рис. 3, затем методом линейной регрессии были определены параметры уравнения, описывающего зависимость параметров ЛДФ от скорости тока жидкости. Таким образом, были получены следующие уравнения:
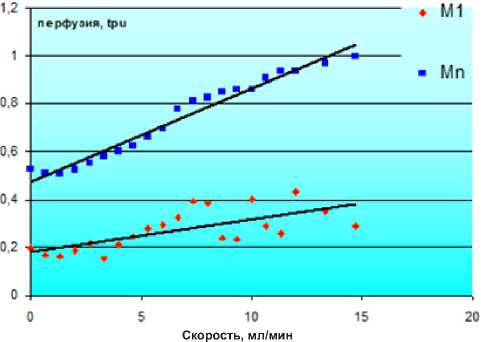
Рис. 3. Зависимость параметров лазерного допплеровского флоуметра М1 и Мn от скорости потока жидкости
Скорость, мл/мин
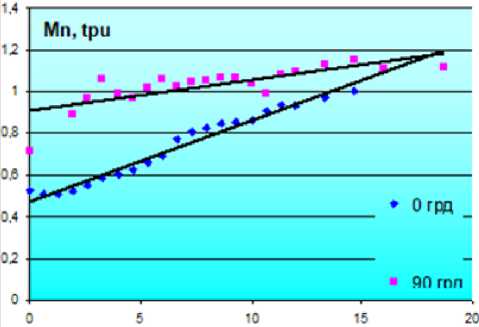
Рис. 4. Сравнение регрессии Мn в зависимости от угла расположения датчика лазерного допплеровского флоуметра к направлению потока жидкости
характер: концентрация = (0,095+1,295×М1)×100%; с аппроксимацией 0,95 (рис. 2).
Скорость = -2,75+34,95×М1 – аппроксимация R 2=0,47 (недостаточная степень аппроксимации);
Скорость = -11,6+24,84×Мn – аппроксимация R 2=0,97 (высокая точность аппроксимации).
Не обнаружено никакой зависимости M0 от скорости движения жидкости (коэффициент детерминации R 2<0,6).
Поскольку движение эмульсии возле края капилляра носит турбулентный характер, экспериментально определенную объемную скорость течения жидкости решили не переводить в линейную скорость.
Чтобы исследовать влияние изменения ориентации датчика относительно направления потока жидкости, датчик был удален из основного потока и установлен перпендикулярно (под углом 90º) прозрачной стенке капилляра с текущей калибровочной эмульсией. Проведенный анализ результатов выявил слабую корреляцию между параметром ЛДФ M1 и скоростью движения жидкости ( R 2<0,6). Полученные нами зависимости носят практически такой же характер, как в основополагающей работе по обработке сигналов ЛДФ [2].
Обсуждение. Согласно источникам [14], объемная скорость кровотока в микрососудистой сети организма человека колеблется примерно от 0,6 до 3,0 мл/мин в капиллярах диаметром 0,001–0,005 мм, в венулах размером 0,2–0,7 мм она достигает 1–10 мл/мин, а в артериолах и мелких артериях диаметром 0,2–1,0 мм скорость кровотока находится в диапазоне 2–100 мл/мин. Следовательно, разработанный нами флоуметр подходит для измерений кровотока в желудочном микроциркуляционном русле, поскольку скорости кровообращения здесь соответствуют диапазону чувствительности прибора.
Уравнение линейной регрессии для нормированного спектрального момента ЛДФ-граммы имело следующий вид: скорость = -32,94+40×Мn, при удовлетворительной аппроксимации (R2=0,69). Сравнение 2 линий регрессии при расположении датчика под углами 0 и 90º к направлению потока жидкости (рис. 4) показало их достоверное отличие (р<0,01).
Подводя итог изложенному, следует отметить, что зависимость показаний прибора от скорости тока жидкости, содержащей движущиеся микрочастицы, и концентрации этих микрочастиц в исследуемой жидкости носит интегральный характер. Амплитуда сигнала на выходе прибора – результат флоуметрии – пропорциональна скорости и количеству эритроцитов. Таким образом, результирующий параметр флуометра определяет динамическую характеристику микроциркуляции – поток крови в единицу времени в зондируемом объеме. Исходя из физической сущности спектральных моментов ЛДФ-граммы таким интегральным показателем тканевой перфузии служит М1.
Поскольку измерения in vivo выполняются внутри определенного объема ткани, включающего неопределенное число беспорядочно размещенных микрососудов, невозможно непосредственно определить скорость либо концентрацию частиц, перемещающихся в тканях. Получаемая нами совокупная характеристика – тканевая перфузия, или объемный кровоток, – представляет собой произведение средней скорости движения частиц на их общий объем. Если перфузия исследуемого участка находится в пределах нормы, то нормализованный спектральный момент принимает значения, близкие к контрольному диапазону (0–1 tpu). Однако при ухудшении кровоснабжения, вызванного ишемией, когда концентрация циркулирующих частиц приближается к нулевым отметкам, Mn резко возрастает вплоть до выхода за пределы стандартного значения калибровки, формируя характерный «зубчатый» профиль графика. При анализе ЛДФ-грамм в условиях ишемии полезно выделить понятие «биологического нуля». Этот термин часто применяется в ЛДФ и обозначает показатели прибора при исследовании тканей с отсутствующим кровообращением, включая фиксированные образцы биологической ткани или живые ткани после проведения специальных тестовых процедур перекрытия сосудов (окклюзионных тестов). Возникновение «биологического нуля» обусловлено специфическими свойствами рассеяния света тканью и наличием внутренних помех самой измерительной системы.
Заключение. В результате проведенной работы по калибровке экспериментальной установки ЛДФ, реализующей измерение микроциркуляторного кровотока бесконтактным способом, подтверждена ее пригодность для проведения измерений микроцир-куляторного русла тканей человека, получены основные зависимости параметров обработки сигнала ЛДФ от объема протекающей калибровочной эмульсии, ее скорости и количества в ней движущихся микрочастиц. Эти параметры являются важнейшими, определяющими все измерения с использованием подобного прибора. Проведена также калибровка установки по собственным шумам и получены значения «биологического нуля» с использованием препарата слизистой оболочки желудочно-кишечного тракта.


