Опыт лечения лимфомы Ходжкина рефрактерного течения
Автор: Червонцева Алевтина Михайловна, Вернюк Мария Андреевна, Гущина Елизавета Евгеньевна, Черкашина Ирина Васильевна, Феденко Александр Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Актуальность. Использование современных программ индукционной химиотерапии при первичной лимфоме Ходжкина позволяет достичь высоких долгосрочных результатов даже у пациентов с исходно неблагоприятным прогнозом. При этом токсичность лечения достаточно высока. Несмотря на эффективность химиотерапии, частота рецидивов и резистентных форм варьирует от 20 до 30 %. Достижение длительных ремиссий заболевания у части этих пациентов даже с помощью интенсивных режимов химиотерапии, включая высокодозную химиотерапию, крайне затруднительно. Описание клинического случая. Представлен опыт лечения лимфомы Ходжкина у молодой пациентки с распространенной стадией заболевания. В дебюте заболевания определялись симптомы интоксикации и неблагоприятные факторы риска: массивное образование в средостении, повышенное СОЭ, инфильтрация мягких тканей, плевры, перикарда, множественное поражение обоих легких, поражение более 3 областей лимфатических коллекторов. С учетом всех данных прогноз заболевания был крайне неблагоприятным с низкой вероятностью достижения ремиссии и высоким риском раннего прогрессирования. Использование индукционной химиотерапии по интенсифицированной программе «EACOPP-14» позволило достичь кратковременной частичной ремиссии. В связи с крайне тяжелой переносимостью лечения и в то же время с учетом достижения частичного эффекта лечение было продолжено по схеме «ABVD». При очередном промежуточном обследовании констатировано прогрессирование заболевания. В дальнейшем пациентке суммарно проведено множество курсов химиотерапии с использованием различных сочетаний химиопрепаратов с кратковременным положительным эффектом и последующим прогрессированием заболевания. Принимая во внимание резистентное к большинству базисных химиопрепаратов течение заболевания, в качестве альтернативного метода использована иммунотерапия ингибитором PD-1 ниволумабом, которая позволила стабилизировать заболевание. Заключение. Применение лекарственного препарата иммунологической направленности у пациентки с химиорезистентным течением лимфомы Ходжкина позволило остановить прогрессирование заболевания, улучшить качество жизни больной без значимых инфекционных осложнений и нежелательных явлений, связанных с применением препарата.
Лимфома ходжкина, резистентность, интенсивная химиотерапия, иммунотерапия
Короткий адрес: https://sciup.org/140254410
IDR: 140254410 | УДК: 616-006.441-08 | DOI: 10.21294/1814-4861-2021-20-1-155-161
Текст научной статьи Опыт лечения лимфомы Ходжкина рефрактерного течения
Эффективность современных программ лекарственного лечения позволяет определить лимфому Ходжкина как высококурабельное заболевание. Благодаря использованию интенсивных режимов индукционной терапии (BEACOPPesc, BEACOPP-14, EACOPP-14) у 90–94 % больных из группы неблагоприятного прогноза возможно достижение полных ремиссий заболевания [1]. Переход на интенсифицированные программы химиотерапии «BEACOPP-14» или «BEACOPPesc» позволил существенно улучшить результаты у пациентов высокого риска с достижением 3-летней выживаемости без прогрессирования (ВБП), равной 67,5 % [2–5]. Однако токсичность лечения достаточно высока [5, 6].
По нашему опыту в процессе выполнения всех запланированных 68 курсов (BEACOPPesc, BEACOPP-14, EACOPP-14) гематологическая токсичность 2–3 ст. регистрировалась практически у всех больных, частота инфекционных осложнений в виде пневмоний, фебрильной нейтропении, мукозитов достигала 22, 39 и 74 % соответственно. Все пациенты нуждались в стационарном лечении и получали терапию Г-КСФ. Таким образом, интенсификация терапии I линии сопровождается большим количеством осложнений, что подталкивает к поиску более взвешенного тактического лечебного подхода.
Тем не менее у ряда больных с распространенными стадиями, несмотря на соблюдение всех временных интервалов и доз химиопрепаратов, частота рецидивов/резистентных форм после инициальной терапии достигает 20–30 % [7, 8]. С целью достижения повторных ремиссий или преодоления резистентности применяются различные режимы
II линии химиотерапии (IGEV, DHAP, BeGEV, ESHAP, miniBEAM и др.). Одним из главных благоприятных прогностических факторов долгосрочной выживаемости следует считать химиочувствительность заболевания. По данным A. Sureda et al., достижение полной/частичной ремиссии позволяет выполнить этим пациентам высокодозную химиотерапию с аутологичной трансплантацией гемопоэтических клеток крови с последующей 5-летней общей выживаемостью (ОВ) – 75 %, выживаемостью, свободной от неудач лечения (ВСНЛ), – 68 %. Напротив, у пациентов с недостаточным ответом на интенсификацию лечения ОВ составила лишь 19 %, а ВСНЛ – 11 % [9].
С внедрением в клиническую практику новых таргетных препаратов результаты лечения больных с рецидивами и первичным резистентным течением заболевания существенно улучшились. С 2016 г. в России зарегистрирован препарат брентуксимаб ведотин (конъюгат моноклонального антитела к CD30 и противоопухолевого препарата мономети-лауристатина Е). Основными показаниями являются его применение у больных с рецидивирующим/ резистентным течением лимфомы Ходжкина к интенсивным режимам химиотерапии, а также после высокодозной терапии с трансплантацией гемопоэтических клеток с высоким риском прогрессирования и рецидива заболевания с целью консолидации достигнутого эффекта. Общий ответ был получен в 75 % случаев, полные ремиссии – в 34 %, частичные ремиссии – в 40 %. [10]. Пятилетняя ОВ и ВБП пациентов, у которых достигнута полная ремиссия заболевания, составили 64 % и 52 % соответственно [11]. Одним из перспективных на сегодняшний момент лечебным подходом в лечении этой когорты больных также рассматрива- ется метод сочетанного использования брентукси-маб ведотина со схемами II линии химиотерапии, в качестве «мостика» перед проведением аутологич-ной/аллогенной трансплантации [12]. Кроме того, с учетом высокой эффективности и достаточно хорошей переносимости, брентуксимаб ведотин предлагается к применению у больных лимфомой Ходжкина (ЛХ) с распространенными стадиями в первой линии терапии в сочетании со схемой «AVD» (B-vedotin+AVD) [13, 14].
В последние годы благодаря успехам молекулярной биологии в понимании патогенеза лимфомы Ходжкина одним из новых перспективных иммунных препаратов в терапии ЛХ является ниволумаб – моноклональное антитело, ингибитор рецептора PD-1 (анти-PD-1). В результате взаимодействия данного антитела с PD-1 на Т-клетках происходит блок опосредованной PD-L1 (лиганд к PD-1, локализующийся на поверхности клеток Березовского–Рид–Штернберга)/PD-1 передачи сигналов иммунной контрольной точки, что приводит к реактивации Т-клеток, которые реализуют цитотоксическую функцию против опухоли. У больных с рецидивирующим и резистентным течением классической ЛХ после аутологичной трансплантации и терапии брентуксимаб ведоти-ном применение ниволумаба позволило достичь объективного ответа у 2/3 пациентов (полные ремиссии – 13 %, частичные ремиссии – 55 %) [15–17]. Следует отметить хорошую переносимость препарата и низкую частоту побочных явлений при длительном применении в случае эффективности лечения.
Результаты российского ретроспективного исследования ниволумаба у больных с рефрактерной и рецидивирующей лимфомой Ходжкина с тяжелой предлеченностью согласуются с опубликованными зарубежными данными и демонстрируют высокую эффективность препарата в качестве монотерапии. Медиана наблюдения составила 25 мес, 2-летняя ОВ – 96 % (медиана ОВ не достигнута), БПВ – 40,6 % (медиана БПВ – 7,9 мес). Объективный ответ получен у 66 % больных. Ниволумаб был эффективен вне зависимости от интенсивности и структуры предшествующей терапии (в том числе без использования высокодозной химиотерапии с аутологичной трансплантацией ГСК и/или брен-туксимаб ведотина) [18].
Клинический пример
Больная К., 23 лет, в январе 2013 г. отметила повышение температуры тела до 39 °С, малопродуктивный кашель. После проведения антибактериальной терапии вышеуказанные жалобы были купированы, однако появилась боль в грудной клетке. Через 2 мес вновь появился кашель, субфебрильная лихорадка, повышенная ночная потливость. При комплексном обследовании выявлена опухоль переднего средостения. В апреле пациентка об- ратилась в МНИОИ им. П.А. Герцена, где была выполнена парастернальная медиастинотомия слева, биопсия опухоли передне-верхнего средостения. При гистологическом исследовании диагностирована классическая лимфома Ходжкина, нодулярный склероз, 2 подтип.
При комплексном обследовании установлена IVb стадия заболевания. По данным КТ выявлено поражение внутригрудных лимфоузлов в виде массивного опухолевого конгломерата («bulky-disease») с инфильтрацией перикарда, плевры, прилежащих отделов верхней доли легочной ткани слева, передней грудной стенки слева, многоочаговым поражением обоих легких, единичное образование в печени. В клиническом анализе крови определялось повышение СОЭ до 54 мм/ч, лейкоцитоз – 24×10 9/л. Больная отнесена к группе больных с неблагоприятным прогнозом, с низкой вероятностью достижения ремиссии и высоким риском раннего прогрессирования.. При оценке согласно международному прогностическому индексу выявлено 5 неблагоприятных факторов (гипоальбуминемия – 38 г/л, лимфопения – 7 %, лейкоцитоз, IV стадия, анемия – 103 г/л).
Принято решение о проведении интенсифицированного лечения по программе «EACOPP-14» (с исключением блеомицина и увеличением дозы доксорубицина) в количестве 6 курсов. С 24.05.13 по 26.06.13 проведено 3 курса «EACOPP-14». Несмотря на молодой возраст и сохранный соматический статус перед началом лечения, переносимость терапии была неудовлетворительная. Каждый послекурсовый период осложнялся развитием ряда инфекционных осложнений (фебрильная лихорадка, афтозный стоматит, бартолинит, трещина заднего прохода, катетер-ассоциированный сепсис, двусторонняя пневмония), гематологической токсичностью (III–IV степени). Проводилась массивная антибактериальная, противогрибковая терапия, введение стимуляторов гранулопоэза, заместительная гемокомпонентная терапия. После трех курсов противоопухолевой терапии отмечена регрессия В-симптомов и кашля, редукция опухолевой массы по данным промежуточного контрольного обследования составила более 50 %.
В связи с крайне тяжелой переносимостью лечения, обусловленной высокой токсичностью проводимой программы «EACOPP-14», и в то же время с учетом достижения частичной ремиссии заболевания в дальнейшем лечение было продолжено по схеме «ABVD». Пациентке было проведено 3 курса «ABVD» с 25.07.13 по 12.11.13.
Однако при очередном контрольном обследовании при УЗИ и КТ была выявлена отрицательная динамика в виде увеличения размеров образования в средостении до 43,3×28,5 мм (ранее 35,5×20,3 мм) с утолщением паракостальных мягких тканей до 5,6 мм и вовлечением верхнемедиастинальных отделов левого легкого. Пациентка
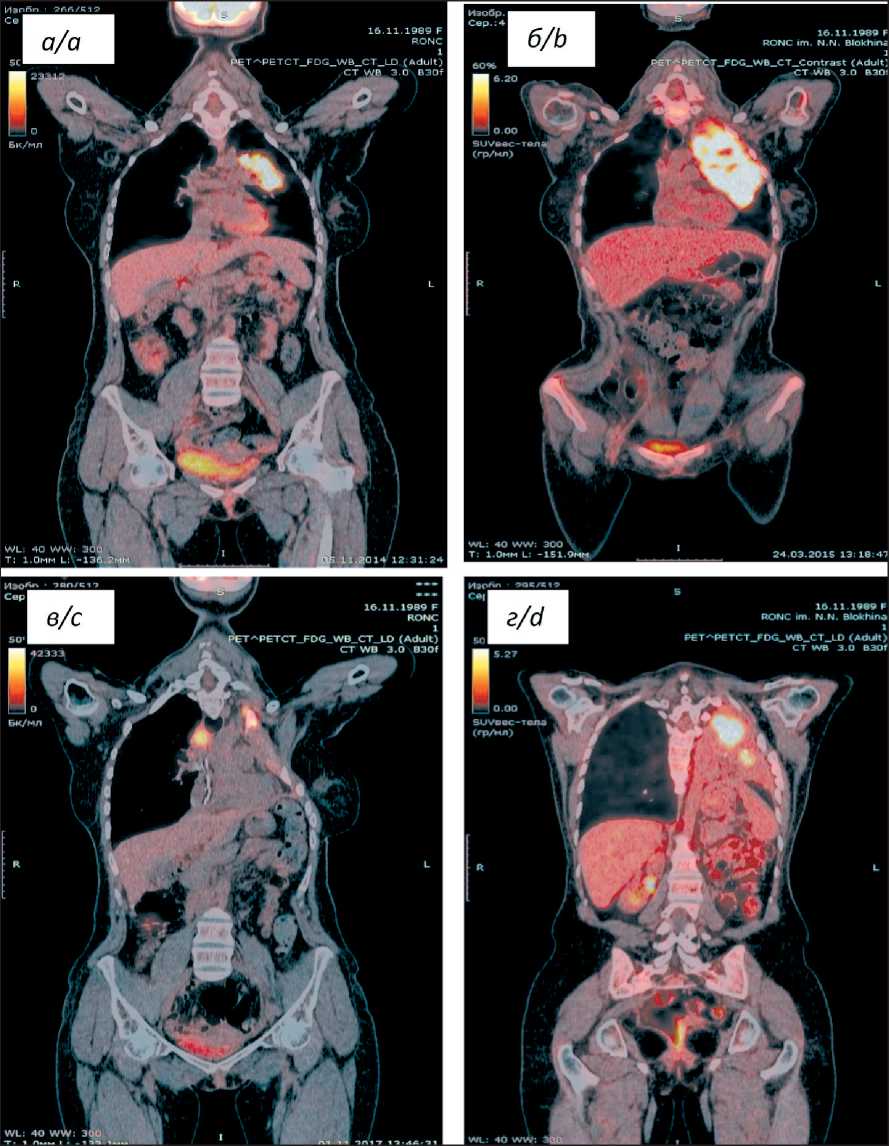
Рис. 1. ПЭТ/КТ на разных этапах лечения: а – кратковременное сокращение опухоли средостения в процессе проведения терапии «спасения» (salvage therapy); б – дальнейшее прогрессирование заболевания на фоне терапии брентуксимаб ведотином; в – регрессия опухоли на начальных этапах терапии ниволу-мабом; г – на длительной терапии ниволумабом, явление «псевдопрогрессирования»
Fig. 1. PET/CT at different stages of treatment: a – short-term reduction of the mediastinal tumor during salvage therapy; b – further progression of the disease during treatment with brentux-imab vedotin; c – tumor regression at the initial stages of nivolumab therapy; d – оn long-term therapy with niv-olumab, the phenomenon of «pseudo-progression»
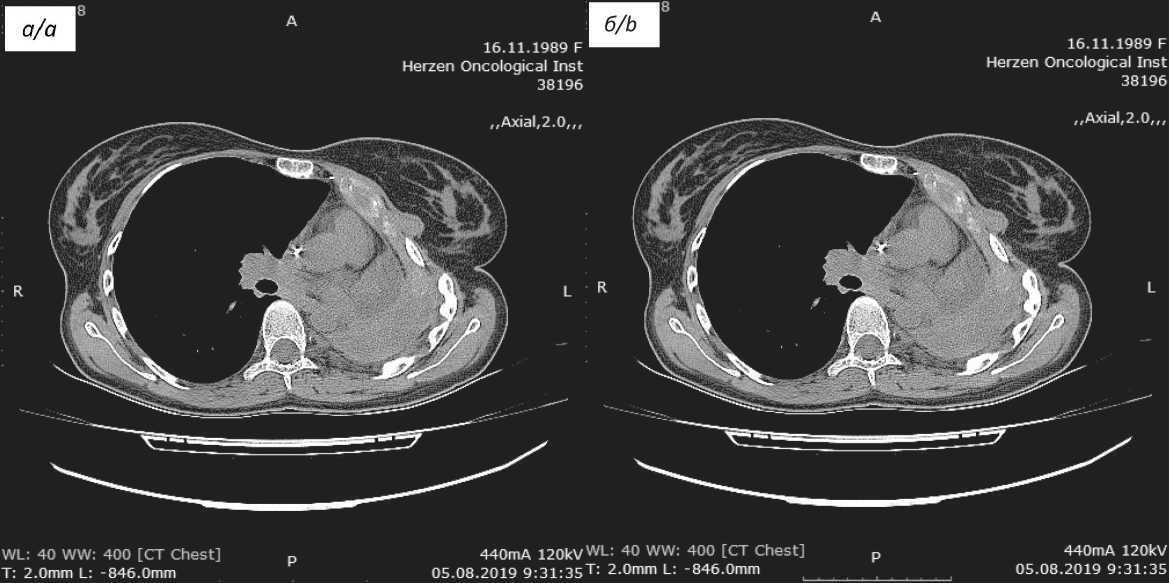
Рис. 2. КТ органов грудной клетки: а – перед началом терапии ниволумабом; б – через 2,5 года от начала лечения ниволумабом Fig. 2. CT of the thorax: a – before nivolumab therapy; b – after 2,5 years from the beginning of treatment nivolumab)
стала предъявлять жалобы на подъемы температуры тела, ночную потливость, покашливание.
Учитывая прогрессирование заболевания, молодой возраст пациентки, несмотря на тяжелую переносимость терапии первой линии («EACOPP-14»), решено было предпринять попытку интенсификации лечения (терапия «спасения»): с целью преодоления резистентности лимфомы провести химиотерапию по программе «IGEV». В дальнейшем при достижении достаточного противоопухолевого эффекта заболевания больной планировалось выполнить высокодозную химиотерапию с последующей трансплантацией аутологичных гемопоэтических стволовых клеток крови (ауто-ГСКК).
С 12.12.13 по 14.01.14 выполнено 2 курса химиотерапии по программе «IGEV». После их завершения вновь отмечено прогрессирование процесса в виде появления В-симптомов, увеличения размеров опухолевых очагов, в том числе образования в грудной полости, врастающего в левое легкое и частично ателектазирущего левый главный бронх. В дальнейшем пациентке суммарно проведено 10 курсов терапии с использованием различных сочетаний химиопрепаратов с кратковременным положительным эффектом и последующим прогрессированием заболевания (рис. 1а). Принимая во внимание резистентное к большинству базисных химиопрепаратов течение заболевания, в программу лечения включен брентуксимаб ведотин. Однако после 4 введения препарата по данным ПЭТ/КТ вновь отмечена отрицательная динамика (рис. 1б). С паллиативной целью выполнена ДЛТ на область средостения, подключичную и подмышечную области слева (СОД 35 Гр). В 2016 г. в качестве альтернативного метода лечения решено было провести иммунотерапию ингибитором PD-1 ниволумабом.
По настоящее время пациентке выполнено 52 введения ниволумаба (2,5 года терапии) с контрольными обследованиями в процессе терапии (рис. 2). Через 2 года от момента начала терапии при ПЭТ/КТ выявлено несколько новых очагов в левом гемитораксе парастернально слева, при
Список литературы Опыт лечения лимфомы Ходжкина рефрактерного течения
- Engert A., Diehl V., Franklin J., Lohri A., Dörken B., Ludwig W.D., Koch P., Hänel M., Pfreundschuh M., Wilhelm M., Trümper L., Aulitzky W.E., Bentz M., Rummel M., Sezer O., Müller-Hermelink H.K., Hasenclever D., Löffler M. Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkin’s lymphoma: 10 years of follow-up of the GHSG HD9 study. J Clin Oncol. 2009 Sep 20; 27(27): 4548-54. https://doi.org/10.1200/JCO.2008.19.8820.
- Hutchings M., Mikhaeel N.G., Fields P.A., Nunan T., Timothy A.R. Prognostic value of interim FDG-PET after two or three cycles of chemotherapy in Hodgkin lymphoma. Ann Oncol. 2005; 16(7): 1160-8. https://doi.org/10.1093/annonc/mdi200.
- Gallamini A., Hutchings M., Rigacci L., Specht L., Merli F., Hansen M., Patti C., Loft A., Di Raimondo F., D’Amore F., Biggi A., Vitolo U., Stelitano C., Sancetta R., Trentin L., Luminari S., Iannitto E., Viviani S., Pierri I., Levis A. Early interim 2-[18F]fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin’s lymphoma: a report from a joint Italian-Danish study. J Clin Oncol. 2007 Aug 20; 25(24): 3746-52. https://doi.org/10.1200/JCO.2007.11.6525.
- Johnson P., Federico M., Kirkwood A., Fosså A., Berkahn L., Carella A., d’Amore F., Enblad G., Franceschetto A., Fulham M., Luminari S., O’Doherty M., Patrick P., Roberts T., Sidra G., Stevens L., Smith P., Trotman J., Viney Z., Radford J., Barrington S. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med. 2016 Jun 23; 374(25): 2419-29. https://doi.org/10.1056/NEJMoa1510093.
- Viviani S., Zinzani P.L., Rambaldi A., Brusamolino E., Levis A., Bonfante V., Vitolo U., Pulsoni A., Liberati A.M., Specchia G., Valagussa P., Rossi A., Zaja F., Pogliani E.M., Pregno P., Gotti M., Gallamini A., Rota Scalabrini D., Bonadonna G., Gianni A.M.; Michelangelo Foundation; Gruppo Italiano di Terapie Innovative nei Linfomi; Intergruppo Italiano Linfomi.ABVD versus BEACOPP for Hodgkin’s lymphoma when high-dose salvage is planned. N Engl J Med. 2011 Jul 21; 365(3): 203-12. https://doi.org/10.1056/NEJMoa1100340.
- Skoetz N., Will A., Monsef I., Brillant C., Engert A., von Tresckow B. Comparison of first-line chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for people with early unfavourable or advanced stage Hodgkin lymphoma. Cochrane Database Syst Rev. 2017 May 25; 5(5): CD007941. https://doi.org/10.1002/14651858.CD007941.pub3.
- Townsend W., Linch D. Hodgkin’s lymphoma in adults. Lancet. 2012 Sep 1; 380(9844): 836-47. https://doi.org/10.1016/S0140-6736(12)60035-X.
- Diefenbach C.S., Connors J.M., Friedberg J.W., Leonard J.P., Kahl B.S., Little R.F., Baizer L., Evens A.M., Hoppe R.T., Kelly K.M., Persky D.O., Younes A., Kostakaglu L., Bartlett N.L. Hodgkin Lymphoma: Current Status and Clinical Trial Recommendations. J Natl Cancer Inst. 2016 Dec 31; 109(4): djw249. https://doi.org/10.1093/jnci/djw249.
- Sureda A., Constans M., Iriondo A., Arranz R., Caballero M.D., Vidal M.J., Petit J., López A., Lahuerta J.J., Carreras E., García-Conde J., García-Laraña J., Cabrera R., Jarque I., Carrera D., García-Ruiz J.C., Pascual M.J., Rifón J., Moraleda J.M., Pérez-Equiza K., Albó C., DíazMediavilla J., Torres A., Torres P., Besalduch J., Marín J., Mateos M.V., Fernández-Rañada J.M., Sierra J., Conde E.; Grupo Español de Linfomas/Trasplante Autólogo de Médula Osea Cooperative Group. Prognostic factors affecting long-term outcome after stem cell transplantation in Hodgkin’s lymphoma autografted after a first relapse. Ann Oncol. 2005 Apr; 16(4): 625-33. https://doi.org/10.1093/annonc/mdi119.
- Younes A., Gopal A.K., Smith S.E., Ansell S.M., Rosenblatt J.D., Savage K.J., Ramchandren R., Bartlett N.L., Cheson B.D., de Vos S., Forero-Torres A., Moskowitz C.H., Connors J.M., Engert A., Larsen E.K., Kennedy D.A., Sievers E.L., Chen R. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol. 2012 Jun 20; 30(18): 2183-9. https://doi.org/10.1200/JCO.2011.38.0410.
- Chen R., Gopal A.K., Smith S.E., Ansell S.M., Rosenblatt J.D., Savage K.J., Connors J.M., Engert A., Larsen E.K., Huebner D., Fong A., Younes A. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2016 Sep; 128(12): 1562-6. https://doi.org/10.1182/blood-2016-02-699850.
- Garcia-Sanz R., Sureda A., de la Cruz F., Canales M., Gonzalez A.P., Pinana J.L., Rodriguez A., Gutierrez A., Domingo-Domenech E., SanchezGonzalez B., Rodriguez G., Lopez J., Moreno M., Rodriguez-Salazar M.J., Jimenez-Cabrera S., Caballero M.D., Martinez C. Brentuximab vedotin and ESHAP is highly effective as second-line therapy for Hodgkin lymphoma patients (long-term results of a trial by the Spanish GELTAMO Group). Ann Oncol. 2019 Apr 1; 30(4): 612-620. https://doi.org/10.1093/annonc/mdz009.
- Younes A., Connors J.M., Park S.I., Fanale M., O’Meara M.M., Hunder N.N., Huebner D., Ansell S.M. Brentuximab vedotin combined with ABVD or AVD for patients with newly diagnosed Hodgkin’s lymphoma: a phase 1, open-label, dose-escalation study. Lancet Oncol. 2013 Dec; 14(13): 1348-56. https://doi.org/10.1016/S1470-2045(13)70501-1.
- Kumar A., Casulo C., Yahalom J., Schöder H., Barr P.M., Caron P., Chiu A., Constine L.S., Drullinsky P., Friedberg J.W., Gerecitano J.F., Hamilton A., Hamlin P.A., Horwitz S.M., Jacob A.G., Matasar M.J., McArthur G.N., McCall S.J., Moskowitz A.J., Noy A., Palomba M.L., Portlock C.S., Straus D.J., VanderEls N., Verwys S.L., Yang J., Younes A., Zelenetz A.D., Zhang Z., Moskowitz C.H. Brentuximab vedotin and AVD followed by involved-site radiotherapy in early stage, unfavorable risk Hodgkin lymphoma. Blood. 2016 Sep 15; 128(11): 1458-64. https://doi.org/10.1182/blood-2016-03-703470.
- Armand P., Engert A., Younes A., Fanale M., Santoro A., Zinzani P.L., Timmerman J.M., Collins G.P., Ramchandren R., Cohen J.B., De Boer J.P., Kuruvilla J., Savage K.J., Trneny M., Shipp M.A., Kato K., Sumbul A., Farsaci B., Ansell S.M. Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II Check Mate 205 Trial. J Clin Oncol. 2018; 36(14): 1428-39. https://doi.org/10.1200/JCO.2017.76.0793.
- Ansell S.M., Lesokhin A.M., Borrello I., Halwani A., Scott E.C., Gutierrez M., Schuster S.J., Millenson M.M., Cattry D., Freeman G.J., Rodig S.J., Chapuy B., Ligon A.H., Zhu L., Grosso J.F., Kim S.Y., Timmerman J.M., Shipp M.A., Armand P. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med. 2015 Jan 22; 372(4): 311-9. https://doi.org/10.1056/NEJMoa1411087.
- Younes A., Santoro A., Shipp M., Zinzani P.L., Timmerman J.M., Ansell S., Armand P., Fanale M., Ratanatharathorn V., Kuruvilla J., Cohen J.B., Collins G., Savage K.J., Trneny M., Kato K., Farsaci B., Parker S.M., Rodig S., Roemer M.G., Ligon A.H., Engert A. Nivolumab for classical Hodgkin’s lymphoma after failure of both autologous stemcell transplantation and brentuximab vedotin: a multicentre, multicohort, single-arm phase 2 trial. Lancet Oncol. 2016 Sep; 17(9): 1283-94. https://doi.org/10.1016/S1470-2045(16)30167-X.
- Lepik K.V., Mikhailova N.B., Kondakova E.V., Tsvetkova L.A., Zalyalov Yu.R., Borzenkova E.S., Moiseev I.S., Baikov V.V., Afanas'ev B.V. Effektivnost' i bezopasnost' nivolumaba v lechenii retsidiviruyushchei i refrakternoi klassicheskoi limfomy Khodzhkina: opyt PSPbGMU im. akad. I.P. Pavlova. Onkogematologiya. 2018; 13(4): 17-26. https://doi.org/10.17650/1818-8346-2019-13-4-17-26.
- Demina E.A., Leont'eva A.A., Tumyan G.S., Ryabukhina Yu.E., Trofimova O.P., Volkova N.V., Pryamikova Yu.I., Sotnikov V.M., Larionova V.B., Medvedovskaya E.G., Paramonova E.V., Manzyuk L.V., Probatova N.A., Kokosadze N.V., Osmanov E.A. Optimizatsiya terapii pervoi linii u patsientov s rasprostranennymi stadiyami limfomy Khodzhkina: effektivnost' i toksichnost' intensivnoi skhemy EASORR-14 (opyt FGBU «NMITs onkologii im. N.N. Blokhina» Minzdrava Rossii). Klinicheskaya onkogematologiya. 2017; 10(4): 443-52.
- Engert A., Haverkamp H., Kobe C., Markova J., Renner C., Ho A., Zijlstra J., Král Z., Fuchs M., Hallek M., Kanz L., Döhner H., Dörken B., Engel N., Topp M., Klutmann S., Amthauer H., Bockisch A., Kluge R., Kratochwil C., Schober O., Greil R., Andreesen R., Kneba M., Pfreundschuh M., Stein H., Eich H.T., Müller R.P., Dietlein M., Borchmann P., Diehl V.; German Hodgkin Study Group; Swiss Group for Clinical Cancer Research; Arbeitsgemeinschaft Medikamentöse Tumortherapie. Reducedintensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin’s lymphoma (HD15 trial): a randomised, openlabel, phase 3 non-inferiority trial. Lancet. 2012 May; 379(9828): 1791-9. https://doi.org/10.1016/S0140-6736(11)61940-5.


