Опыт многократного применения гибридной изолированной химиоперфузии печени мелфаланом при ее метастатическом поражении
Автор: Бабич А.И., Привалов М.А., Демко А.Е., Рева В.А., Мануковский В.А., Черемисов В.В., Решетов И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Актуальность. Частота злокачественных новообразований печени увеличивается, а радикальные операции могут быть выполнены у небольшого числа пациентов, большинство получают лекарственное лечение. Изолированная химиоперфузия печени (ИХП) - метод регионарной химиотерапии, эффективный при некоторых метастазах, однако он имеет высокую частоту осложнений и сложен при выполнении. Усовершенствованный метод гибридной ИХП обеспечивает новые возможности при лечении нерезектабельных новообразованияй печени. Описание клинического случая. Больному 64 лет с диагнозом: Рак сигмовидной кишки IV стадии проведена гибридная ИХП. Пациент выписан через 6 сут в удовлетворительном состоянии, без осложнений. Через 21 день после первой гибридной химиоперфузии проведена системная химиотерапия. Вторая процедура гибридной химиоперфузии проведена без лапаротомного этапа, путем мобилизации общих бедренных вены и артерии справа. В результате химиотерапии получен положительный результат по шкале mRECIST в виде полного ответа опухоли.
Изолированная химиоперфузия печени мелфаланом, метастатическое поражение печени, метастазы колоректального рака
Короткий адрес: https://sciup.org/140303742
IDR: 140303742 | УДК: 616.36-006-033.2-08:615.28 | DOI: 10.21294/1814-4861-2024-23-1-155-161
Текст научной статьи Опыт многократного применения гибридной изолированной химиоперфузии печени мелфаланом при ее метастатическом поражении
За последние десятилетия частота злокачественных новообразований печени (первичных и метастатических) имеет тенденцию к увеличению. Хирургическое удаление участков печени, пораженных образованиями, является основой лечения. Однако радикальные хирургические вмешательства могут быть выполнены не более чем у 20–25 % пациентов с новообразованиями печени [1–4]. Поэтому большинство пациентов получают лекарственное лечение. В то же время благодаря уникальной сосудистой анатомии печени получили развитие методы регионарной химиотерапии, применение которых позволяет напрямую воздействовать на опухолевые клетки и снизить общую системную токсичность. Среди методов регионарной химиотерапии чаще всего применяется трансартериальная химиоэмболизация, наименее часто – изолированная химиоперфузия печени (ИХП) [1, 4, 5].
Изолированная химиоперфузия печени – метод регионарной химиотерапии, суть которого заключается в выключении печени из системного кровотока, создании искусственного контура кровообращения печени с высокой концентрацией химиотерапевтического агента (как правило, мелфалана) на ограниченный период времени и отмывании печени от химиопрепарата перед включением в системный кровоток. Различные исследователи сообщают о частоте объективных ответов образований после ИХП, равной 37–52 % при метастазах увеальной меланомы, 50–60 % – при метастатическом поражении печени при прогрессировании колоректального рака, 45–55 % – при холангиокарциноме печени [5–11].
Несмотря на многообещающие результаты, применение данного метода ограничено вследствие сложности выполнения, высокой частоты послеоперационных осложнений (до 10 %) и возможности выполнить «открытую» ИХП только однократно. Развитие медицинских технологий привело к появлению метода ИХП. A.M. Eggermont et al. предложен малоинвазивный способ, по сути аналог ИХП, – хемосатурация с чрескожной перфузией печени. Авторы сообщают о сопоставимой, в сравнении с ИХП, эффективности данного метода в отношении нерезектабельных злокачественных новообразований печени. Кроме того, данную процедуру можно проводить многократно у одного и того же пациента [12]. Таким образом, изучение вопросов применения технологии ИХП у пациентов с нерезектабельными новообразованиями печени представляется актуальным.
Здесь представлен опыт применения разработанного нами усовершенствованного способа традиционной химиоперфузии – гибридной ИХП.
Клиническое наблюдение
В нашу клинику поступил пациент М., 64 года, с аденокарциномой сигмовидной кишки IV стадии, T3N0M1(hep). В анамнезе комплексное лечение, включая лапаротомию, паллиативную резекцию сигмовидной кишки от 06.2021; 2 курса химиотерапии по схеме FOLFOX. Прогрессирование заболевания в виде увеличения метастазов в печени. В рамках проводимого в ГБУ «НИИ СПб им. И.И. Джанелидзе» научного исследования эффективности методов изолированных органных химиоперфузий решено провести гибридную ИХП во время системной химиотерапии.
В условиях операционной 27.09.2021, под общим обезболиванием с искусственной вентиляцией легких, в положении больного на спине выполнена лапаротомия по Рио-Бранко. Острым путем рассечены сращения после предыдущих оперативных вмешательств. Для мобилизации аорты рассекли малый сальник, пересекли правую ножку диафрагмы и супрацеликально поддиафрагмально взяли на сосудистый турникет аорту. У пациента имелась типичная анатомия печеночной артерии (Michels 1 тип). Для формирования единого артериального ствола от аорты до печени последовательно перевязаны и пересечены: левая желудочная, селезеночная, правая желудочная артерии. Га- стродуоденальная артерия взята на обтяжку и, после получения пульсирующего артериального ретроградного кровотока, перевязана.
Выполнялась системная гепаринизация до достижения активированного времени свертывания в 400 сек. Далее через гастродуоденальную артерию в собственную печеночную артерию установлена канюля (8Fr) для подачи оксигенированной смеси с мелфаланом. В нижнюю полую вену (НПВ) установлен двухбаллонный катетер таким образом, чтобы нижний баллон после раздувания окклюзировал НПВ ниже кавальных ворот, верхний баллон окклюзировал НПВ выше кавальных ворот, а просвет для перфузии располагался на уровне кавальных ворот. После контроля позиционирования катетера в НПВ и канюли в собственной печеночной артерии последовательно пережаты: аорта под диафрагмой, общая печеночная артерия и воротная вена; последовательно раздуты нижний и верхний баллоны в НПВ. Сформирован перфузионный контур – подача раствора в собственную печеночную артерию, забор крови из ретропеченочного отдела НПВ (рис. 1).
Состав заполнения резервуара перфузионного контура: 1000 мл физиологического раствора хлорида натрия, 300 мл раствора гидрокарбоната натрия и мелфалан из расчета 1,5 мг на 1 кг массы тела. Содержимое перфузионного контура перед подачей в печеночную артерию направлялось в оксигенатор с теплообменником при помощи роликового насоса аппарата искусственного кровообращения (Stockert S5). Cкорость перфузии – 1200 мл в мин, давление в артериальной канюле было на уровне 14 мм рт. ст.; перфузию проводили в условиях гипероксии и гипертермии при температуре 39,5–40 °C; длительность ИХП – 25 мин. После окончания изолированной химиоперфузии печень отмывали 1500 мл 5 % раствора глюкозы; далее удалили канюли и ушили места канюляции сосудов, нейтрализовали гепарин раствором протамина сульфата; выполнили холецистэктомию, послойно ушили лапаротомную рану.
Время операции – 3 ч 30 мин. Интраоперационная кровопотеря около 300 мл. Интра- и послеоперационных осложнений не отмечено. Уровни АЛТ и АСТ нормализовались на 3-и сут после операции. Длительность нахождения в отделении реанимации – 2 сут. Пациент выписан на 6-е сут после операции в удовлетворительном состоянии.
Через 21 день после ИХП проведена системная химиотерапия по прежней схеме. 19.11.2021 выполнен очередной сеанс гибридной ИХП. Учитывая, что во время первого сеанса был сформирован единый артериальный ствол от аорты до печени, необходимости в выполнении лапаротомного этапа не было. ИХП проводилась следующим образом: в условиях общего обезболивания с искусственной вентиляцией легких, в положении пациента лежа на спине на операционном столе,
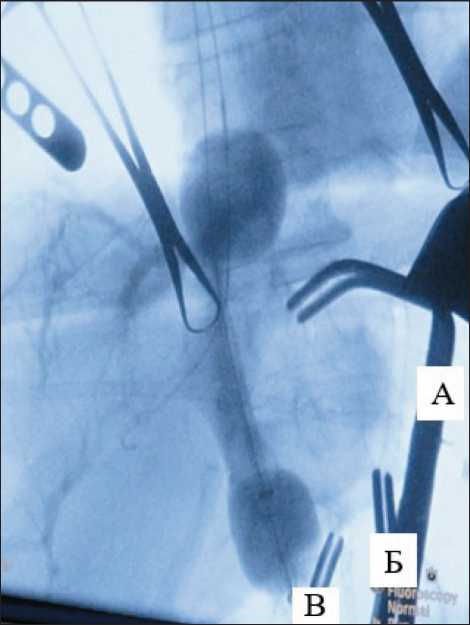
Рис. 1. Интраоперационная флюороскопия. В нижней полой вене раздут 2-баллонный катетер; сосудистыми зажимами пережата аорта (А), общая печеночная артерия (Б), воротная вена (В). Примечание: рисунок выполнен авторами
Fig. 1. Intraoperative fluoroscopy. A 2-balloon catheter is inflated in the inferior vena cava. The aorta (А), common hepatic artery (Б), portal vein (В) are clamped with vascular clamps. Note: created by the authors бедренным доступом по линии Кена справа длиной 5 см мобилизованы правая общая бедренная вена (ОБВ) и правая общая бедренная артерия (ОБА). Выполнена системная гепаринизация до достижения активированного времени свертывания в 400 сек. Через поперечную артериотомию ОБА в аорту установлен двухбаллонный катетер таким образом, чтобы нижний баллон после раздутия перекрывал просвет аорты, верхней брыжеечной артерии, правой и левой почечных артерий; верхний – просвет аорты выше сформированного ранее артериального ствола (чревного ствола). Канал для проведения перфузии располагался на уровне артериального ствола. Двухбаллонный катетер в НПВ заводился через ОБВ, как и при первой процедуре ИХП (рис. 2). Схема позиционированных баллонных катетеров и сформированного перфузионного контура представлена на рис. 3. Последовательно раздуты баллоны: нижний баллон в аорте, нижний баллон в НПВ, верхний баллон в аорте, верхний баллон в НПВ. Старт химиоперфузии. Параметры перфузии такие же, как и во время первой процедуры. После отмывания печени катетеры удалены из ОБА и ОБВ. Артериотоми-ческое отверствие ушито (пролен 5.0). На ОБВ затянут сформированный ранее кисетный шов. Швы на кожу.
Время операции – 2 ч. Интраоперационная кровопотеря – не более 50 мл. Интра- и послеопе-
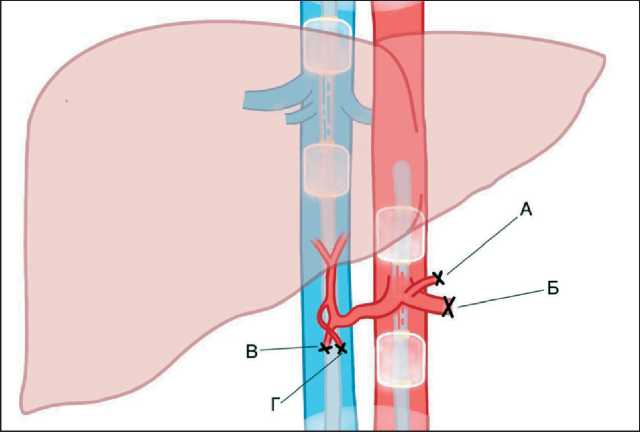
Рис. 3. Схема изолированной химиоперфузии печени: А – перевязанная левая желудочная артерия; Б – перевязанная селезеночная артерия; В – перевязанная правая желудочная артерия; Г – перевязанная гастродуоденальная артерия. Примечание: рисунок выполнен авторами
Fig. 3. Scheme of isolated liver chemoperfusion. A – ligated left gastric artery; B – ligated splenic artery; B – ligated right gastric artery; G – ligated gastroduodenal artery. Note: created by the authors
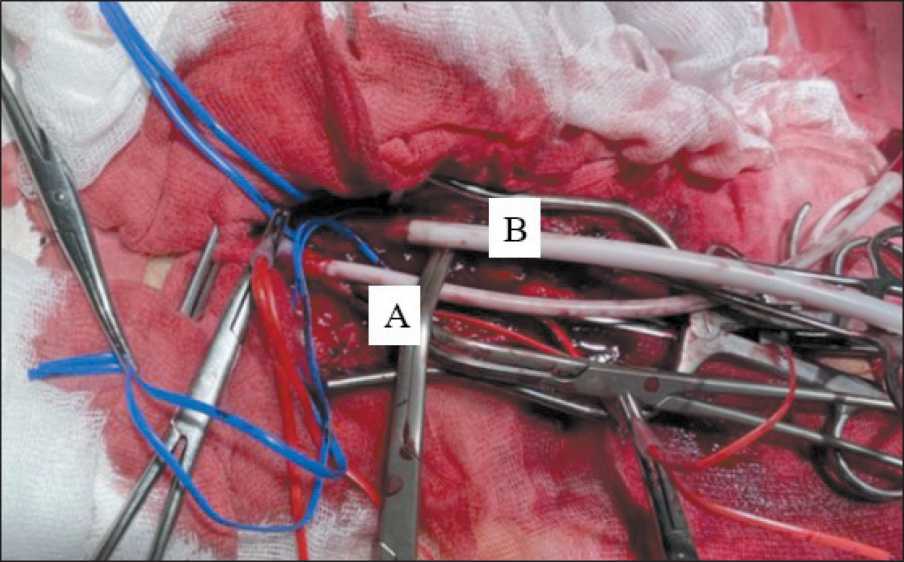
Рис. 2. Интраоперационное фото. Через артериотомическое и венотомическое отверстия в аорту (А) и нижнюю полую вену (В) установлены 2-баллонные катетеры Примечание: рисунок выполнен авторами
Fig. 2. Intraoperative photo. Through the arteriotomy and venotomy holes, 2-balloon catheters are installed into the aorta (A) and inferior vena cava (B) Note: created by the authors
рационных осложнений не отмечено. Препараты крови во время и после процедуры не переливались. Уровень АЛТ и АСТ нормализовался на 3-и сут после операции. Длительность нахождения в отделении реанимации – 1 сут. Пациент выписан на 5-е сут после операции в удовлетворительном состоянии. В течение 30-дневного амбулаторного наблюдения явлений гематологической и иной токсичности не отмечено.
Через 30 дней после гибридной ИХП выполнена контрольная мультиспиральная компьютерная томография органов брюшной полости. По шкале mRECIST наблюдается полный ответ опухоли.
Обсуждение
В настоящее время нерешенными остаются вопросы выбора показаний для проведения ИХП и способа проведения манипуляции. В мире ИХП наиболее часто проводится при нерезектабельном метастатическом поражении печени при прогрессировании увеальной меланомы [6]. В то же время ряд исследователей считает обоснованным применение ИХП у пациентов с изолированным метастатическим поражением печени при колоректальном раке, нейроэндокринных образованиях и холангиокарциноме [5, 7, 8, 12, 13]. Мы считаем, что на данном этапе развития медицинской науки, достижений лекарственной терапии применение ИХП нужно обсуждать при изолированном поражении печени, когда исчерпаны все доступные консервативные методы лечения и у пациентов с низкой коморбидностью в качестве дополнения к системному лекарственному лечению. Кроме того, ИХП можно проводить теми же препаратами, которые используются при системном лечении у пациентов, у которых по каким-либо причинам (почечная недостаточность, непереносимость системной химиотерапии) необходима редукция дозы химиопрепарата, а основной источник опухоли находится в печени [14, 15].
Преимуществами разработанного способа в сравнении с традиционной ИХП и хемосатурацией с инфузией в печеночную артерию являются:
– малая травматичность – возможность выполнить лапароскопически коррекцию артериальной анатомии – клипирование артерии при 1 типе (наиболее часто встречающемся), а двухбаллонные катетеры установить пункционно;
– нет необходимости в мобилизации НПВ и ее притоков, которая бывает затруднительной при увеличенной в размерах метастатически измененной печени, поскольку перекрытие просвета НПВ и коллатералей осуществляется раздутыми в просвете НПВ баллонами;
– нет необходимости в вено-венозном шунте (из нижней полой и воротной вен в верхнюю полую вену), поскольку системная гемодинамика поддерживается за счет пережатия одной зоны аорты и пережатия НПВ тотчас выше печени, а тепловая ишемия, при предварительной гепаринизации, в течение 30 мин является допустимой;
– нет необходимости в использовании дорогостоящих фильтров (как при хемосатурации);
– процедуру гибридной ИХП возможно выполнить многократно (традиционную ИХП – только 1 раз).
Что касается продолжительности ИХП, то, по нашему мнению, нет необходимости проводить химиоперфузию в течение 1 ч. Показано, что через 30 мин после химиоперфузии остается не более 7 % активных молекул мелфалана. Таким образом, простота и однообразие выполнения предложенной нами гибридной ИХП, ее низкая стоимость будут способствовать широкому распространению данного метода и позволят провести «большие» рандомизированные исследования, которые по- ставят точку в обсуждении обоснованности данной новой медицинской технологии и определят ее место. Чтобы оценить отдаленные результаты, необходимы дальнейшие исследования для валидации полученных результатов.
Список литературы Опыт многократного применения гибридной изолированной химиоперфузии печени мелфаланом при ее метастатическом поражении
- Polikarpov A.A., Tarazov P.G., Granov D.A., Polysalov V.N. Rentgenendovaskulyarnye protsedury v lechenii bol'nykh s nerezektabel'nymi metastazami kolorektal'nogo raka v pecheni. Rossiiskii onkologicheskii zhurnal. 2014; 19(4): 40-1.
- Adam R., Kitano Y. Multidisciplinary approach of liver metastases from colorectal cancer. Ann Gastroenterol Surg. 2019; 3(1): 50-6. https://doi.org/10.1002/ags3.12227.
- Tzeng C., Aloia T. Colorectal Liver Metastases. J Gastrointest Surg. 2012; 17: 195-201. https://doi.org/10.1007/s11605-012-2022-3.
- Gruber-Rouh T., Naguib N., Eichler K., Ackermann H., Zangos S., Trojan J., Beeres M., Harth M., Schulz B., Nour-Eldin A., Vogl T.J. Transarterial chemoembolization of unresectable systemic chemotherapy-refractory liver metastases from colorectal cancer: Long-term results over a 10-year period. Int J Cancer. 2013; 134: 1225-31. https://doi.org/10.1002/ijc.28443.
- Alexander H.R., Bartlett D.L., Libutti S.K., Pingpank J.F., Fraker D.L., Royal R., Steinberg S.M., Helsabeck C.B., Beresneva T.H. Analysis of factors associated with outcome in patients undergoing isolated hepatic perfusion for unresectable liver metastases from colorectal center. Ann Surg Oncol. 2009; 16(7): 1852-9. https://doi.org/10.1245/s10434-009-0482-9.
- Ben-Shabat I., Hansson C.,Eilard M., Cahlin C., Rizell M., Lindnér P., Mattsson J., Bagge R. Isolated hepatic perfusion as a treatment for liver metastases of uveal melanoma. J Vis Exp. 2015; (95): 52490. https://doi.org/10.3791/52490.
- van Iersel L.B.J., Koopman M., van de Velde C.J.H., Mol L., van Persijn van Meerten E.L., Hartgrink H.H., Kuppen P.J.K., Vahrmeijer A.L., Nortier J.W.R., Tollenaar R.A.E.M., Punt C., Gelderblom H. Management of isolated nonresectable liver metastases in colorectal cancer patients: a case-control study of isolated hepatic perfusion with melphalan versus systemic chemotherapy. Ann Oncol. 2010; 21(8): 1662-7. https://doi.org/10.1093/annonc/mdp589.
- Hafström L.R., Holmberg S.B., Naredi P.L., Lindnér P.G., Bengtsson A., Tidebrant G., Scherstén T.S. Isolated hyperthermic liver perfusion with chemotherapy for liver malignancy. Surg Oncol. 1994; 3(2): 103-8. https://doi.org/10.1016/0960-7404(94)90005-1.
- Huibers A., DePalo D.K., Perez M.C., Zager J.S., Olofsson Bagge R. Isolated hyperthermic perfusions for cutaneous melanoma in-transit metastasis of the limb and uveal melanoma metastasis to the liver. Clin Exp Metastasis. 2023. https://doi.org/10.1007/s10585-023-10234-6.
- Olofsson Bagge R., Nelson A., Shafazand A., All-Eriksson C., Cahlin C., Elander N., Helgadottir H., Kiilgaard J.F., Kinhult S., Ljuslinder I., Mattsson J., Rizell M., Sternby Eilard M., Ullenhag G.J., Nilsson J.A., Ny L., Lindnér P. Isolated Hepatic Perfusion With Melphalan for Patients With Isolated Uveal Melanoma Liver Metastases: A Multicenter, Randomized, Open-Label, Phase III Trial (the SCANDIUM Trial). J Clin Oncol. 2023; 41(16): 3042-50. https://doi.org/10.1200/JCO.22.01705.
- Bethlehem M.S., Katsarelias D., Olofsson Bagge R. Meta-Analysis of Isolated Hepatic Perfusion and Percutaneous Hepatic Perfusion as a Treatment for Uveal Melanoma Liver Metastases. Cancers (Basel). 2021; 13(18): 4726. https://doi.org/10.3390/cancers13184726.
- Eggermont A.M., van IJken M.G., van Etten B., van der Sijp J.R., ten Hagen T.L., Wiggers T., Oudkerk M., de Boeck G., de Bruijn E.A. Isolated hypoxic hepatic perfusion (IHHP) using balloon catheter techniques: from laboratory to the clinic towards a percutaneous procedure. Hepatogastroenterology. 2000; 47(33): 776-81.
- Dewald C.L.A., Becker L.S., Maschke S.K., Meine T.C., Alten T.A., Kirstein M.M., Vogel A., Wacker F.K., Meyer B.C., Hinrichs J.B. Percutaneous isolated hepatic perfusion (chemosaturation) with melphalan following right hemihepatectomy in patients with cholangiocarcinoma and metastatic uveal melanoma: peri- and post-interventional adverse events and therapy response compared to a matched group without prior liver surgery. Clin Exp Metastasis. 2020; 37(6): 683-92. https://doi.org/10.1007/s10585-020-10057-9.
- Vogel A., Ochsenreither S., Zager J.S., Wacker F., Saborowski A. Chemosaturation for primary and secondary liver malignancies: A comprehensive update of current evidence. Cancer Treat Rev. 2023; 113: 102501. https://doi.org/10.1016/j.ctrv.2022.102501.
- Rowcroft A., Loveday B.P.T., Thomson B.N.J., Banting S., Knowles B. Systematic review of liver directed therapy for uveal melanoma hepatic metastases. HPB (Oxford). 2020; 22(4): 497-505. https://doi.org/10.1016/j.hpb.2019.11.002.


