Опыт получения ХС из побочных продуктов переработки пресноводных рыб
Автор: Мухаммад Али, Антипова Л.В., Куцова А.Е.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевые системы
Статья в выпуске: 4 (106) т.87, 2025 года.
Бесплатный доступ
Статья посвящена анализу источников, методов получения и биомедицинского потенциала хондроитин сульфата (ХС), с особым акцентом на возможность его экстракции из побочных продуктов переработки пресноводных рыб. ХС, как сульфатированный гликозаминогликан, является ключевым структурным и функциональным компонентом внеклеточного матрикса, играя критическую роль в поддержании здоровья суставов, нейропластичности, регенерации тканей и модуляции воспалительных процессов. Его биологическая активность напрямую зависит от структурных особенностей, таких как степень сульфатирования («сульфатный код»), молекулярная масса и пространственная организация, которые, в свою очередь, определяются источником сырья и технологией выделения. В работе подчеркивается, что традиционное промышленное производство ХС опирается на сырье животного происхождения (хрящи крупного рогатого скота, свиней, кур), что сопряжено с рядом ограничений, включая религиозные аспекты, риски зоонозных заболеваний и нестабильность сырьевой базы. В этом контексте гидробионты, и особенно побочные продукты рыбоперерабатывающей промышленности (скелеты, хрящи, головы), рассматриваются как перспективная и устойчивая альтернатива. Использование такого сырья позволяет решить проблему утилизации отходов и соответствует принципам экономики замкнутого цикла. В статье проводится детальный обзор традиционных (щелочной и кислотный гидролиз) и современных (ферментативный, ультразвуковой, микроволновой, сверхкритическая флюидная экстракция) методов извлечения ХС. Делается вывод, что разработка эффективных и рентабельных технологий получения ХС из рыбных отходов представляет собой актуальную научно-практическую задачу. Такие технологии должны обеспечивать не только высокий выход и чистоту, но и сохранение специфической структуры сульфатированных изоформ, что определяет их терапевтическую эффективность. Внедрение подобных решений позволит расширить сырьевую базу для производства ХС, создать новые цепочки добавленной стоимости в рыбной отрасли и удовлетворить растущий рыночный спрос на функциональные нутрицевтики и биомедицинские материалы с предсказуемыми свойствами.
Хондроитин сульфат, гликозаминогликаны, побочные продукты рыбопереработки, экстракция, методы очистки, структура и функции, сульфатный код, функциональные продукты питания, нутрицевтики, биомедицинские материалы
Короткий адрес: https://sciup.org/140313604
IDR: 140313604 | УДК: 640 | DOI: 10.20914/2310-1202-2025-4-93-100
Текст научной статьи Опыт получения ХС из побочных продуктов переработки пресноводных рыб
В последние годы потребительский спрос, а следовательно, и ассортимент продуктов питания, сместился в сторону функциональных обогащенных продуктов питания и пищевых добавок. Это открывает новые возможности для использования хондроитинсульфата в качестве терапевтического нутриента, а также создает проблемы регулирования, стандартизации и контроля качества этих новых категорий продуктов, требующих повышенного внимания.
Хондроитин сульфат (ХС) - это типичный сульфатированный гликозаминогликан (ГАГ), основной компонент внеклеточного матрикса, в частности хрящевой ткани. Он играет важную роль в поддержании здоровья суставов и опорнодвигательного аппарата. Он способствует задержке воды в хряще, улучшает его амортизационные свойства и ингибирует ферменты, разрушающие хрящевую ткань. Многочисленные исследования, посвященные его защитному эффекту для хряща, особенно при остеоартрите, подтверждают его важность для укрепления здоровья.
Особые структурные свойства молекулы, включая её высокую анионность за счет большого количества сульфатных или карбоксильных групп, позволяют существовать множеству различных структурных типов и производных. Каждый из них отвечает за придание ХС разнообразных биологических функций, влияющих на развитие многих патологических процессов [1]. Доказано, что образцы сульфатирования ХС («сульфатный код»), обладают структурной сложностью и влияют на биологические функции. Нарушения степени сульфатирования ХС часто ассоциируются со скелетной дисплазией, дегенеративными заболеваниями и злокачественными опухолями. Качественный состав и последовательность сульфатирования (XC-A и XC - С; XC - D и XC - Е) идентифицированы в тканях рака груди. Известно, что синтезированные ХС дисахариды с различной степенью сульфатирования по-разному влияют на различные типы клеток [2]. Под действием отрицательного заряда ХС могут взаимодействовать с белками внеклеточного матрикса, регулируя клеточную активность, а модификации за счет взаимодействия ионов металлов и пептидов, образующих комплексы, в последние годы представляют большой интерес для исследователей [3].
Хондроитин сульфат в основном применяется в ортопедии и ревматологии (в качестве лекарственного препарата и пищевой добавки для лечения остеоартрита), а также в спортивной медицине (для профилактики эрозии суставов) и питании (в качестве функционального пищевого ингредиента).
Рынок хондроитин сульфата представлен разнообразной группой производителей. Различные препараты ХС производятся из тканей животных (например, крупного рогатого скота, свиней и кур) и водных обитателях (хрящах рыб, акул, скатов и костных рыб) [4]. Производители различаются по этим источникам сырья, уровням чистоты и формам выпуска (порошок, капсулы, инъекции). Конечные продукты ХС, полученные из этих смешанных источников, могут иметь разные характеристики, включая чистоту, биологическое воздействие, наличие примесей и клиническую эффективность, что порождает проблемы качества и безопасности препаратов [4]. Для оценки мировых стандартов поставок и качества крайне важно проанализировать основных производителей хондроитин сульфата.
Несмотря на широкое использование хондроитин сульфата в качестве добавки, наблюдается отсутствие четко регламентированных «продуктов» (сырья или стандартных ингредиентов) для промышленного производства обогащенных продуктов питания, а не только фармацевтических препаратов или пищевых добавок. Это создает регуляторный вакуум, который может повлиять на качество и безопасность конечного продукта. Важнейшим этапом в реализации технологий ХС является экстракция. Существующие методы экстрагирования ХС с использованием щелочей или других органических веществ не соответствуют принципам экологически чистого производства. Альтернативным способом получения ХС из животных или водных источников, выступает биосинтез и ферментация [ Ошибка! Источник ссылки не найден. ]. Весьма перспективно комбинирование биосинтеза и ферментации с помощью генной инженерии. Например, показано, что дрожжи Pichia pastoris могут служить клеточной фабрикой для получения ХС типа А, что решает вопрос дефицита сырья животного происхождения для этих целей в будущем [ Ошибка! Источник ссылки не найден. ].
Химическая природа ХС известна и описана, идентифицировано молекулярное разнообразие в природных источниках : Хондроитинсульфат (ХС) - это сульфатированный гликозаминогликан (ГАГ), состоящий из повторяющихся диса-харидных единиц.
Каждая дисахаридная единица состоит из двух молекул сахара: N-ацетилгалактозамин (GаlNАс) и Глюкуроновой кислоты (О1сА)
Эти единицы связаны между собой в-1,4-гликозидными связями. Ключевой структурной особенностью ХС является наличие сульфатных групп, присоединенных к гидроксильным группам Gа1NАс, которые могут различаться по положению и количеству, что приводит к различным подтипам ХС Общая структура представляет собой последовательность соединенных между собой фрагментов [Ошибка! Источник ссылки не найден.]: [GlсА – β(1→3) – GаlNАс-β(1→4)]n, где GlсА: глюкуроновая кислота GаlNАс: N-ацетилгалактозамин n: количество повторяющихся дисахаридных единиц Известны и описаны схемы сульфатирования [Ошибка! Источник ссылки не найден.]:
Хондроитин-4-сульфат (ХС-A): сульфатная группа в 4-й позиции GаlNАс.
Хондроитин-6-сульфат (ХС-C): сульфатная группа в 6-й позиции GаlNАс.
Хондроитин-2,6-сульфат (ХС-D): сульфатные группы как во 2-й позиции GlсА, так и в 6-й позиции GаlNАс.
Хондроитин-4,6-сульфат (ХС-E): сульфатные группы как в 4-й, так и в 6-й позиции GаlNАс.
Молекулярное разнообразие ХС возникает из-за изменений в моделях сульфатирования, когда положение и количество сульфатных групп различается, что приводит к возникновению различных подтипов (например, ХС – A, ХС – C, ХС – D, ХС – E). [2] Количество повторяющихся дисахаридных единиц может различаться, что влияет на длину цепи и молекулярную массу.
Пространственное строение представлено: трехмерной структурой ХС, которая различается в зависимости от модели сульфатирования и взаимодействия с другими молекулами. Разнообразие строения позволяет ХС выполнять широкий спектр биологических функций, многие из которых расшифрованы.
Например ХС, является важнейшим компонентом внеклеточного матрикса (ВКМ) и выполняет ряд функций в организме [ Ошибка! Источник ссылки не найден. ]:
-
• ХС является основным компонентом протеогликанов (например, аггрекана) в хряще. Он притягивает и удерживает воду, обеспечивая сжимаемость и упругость хряща, что необходимо для функционирования суставов и защиты от ударов;
-
• регуляторная функция ХС заключается во взаимодействии с факторами роста, цитокинами и рецепторами клеточной поверхности, модулируя сигнальные пути, участвующие в пролиферации, дифференцировке и миграции клеток, влияя на восстановление и развитие тканей;
-
• установлены противовоспалительные эффекты ХС, которые подавляют выработку провоспалительных факторов, разрушающих хрящ. Это делает его полезным при лечении остеоартрита и других воспалительных заболеваний суставов;
-
• в нервной системе ХС является компонентом, который стабилизирует синапсы и регулирует
-
• ХС способствует восстановлению тканей, регулируя активность факторов роста и заживление ран; усиливает отложение коллагена;
-
• некоторые формы ХС (например, XC-E) проявляют умеренную антикоагулянтную активность, взаимодействуя с антитромбином, выполняя функции стабилизации крови, подобно гепарину;
-
• наконец, ХС вместе с гиалуроновой кислотой способствует вязкости синовиальной жидкости, уменьшая трение между поверхностями суставов.
Поскольку потребление мяса и объемы его производства растет, на скотобойнях образуется большое количество съедобных побочных продуктов, включая хрящи животных. Аналогичное можно отметить и рыбоперерабатывающем секторе экономики. Полисахариды или белки, содержащиеся в хрящах животных, могут быть переработаны в ценные ингредиенты для промышленной продукции. Информационные данные по получению ХС представлены на рисунке 1А.
Курятина является одним из самых популярных видов мяса по всему миру. Отчет Управления сельского хозяйства США за 2021 год указывает, что ежегодное производство куриного мяса в России составляет 4.725 миллиона метрических тонн, что означает значительное количество побочных продуктов (например, кости, хрящи и соединительные ткани). В частности, из куриной грудинки обычно делают закуски (хрящи и курятина) за счет богатого содержания питательных веществ (например, коллаген и полисахариды). Отмечено, что ХС и пептиды ХС могут быть извлечены из хряща куриной грудинки [Ошибка! Источник ссылки не найден.–Ошибка! Источник ссылки не найден.]. Показано, что другие части, включая хрящи передней грудной клетки, проксимальные хрящи плеча, дистальные хрящи плеча, проксимальные хрящи бедра, дистальные хрящи бедра, проксимальные хрящи голени и дистальные хрящи голени бройлеров, могут быть использованы для извлечения пептидов ХС с помощью тканевого автолиза с использованием буфера ацетата натрия с концентрацией 0,5 моль/л [Ошибка! Источник ссылки не найден.]. Кроме того, костная ткань куриных ног (то есть концы костей ног) содержит полисахариды (в основном ХС). Экспериментально доказано, что и костный бульон может быть использован для изоляции ХС [Ошибка! Источник ссылки не найден.]. Более того, побочные продукты от механического обвалки курятины, такие как (раздробленные кости, хрящи, кожа, жировая ткань и мышцы) также могут быть использованы для получения ХС [Ошибка! Источник ссылки не найден.]. В данных литературы описан способ получения ХС из этого побочного сырья с использованием протеолиза.
Кости грудинного отдела имеют наивысшую концентрацию целевого продукта. Доказано, что основным компонентом глюкамино-гликана (ГАГ) в вышеописанных образцах является ХС. Аналогичные исследования предполагают, что сульфатированный гликозаминогликан можно выделить из костей крыла, костей ног, передних костей и задних костей куриных тушек, а из целой куриной тушки массой 1,66 кг можно получить 1,9 г ХС [Ошибка! Источник ссылки не найден.]. Хрящи или хряще подобные ткани других видов домашней птицы (например, уток, гусей и индеек) теоретически могут быть использованы для получения ХС, однако исследования на эту тему и смежные вопросы мало отражены в современной литера- туре. Вероятно, это связано с ограниченностью объемов производства по сравнению с побочными продуктами при переработке кур.
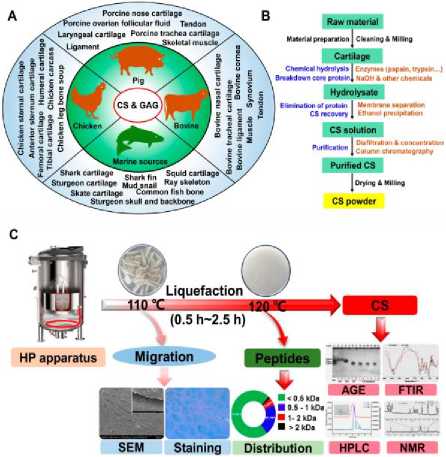
Рисунок 1. Источники ХС и методы добычи, основанные на использовании хряща. (A) Основные источники ХС и GAG; (B) традиционные процессы экстракции ХС, основанные на использовании хряща; (C) совместная продукция ХС и пептидов из грудинного хряща курицы путем обработки горячим давлением [Ошибка! Источник ссылки не найден.]
Figure 1. Sources of cholesterol and extraction methods based on the use of cartilage. (A) Main sources of cholesterol and GAG; (B) traditional cholesterol extraction processes based on the use of cartilage; (C) co-production of cholesterol and peptides from chicken sternal cartilage by hot pressure treatment [11]
Говяжьи побочные продукты являются еще одним основным источником ХС. Говяжий носовой хрящ, трахейный хрящ и роговица глаза – все это общие сырьевые материалы, используемые для получения ХС. Недавнее исследование показало, что ХС можно извлечь из говяжьего носового хряща после обработки папаином и трипсином, причем фракция с наименьшей молекулярной массой ХС проявила более сильную антиоксидантную активность [ Ошибка! Источник ссылки не найден. ]. Имеются литературные данные об извлечении ХС и хондроитин сульфатных Протеогликаов из говяжьего трахейного хряща. При этом цепи ХС были гетерогенными, с разными уровнями хондроитин-4- и 6-сульфатов [ Ошибка! Источник ссылки не найден. ]. ХС можно получать из роговицы и других соединительных тканей. Роговица глаз говядины может быть использована для извлечения ХС – протеогликанов, которые могут быть применены в исследованиях, касающихся структурных взаимодействий, участвующих в адгезии инфицированных Plasmodium falciparum красных кровяных клеток [ Ошибка! Источник ссылки не найден. ]. Из соединительных тканей выделены и описаны два преобладающих
Мухаммад Али и др. Вестник ВГУИТ, 2025, Т. 87, №. 4, протеогликана в говяжьих сухожилиях и связках - декорин и бигликан [ Ошибка! Источник ссылки не найден. , Ошибка! Источник ссылки не найден. ].
Побочные продукты переработки свиней являются еще одним источником ХС. В частности, изучалось использование хрящей носа, гортани и трахеи свиней для получения ХС [ Ошибка! Источник ссылки не найден. ]. Фолликулярная жидкость свиных яичников также может быть использована для изоляции протеогликанов, включая ХС и дерматансульфат [ Ошибка! Источник ссылки не найден. ]. В свиных сухожилиях и связках большинство ГАГов составляет гиалуронан, за которым следуют дерматансульфат и небольшие количества ХС [ Ошибка! Источник ссылки не найден. ]. В скелетной мышце свиней также можно выделить сульфатированные ГАГи [ Ошибка! Источник ссылки не найден. ]. Другие источники животного происхождения, включая хрящи носа овец [ Ошибка! Источник ссылки не найден. ] и растущие оленьи рога [ Ошибка! Источник ссылки не найден. ], также были описаны при извлечении ХС. При этом установлена химическая природа ХС из оленьих рогов [ Ошибка! Источник ссылки не найден. , Ошибка! Источник ссылки не найден. ], ГАГи могут быть изолированы из различных частей растущих рогов лося; было подтверждено, что в среднем общее количество уроновой кислоты в ГАГах составляет 88 % в каждом фрагменте рога.
Хотя большинство коммерческого ХС получают из животных источников (например, хрящей или некартежных тканей кур, говядины, свинины, овец и других наземных животных), некоторые проблемы, связанные с этими источниками, включая религиозные ограничения и безопасность (например, бешенство, птичий грипп H7N9, сап и другие риски пищевой цепи), следует учитывать. Указанные выше проблемы могут быть исключены путем использования костистых рыб и других гидробионтов в качестве источников ХС. При этом ХС из этих источников (акула, осетр и скат) показал лучшую активность и качество. Было сообщено, что ежегодно добывается 132 миллиона гидробионтов, включая аквакультуру (в основном рыбу, моллюсков и ракообразных), и более 35 % общей массы составляют побочные продукты или отходы [Ошибка! Источник ссылки не найден.]. Значительные объемы побочных продуктов в виде хрящевых материалов или костей рыбы (например, акулы, лосося, ската и обычной рыбы) и других гидробионтов, таких как морские губки, морские огурцы, кальмары, моллюски и некоторые беспозвоночные, являются хорошими источниками для получения ГАГов [Ошибка! Источник ссылки не найден.,Ошибка! Источник ссылки не найден.]. Для этих водных организмов были исследованы хрящ акулы [Ошибка! Источник ссылки не найден.–Ошибка! Источник ссылки не найден.], хрящ ската [Ошибка! Источник ссылки не найден.], хрящ кальмара [Ошибка! Источник ссылки не найден.], хрящ, череп и позвоночник осетра [Ошибка! Источник ссылки не найден.] и улитки-пресмыкающиеся [Ошибка! Источник ссылки не найден.] для получения ХС с помощью различных методов извлечения. Хотя плавники акул являются известным источником ХС высокого качества, нерациональное использование акул и другие экологические аспекты приводят к ограниченному объему извлечения ХС. Привлекательным источником ХС являются скелеты ската, однако практического значения они не имеют. [Ошибка! Источник ссылки не найден.,Ошибка! Источник ссылки не найден.,]. ХС также может быть изолирован и очищен из костей обычных рыб, таких как морской волк, треска, акула-катран, лосось и тунец [Ошибка! Источник ссылки не найден.]. Содержание ХС в них колеблется от 0,011 % для трески до 0,34 % для морского волка с различными структурными дисахаридами.
Расшифровка функций ХС в поддержании здоровья опорно-двигательной системы человека привели к мощному развитию направления по получению и применению препаратов на основе изученных сырьевых источников. Обобщение информации позволяет выделить наиболее важные этапы технологии - извлечение и очистка целевого вещества.
В настоящее время (ХС) широко используется в фармацевтике и в составе нутрицевтиков, благодаря своим терапевтическим свойствам, особенно при лечении остеоартрита.
Извлечение ХС из хрящей животных (бычьего, свиного, птицеводческого или водного происхождения) включает несколько методов, каждый из которых имеет свои уникальные преимущества и недостатки. [ Ошибка! Источник ссылки не найден. ]
Представляет научный и практический интерес анализ наиболее распространенных способов извлечения ХС из сырья - побочных продуктов животного происхождения. Хрящ обрабатывают щелочным раствором (например, КаОН) для гидролиза сопутствующих белков и
Muhammad Ali et al. Proceedings of VSUET, 2025, vol. 87, no. 4, pp. 93-100
выделения ХС. Щелочные условия разрушают
пептидные связи, растворяя протеогликановую матрицу.
К преимуществам способа можно отнести высокий выход ХС за счет эффективной деградации белка. Способ прост в исполнении, экономически эффективен и удовлетворяет условиям крупномасштабного производства.
Однако, жесткие условия могут привести к частичной деградации цепей ХС. При реализации способа требуется нейтрализация после экстрагирования, что усложняет процесс и приводит к образованию солей.
Известен опыт ферментативного гидролиза [ Ошибка! Источник ссылки не найден. ].
Апробированы ферменты, такие как папаин, трипсин или протеиназа К и др. для расщепления белков в хряще, высвобождая XC. Этот метод выполняется в условиях мягкого рН и температуры. При этом сохраняется структурная целостность цепей XC. За счет высокой специфичности гидролиза белка минимизируются загрязнения конечных продуктов. Вместе с тем, можно отметить, что ферменты дороги и увеличивают производственные затраты.
А также требуется точный контроль рН, температуры и концентрации фермента.
Применяется Кислотная экстракция [ Ошибка! Источник ссылки не найден. ], когда хрящ обрабатывают кислотными растворами (например, НСl) для выделения XC. Кислотные условия обеспечивают гидролиз коллагена и других белков.
Способ характеризуется простотой и экономичностью. Установлено, что при этом возникает частичная десульфатация XC, что снижает его биологическую активность.
Кроме этого, жесткие условия могут разрушать цепи XC, влияя на его молекулярную массу.
Ультразвуковую экстрагирование применяют для разрушения хрящевой ткани, что создает условия для высвобождения XC. Эффект кавитации усиливает разрушение внеклеточного матрикса [ Ошибка! Источник ссылки не найден. ]. Способ обеспечивает более интенсивную экстракцию по сравнению с традиционными методами.
При этом значительно сокращается использование химических веществ, что делает процесс экологически чистым.
Однако, реализация способа требует специализированного оборудования, что увеличивает производственные затраты. Следует учитывать, что длительное воздействие ультразвука может привести к фрагментации цепей XC.
При обработке хряща имеется опыт использования сверхкритического диоксида углерода (CO₂), состояние которого обеспечивает
Высокая чистота экстрагированного XC достигается селективностью экстракции.
К недостаткам можно отнести высокую стоимость оборудования и значительные эксплуатационные расходы, а также ограниченная масштабируемость для промышленного применения [ Ошибка! Источник ссылки не найден. ].
В процессе микроволновой экстракции нагрев и разрушение хрящевой ткани достигаются за счет микроволновой энергии, высвобождающей XC – быстрый нагрев усиливает разрушение внеклеточного матрикса. Способ характерен интенсивностью и экономичностью экстракции, а также энергоэффективностью по сравнению с традиционными методами нагрева. Однако существует риск перегрева, который может привести к деградации XC.
Технология требует точного контроля параметров микроволн (мощность, время, температура). [ Ошибка! Источник ссылки не найден. ].
Известен опыт применения ионообменной хроматографии, когда после первоначальной экстракции XC очищается с помощью ионообменных смол. При этом отрицательно заряженные сульфатные группы XC связываются с положительно заряженными, что дает высокую чистоту XC.
Этот способ обеспечивает удовлетворяет требованиям для фармацевтических применений, эффективно удаляет загрязняющие вещества, включая белки и другие ГАГ. Однако способ дорог, процесс трудоемок, а также требует дополнительных этапов для регенерации и обслуживания смол.
Достаточно прост и распространен для практического применения метод осаждения [ Ошибка! Источник ссылки не найден. ], когда XC осаждается из раствора с использованием этанола или других растворителей. Добавление растворителей снижает растворимость XC, который выпадает в осадок. Процесс простой и экономичный, реализация в условиях крупномасштабного производства, не требует специального оборудования. Как недостаток, следует отметить недостаточную чистоту за счет соосажде-ния примесей. Требуется тщательный контроль концентрации растворителя и температуры.
При мембранной фильтрации XC отделяется от примесей с помощью ультрафильтрационных или нанофильтрационных мембран. [ Ошибка! Источник ссылки не найден. ] Мембраны избирательно пропускают XC, удерживая более крупные сопутствующие молекулы.
Способ весьма привлекателен для реализации, масштабируемый и эффективный для промышленного применения. В нем не используются органические растворители, что делает его экологически чистым.
Сопутствует загрязнение мембран, что со временем снижает эффективность процесса.
Требуется регулярное обслуживание и замена мембран.
В комбинированных методах для экстракции и очистки используется сочетание ферментативного гидролиза, щелочной обработки и ионообменной хроматографии. [ Ошибка! Источник ссылки не найден. ]. Такой подход максимизирует выход и чистоту, подходит для конкретных исходных материалов и применений.
Однако, в большинстве случаев, процесс сложный и трудоемкий.
Требует более высоких эксплуатационных расходов из-за многоэтапности.
Заключение
Выбор метода экстракции зависит от желаемого конечного результата выхода, чистоты и направления применения XC.
Для XC фармацевтического класса предпочтительны такие методы, как ферментативный гидролиз и ионообменная хроматография, из-за их способности сохранять структурную целостность и биологическую активность. Однако эти методы являются дорогостоящими и требуют много времени. Для промышленного производства более подходящими являются методы щелочного гидролиза и осаждения из-за их экономической эффективности и масштабируемости.
Новые технологии, такие как ультразвуковая и микроволновая экстракция, предлагают более быстрые и экологически чистые альтернативы, но требуют дальнейшей оптимизации для минимизации деградации XC. Сверхкритическая флюидная экстракция, хотя и является высокочистой, ограничена ее высокой стоимостью и проблемами масштабируемости.
Поиск новых более современных принципов, подходов и методов в получении ХС следует признать актуальной проблемой. Но менее важный этап исследований связан с расширением перечня потенциальных сырьевых источников в разработке препаратов ХС с различной применяемостью в практической деятельности человека.


