Опыт применения метода локального отрицательного давления в комплексном лечении некротизирующих инфекций мягких тканей
Автор: Кисляков В.А., Горшунова Е.М., Аль-арики М.К.М.
Журнал: Московский хирургический журнал @mossj
Рубрика: Гнойная хирургия
Статья в выпуске: 3 (89), 2024 года.
Бесплатный доступ
Введение. Лечение обширных ран, как последствия некротизирующих инфекций мягких тканей, представляет собой важную проблему из-за роста данной патологии, частого поражения работоспособного населения, высокой вероятности инвалидизации, сложностей реконструкции в условиях дефицита пластического материала.Цель работы: определить эффективность применения системы для лечения ран методом локального отрицательного давления (ЛОД) у пациентов с некротизирующими фасциитом, миозитом конечностей и/или туловища.Материалы и методы. Мы обобщили результаты лечения методом ЛОД у 24 пациентов при некротизирующих инфекциях мягких тканей конечностей и/или туловища. В схему лечения включались повязки ЛОД, вторичные хирургические обработки (ВХО) ран, сопровождающиеся сменой компонентов системы. Конечной точкой было закрытие обширных раневых дефектов.Результаты и обсуждение. Среднее число ВХО после выполнения первичного дебридмента - составило 5,86. Среднее число смен компонентов системы ЛОД - 3,7. До заключительного этапа - наложение вторичных швов либо выполнения аутодермопластики дошло 7 из 24 пациентов. Остальные пациенты выписаны на амбулаторный этап лечения с гранулирующими (суммарно менее 1 % площади тела) дефектами. Ампутаций удалось избежать во всей серии случаев. Сроки госпитализации в среднем составили 24,95 койко-дней (медиана - 22, мода - 21).Заключение. Использование метода ЛОД в лечении больных с некротизирующими инфекциями мягких тканей позволило нам ускорить очищение ран и в более ранние сроки перейти к реконструктивному этапу лечения. В будущем, при получении подтверждений на статистически значимой выборке, возможно предложение метода ЛОД, как метода выбора при лечении таких пациентов.
Некротизирующая инфекция мягких тканей, метод локального отрицательного давления, заживление ран
Короткий адрес: https://sciup.org/142242554
IDR: 142242554 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2024-3-129-135
Текст научной статьи Опыт применения метода локального отрицательного давления в комплексном лечении некротизирующих инфекций мягких тканей
Некротизирующие инфекции мягких тканей (necrotizing soft tissue infections, NSTI) представляют собой группу тяжелых заболеваний, характеризующихся быстро прогрессирующим некрозом мягких тканей, практически всегда ассоциированных с развитием сепсиса и полиорганной недостаточности. Этот термин объединяет газовую гангрену, некротизирующий целлюлит, некротизирующий фасциит, некротизирующий миозит и комбинированные заболевания. Возрастной или половой предрасположенности не существует, но более высокие показатели заболеваемости наблюдаются у пациентов пожилого возраста с ожирением, сахарным диабетом и ослабленным иммунитетом, а также у лиц, страдающих алкоголизмом и заболеваниями периферических сосудов. Однако некротизирующие инфекции могут поражать и молодых, здоровых пациентов, не имеющих ни одного из предрасполагающих факторов [1].
Уровень смертности достигает 20 % [2]. В Соединенных Штатах Америки ежегодно регистрируется до 3800–5800 случаев заболевания и смертность составляет от 8 % до 17 % [3]. В Нидерландах заболеваемость некротизирующими инфекциями оценивается примерно в 1,1–1,4 случая на 100 000 человек, что соответствует 193–238 пациентам ежегодно; смертность составляет 23–29 % и 11–14 % подвергаются ампутации [4]. В Новой Зеландии заболеваемость составляет 1,69 на 100 000 человек при летальности до 20,8 % [5]. В Корее заболеваемость некротизирующим фасциитом составляет 0,86 на 100 000 населения [6].
Некротизирующие инфекции отличаются многообразием возбудителей и их неспецифичностью. В литературе этих бактерий образно называют «плотоядными» – механизмы их действия многообразны и включают выделение бактериальных некротоксинов (как у Clostridium perfringens, Streptococcus pyogenes); тромбоз и коагуляцию микрососудов с вторичным некрозом за счет высвобождения гепариназы; высвобождение бета-лактамаз, препятствующих действию антибиотиков. Различная степень и скорость развития системной токсичности зависит от штамма бактерий и вырабатываемых ими токсинов [7].
Условно можно выделить две микробиологические категории: полимикробные и мономикробные некротизирующие инфекции. В нашей стране чаще встречается разделение на клостридиальные и неклостридиальные некротизирующие инфекции [8]. Guiliano с соавт. предлагают выделять в отдельную категорию β-гемолитические стрептококки группы А в виде моновозбудителя, отдельно стрептококки в ассоциациях; клостридиальные инфекции и редкие инфекции, например, Vibrio vulnificus или Aeromonas hydrophila. Последние связаны с воздействием морской воды или употреблением сырых устриц, эндемичны для юго-востока США, Центральной и Южной Америки и Азии. Обычно имеет место полимикробная ассоциация (55–57 %), однако все чаще сообщается о моно-микробной инфекции, вызванной только β-гемолитическими стрептококками, и метициллин-резистентным золотистым стафилококком (MRSA) [9].
Внедрение возбудителя в подкожную клетчатку может произойти из-за любого, даже минимального, дефекта эпителия или поверхности слизистой оболочки (при травмах, хирургических вмешательствах, внутривенных инъекциях – как лекарств, так и наркотических веществ, при кожных инфекциях и язвах, укусах животных и насекомых), однако описаны и идиопатические случаи, когда гипотетический источник инфицирования так и не был обнаружен.
Деструктивный процесс может поражать любую часть тела и распределение следующее: нижние конечности – 32 %, верхние конечности – 24 %, промежность – 16 %, туловище – 16 %, а также голова или шея – 10 % [10].
Характерной особенностью некротизирующих инфекций мягких тканей является скудность наружных, видимых проявлений при массивном и молниеносно развивающемся поражении глубже лежащих слоев. По мере распространения патологического процесса у пациентов нарастают боли, часто выходящие за пределы видимой пораженной области, и появляются признаки системной интоксикации. К более поздним проявлениям относятся появление булл и экхимозов, предшествующих формированию некроза кожи, и крепитация тканей. Такие лабораторные данные, как количество лейкоцитов, уровень гемоглобина, натрия, глюкозы, креатинина и уровня C-реактивного белка – могут быть использованы в качестве индикатора риска наличия некротизирующего фасциита (разработана шкала LRINEC) [11]. Инструментальные методы визуализации не очень информативны: КТ или МРТ могут выявить отек мягких тканей, нарушение послойного строения области, что неспецифично; включение же пузырьков газа встречается не во всех случаях (20,3 %) и их отсутствие не может считаться критерием исключения диагноза некротизирующей инфекции [12]. Диагноз подтверждается интраоперационно, при обнаружении мышц типа “вареного мяса” и серо-бурое зловонное отделяемое по типу “посудных помоев”. Фасции серые, отечные, безжизненные, мышцы не реагируют на коагуляцию, кровоточивость на разрезе отсутствует, в просвете сосудов – темные тромбы [13].
После появления симптомов прогрессирование заболевания происходит за считанные часы. Диагностика затруднена тем, что кожные проявления не соответствуют тяжести заболевания. Особенности некротизирующих инфекций приводят к тому, что необходимо выполнение как можно более раннего и радикального хирургического вмешательства в объеме широкого вскрытия патологического очага и некрэктомии. Ввиду тяжести состояния пациента и нечеткой отграниченности процесса зачастую требуется несколько этапных ВХО, что приводит к образованию обширных дефектов мягких тканей, дефициту местного пластического материала, обнажению важных для жизнеспособности конечностей структур – крупных суставов, сосудистых и нервных пучков.
Антибактериальная терапия назначается эмпирически и в соответствии с протоколом, корректировки ведутся по данным посевов, и не всегда лабораторные данные успевают за конверсией флоры, неизбежной в условиях стационара.
С учётом перечисленных особенностей требуется изменение традиционного подхода к ведению таких больных – уход от регулярных травматичных и болезненных перевязок, многомесячных госпитализаций, длительной вынужденной иммобилизации. Логичным представляется включение в схему лечения таких пациентов метода локального отрицательного давления (ЛОД).
В литературе широко представлены описания клинических случаев, когда использование метода ЛОД помогло достичь хороших результатов у пациентов с некротизирующими инфекциями или обширными флегмонами. Имеются попытки статистического анализа применения схожих методик. Так, к настоящему моменту, по данным портала ClinicalTrials.gov, завершены и опубликованы результаты 22 рандомизированных клинических исследований, изучавших возможности использования метода локального отрицательного давления на ранах различного генеза и локализации, из них о лечении инфекции области хирургического вмешательства – 12, об инфицированных ранах иного происхождения – 5 (в том числе диабетическая стопа – 2, пролежни – 1). Применение метода ЛОД также описано и для пациентов с обширными дефектами – ожогами, инфицированными Pseudomonas aeruginosa, последствиями травм и в т.ч. открытых переломов, минно-взрывной травмой [14, 15]. В то же время применение метода ЛОД у пациентов с некротизирующими инфекциями туловища и конечностей присутствует в открытых источниках в виде описания отдельных случаев и малопригодно для статистического анализа.
Материалы и методы
Мы обобщили опыт лечения 24 пациентов, проходивших лечение с применением метода ЛОД по поводу некротизирующих инфекций конечностей и/или туловища на базе отделения гнойной хирургии ГКБ им. А.К. Ерамишанцева в 2021–2023 гг. Критериями включения были возраст старше 18 лет c клинической картиной некротизирующей инфекции. Критериями исключения были досуточная летальность, выполнение ампутации конечности в рамках первичной санации очага.
Схема проводимого лечения выглядит следующим образом:
-
1. Хирургическая обработка гнойно-некротического очага выполнялась по экстренным показаниям после установки диагноза. Операция завершалась тампонированием ран салфетками с раствором 3 % перекиси водорода, наложением традиционной асептической повязки.
-
2. Выполнение ВХО, некрэктомии на 2–3 сутки; установка в рану (раны) компонентов системы ЛОД.
-
3. Этапные ВХО со сменой компонентов системы ЛОД через 3–4 суток с интраоперационной оценкой ран:
-
a. Иссечение некрозов по мере их формирования.
-
b. Наложение ранних или поздних вторичных швов на гранулирующие участки раны.
-
c. Наложение тензионных швов «через губку» на тампонированные участки раны.
-
4. Выполнение аутодермопластики расщепленным лоскутом либо местными тканями в качестве завершающего этапа.
Помимо указанного хирургического пособия, в схеме лечения использовались инфузионная терапия и антибактериальная – в качестве стартовой минимум два антибиотика, с последующей сменой согласно результатам посевов. Таким образом, в лечении принимала участие мультидисциплинарная команда с привлечением реаниматологов, терапевта, эндокринолога, клинического фармаколога.
Среди пациентов было 16 мужчин и 8 женщин. Средний возраст составил 53,86 лет (минимум 22 года, максимум 74 года), пациентов трудоспособного возраста (мужчины до 55 лет, женщины до 60 лет) было более половины – 14 из 24. Локализация поражения согласуется с литературными данными: чаще всего нижние конечности – 14, верхние – 4; более редко встречалось поражение туловища – 6 (25 %).
По выделенному возбудителю наблюдалось следующее распределение: полимикробные ассоциации – 16, в том числе Streptococcus + Staphylococcus – 9 случаев, из них 2 – с участием MRSA; 5 – с участием Enterococcus. Также в микробном пейзаже встречались Proteus mirabilis ESBL, Acinetobacter baumannii complex, Klebsiella pneumoniae, Providencia stuartii, Candida albicans. Монокультуры Streptococcus – в 3 и Staphylococcus – в 2 случаях были выделены от молодых пациентов без сопутствующей патологии. В 3 случаях идентифицировать возбудителя не удалось.
Результаты
Среднее число ВХО после выполнения первичного де-бридмента составило 5,86. Среднее число смен компонентов системы ЛОД – 3,7.
В полном объеме до заключительного этапа – наложение вторичных швов, либо выполнения аутодермопластики расщепленным лоскутом – дошло 7 из 24 пациентов. Остальные пациенты выписаны на амбулаторный этап лечения с гранулирующими небольшими (суммарно менее 1 % площади тела) дефектами. Их ведение продолжалось с применением высокоплазменных потоков аппаратом “Плазон” и современных высокотехнологичных повязок. Ампутаций удалось избежать во всей серии случаев. Сроки госпитализации в среднем составили 24,95 койко-дней (медиана – 22, мода – 21).
Контрольной группы в режиме проспективного исследования не имелось, ввиду этической сомнительности такого предложения для пациентов, отказавшихся от предлагаемого лечения методом ЛОД, не было. Сравнение с литературными данными на сегодняшний день сложно ввиду отсутствия достаточно крупных или однородных выборок. Пролеченные с использованием метода ЛОД чаще представлены в публикациях в виде отдельных клинических случаев.
Приводим свое наблюдение: пациент Е., 41 года, без соматической патологии в анамнезе, поступил на 2 сутки от начала заболевания с жалобами на интенсивные боли в области левого коленного сустава, общее недомогание, повышение температуры тела до 39,3 % . Отмечено резкое ограничение подвижности в суставе, местная гиперемия с синюшным оттенком, распространяющиеся по наружной поверхности на нижнюю треть левого бедра и до середины левой голени, местная гипертермия, увеличение паховых лимфатических узлов слева. Рентгенологически признаков остеодеструкции не обнаружено. При поступлении: гемоглобин 167 г/л, эритроцитов 4,53 х1012, лейкоцитов 9,0 х109; МНО 1,73 нмоль/мл; АЧТВ 30,0 с, протромбин 48 %; фибриноген 6,01 г/л; креатинин 512 мкмоль/л, мочевина 19,9 мМоль/л, калий 4,6 мМоль/л; С-реактивный белок 192,53 мг/л. В экстренном порядке выполнена хирургическая обработка гнойного очага. Визуально, подкожная клетчатка с обширными очагами расплавления, серая; мышцы “вареные”, отечные. Выставлен диагноз обширной некротической флегмоны левой голени и левого бедра. Послеоперационный период в отделении реанимации – сепсис с клиникой острого почечного повреждения, потребовавшего проведения заместительной почечной терапии – сеансы гемодиафильтрации на 2, 3, 4 сутки госпитализации. Достигнуто снижение креатинина до 83 мкмоль/л, мочевины до 7,5 мМоль/л, калия до 3,9 мМоль/л. Отмечено падение числа лейкоцитов до 3х109 на следующие сутки после хирургической обработки флегмоны с последующим нарастанием до максимально 18,3х109 на 4 сутки госпитализации. Пациенту выполнялись этапные ВХО ран левого бедра и голени под общей анестезией на 2, 3 сутки госпитализации. Максимальный размер ран на наружной поверхности бедра и области колена до 8х12 см, на голени до 12х30 см, дном ран являлись мышцы. Кожа на площади порядка 340 см2, в том числе по задне-наружной поверхности коленного сустава, отсутствует полностью (рис. 1).
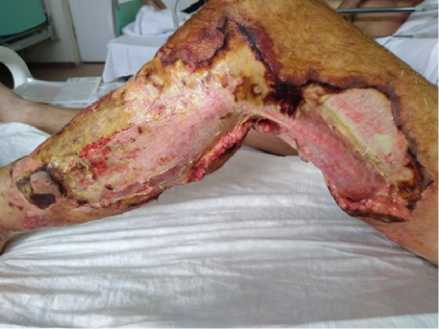
Рис. 1. Пациент Е., 41 год, обширная рана левой нижней конечности после хирургической обработки флегмоны левой голени и бедра, некрэктомии Fig. 1. Patient E., 41 years old, extensive wound of the left lower limb after surgical treatment of phlegmon of the left leg and thigh, necrectomy
На 5 сутки на имеющиеся раны смонтирована система для лечения раны в условиях ЛОД в постоянном режиме 125 мм рт. ст., учитывая площадь раны. (рис. 2).
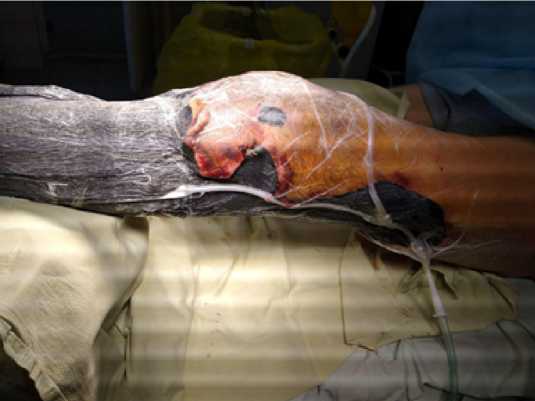
Рис. 2. Пациент Е., 41 год, монтаж циркулярной повязки ЛОД на обширную рану левой нижней конечности
Fig. 2. Patient E., 41 years old, installation of a circular LNP bandage on a large wound of the left lower limb
Выполнялись этапные ВХО со сменой компонентов системы каждые 3 дня. На 18 сутки госпитализации выполнена аутодермопластика дефекта свободным перфорированным лоскутом; для удаления экссудата, лучшей адаптации лоскута и стимуляции заживления раны продолжено ведение в условиях ЛОД в переменном режиме 125/65 мм рт. ст. На 23 сутки выполнен демонтаж системы: признаков лизиса пересаженного лоскута не отмечено, на открытых участках устойчивый рост грануляций. Лабораторно: С-реактивный белок 47,91 мг/л, креатинин 81 мкмоль/л, мочевина 2,1 мМоль/л, прокальцитонин менее 0,5 нг/мл, гемоглобин 80 г/л, лейкоциты 9 х109. На 30 сутки пациент выписан под амбулаторное наблюдение. Контроль через месяц: рана на голени практически полная эпителизация с остаточным участком до 4х2 см в дистальной порции (выполнен грануляциями), на бедре также хорошее замещение лоскутом, оставшийся участок порядка 6х2 см гранулирует, с краевой эпителизацией (рис. 3, 4). Отмечена незначительная тугоподвижность в коленном суставе – назначено ЛФК, комплекс реабилитации.
Заключение
Использование метода ЛОД в комплексе лечения больных с некротическими инфекциями мягких тканей позволяет ускорить очищение ран, стимулировать их заживление и в более ранние сроки перейти к реконструктивному этапу лечения, облегчить активизацию пациента в послеоперационном пе- риоде. Однако для достоверного доказательства преимуществ использования метода ЛОД необходимо накопить достаточный опыт для изложения в виде достаточной серии наблюдений и последующего статистического анализа.
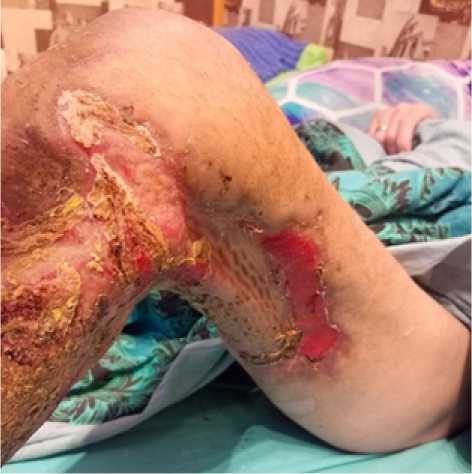
Рис. 3. Пациент Е., 41 год, результаты лечения через 1 месяц
Fig. 3. Patient E., 41 years old, treatment results after 1 month
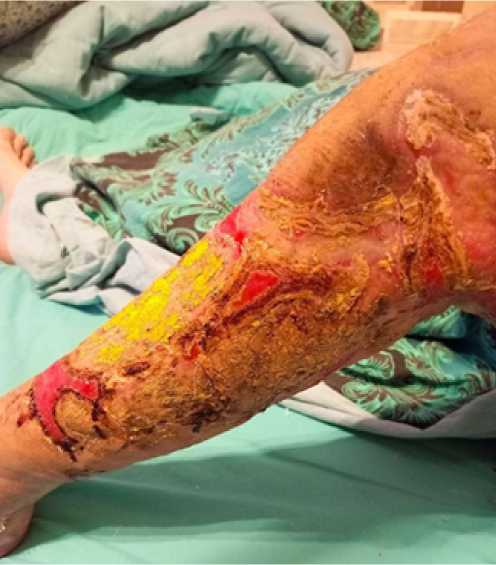
Рис. 4. Пациент Е., 41 год, результаты лечения через 1 месяц
Fig. 4. Patient E., 41 years old, treatment results after 1 month
Список литературы Опыт применения метода локального отрицательного давления в комплексном лечении некротизирующих инфекций мягких тканей
- Hakkarainen T.W., Kopari N.M., Pham T.N., Evans H.L. Necrotizing soft tissue infections: review and current concepts in treatment, systems of care, and outcomes. Curr Probl Surg., 2014, Aug; № 51(8), рр. 344-362.
- Nawijn F., Smeeing D.P.J., Houwert R.M., Leenen L.P.H., Hietbrink F. Time is of the essence when treating necrotizing soft tissue infections: a systematic review and meta-analysis. World J Emerg Surg., 2020, Jan 8; № 15, рр. 4.
- Psoinos C.M., Flahive J.M., Shaw J.J., Li Y., Ng S.C., Tseng J.F., Santry H.P. Contemporary trends in necrotizing soft-tissue infections in the United States. Surgery, 2013, № 153(6), рр. 819-827.
- Nawijn F., de Gier B., Brandwagt D.A.H., Groenwold R.H.H., Keizer J., Hietbrink F. Incidence and mortality of necrotizing fasciitis in The Netherlands: the impact of group A Streptococcus. BMC Infect Dis., 2021, Dec 6; № 21(1), рр. 1217.
- Das D.K., Baker M.G., Venugopal K. Increasing incidence of necrotizing fasciitis in New Zealand: a nationwide study over the period 1990 to 2006. J Infect., 2011, Dec; № 63(6), рр. 429-433.
- Choi H.K., Seo G.H., Han E. The incidence and seasonal variation of necrotizing fasciitis in Korea: a nationwide cross-sectional study. Clinical Microbiology and Infection, 2020, Volume 26, Issue 8, рр. 1090.e1-1090.e6.
- Petreanu C.A., Constantin T., Iosifescu R., Gibu A., Zariosu A., Croitoru A. Necrotizing fasciitis of the chest wall: A clinical case report and literature review. Exp Ther Med., 2022, Jan; № 23(1), рр. 90.
- Stevens D.L., Bryant A.E. Necrotizing Soft-Tissue Infections. N Engl J Med. 2017 Dec 7;377(23):2253-2265.
- Madsen M.B., Skrede S., Bruun T., Arnell P., Rosén A., Nekludov M., Karlsson Y., Bergey F., Saccenti E., Martins Dos Santos V.A.P., Perner A., Norrby-Teglund A., Hyldegaard O. Necrotizing soft tissue infections - a multicentre, prospective observational study (INFECT): protocol and statistical analysis plan. Acta Anaesthesiol Scand., 2018, Feb; № 62(2), рр. 272-279.
- Lancerotto L., Tocco I., Salmaso R., Vindigni V., Bassetto F. Necrotizing fasciitis: classification, diagnosis, and management. J Trauma Acute Care Surg., 2012, March; № 72(3), рр. 560-566.
- Wong C.H., Khin L.W., Heng K.S., Tan K.C., Low C.O. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: a tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med., 2004, Jul; № 32(7), рр. 1535-1541.
- Goh T., Goh L.G., Ang C.H., Wong C.H. Early diagnosis of necrotizing fasciitis. Br J Surg., 2014, Jan; № 101(1), рр. e119-125.
- Hysong A.A., Posey S.L., Blum D.M., Benvenuti M.A., Benvenuti T.A., Johnson S.R., An T.J., Devin J.K., Obremskey W.T., Martus J.E., Moore-Lotridge S.N., Schoenecker J.G. Necrotizing Fasciitis: Pillaging the Acute Phase Response. J Bone Joint Surg Am., 2020, Mar 18; № 102(6), рр. 526-537.
- Порханов В. А., Богданов С. Б., Горюнов С. В., Фисталь Э. Я., Меркулов Д. С., Поляков И. С., Коваленко А. Л., Федоров П. Л., Муханов М. Л., Керимов А. А. Вакуумная терапия - учебно-методическое пособие для врачей. Краснодар: ФГБОУ ВО КубГМУ Минздрава России, 2023. 348 с.
- Горюнов С.В., Абрамов И.С., Чапарьян Б.А., Егоркин М.А., Жидких С.Ю. Руководство по лечению ран методом управляемого отрицательного давления. М. : Апрель, 2013. 130 с.


