Опыт применения микрожидкостных чипов для сортировки спермы у пациентов с лечением бесплодия
Автор: Беляева Л.А., Шурыгина О.В., Тугушев М.Т., Миронов С.Ю.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Цель работы - анализ эффективности использования микрожидкостных чипов для селекции спермы. Материалы и методы. Методика в настоящее время является экспериментальной и применялась после предварительного получения индивидуального добровольного согласия пациента. Проводился ретроспективный анализ медицинских карт 4 групп пациенток (2 анализируемые, 2 контрольные). Общее число изученных медицинских карт составило 54. Микрожидкостный чип и его модификации (FERTILE/FERTILE PLUS CHIP) предназначены для отбора и селекции нормальных подвижных сперматозоидов для использования в процедурах экстракорпорального оплодотворения (ЭКО), интрацитоплазматической инъекции сперматозоида в яйцеклетку (ИКСИ). Оценивались показатели преимплантационного развития эмбрионов in vitro. Результаты. Были проанализированы эмбриологические показатели циклов лечения бесплодия методами ВРТ. Ключевые показатели преимплантационного развития эмбрионов: уровень оплодотворения, дорастания до бластоцисты, криоконсервации эмбрионов - были выше в обеих анализируемых группах по сравнению с контрольными группами (со стандартной обработкой спермы). Полученные результаты по культивированию эмбрионов, созданных при оплодотворении сперматозоидами, полученными на основе селекции с помощью микрофлюидных чипов, позволяют предполагать более физиологичный характер сепарации гамет. Центрифугирование при стандартной обработке эякулята для получения фракции активно-подвижных сперматозоидов отрицательно влияет на цитофизиологию мужских гамет и вызывает разрывы в цепочке ДНК в головке сперматозоида. Выводы. Выявлены тенденции к улучшению эмбриологических показателей культивирования эмбрионов in vitro, полученных при селекции сперматозоидов с помощью микрожидкостных чипов. Данный метод позволяет отбирать цитофизиологически компетентные сперматозоиды, не повышая показатель фрагментации ДНК и улучшая качество эмбрионов.
Микрофлюидика, бесплодие, вспомогательные репродуктивные технологии, селекция сперматозоидов
Короткий адрес: https://sciup.org/14129941
IDR: 14129941 | УДК: 57.088.7 | DOI: 10.34014/2227-1848-2024-1-82-90
Текст научной статьи Опыт применения микрожидкостных чипов для сортировки спермы у пациентов с лечением бесплодия
Введение. В настоящее время в области репродуктивной медицины и андрологии активно развиваются и совершенствуются новые методы селекции сперматозоидов [1–3]. Существующих классических методов отбора гамет, основанных на их морфологической оценке, недостаточно для определения оплодотворяющей способности [4–7].
Одним из наиболее перспективных методов сортировки сперматозоидов является использование микрожидкостных чипов [8–10]. Технология основана на принципах течения жидкости в микроканалах – микрофлюидике. Это многообещающая и быстроразвивающа-яся междисциплинарная область исследований. Она особенно востребована в биомедицинских исследованиях, где возникает необходимость выполнить разделение частиц биоматериала. Микрофлюидика лежит в основе так называемых лабораторий на чипе – миниатюрных приборов, позволяющих осуществлять многостадийные химические процессы, включающие химические реакции, перемешивание, концентрирование и сепарацию на одном чипе размером с маленькую монетку. Такие системы перспективны не только в качестве микрореакторов в синтетической химии, но и в качестве портативных аналитических устройств, например для диагностики онкологических и инфекционных заболеваний. Лаборатория на чипе является одним из самых востребованных методов микрофлюидики [11–14].
Микрожидкостные чипы, предназначенные для отбора сперматозоидов, имитируют прохождение сперматозоидами всех барьеров при естественном оплодотворении. Это устройства для однократного применения, в каждом из которых есть входной порт для внесения образца и выходной порт, соединенные микропоточным каналом (рис. 1, 2).

Рис. 1. Микрожидкостный чип FERTILE
Fig. 1. The FERTILE Microfluidic Sperm Sorting Chip
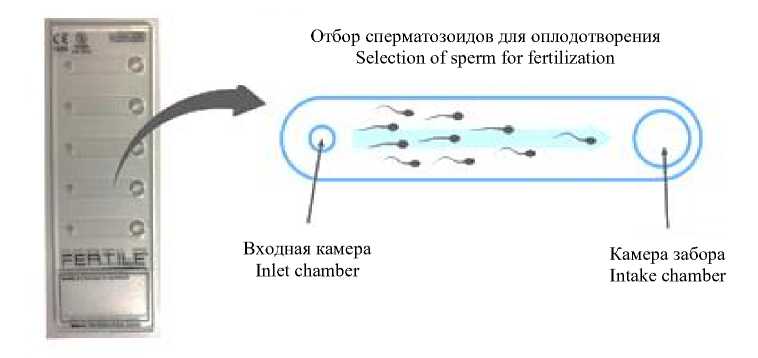
Рис. 2. Схема работы микрожидкостного чипа FERTILE
Fig. 2. Operation scheme of the FERTILE Microfluidic Sperm Sorting Chip
Микропористый фильтр с определенным диаметром пор осуществляет физиологическую селекцию сперматозоидов. Преимуществом данного метода является бережная сортировка сперматозоидов без применения центрифугирования образцов. Последнее может приводить к появлению фрагментации ДНК в головке сперматозоида и, как следствие, к снижению его оплодотворяющей способности [15–17].
Цель исследования. Анализ эффективности использования микрожидкостных чипов для селекции спермы для проведения оплодотворения в программах лечения бесплодия методами вспомогательных репродуктивных технологий.
Материалы и методы. Методика в настоящее время является экспериментальной и применялась после предварительного получения индивидуального добровольного согласия пациента в лаборатории вспомогательных репродуктивных технологий (ВРТ) Клинического госпиталя ИДК АО «Медицинская компания ИДК» (г. Самара).
Микрожидкостный чип и его модификации (FERTILE/FERTILE PLUS CHIP) предназначены для отбора и селекции нормальных подвижных сперматозоидов для использования в процедурах экстракорпорального оплодотворения (ЭКО), интрацитоплазматической инъекции сперматозоида в яйцеклетку (ИКСИ) (KOEK BİYOTEKNOLOJİ BİYOMÜHEN-DİSLİK VE MEDİKAL HİZMETLERİ SAN. VE TİC. A. Ş. EGE SERBEST BÖLGESİ ŞUBESİ, Turkey). Принцип действия микрочипа основан на пространственном 3D-сор-тинге сперматозоидов по подвижности с использованием микропор. Микросреда, создаваемая компонентами микрочипа, обеспечивает барьерные механизмы для отделения и отбора сперматозоидов с более высокой подвижностью, лучшей морфологией и меньшей фрагментацией ДНК. Ключевой особенностью конструкции микрофлюидного устройства являются два канала, разделенные проницаемой фазовой направляющей структурой; один из каналов заполнен нативной спермой, другой – буферным раствором. Образцу спермы дается возможность достичь равновесия в обеих камерах, при этом неподвижные сперматозоиды остаются в исходном канале, а примерно половина подвижных сперматозоидов переплывает через фазо-водный барьер в буферный канал.
В ходе исследования был проведен ретроспективный анализ медицинских карт стационарного больного на базе Клинического госпиталя ИДК. Для анализа формировались четыре группы пациенток: I группа – 10 женщин, программы ИКСИ, отбор сперматозоидов с помощью микрожидкостных чипов; II группа (контрольная) – 17 женщин, программы ИКСИ, селекция сперматозоидов стандартным методом центрифугирования; III группа – 7 женщин, программы ЭКО, отбор сперматозоидов с помощью микрожидкост-ных чипов; IV группа (контрольная) – 20 женщин, программы ЭКО, селекция сперматозоидов стандартным методом центрифугирования. Группы были сопоставимы по возрасту пациенток и количеству попыток лечения бесплодия методами ВРТ.
Для определения эффективности селекции сперматозоидов с помощью микрожид-костных чипов для выполнения оплодотворения в программах ЭКО и ИКСИ и изучения ее влияния на преимплантационное развитие эмбрионов in vitro каждый образец спермы разделялся на две порции. Первая часть образца загружалась в микрожидкостный чип FERTILE/FERTILE PLUS по методике, указанной производителем. Вторая часть образца спермы обрабатывалась методом центрифугирования в градиенте плотностей (концентраций 40 % и 80 % в HEPES-буферном растворе) по стандартной методике производителей культуральных сред FertiPro (Франция).
После проведения оплодотворения оценивались показатели преимплантационного развития эмбрионов in vitro , полученных при оплодотворении ооцитов сперматозоидами после центрифугирования в градиентах плотности и после использования мембранного двухкамерного микрофлюидного чипа.
Критерии включения пациентов в экспериментальное исследование: количество ооцитов у пациентки не менее 8, общая концентрация сперматозоидов не менее 5 млн/мл.
Все анализируемые показатели развития эмбрионов in vitro : процент оплодотворения, процент дробления, процент развития до бластоцисты – рассчитывались в соответствии с методическими рекомендациями «Организация внутреннего контроля и безопасности медицинской деятельности в клинике/отделении вспомогательных репродуктивных технологий» Федеральной службы по надзору в сфере здравоохранения, ФГБУ «Центр мониторинга и экономической экспертизы» Росздравнадзора:
% нормального оплодотворения = количество ооцитов с 2PN, 2PB / общее количество инъецированных ооцитов MII × 100 %;
% дробления = количество дробящихся эмбрионов 2-го дня / общее количество ооцитов с 2PN, 2PB × 100 %;
% бластуляции = количество бластоцист / общее количество ооцитов с 2PN, 2PB × 100 %.
Ограниченное количество образцов мик-рожидкостных чипов FERTILE CHIP не позволило провести на данном этапе стандартную статистическую обработку полученных данных, однако дало возможность проследить формирование определенных тенденций.
Результаты. Были проанализированы эмбриологические показатели циклов лечения бесплодия методами ВРТ. Для расчетов всех данных была создана сводная табл. 1.
Таблица 1
Table 1
Эмбриологические показатели циклов лечения бесплодия методами ВРТ
Embryological indicators of infertility treatment cycles using ART
|
Показатель Parameter |
ИКСИ, анализируемая группа, n=10 ICSI, experimental group, n=10 |
ИКСИ, контрольная группа, n=17 ICSI, control group, n=17 |
ЭКО, анализируемая группа, n=7 IVF, experimental group, n=7 |
ЭКО, контрольная группа, n=20 IVF, control group, n=20 |
|
Средний возраст пациенток, лет Mean age of patients, years old |
33,9 |
34,1 |
32 |
32,2 |
|
Номер попытки лечения бесплодия у пациентов Number of attempts to treat infertility |
2 |
2,4 |
1,5 |
1,7 |
|
Среднее количество полученных ооцитов у пациенток Average number of oocytes obtained |
8,3 |
8,5 |
9,5 |
9,6 |
|
Процент оплодотворения Fertilization rate, % |
87,3 |
83,4 |
87,8 |
83,5 |
|
Процент дробления Cleavage, % |
96,3 |
96,8 |
97,7 |
98,2 |
|
Процент дорастания до бластоцисты Blastocyst development, % |
56,3 |
55,2 |
53,5 |
46,4 |
|
Процент замороженных эмбрионов Frozen embryos, % |
32 |
18,3 |
38,1 |
30,9 |
В соответствии с полученными данными ключевые показатели преимплантационного развития эмбрионов: уровень оплодотворения, дорастания до бластоцисты, криоконсервации эмбрионов – в обеих анализируемых группах превышали показатели групп сравнения (со стандартной обработкой спермы). Повышение последних двух показателей свидетельствует о более высоком качестве и компетенции эмбрионов, получаемых в ходе использования сперматозоидов, отобранных с помощью микрожидкостных чипов. Это может потенциально привести к более высоким показателям частоты наступления беременности и живорождения.
Обсуждение. Полученные результаты по культивированию эмбрионов, созданных при оплодотворении сперматозоидами, полученными на основе селекции с помощью микро-флюидных чипов, позволяют предполагать более физиологичный характер сепарации гамет. Центрифугирование при стандартной обработке эякулята для получения фракции активно-подвижных сперматозоидов отрицательно влияет на цитофизиологию мужских гамет и вызывает разрывы в цепочке ДНК в головке сперматозоида. Это не только влияет на биологические компетенции эмбрионов, но может, по отдельным данным, приводить к невынашиванию беременности [17]. Фрагментация ДНК сперматозоидов также вносит свой негативный вклад в формирование эуплоид-ных эмбрионов [18]. Это особенно значимо для пациентов старше 35 лет. Именно в этом возрасте в ооцитах пациенток происходит неуклонный рост уровня анеуплоидии и вероятность наступления клинической беременности снижается [19, 20]. Еще одним значимым фактором является возраст мужчины и изначально высокий уровень фрагментации ДНК. В связи со всеми вышеперечисленными фактами селекция гамет имеет критичное значение. Именно поэтому специалистами ведется активный поиск новых физиологических способов отбора клеток, и микрожидкостные чипы в ближайшем будущем могут стать наиболее перспективным инструментом для этой цели.
Заключение. В проведенном исследовании нами были отмечены положительные тенденции, заключающиеся в улучшении эмбриологических показателей культивирования эмбрионов in vitro , полученных при селекции сперматозоидов с помощью микрожид-костных чипов. Данный метод позволяет отбирать цитофизиологически компетентные сперматозоиды, не повышая показатель фрагментации ДНК и улучшая качество эмбрионов. Эта практика может быть эффективным решением при наличии таких патологий, как астенотератозооспермия, олигоастенозоос-пермия, необъяснимое бесплодие, и позволить реализовать стратегию персонализированного подхода к каждому пациенту. В настоящее время необходимо провести расширенные исследования для получения дополнительных данных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Беляева Л.А., Шурыгина О.В.
Литературный поиск, участие в исследовании, обработка материала: Тугушев М.Т.
Статистическая обработка данных: Миронов С.Ю.
Анализ и интерпретация данных: Беляева Л.А.
Написание и редактирование текста: Беляева Л.А.
Список литературы Опыт применения микрожидкостных чипов для сортировки спермы у пациентов с лечением бесплодия
- De Wagenaar B., Berendsen J.T.W. Microfluidic single sperm entrapment and analysis. Lab Chip. 2015; 15 (5): 1294-1301.
- Cho B.S., Schuster T.G., ZhuX., Chang D., Smith G.D., Takayama S. Passively driven integrated microfluidic system for separation of motile sperm. Anal. Chem. 2003; 75 (7): 1671-1675.
- Schuster T.G., ChoB., Keller L.M., TakayamaS., Smith G.D. Isolation of motile spermatozoa from semen samples using microfluidics. Reprod. Biomed. Online. 2003; 7 (1): 75-81.
- Cagla Guler, Sureyya Melil. Sperm Selection and Embryo Development: A Comparison of the Density Gradient Centrifugation and Microfluidic Chip Sperm Preparation Methods in Patients with Astheno-Teratozoospermia. Life (Basel). 2021; 11 (9): 933.
- Shan-Shan Tang, Jin-Chun Lu. Analysis of selected sperm samples by a computer-assisted system with high frame rate: A prospective study. Health Sci Rep. 2023; 6 (5): e1217.
- Lingling Qiu, Jinxiang Wu. Selection of fertilization strategies for different sperm parameters in vitro fertilization. Ann Transl Med. 2022; 10 (18): 996.
- Carrageta D.F., Bernardino R.L., Soveral G., Calamita G., Alves M.G., Oliveira P.F. Aquaporins and male (in)fertility: Expression and role throughout the male reproductive tract. Arch. Biochem. Biophys. 2020; 679: 108222.
- Chang-Yu Chen, Tsun-Chao Chiang. Sperm quality assessment via separation and sedimentation in a microfluidic device. Analyst. 2013; 138 (17): 4967-4974.
- Pinar Ozcan, Taha Takmaz. Does the use of microfluidic sperm sorting for the sperm selection improve in vitro fertilization success rates in male factor infertility? J Obstet Gynaecol Res. 2021; 47 (1): 382-388.
- Huang H., Huang P., Yao D. Enhanced efficiency of sorting sperm motility utilizing a microfluidic chip. Microsystem Technologies. 2015; 23 (2): 305-312.
- Quinn M.M., Jalalian L., Ribeiro S., Ona K., Demirci U., Cedars M.I., Rosen M.P. Microfluidic sorting selects sperm for clinical use with reduced DNA damage compared to density gradient centrifugation with swim-up in split semen samples. Hum. Reprod. 2018; 33 (8): 1388-1393.
- Cagla Guler, Sureyya Melil. Sperm Selection and Embryo Development: A Comparison of the injection for unexplained infertility: a prospective, randomized controlled trial. J Assist Reprod Genet. 2019; 36 (3): 403-409.
- Smith G.D., Takayama S. Application of microfluidic technologies to human assisted reproduction. Mol. Hum. Reprod. 2017; 23 (4): 257-268. DOI: https://dx.doi.org/10.1093/molehr/gaw076.
- Samuel R., Feng H., Jafek A., Despain D., Jenkins T., Gale B. Microfluidic-based sperm sorting & analysis for treatment of male infertility. Transl. Androl. Urol. 2018; 7 (Suppl. 3): 336-347.
- Narayanamurthy V., Jeroish Z.E., Bhuvaneshwari K.S., BayatP., Premkumar R., Samsuri F., YusoffM.M. Advances in passively driven microfluidics and lab-on-chip devices: a comprehensive literature review and patent analysis. RSC Adv. 2020; 10 (20): 11652-11680.
- Manhee Lee, Jin Woo Park. Viscous Cervical Environment-on-a-Chip for Selecting High-Quality Sperm from Human Semen. Biomedicines. 2021; 9 (10): 1439.
- Ender Yalcinkaya Kalyan, Seren Can Celik. Does a microfluidic chip for sperm sorting have a positive add-on effect on laboratory and clinical outcomes of intracytoplasmic sperm injection cycles? A sibling oocyte study Andrologia. 2019; 51 (10): e13403.
- Molly M. Quinn, Liza Jalalian. Microfluidic sorting selects sperm for clinical use with reduced DNA damage compared to density gradient centrifugation with swim-up in split semen samples. Hum Reprod. 2018; 33 (8): 1388-1393.
- ZhangX., Khimji I., Gurkan U.A., Safaee H., Catalano P.N., Keles H.O. Lensless imaging for simultaneous microfluidic sperm monitoring and sorting. Lab. Chip. 2011; 11 (15): 2535-2540.
- Nasr Esfahani M.H., Deemeh M.R., Tavalaee M., Sekhavati M.H., Gourabi H. Zeta sperm selection improves pregnancy rate and alters sex ratio in male factor infertility patients: A double-blind, randomized clinical trial. Int. J. Fertil. Steril. 2016; 10 (2): 253-260.


