Опыт создания и использования 3D-моделей органов при опухолевом поражении печени и легкого
Автор: Белков Дмитрий Сергеевич, Егиев Валерий Николаевич, Мачульский Дмитрий Сергеевич, Кононец Павел Вячеславович, Ханычев Виталий Викторович, Алексеева Елена Ильинична, Забережный Иван Алексеевич, Дегтев Владимир Юрьевич
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические исследования
Статья в выпуске: 1 (53), 2017 года.
Бесплатный доступ
В настоящее время в хирургическом лечении злокачественных опухолей печени и легкого значительно расширяются показания к выполнению органосохранных операций. Адекватная оценка методов предоперационной диагностики играет решающую роль при определении показаний к дан- ным операциям. Попытки сделать результаты исследований более наглядными и менее зависимыми от интерпретации врача, привели к развитию и широкому внедрению в хирургическую практику 3D-моделирования органов. Изначально, появившись в виде компьютерных реконструкций, дан- ное направление с развитием технологии 3D-печати, преобразовалось в создание «нативных» 3D-моделей. Основным из недостатков данного метода является высокая цена моделей, которая составляет от 1500 до 4000 долларов США. На базе Московской онкологической больницы № 62 и НИИ«КУРС» была разработана оригинальная технология создания подобных моделей, позволившая в несколько раз сократить их стоимость. Созданные 3D-модели легкого и печени, пораженных опухолевым процессом, в масштабе 1:1, позволили уточнить их анатомические особенности, взаимоотно- шение опухоли с внутренними структурами органов и определить адекватный объем предстоящей операции.
3d-модель легкого, 3d-модель печени, 3d-моделирование органов, органосохранные операции, сегментэктомия
Короткий адрес: https://sciup.org/142211301
IDR: 142211301 | УДК: 616-089.16
Текст научной статьи Опыт создания и использования 3D-моделей органов при опухолевом поражении печени и легкого
В настоящее время в хирургическом лечении злокачественных опухолей печени и легкого значительно расширяются показания к выполнению органосохранных операций. По данным разных авторов, количество таких операций, как сегментэктомия при раке легкого составляет около 15,2-20 % (стадии Ia, Ib) [1–3], лобэктомия - до 58% (при более поздних его стадиях) [4]. При опухолевом поражении печени удаление одного или нескольких сегментов составляет более 50% от всех резекционных операций [5–9]. Данная тенденция предъявляет повышенные требования к предоперационной диагностике с точным определением локализации опухоли, ее взаимоотношений с внутренними структурами органа, объема оставшейся его части после резекции и т.д.
Такие методы, как КТ, МРТ, УЗИ, ангиография, как правило, позволяют решить большинство из поставленных задач. Однако, оценка 2-х мерных изображений, полученных при их выполнении, в некоторых случаях не дает информацию, достаточную для определения адекватного объема операции или оперативного доступа.
Попытки сделать методы исследования более наглядными и менее зависимыми от интерпретации врача, привели к развитию и широкому внедрению в хирургическую практику 3D-моделирования. Изначально, появившись в виде компьютерных реконструкций, данное направление, с развитием технологии 3D-печати, преобразовалось в создание «нативных» 3D-моделей [10–16].
Один из пионеров данного направления, профессор Maki Sugimoto (Kobe University Hospital, Japan ) в 2011 году впервые представил 3D-модели пораженных опухолью печени и почек, полученных при обработке 2-х мерных КТ-изображений программой OsiriX и отпечатанных полностью на 3D-принтере [17–19]. Данная технология позволила ему создать модели органов с опухолью с точностью отображения внутренних структур до 1 мм. При этом внутреннее «дерево»,выполненное из цветного пластика, находилось внутри прозрачного плотного материала из фотополимера. В настоящее время 3D-модели наиболее активно используются в торакальной и гепатобилиарной хирургии [20–26].
Основным из недостатков данного метода является его высокая стоимость, которая, по данным разных авторов, составляет от 1500 до 4000 долларов США, что значительно ограничивает широкое использование данного метода в медицинской практике [27–29].
Материалы и методы
На базе Московской городской онкологической больницы № 62 и НИИ «КУРС» г. Москва была разработана оригинальная технология создания подобных моделей, позволив- шая в несколько раз сократить их стоимость с сохранением как точности отображения внутренней структуры органа до 1 мм (что соответствует субсегментарному уровню), так и четкости визуализации через воссозданную «прозрачную» паренхиму органа.
Создание данных 3D-моделей состояло из следующих этапов: выполнение КТ органов грудной клетки, брюшной полости с внутривенным контрастированием (рис 1, 2).
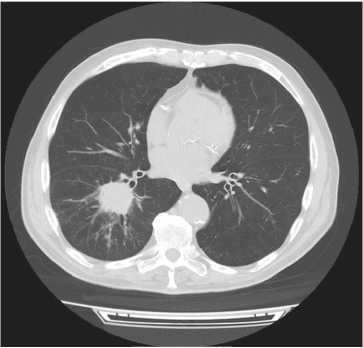
Рис. 1. КТ грудной клетки. Образование
При этом очень важно использовать изображения, на которых хорошо контрастируются и артерии и вены, что, как правило, удается получить в венозную фазу. Толщина среза должна быть не более 1 мм;
преобразование 2-х мерных изображений, полученных при КТ, в 3-х мерные.
Для этих целей нами была использована программа OsiriX с последующей обработкой изображения программой 3d Max. Отдельно формировались изображения внутреннего «дерева» органа с опухолью и внешней его оболочки. Внутренние структуры совмещались со своеобразной «площадкой», которая топографически соответствовала корню легкого и воротам печени. В дальнейшем, эта «площадка» являлась местом соединения с внешней оболочкой органа (рис. 3–6);

Рис. 3. Внутренняя структура легкого с опухолью
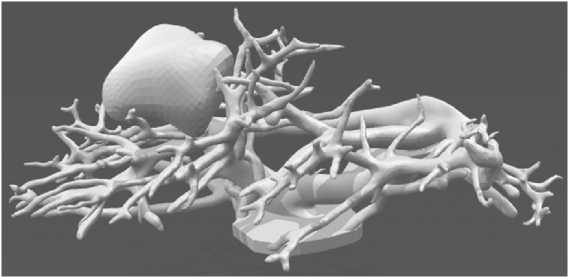
Рис. 4. Внутренняя структура печени с опухолью
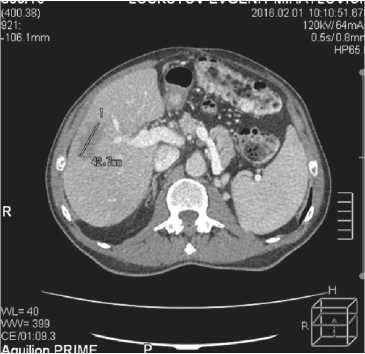
Рис. 2. КТ брюшной полости. Образование 36-37 мм нижней доли правого легкого 43-31 мм на границе 5,8 сегментов печени
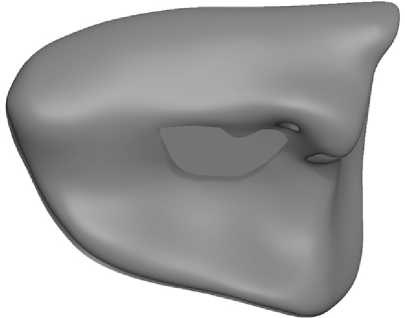
Рис. 5. Внешняя оболочка легкого
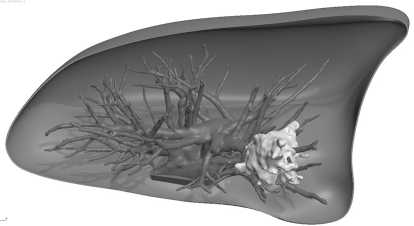
Рис. 6. Совмещение внутренней структуры и внешней оболочки легкого
печать 3х-мерной модели внутренней структуры органа с опухолью до элементов диаметром около 1 мм. на 3D-принтере.
Нами был использован принтер Fortus 900 mc. Отдельно печаталась форма внешней оболочки органа. Материалом для создания модели являлся пластик. В случае создания внешней формы для легкого мы использовали гипсовую модель, что позволило сделать ее более дешевой (рис. 7, 8);
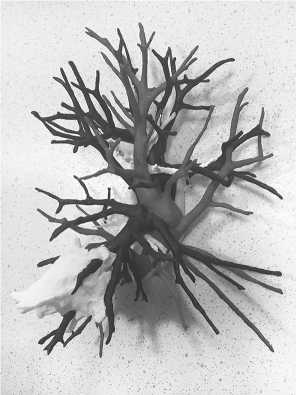
Рис. 9. Внутренняя структура легкого с опухолью
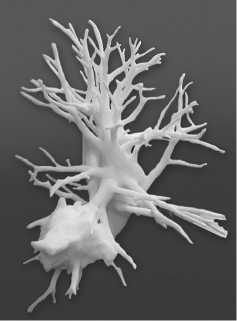
Рис. 7. 3D-модель внутренней структуры легкого

Рис. 10. Внутренняя структура печени с опухолью
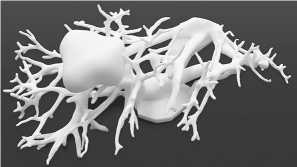
Рис. 8. 3D-модель внутренней структуры печени
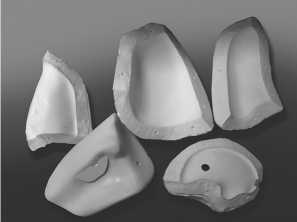
Рис. 11. Гипсовая модель формы легкого
окраска внутренних структур легкого, печени вручную.
Важно, чтобы краска не взаимодействовала с материалом заливки модели (силикон), так как изображение может получиться размытым (рис.9-12);
сопоставление внешней формы и внутренней структуры органа в области корня легкого или ворот печени (рис. 13);

Рис. 12. Пластиковая модель формы печени
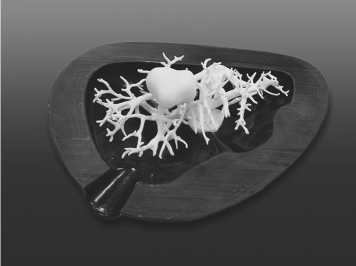
Рис. 13. Сопоставление внешней формы и внутренней структуры печени заливка силиконом через технологическое отверстие во внешней форме с соблюдением нескольких вариантов температурного режима (около 8-ми часов при температуре 25-27 оС или 3 часа при 85-90 оС).
При этом, формирующиеся внутри пузыри в большинстве своем перемещаются на поверхность самостоятельно. После того, как силикон затвердеет, внешняя форма разрезалась, а готовая модель извлекалась (рис. 14-17).
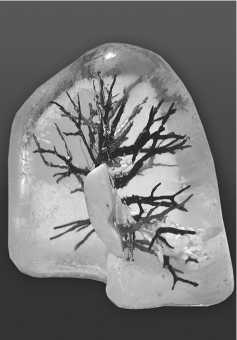
Рис. 14. 3D-модель легкого(медиастинальная поверхность)
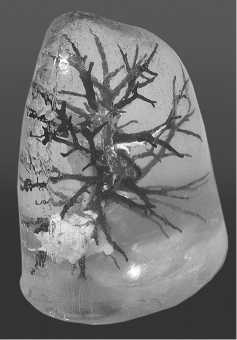
Рис. 15. 3D-модель легкого(реберная поверхность)
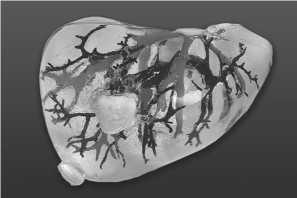
Рис. 16. 3D-модель печени (диафрагмальная поверхность)
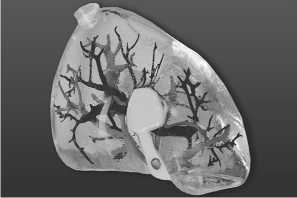
Рис. 17. 3D-модель печени (висцеральная поверхность)
Результаты и их обсуждение
Формирование 3D-модели при раке легкого позволило диагностировать на предоперационном этапе такие анатомические особенности, как отхождение артерии А5 от артерии базальной пирамиды ниже отхождения А6 , а А4 - на уровне отхождения А6. При размере опухоли 36х37х37 мм было визуализировано вовлечение в онкологический процесс 8, 9, 10 бронхов, а так же 8, 9, 10 артерии и вены, что определило объем операции, как нижнюю лобэктомию.
В случае злокачественного поражения печени опухоль размером 43-31 мм располагалась на границе 5-го и 8-го сегментов с вовлечением в опухолевый процесс портальных вен 8-го и 5-го сегментов, что позволило на предоперационном этапе определить мезогепатэктомию, как адекватный объем операции.
Срок создания 3D-моделей по указанной технологии составляет 3-4 дня. Точность воссоздания структур - до 1 мм, соответствует сегментарному и субсегментарному уровням. Себестоимость данных моделей составляет около 30000 рублей, что в 3-4 раза дешевле зарубежных аналогов.
3D-моделирование органов и систем в предоперационном периоде позволяет решить следующие задачи:
точное определение объема операции, что особенно актуально при возможности выполнения органосохранных операций;
выявление оптимального оперативного доступа с учетом индивидуальных особенностей анатомии, а так же топографического отношения опухоли к подлежащим структурам;
определение особенностей реконструктивного этапа операции, особенно при сложных и комбинированных доступах;
обучение студентов и клинических ординаторов путем разбора предстоящей операции на доступных визуальному осмотру моделях пораженных органов;
наглядное объяснение пациентам особенностей их заболевания и предстоящей операции.
В качестве путей дальнейшего развития данного направления, мы начали разработку голографических способов визуализации органов, внедрение в практику интраоперационной навигации, а так же использование материалов по технологии «Biotexture» (симуляция физических свойств тканей органа) [30], что позволит непосредственно выполнить «тренировочную» операцию на точной модели органа пациента.
Выводы
Таким образом, 3D-моделирование является логичным путем развития предоперационной диагностики при опухолевом поражении органов грудной клетки и брюшной полости, позволяя хирургу наиболее точно определить объем и ход выполнения операции. Тем самым, снижается процент осложнений и повышается качество жизни больного после оперативного лечения. Оптимизация технологии создания 3D-моделей со снижением стоимости позволит внедрить их в широкую хирургическую практику.
Список литературы Опыт создания и использования 3D-моделей органов при опухолевом поражении печени и легкого
- Архипов И.В., Гаврилов А.В., Галан Т.И., Камалов Ю.Р., Ким Е.Ф., Ховрин В.В., Ятченко А.М. «Первый опыт применения отечественной рабочей станции MULTIVOX 2D/3D для оценки ангиоархитектоники печени у потенциальных родственных доноров фрагментов печени»//Материалы 3 Всероссийского национального конгресса лучевых диагностов и терапевтов «РАДИОЛОГИЯ-2009». г. Москва. Видар 2009г. с. 448-449.
- Гаврилов А.В., Риман В.В., Зайцев П.В., Риттер Е.Е., Королев Е.В., Селезнев Б.В. Система для трехмерной визуализации внутренних структур и органов человека по данным ультразвуковой эхоскопии. Компьютерная хроника. 1994. №3-4. С.67-76.
- Камалов Ю.Р., Гаврилов А.В., Ховрин В.В., Ким Э.Ф., Филин А.В., Семенков А.А., Ким С.Ю., Рзаев Р.Т., Архипов И.В. Возможности 3D-реконструкции КТ-изображений при ортотопической трансплантации печени.//Медицинская визуализация, № 4, с. 130-133.
- Altorki NK, Yip R, Hanaoka T, Bauer T, Aye R, Kohman L, Sheppard B, Thurer R, Andaz S, Smith M, Mayfield W, Grannis F, Korst R, Pass H, Straznicka M, Flores R, Henschke CI; I-ELCAP Investigators. Sublobar resection is equivalent to lobectomy for clinical stage 1A lung cancer in solid nodules.//J Thorac Cardiovasc Surg. 2014 Feb;147(2):754-62.
- Bradley M. Hemminger, PhD, Paul L. Molina, MD, Thomas M. Egan, MD, Frank C. Detterbeck, MD, Keith E. Muller, PhD, Christopher S. Coffey, PhD, and Joseph K. T. Lee, MD. Assessment of Real-Time 3D Visualization for Cardiothoracic Diagnostic Evaluation and Surgery Planning.//J Digit Imaging. 2005 Jun; 18(2): 145-153.
- Chan EG, Landreneau JR, Schuchert MJ, Odell DD, Gu S, Pu J, Luketich JD, Landreneau RJ. Preoperative (3-dimensional) computed tomography lung reconstruction before anatomic segmentectomy or lobectomy for stage I non-small cell lung cancer.//J Thorac Cardiovasc Surg. 2015 Sep;150(3):523-8.
- Dagher I, Proske JM, Carloni A, Richa H, Tranchart H, Franco D. Laparoscopic liver resection: results for 70 patients.//J Surg Endosc. 2007 Apr;21(4):619-24. Epub 2007 Feb 8.
- Enrique F, Cipriano G, Lycio L, Dessotte U, Walter Villela de Andrade Vicente, and Roberto Barbosa Évora P. A survey among Brazilian thoracic surgeons about the use of preoperative 2D and 3D images.//J Thorac Dis. 2016 Aug; 8(8): 2175-2184.
- Han HS, Yoon YS, Cho JY, Hwang DW. Laparoscopic liver resection for hepatocellular carcinoma: korean experiences.//J Liver Cancer. 2013 Jan;2(1):25-30.
- Jean-François Gigot, MD, PhD, David Glineur, MD, Juan Santiago Azagra, MD, Martine Goergen, MD, Marc Ceuterick, MD, Mario Morino, MD, PhD, José Etienne, MD, Jacques Marescaux, MD, FACS, Didier Mutter, MD, PhD, Ludo van Krunckelsven, MD, Bernard Descottes, MD, PhD, Dominique Valleix, MD, François Lachachi, MD, Claude Bertrand, MD, Baudouin Mansvelt, MD, Guy Hubens, MD, FACS, Jean-Pierre Saey, MD, Romain Schockmel, MD, and under the auspices of the Hepatobiliary and Pancreatic Section of the Royal Belgian Society of Surgery and the Belgian Group for Endoscopic Surgery. Laparoscopic Liver Resection for Malignant Liver Tumors. Preliminary Results of a Multicenter European Study. // J Ann Surg. 2002 Jul; 236(1): 90-97.
- Igami T, Nakamura Y, Hirose T, Ebata T, Yokoyama Y, Sugawara G, Mizuno T, Mori K, Nagino M. Application of a three-dimensional print of a liver in hepatectomy for small tumors invisible by intraoperative ultrasonography: preliminary experience.//World J Surg. 2014 Dec;38(12):3163-6.
- Kanzaki M, Kikkawa T, Shimizu T, Maeda H, Wachi N, Isaka T, Murasugi M, Onuki T. Presurgical planning using a three-dimensional pulmonary model of the actual anatomy of patient with primary lung cancer.//J Thorac Cardiovasc Surg. 2013 Mar;61(2):144-50.
- Keenan RJ, Landreneau RJ, Maley RH Jr, Singh D, Macherey R, Bartley S, Santucci T. Segmental resection spares pulmonary function in patients with stage I lung cancer.//J Ann Thorac Surg. 2004 Jul;78(1):228-33.
- Lorraine L. 3D-Printed Prostate Models Aid Nerve-Sparing Surgery. NEW YORK (Reuters Health) -Patient-specific printed three-dimensional (3D) models of the prostate gland and the index cancer lesion may facilitate nerve-sparing prostatectomy, a new report suggests.//October 27, 2015.
- Ma QL, Guo YQ, Shi B, Tian YC, Song ZY, Liu DR. For non-small cell lung cancer with T3 (central) disease, sleeve lobectomy or pneumonectomy?//J Thorac Dis. 2016 Jun;8(6):1227-33.
- Marcia F. Demand Grows for Printed Presurgical 3D Models.//CHICAGO -the Radiological Society of North America 2015 Annual Meeting. December 04, 2015.
- Murakami T, Tajika Y, Ueno H, Awata S, Hirasawa S, Sugimoto M, Kominato Y, Tsushima Y, Endo K, Yorifuji H. An integrated teaching method of gross anatomy and computed tomography radiology.//J Anat Sci Educ. 2014 Nov-Dec;7(6):438-49. doi: 10.1002/ase.1430. Epub 2014 Jan 17.
- Neeff H, Makowiec F, Harder J, Gumpp V, Klock A, Thimme R, Drognitz O, Hopt UT. Hepatic resection for hepatocellular carcinoma-results and analysis of the current literature.//J Zentralbl Chir. 2009 Apr;134(2):127-35.
- Powers MK, Lee BR, Silberstein J. Three-dimensional printing of surgical anatomy.//J Curr Opin Urol. 2016 May;26(3):283-8.
- Rosset, A., Spadola, L. & Ratib, O. J. Osiri X: An Open-Source Software for Navigating in Multidimensional DICOM Images.//J Digit Imaging (2004) 17: 205.
- Shiga Y. Surgeons develop personalized 3-D printed kidney to simulate surgery prior to cancer operation.//J European Association of Urology, April 14, 2014.
- Soejima Y, Taguchi T, Sugimoto M, Hayashida M, Yoshizu-mi T, Ikegami T, Uchiyama H, Shirabe K, Maehara Y. Three-dimensional printing and biotexture modeling for preoperative simulation in living donor liver transplantation for small infants.//J Liver Transpl. 2016 Nov;22(11):1610-1614.
- Soler L, Nicolau S, Pessaux P, Mutter D, Marescaux J. Real-time 3D image reconstruction guidance in liver resection surgery.//J Hepatobiliary surgery and nutrition Vol. 3, No 2, April 2014.
- Sugimoto M. Multi-material color 3D printing enables bio-texture modeling of internal organs.//J Stratasys for a 3D World. 2014.
- Sugimoto M. Recent advances in visualization, imaging, and navigation in hepatobiliary and pancreatic sciences.//J Hepatobiliary Pancreat Sci. 2009;17:574-6.
- Tack P, Victor J, Gemmel P, and Annemans L. 3D-printing techniques in a medical setting: a systematic literature review.//J Biomed Eng Online. 2016; 15: 115.
- Takamoto T, Hashimoto T, Ogata S, Inoue K, Maruyama Y, Miyazaki A, Makuuchi M. Planning of anatomical liver segmentectomy and subsegmentectomy with 3-dimensional simulation software.//J Liver Transplantation Volume 22, Issue 11, pages 1610-1614, November 2016.
- Takamoto T, Hashimoto T, Ogata S, Inoue K, Maruyama Y, Miyazaki A, Makuuchi M. Planning of anatomical liver segmentectomy and subsegmentectomy with 3-dimensional simulation software.//J Liver Transplantation Volume 22, Issue 11, pages 1610-1614, November 2016.
- Tsutani Y, Miyata Y, Nakayama H, Okumura S, Adachi S, Yoshimura M, Okada M. Oncologic outcomes of segmentectomy compared with lobectomy for clinical stage IA lung adenocarcinoma: propensity score-matched analysis in a multicenter study.//J Thorac Cardiovasc Surg. 2013 Aug;146(2):358-64.
- Volonté F, Pugin F, Bucher P, Sugimoto M, Ratib O, Morel P. Augmented reality and image overlay navigation with OsiriX in laparoscopic and robotic surgery: not only a matter of fashion.//J Hepatobiliary Pancreat Sci. 2011 Jul;18(4):506-9.


