Органосохраняющее лечение начальных форм инвазивной аденокарциномы шейки матки
Автор: Антипов В.А., Новикова О.В., Балахонцева О.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (37), 2010 года.
Бесплатный доступ
В период с 2005 по 2009 г. в МНИОИ им. П.А. Герцена наблюдалось 54 пациентки после выполнения модифицированной радикальной абдоминальной трахелэктомии (РАТ). В 74,1 % случаев операции выполнены больным с плоскоклеточным раком, в 22,2 % - с аденокарциномой, в 3,7 % - со светлоклеточной аденокарциномой. У 27,8 % пациенток установлен рак шейки матки IА1 стадии по FIGO с вовлечением лимфо-васкулярного пространства, у 25,9 % - IА2, у 38,9 % - IB1, у 3,7 % - IB2, у 3,7 % - IIA стадия. Период наблюдения после РАТ составил от 1 до 49 мес (медиана - 20 мес). Выявлено 2 (3,7 %) рецидива, через 4 и 5 мес после операции, в обоих случаях у больных с плоскоклеточным раком. Учитывая небольшую численность пациенток, установленные различия по рецидивам между плоскоклеточным раком и аденокарциномой нельзя считать значимыми. Радикальная трахелэктомия обеспечивает высокую онкологическую эффективность лечения начальной инвазивной аденокарциномы шейки матки. Не получено убедительных данных о более неблагоприятном прогнозе при адено- карциноме в сравнении с плоскоклеточным вариантом рака шейки матки. Вероятно, особенностью аденокарциномы является местный характер рецидивов, но необходимо дальнейшее накопление данных для подтверждения этого положения.
Аденокарцинома, органосохраняющее лечение, радикальная трахелэктомия
Короткий адрес: https://sciup.org/14055593
IDR: 14055593 | УДК: 618.146-006.66-089
Текст научной статьи Органосохраняющее лечение начальных форм инвазивной аденокарциномы шейки матки
Аденокарцинома (АК) шейки матки представляет собой особый гистологический вариант, имеющий отличия от преобладающего при данной локализации плоскоклеточного рака
(ПК) не только на тканевом уровне, но и в особенностях патогенеза, диагностики и лечения. На долю аденокарциномы приходится не более 8–10 % среди всех злокачественных опухолей шейки матки, однако в последние десятилетия наблюдается тенденция к увеличению частоты АК, особенно в группе пациенток репродуктивного возраста [4, 7, 8, 26, 32]. В связи с этим перед онкологами встает вопрос о возможности поставить знак равенства в принципах органосохраняющего лечения для плоскоклеточного и железистого рака шейки матки или необходимости разработки особых подходов в зависимости от гистологического строения опухоли.
Патогенез аденокарциномы шейки матки изучен существенно меньше, чем плоскоклеточного рака, и до конца не ясен. Обе опухоли имеют много общих факторов риска, однако их вклад в канцерогенез различен. К примеру, число беременностей и родов в меньшей степени, а ожирение в большей мере влияют на риск развития АК в сравнении с плоскоклеточным раком. В отличие от ПК курение не является значимым фактором риска [13]. Несколько отличается и роль ВПЧ в патогенезе аденокарциномы, при этой опухоли наиболее часто определяются типы 16 и 18 – в 82 % случаев [8]. При этом ВПЧ 18 типа обнаружен у 50 % пациенток с аденокарциномой, тогда как при плоскоклеточном раке – у 15 % [26]. К факторам риска развития АК относят длительный прием комбинированных оральных контрацептивов (более 10–12 лет) [4].
Диагностика железистой атипии и рака в сравнении с плоскоклеточными вариантами значительно сложнее. Поражение в большинстве случаев располагается в цервикальном канале и на преинвазивной стадии протекает бессимптомно. Отсутствует характерная коль-поскопическая картина, иногда удается визуализировать атипические сосуды. Появление посткоитальных или спонтанных кровянистых выделений, как правило, свидетельствует о наличии инвазии. Цитологическое исследование остается основным в скрининге АК, хотя чувствительность метода существенно ниже, чем при плоскоклеточной дисплазии и раке. Применение современных методов жидкостной цитологии не позволило повысить эффективность диагностики аденокарциномы [4].
Аденокарцинома шейки матки характеризуется повышенным риском метастатического поражения яичников по сравнении с ПК раком.
При IB–IIB стадиях частота метастатического поражения яичников при аденокарциноме составила 5 %, по сравнению с 0,8 % при плоскоклеточном раке (p<0,01) [27]. Ряд авторов считают оправданным удаление яичников в случаях аденокарциномы шейки матки [2].
Вопрос о том, является ли гистотип рака шейки матки (РШМ) самостоятельным прогностическим фактором общей и безрецидивной выживаемости, остается открытым. Большинство исследователей утверждают, что при аденокарциноме прогноз оказывается существенно хуже и показатели 5-летней безрецидивной выживаемости на 10–20 % ниже, чем при плоскоклеточном раке [10, 12, 17, 22, 30]. Однако опубликованы работы, в которых различий в уровнях выживаемости для плоскоклеточного рака и аденокарциномы не установлено [3, 14, 18, 19, 20, 28].
Эффективным методом лечения преинва-зивного и микроинвазивного рака шейки матки (стадия Ia1 без вовлечения лимфо-васкулярного пространства) является конизация (ампутация) шейки матки. Метод позволяет сохранить репродуктивный потенциал у молодых больных и обеспечить высокие показатели безрецидив-ной выживаемости. По данным МНИОИ им. П.А. Герцена в зависимости от техники выполнения ампутации шейки матки частота рецидивов составляет: 3,6 % – при ножевой ампутации, 3,4 % – при лазерной ампутации, 0 % – при электроконизации, 1,6 % – при ультразвуковой ампутации [1]. У пациенток с аденокарциномой, учитывая возможность мультифокального поражения по протяженности цервикального канала, как правило, выполняется более высокая кони-зация, в связи с чем ряд авторов рекомендуют профилактическое наложение швов на шейку матки во II триместре беременности [2].
Разработка нового варианта оперативного лечения рака шейки матки – радикальной тра-хелэктомии – позволила расширить показания к органосохраняющему лечению до Ib2, иногда IIa стадии.
Цель исследования – оценка эффективности радикальной трахелэктомии при лечении плоскоклеточного рака и аденокарциномы шейки матки.
Материал и методы
В нашем институте критериями отбора для выполнения органосохраняющего лечения в объеме радикальной абдоминальной трахелэктомии являлись: клиническая стадия рака шейки матки по FIGO Ia1 с вовлечением лимфо-васкулярного пространства, Ia2, Ib1, IIа; размеры опухоли менее 4 см; плоскоклеточный, аденоплоско-клеточный рак и аденокарцинома; отсутствие признаков метастатического поражения тазовых лимфоузлов и/или отдаленных метастазов; возраст до 45 лет; настойчивое желание пациентки в последующем реализовать репродуктивную функцию и информированное согласие на использование относительного нового варианта лечения. В качестве противопоказаний к выполнению радикальной трахелэктомии были определены другие неплоскоклеточные гистологические варианты рака шейки матки (светлоклеточный, нейроэндокринный и др.), тяжелые сопутствующие соматические заболевания или гинекологическая патология, ставящие под сомнение возможность наступления беременности после операции, вынашивания беременности и рождения здорового ребенка.
Техника операции принципиально не отличалась от разработанной Smith et Ungar [29], за исключением сохранения восходящих ветвей маточных артерий. На первом этапе модифицированной радикальной абдоминальной трахелэктомии (РАТ) выполняли лапаротомию и тазовую лимфаденэктомию. Удаленные лимфоузлы подвергали срочному гистологическому исследованию. В случае их метастатического поражения объем операции изменялся до расширенной экстирпации матки с транспозицией яичников (конверсия). При отсутствии опухолевых клеток в лимфоузлах переходили ко второму этапу РАТ – удалению шейки матки с парацервикальной, параметральной клетчаткой и верхней третью влагалища с сохранением восходящих ветвей маточных артерий. Интактность проксимального края резекции шейки матки подтверждали при срочном гистологическом исследовании. Операцию завершали формированием маточно-влагалищного анастомоза.
В период с 2005 по 2009 г. органосохраняющее лечение в объеме модифицированной РАТ с сохранением маточных артерий выполнено 65
пациенткам репродуктивного возраста, средний возраст – 33 года (от 22 до 44 лет). Плоскоклеточный вариант РШМ установлен у 72,3 % больных, аденокарцинома (включая 3 случая аденоплоскоклеточного рака) – у 24,6 %, другие гистотипы рака шейки матки (светлоклеточная мезонефральная аденокарцинома, светлоклеточная аденокарцинома) – у 2 (3,1 %) больных.
В 8 случаях (плоскоклеточный рак – 5 больных, аденокарцинома – 3) при срочном гистологическом исследовании были обнаружены метастазы в подвздошно-обтураторных лимфатических узлах или опухолевые клетки по краю резекции, что потребовало конверсии на расширенную экстирпацию матки с транспозицией яичников или с удалением придатков, с последующей лучевой терапией.
При плановом гистологическом исследовании у 4 пациенток установлены метастазы в тазовых лимфатических узлах. В 2 случаях выполнены повторные оперативные вмешательства с последующей лучевой терапией, в 1 – облучение, и эти пациентки выбыли из исследования. В 1 случае при светлоклеточной аденокарциноме и метастатическом поражении тазовых лимфоузлов проведено 6 курсов химиотерапии таксанами и препаратами платины, пациентка включена в основную группу наблюдения после РАТ (табл. 1). Таким образом, основную группу исследования составили 54 пациентки, прослеженные после модифицированной РАТ с целью оценки онкологических результатов лечения в зависимости от гистологического варианта рака шейки матки (плоскоклеточный или аденокарцинома).
Результаты и обсуждения
Среди 54 пациенток основной группы гистологическая структура опухоли в 74,1 % соответствовала плоскоклеточному раку, в 22,2 % – аденокарциноме, в 3,7 % – светлоклеточной аденокарциноме. У 27,8 % пациенток установлена IА1 стадия РШМ по FIGO с вовлечением лимфо-васкулярного пространства, у 25,9 % – IА2 у 38,9 % – IB1, у 2 (3,7 %) – IB2, в 2 (3,7 %) – IIA, стадия. У 6 (11 %) пациенток размер опухоли составлял 2 см и более. Высокая степень дифференцировки наблюдалась в 35 % случаев, умеренная – в 22 %, низкая – в 43 % (табл. 2).
Характеристика групп больных с различными гистотипами РШМ
Таблица 1
|
Характеристика больных |
Все гистотипы |
ПК рак |
АК |
Другие гистологические варианты |
|
Больные, которым осуществлялась попытка выполнения модифицированной РАТ |
65 |
47 |
16 |
2* |
|
Средний возраст (лет) |
33 (22–44) |
33 (22–44) |
33 (26–41) |
22–29 |
|
Частота конверсии |
8 (12,3 %) |
5 (10,6 %) |
3 (18,8 %) |
- |
|
Частота метастазов в тазовых лимфоузлах при плановом гистологическом исследовании |
4 |
2 |
1 |
1 |
|
Число больных, прослеженных после РАТ |
54 |
40 |
12 |
2 |
Примечание: * – светлоклеточная аденокарцинома, светлоклеточная мезонефральная аденокарцинома.
Характеристика больных, прослеженных после модифицированной РАТ, и онкологические результаты лечения
Таблица 2
|
Характеристика больных |
Все гистотипы (n=54) |
Плоскоклеточный рак (n=40) |
АК (n=12) |
Другие гистологические варианты (n=2) |
|
Распределение по стадиям |
||||
|
Ia1 |
15 (27,8 %) |
12 |
3 |
|
|
Ia2 |
14 (25,9 %) |
10 |
4 |
|
|
Ib 1 |
21 (38,9 %) |
15 |
5 |
1 |
|
Ib 2 |
2 (3,7 %) |
1 |
1 |
|
|
IIa |
2 (3,7 %) |
2 |
||
|
Степень дифференцировки |
||||
|
опухоли: |
||||
|
высокая |
19 (35 %) |
12 |
7 |
|
|
умеренная |
12 (22 %) |
9 |
1 |
2 |
|
низкая |
23 (43 %) |
19 |
4 |
|
|
Длительность наблюдения Медиана |
1–49 мес 20 мес |
1–49 мес 21 мес |
5–43 мес 20 мес |
7–14 мес |
|
Рецидивы |
2 (3,7 %) |
2 |
- |
- |
Период наблюдения после РАТ составил от 1 до 49 мес (медиана – 20 мес). Установлено 2 рецидива РШМ, что составило 3,7 %. Рецидивы диагностированы на сроке наблюдения 4 и 5 мес после операции. В обоих случаях у пациенток имелось сочетание неблагоприятных прогностических факторов в виде низкодифференцированного варианта плоскоклеточного рака, вовлечения лимфо-васкулярного пространства, IВ1 стадия заболевания. У одной больной рецидив возник в культе шейки матки, у другой – в своде влагалища и в виде инфильтрата по стенке таза, а также метастатическое поражение левого яичника. Проведено комбинированное лечение и в настоящее время обе пациентки живы. В группе больных с аденокарциномой, а также в наблюдениях светлоклеточной и свет- локлеточной мезонефральной аденокарциномы рецидивов после РАТ не зарегистрировано. С учетом небольшой численности пациенток установленные различия по рецидивам между плоскоклеточным раком и аденокарциномой нельзя считать значимыми (рис. 1).
Аденокарцинома не является редким гистологических вариантом РШМ у пациенток репродуктивного возраста, у которых распространенность и размеры опухоли допускают выполнение органосохраняющего лечения. В нашем исследовании при отборе больных для проведения РАТ частота аденокарциномы составила 22 %, в исследованиях других авторов этот показатель оказался даже выше, достигая 40–50 % [6, 11, 16, 21, 23]. Эти данные убедительно свидетельствуют о необходимости пристального
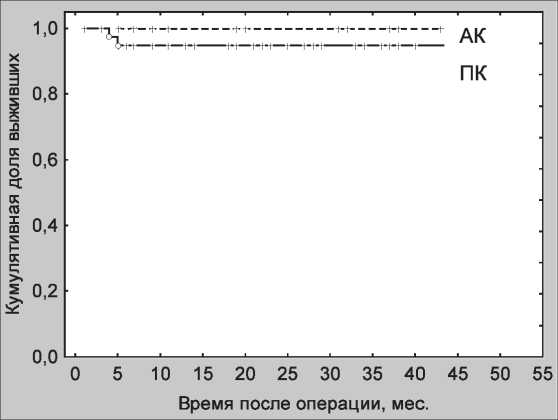
Рис. 1. Безрецидивная выживаемость после модифицированной радикальной абдоминальной трахелэктомии в группе пациенток с плоскоклеточным раком шейки матки (ПК) и аденокарциномой (АК)
внимания к вопросам органосохраняющего лечения при аденокарциноме и актуальности сравнительной оценки эффективности радикальной трахелэктомии для плоскоклеточного рака шейки матки и аденокарциномы.
Началом отсчета в практическом использовании метода радикальной трахелэктомии принято считать 1987 г., когда во Франции D. Dargent впервые выполнил операцию влагалищным доступом. Спустя 7 лет были опубликованы первые отдаленные результаты, свидетельствовавшие об онкологической эффективности метода и возможности наступления беременностей и родов [9]. Постепенно технику радикальной вагинальной трахелэктомии (РВТ) стали применять еще несколько клиник, но их число по всему миру до настоящего времени невелико. В 1997 г. Smith et Ungar предложили выполнять радикальную трахелэктомию с использованием абдоминального доступа, полагая, что такой вариант технически проще [29]. Однако пока количество центров, публикующих данные по абдоминальной трахелэктомии, еще меньше, чем по РВТ.
Согласно последнему обзору литературы в мире выполнено более 600 трахелэктомий вагинальным доступом, при этом частота рецидивов не превысила 5 %, а смертность – 3 %, что сопоставимо с классическим лечением в объеме операции Вертгейма [21, 24]. Наибольшим опытом по применению РАТ располагают венгерские онкологи, которые в 2008 г. сообщили о 101 абдоминальной трахелэктомии, выполненной в 1997–2008 гг. Частота рецидивов составила 1 %, летальных исходов не было [31].
Полученные данные по частоте рецидивов после РАТ (3,7 %) в целом соответствуют опубликованным, что, с одной стороны, закономерно, поскольку критерии отбора пациенток для органосохраняющего лечения принципиально не отличались. С другой стороны, исследование показало, что изменение техники операции РАТ в виде сохранения маточных артерий не оказало неблагоприятного влияния на уровень безреци-дивной выживаемости. Нами не установлено существенных отличий в органосохраняющем лечении начального инвазивного РШМ при плоскоклеточном варианте и аденокарциноме. Частота конверсий и адъювантного лечения по результатам планового гистологического исследования не зависела от гистотипа опухоли. После операции было прослежено 40 пациенток с плоскоклеточным раком и 12 – с аденокарциномой. Группы не отличались по прогностическим факторам, включая стадию заболевания и степень дифференцировки опухоли, а также по длительности наблюдения после операции. При этом 2 рецидива при плоскоклеточном раке при наличии других неблагоприятных факторов – стадии IB1 и низкой дифференцировки опухоли. Таким образом, наши результаты не подтвердили предположение о повышенном риске рецидивов после РАТ при аденокарциноме шейки матки в сравнении с плоскоклеточным раком.
При анализе литературы обращают на себя внимание сроки выявления рецидивов после радикальной трахелэктомии. В большинстве случаев рецидивы наблюдается в первые два года после операции, однако в работах со значительной длительностью наблюдения рецидивы описаны через 6–7 лет после операции. В публикации Beiner et al. [6] из 5 рецидивов три возникли через 44, 77 и 84 мес после РВТ, по данным Marchiole et al. [21], из 7 рецидивов один диагностирован спустя 93 мес после операции. Нельзя исключить, что в исследованиях с небольшим сроком наблюдения общая частота рецидивов может быть несколько занижена.
Общепринятого алгоритма обследования больных после радикальной трахелэктомии не выработано. Предлагается выполнять кольпоскопию и цитологическое исследование (± выскабливание цервикального канала) каждые 3–4 мес в течение первых 3 лет после операции, затем каждые 6 мес в течение 2 лет и далее 1 раз в год. Некоторые авторы придерживаются мнения о необходимости проведения МРТ через 6, 12 и 24 мес после операции [25]. Вопрос о необходимости выполнения гистерэктомии после реализации пациенткой репродуктивной функции остается открытым [24].
Примерно в 40 % случаев рецидивы после радикальной трахелэктомии возникают в параметрии или по стенке таза, что может быть обусловлено недостаточным удалением параметральной клетчатки или наличием микроскопической инвазии лимфо-васкулярного пространства. В 25 % случаев диагностируются метастазы в тазовые, парааортальные и/или надключичные лимфоузлы. Для сокращения риска таких рецидивов предлагается использовать интраоперационное определение сторожевых лимфоузлов [5, 15]. Рецидивы в области маточновлагалищного анастомоза, шейки и тела матки принято объединять термином «центральные». Кроме нашего исследования, они описаны Hertel et al. [16] – 2 случая при аденокарциноме и 1 случай при плоскоклеточном раке, а также Diaz et al. [11] – 1 случай при аденокарциноме. Hertel et al. объясняют возникновение центральных рецидивов при аденокарциноме возможностью мультифокального роста.
Как и в нашем исследовании, у других авторов не получено убедительных данных в пользу неблагоприятного прогноза при аденокарциноме в сравнении с плоскоклеточным раком. Только в исследовании Hertel et al. [16], где аденокарцинома наблюдалась в 31 % случаев, 3 из 4 рецидивов возникли при аденокарциноме. Явно неблагоприятным гистотипом является нейроэндокринная опухоль, и большинство авторов рассматривают этот вариант в качестве абсолютного противопоказания к проведению органосохраняющего лечения даже при начальных стадиях инвазивного рака шейки матки [5, 21, 23].
Наиболее значимым фактором риска возникновения рецидивов после радикальной трахелэктомии является размер опухоли и, в меньшей степени, инвазия лимфо-васкулярного пространства. В работе Marchiole et al. в 86 % случаев рецидивов размер первичной опухоли равнялся или превышал 2 см. При многофакторном анализе для определения значимости различных прогностических факторов (размер опухоли, наличие метастазов в лимфоузлах, вовлечение лимфо-васкулярного пространства, гистотип опухоли, возраст и тип операции – РВТ и радикальная гистерэктомия) авторы установили, что размер опухоли ≥2 см (ОР=10) и наличие или отсутствие инвазии лимфо-васкулярного пространства (ОР=5) явились независимыми прогностическими факторами рецидива после РВТ [21]. При вовлечении лимфо-васкулярного пространства частота рецидивов составляет 12 % в сравнении с 2 % при отсутствии инвазии [6, 21]. Этот фактор не рассматривается как противопоказание к выполнению радикальной трахелэктомии, однако пациентки должны быть информированы о более высоком риске рецидива.
Проведенное исследование и анализ литературы позволяют заключить, что аденокарцинома не является редким гистотипом у пациенток репродуктивного возраста и не должна рассматриваться в качестве противопоказания к проведению органосохраняющего лечения. Влагалищная и абдоминальная радикальная трахелэктомия обеспечивают высокую онкологическую эффективность лечения начальной инвазивной аденокарциномы шейки матки. Не получено убедительных данных о более неблагоприятном прогнозе при аденокарциноме в сравнении с плоскоклеточным вариантом рака шейки матки. Вероятно, особенностью аденокарциномы является местный характер рецидивов, но необходимо дальнейшее накопление данных для подтверждения этого положения.


