Основные аспекты искусственного кровообращения при операциях на дуге аорты
Автор: Пономаренко И.В., Панфилов Д.С., Сондуев Э.Л., Козлов Б.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.36, 2021 года.
Бесплатный доступ
В статье приведен собственный опыт органопротекции при операциях на грудной аорте в условиях циркуляторного ареста (ЦА) и предложена собственная концепция перфузионной защиты органов при операциях по поводу расслоения и аневризм грудной аорты.
Грудная аорта, перфузия, циркуляторный арест
Короткий адрес: https://sciup.org/149139091
IDR: 149139091 | УДК: 616.132.1-089:616.1-78 | DOI: 10.29001/2073-8552-2021-36-4-120-124
Текст научной статьи Основные аспекты искусственного кровообращения при операциях на дуге аорты
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ / CLINICAL INVESTIGATIONS
Реконструктивные вмешательства на дуге аорты представляют собой один из самых сложных разделов сердечно-сосудистой хирургии. Это касается не только хирургической техники и тактики, объема вмешательства, но и проведения искусственного кровообращения (ИК), при котором важную роль играют конфигурация контура, температурный режим, методы оценки адекватности перфузии.
Критериальным стандартом хирургии дуги аорты сегодня считается сочетание антеградной селективной перфузии головного мозга с оптимальной для длительности вмешательства температурой циркуляторного ареста (ЦА) [1, 2].
Значительный опыт выполненных хирургических вмешательств на дуге аорты с использованием ЦА по поводу аневризм и расслоений аорты (292 операции) позволил разработать собственную концепцию проведения ИК, которая представлена в данном сообщении.
Перфузия головного мозга
Для защиты головного мозга во время ЦА мы применяем унилатеральную антеградную перфузию головного мозга (уАПГМ) [3] со следующими характеристиками: скорость потока крови составляет 700–1000 мл/мин (с учетом перфузии правой руки), перфузия проводится под контролем давления (50–70 мм рт. ст.). Адекватность уАПГМ оценивается посредством инфракрасной спектроскопии (near-infrared spectroscopy – NIRS), данные которого позволяют мониторировать насыщение кислородом гемоглобина в оттекающей от мозга крови.
Для артериального возврата мы используем безымянную артерию. Кровь в пациента подается через (основную) линию, фиксированную в синтетическом протезе, анастомозированным с брахиоцефальным стволом (БЦС) по типу «конец в бок» (рис. 1).
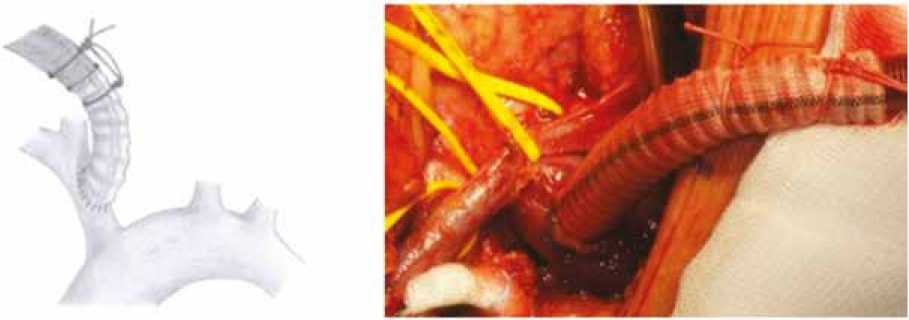
a b
Рис. 1. Схематическое изображение ( a ) и интраоперационная фотография ( b ) проведения перфузии через брахиоцефальный ствол Fig. 1. Schematic representation ( a ) and intraoperative photograph ( b ) of the perfusion performed through the innominate artery
Известно, что прямая канюляция артерии увеличивает риск атероэмболии вследствие манипуляций с атеросклеротически измененной стенкой сосуда [4]. Таким образом, канюляция БЦС через протез позволяет сократить до минимума эмболические осложнения, обусловленные непосредственной канюляцией БЦС. К основной артериальной линии после фильтра всякий раз присоединяется дополнительная заполненная магистраль. Значимое снижение венозной оксигенации левой гемисферы головного мозга в ходе уАПГМ, отмеченной по данным NIRS (более 20% от исходных значений), является показанием к конверсии на билатеральный вариант церебральной перфузии. В этом случае дополнительную артериальную линию используют для перфузии левого полушария через левую общую сонную артерию. Левая подключичная артерия всегда пережимается во избежание синдрома «обкрадывания».
Многими авторами обоснованно признается возможность билатеральной перфузии головного мозга (БПГМ) для его защиты в качестве альтернативы уАПГМ. Однако БПГМ требует канюляции не одного, а двух–трех сосудов с соответственным возрастанием рисков неврологических катастроф. В пользу выбранной нами тактики с использованием унилатеральной церебральной перфузии свидетельствуют данные крупного метаанализа (6788 пациентов), проведенного E. Angeloni et al. Авторы опубликовали сопоставимые показатели летальности (7,6 против 9,8%, p = 0,19) и неврологических осложнений (5,8 против 6,9%, p = 0,53) в случаях применения уАПГМ и БПГМ соответственно. Высказано мнение о том, что развитие неврологического дефицита при билатеральной церебральной перфузии обусловлено дополнительными манипуляциями на брахиоцефальных сосудах, что увеличивает риск эмболизации артерий головного мозга.
При этом при унилатеральной перфузии высокоскоростной ретроградный поток из супрааортальных сосудов, вероятно, минимизирует риск эмболических осложнений [5]. Таким образом, согласно данным литературы, в ряде случаев уАПГМ эквивалентна БПГМ по клиническим результатам, но более проста в техническом исполнении.
Частота постоянных неврологических осложнений по ишемическому типу у оперированных нами пациентов с использованием уАПГМ составила 2 (0,68%) случая, а преходящих неврологических нарушений, проявившихся делирием, ажитацией, дезориентацией пациентов – 13 (4,5%) случаев.
Дистальная перфузия
Концепцию дистальной перфузии (ДП) через бедренную артерию использовал еще в 1957 г. M.E. DeBakey [6]. В 2006 г. А. Della Corte et al. показали, что ДП посредством внутрипросветной канюляции нисходящей грудной аорты снижает количество респираторных и почечных осложнений, укорачивает длительность искусственной вентиляции легких, нахождение в палате интенсивной терапии и срок госпитализации [7].
В нашей клинике до последнего времени ДП проводили через дополнительную линию, предназначенную для билатеральной перфузии головы (если линия не использовалась по назначению), сразу после выполнения дистального анастомоза. В ходе первых операций с ДП (33 случая) для установки дополнительной артериальной линии канюлировали протез аорты проксимальнее зоны дистального анастомоза на 2 см (рис. 2).
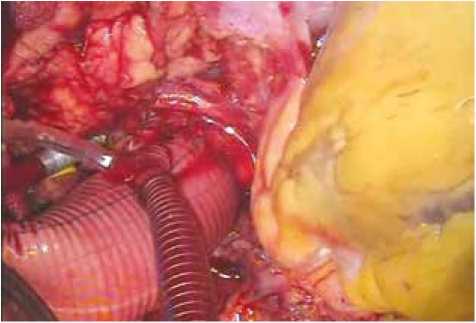
Рис. 2. Способ установки дополнительной артериальной линии путем канюлирования протеза
Fig. 2. An approach to the placement of an additional arterial line by cannulating the prosthesis
Поскольку при этом нарушалась целостность протеза, что впоследствии требовало дополнительных усилий по его герметизации, было решено перейти к использованию одноступенчатой прямой венозной канюли с раздуваемой манжетой (15 случаев), рисунок 3. Такой подход позволяет избежать дополнительных манипуляций с протезом аорты, но в определенной мере ухудшает экспозицию операционного поля.
При использовании гибридного протеза аорты с дополнительной браншей ДП осуществляли через нее (10 случаев), рисунок 4. Такой вариант ДП в большой степе- ни облегчает манипуляцию в операционном поле, одновременно обеспечивая адекватную скорость перфузии нижней половины тела.
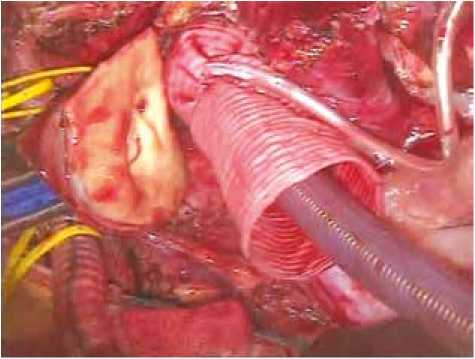
Рис. 3. Способ установки дополнительной артериальной линии с помощью прямой венозной канюли с раздуваемой манжетой
Fig. 3. An approach to the placement of an additional arterial line using a straight venous cannula with an inflated cuff
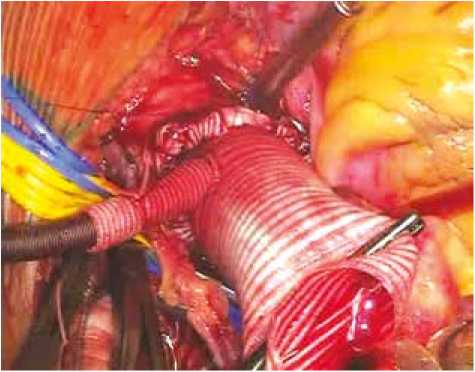
Рис. 4. Способ установки дополнительной артериальной линии в браншу протеза
Fig. 4. An approach to the placement of an additional arterial line to the branch of the prosthesis
Температурный режим
Степень охлаждения пациента перед ЦА выбирается в зависимости от вида операции («полудуга» либо «замороженный хобот слона») и, соответственно, предполагаемой длительности ЦА. После публикации H. Kamiya et al. [8], согласно которой умеренная гипотермия имеет ряд преимуществ перед глубокой в отношении выраженности общего воспалительного ответа и гипокоагуляции, произошел сдвиг парадигмы в сторону увеличения температурного режима до уровня 28–35 °C, что потенциально несет угрозу неадекватной защиты организма, особенно при выполнении вмешательств хирургами, не имеющими соответствующего опыта и мастерства.
При рассмотрении вопроса температурного режима логически возникает следующая дилемма: адекватная перфузия головного мозга сегодня достижима при любой температуре, в том числе при нормотермии, и с учетом отрицательных эффектов охлаждения пациента перфузия мозга нормотермической кровью оказывается наиболее адекватным подходом. Однако формирование открытого дистального анастомоза, как правило, выполняют на гипотермическом ЦА. Оригинальным выходом из данной ситуации служит использование двух контуров, отдельно для перфузии головы и остального тела. Данную концепцию с превосходными результатами применили Е.В. Россейкин и М.Е. Евдокимов в Пензе [9]. Однако это усложняет конфигурацию контуров ИК и существенно повышает стоимость операции.
Руководствуясь небольшим прогнозированным временем ЦА при операциях «hemiarch» (15–18 мин) мы охлаждаем пациента до уровня 28–30 оС. При более объемных вмешательствах на дуге аорты – классический и «замороженный хобот слона» – время ожидаемого ЦА составляет 30–40 мин. С учетом этого обстоятельства мы обеспечиваем уровень умеренной гипотермии в диапазоне 25–28 оС.
Управление кислотно-основным состоянием
В нашей клинике альфа-стат является принятым стандартом стратегии управления pH. В отличие от рН-стат она предотвращает «роскошную» перфузию за счет поддержания церебральной ауторегуляции [10]. Кроме того, применение альфа-стат стратегии не предусматривает подачи в оксигенатор углекислого газа, что немаловажно, поскольку не требует специальных газовых блендеров и источника СО2.
Таким образом, используемая нами стратегия комплексной перфузионной органопротекции при выполнении реконструктивных операций на грудной аорте, включающая уАПГМ, через брахиоцефальный ствол в сочетании с перфузией нижней половины тела на фоне умеренной гипотермии позволяет обеспечить достаточный уровень защиты органов и систем, тем самым создавая условия для сокращения послеоперационных осложнений и летальности.
Список литературы Основные аспекты искусственного кровообращения при операциях на дуге аорты
- Misfeld M., Mohr F., Etz C. Best strategy for cerebral protection in arch surgery - antegrade selective cerebral perfusion and adequate hypothermia. Ann. Cardiothorac. Surg. 2013;2(3):331-338. DOI: 10.3978/j.issn.2225-319X.2013.02.05
- Белов Ю.В., Чарчян Э.Р., Аксельрод Б.А., Гуськов Д.А., Федулова С.В., Еременко А.А. и др. Защита головного мозга и внутренних органов при реконструктивных вмешательствах на дуге аорты: особенности интраоперационной тактики и мониторинга. Патология кровообращения и кардиохирургия. 2016;20(4):34-44. DOI: 10.21688-1681-3472-2016-4-34-44.
- Козлов Б.Н., Панфилов Д.С., Кузнецов М.С., Пономаренко И.В., Насрашвили Г.Г., Шипулин В.М. Антеградная унилатеральная перфузия головного мозга через брахиоцефальный ствол при операциях на дуге аорты. Ангиология и сосудистая хирургия. 2016;22(1):195-197.
- Hagl C., Khaladj N., Karck M., Kallenbach K., Leyh R., Winterhalter M. et al. Hypothermic circulatory arrest during ascending and aortic arch surgery: Тhe theoretical impact of different cerebral perfusion techniques and other methods of cerebral protection. Eur. J. Cardiothorac. Surg. 2003;24(3):371-378. DOI: 10.1016/s1010-7940(03)00337-3
- Angeloni E., Melina G., Refice S.K., Roscitano A., Capuano F., Comito C. et al. Unilateral versus bilateral antegrade cerebral protection during aortic surgery: Аn updated meta-analysis. Ann. Thorac. Surg. 2015;99(6):2024-2031. DOI: 10.1016/j.athoracsur.2015.01.070
- De Bakey M.E., Crawford E.S., Cooley D.A., Morris G.C. Jr. Successful resection of fusiform aneurysm of aortic arch with replacement by homograft. Surg. Gynecol. Obstet. 1957;105(6):657-664.
- Della Corte A., Scardone M., Romano G., Amarelli C., Biondi A., De Santo L.S. et al. Aortic arch surgery: Thoraco-abdominal perfusion during antegrade cerebral perfusion may reduce postoperative morbidity. Ann. Thorac. Surg. 2006;81(4):1358-1364. DOI: 10.1016/j.athoracsur.2005.11.062
- Kamiya H., Hagl C., Kropivnitskaya I., Böthig D., Kallenbach K., Khaladj N. et al. The safety of moderate hypothermic lower body circulatory arrest with selective cerebral perfusion: A propensity score analysis. J. Thorac. Cardiovasc. Surg. 2007;133(2):501-509. DOI: 10.1016/j.jtcvs.2006.09.045
- Россейкин Е.В., Евдокимов М.Е., Базылев В.В., Батраков П.А., Кобзев Е.Е., Гебгарт Т.В. Смена парадигмы при операциях на дуге аорты - "теплая голова - холодное тело". Патология кровообращения и кардиохирургия. 2016;20(4):26-33. DOI: 10.21688-1681-3472-2016-4-26-33.
- Halstead J., Spielvogel D., Meier D., Weisz D., Bodian C., Zhang N. et al. Optimal pH strategy for selective cerebral perfusion. Eur. J. Cardiothorac. Surg. 2005;28(2):266-273. DOI: 10.1016/j.ejcts.2005.04.029


