Основные закономерности микробиологического сэлвидж синтеза нуклеозидфосфатов и нуклеиновых коферментов. 2. Роль гликолиза в фосфориллировании нуклеозидфосфатов до нуклеозидди- и трифосфатов
Автор: Цыренов В.Ж., Пинуев И.в, Санданов А.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Пищевая технология, биотехнология и биохимия
Статья в выпуске: 1 (24), 2009 года.
Бесплатный доступ
В статье рассмотрены возможности участия гликолиза в фосфориллировании нуклеозидфосфатов
Короткий адрес: https://sciup.org/142142079
IDR: 142142079 | УДК: 602:577.113.3
Текст научной статьи Основные закономерности микробиологического сэлвидж синтеза нуклеозидфосфатов и нуклеиновых коферментов. 2. Роль гликолиза в фосфориллировании нуклеозидфосфатов до нуклеозидди- и трифосфатов
Вещества нуклеотидной природы участвуют в наиболее важных процессах жизнедеятельности живых организмов: функционировании наследственного аппарата и биосинтеза белков, регуляции биохимических процессов и энергетическом обмене. Все более расширяется область практического использования нуклеозидфосфатов, нуклеозидов, нуклеотидных препаратов в качестве лекарств, применения их в производстве реактивов, лекарств, вкусовых добавок и других ценных препаратов для нужд химической, фармацевтической и пищевой промышленности.
Из методов получения нуклеозидфосфатов наиболее перспективным является микробиологический метод, который на практике осуществляется двумя способами. Первый способ – прямая ферментация с применением ауксотрофных мутантов - основан на использовании de novo путей биосинтеза нуклеозидфосфатов.
Второй способ микробиологического синтеза – сэлвидж (salvage)-синтез. Биохимическая основа этого способа - уникальные реакции реутилизации низкомолекулярных продуктов катаболизма нуклеиновых кислот (пурины, пиримидины и их нуклеозиды), протекающие в клетках живых организмов [1-7].
При практическом исполнении микробиологического метода необходимо постоянно решать проблемы увеличения выхода целевых продуктов и их ассортимента, совершенствования технологии на основе результатов многих фундаментальных наук – молекулярной биологии и генетики, микробиологии, биохимии, а также многих технических дисциплин.
Развитие, совершенствование сэлвидж-синтеза и успешное его применение во многом определяется знанием биохимических механизмов синтеза нуклеотидов и системы регуляции у штаммов продуцентов. Особый интерес представляет изучение особенностей биоэнергетики, взаимосвязь фосфорного и углеводного обменов.
Данная статья посвящена исследованию гликолиза в качестве возможного источника при сэлвидж-синтезе нуклеозидфосфатов у штаммов продуцентов из группы коринеформных бактерий.
Материалы и методы
Исследовали микроорганизмы из группы коринеморфных бактерий, осуществляющих сэлвидж синтез нуклеотидов: Corynebacterium flavum ВСТИ 301 (Цыренов и др. Авторское свидетельство 726161, СССР, 1980) и музейный штамм Corynebacterium Ammoniagenes ATCC 6872 (Лукин и др., 1978), который в настоящее время известен как Corynebacterium Ammoniagenes. Исследование механизма биосинтеза нуклеотидов у упомянутых выше микроорганизмов было проведено на примере образования ATP из аденина и GTP из гуанина с использованием бесклеточного экстракта.
Б
E
10 15 20 25
Р-5-Ф, мкМ
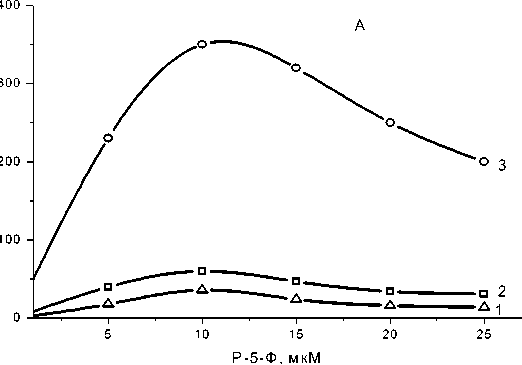
Рис. 1. Влияние концентрации Р-5-Ф на образование нуклеозидфосфатов бесклеточным экстрактом. Условия: Использована реакционная смесь № 4. Концентрация Р-5-Ф указана на рисунке, аденин 0,6 мкМ, С14-аденин 12х105 имп/мин, MgSO 4 5 мкМ, трис-HCl -буфер (рН 8,0) 10 мкМ и экстракт 1,2 мг по белку в конечном объеме 1 мл. А - Corynebacterium flavum ВСТИ 301.
Б - Corynebacterium ammoniagenes ATCC6872. Е - удельная активность экстракта.
1 - AMP; 2 - ADP; 3 - ATP
Проведение ферментаций. С одно- двухсуточного косячка микроорганизмы переносили в посевную среду состава: глюкоза – 2%, пептон – 1,5%, FeSO 4 ∙7H 2 O, K 2 HPO 4 -0,1%, NaCl – 0,25%, биотин – 30 мкг, pH – 7,3. Культивирование микроорганизмов осуществляли в колбах Эрленмейера на круговой качалке при 280°С. 10% (по объему) посевного материала переносили в ферментационную среду состава: глюкоза – 10%, MgSO 4 ∙7H 2 O – 1%, CaCl 2 ∙2H 2 O –
0,01%, K 2 HPO 4 -1%, биотин – 30мкг/л, пептон – 0,5%, pH 7,6. При подборе оптимальных условий ферментаций варьировали составы сред. Для осуществления сэлвидж синтеза в определенные сроки культивирования вносили предшественник. Контроль уровня марганца и цинка проводили атомно-адсорбционным спектрофотометром “Спектр-1”. Биомассу определяли турбидиметрическим методом.
E

Аденин
Рис.2. Влияние концентрации аденина на выход нуклеозидфосфатов. Использовалась реакционная смесь №4 с Р-5-Ф, 10 мкМ. Е - удельная активность экстракта. 1 - AMP; 2 - ADP; 3 - ATP
мкМ
Для получения бесклеточного экстракта использовали двухсуточную культуру. Клетки отделяли центрифугированием при 5000xg, в течение 15 минут, трижды промывали 0,9% NаС1. Взвесь клеток в трис-НС1-буфере, рН 7,5; 0,05 М (0,6-0,7 г клеток по сухому весу в 15 мл буфера) подвергали дезинтеграции в прессе типа Хьюза посредством экструзии из твердого состояния под давлением 3500 кг/см2 при температуре -35° С. Полученную смесь центрифугировали при 20000 xg в течение 30 минут. Супернатант использовали в качестве бесклеточного экстракта. Белок определяли по Лоури.
E 120

0И--------------------------11111111---------------------
7,0 7,5 8,0 8,5 9,0
pH
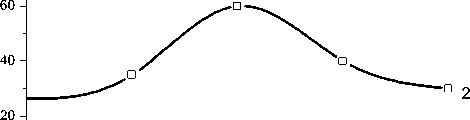
Рис.3. Влияние рН трис-HCl -буфера на образование AMP из ФРПФ (1) и ATP из Р-5-Ф (2). Использовалась смесь №1 (концентрация ФРПФ 0,5 мкМ) и смесь №4 (см.рис.1, концентрация Р-5-Ф 1 мкМ)
Для изучения энзиматических реакций, участвующих в биосинтезе ATP из аденина и гуанина, использовалось 6 составов реакционной смеси. Для исследования аденинфосфорибозилтрансферазной активности применяли смесь № I: ФРПФ 0,5 мкМ, аденин 0,6
мкМ, С14-аденин (гуанин) 12х105 имп/мин, MgCl 2 5 мкМ, трис-нс1-буфер (рН 8,0) 10 мкМ и экстракт энзимов 0,5 мг по белку в конечном объеме 1 мл. При испытании рибозо-5-фосфата (Р-5-Ф) в качестве рибозильного компонента ATP использовали смесь № 2: Р-5-Ф I мкМ, аденин 0,6 мкМ, С14-аденин 12х105 имп/мин, ATP 0,5 мкМ, MgCl 2 5 мкМ, трис-буфер (pH 8.0) 10 мкМ и экстракт 1,2 мг белку в конечном объеме 1 мл.; смесь № 3 - смесь №2 без Р-5-Ф; смесь №4 - смесь №2 без ATP и смесь №5 и смесь №2 без MgCl 2 (рис. 1, 2, 3, 4). Для исследования фосфориллирования AMP до ATP составляли смесь № 6: Р-5-Ф 0-15 мкМ, Mgcl 2 5 мкМ, трис-HCl -буфер (рН 8,0) 10 мкМ, AMР - 0,3 мкМ, С14-AMP 12,5х105 имп/мин и экстракт 1,2 мг по белку в конечном объеме 1 мл. Инкубацию проводили при 30°С, без встряхивания. Реакция останавливалась добавлением 0,1 мл 60%-ной трихлоруксусной кислоты.


0,0
E
0,5 1,0 1,5 2,0
т, Время, часы
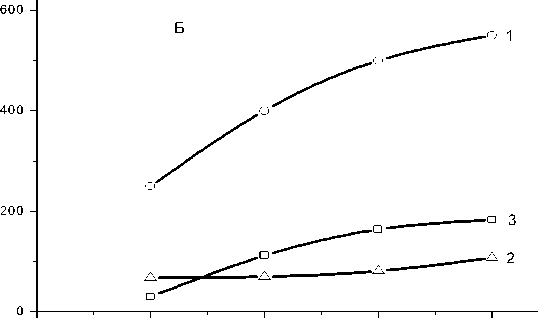
0,0 0,5 1,0 1,5 2,0
т, Время, часы
Рис. 4. Влияние времени инкубирования на образование нуклеозидфосфатов в реакционной смеси №4 (Р-5-Ф - 5 мкМ). А - Corynebacterium flavum ВСТИ 301. Б - Corynebacterium ammoniagenes ATCC6872. Е - удельная активность экстракта: нМ нуклеотидов на мг белка за время инкубации, указанное на рисунке. 1 - AMP; 2 - ADP; 3 – ATP
Образующиеся в реакционной смеси нуклеотиды определяли с помощью восходящей бумажной хроматографии в системе изомасляная кислота – 1 н NH 4 OH - уксусная кислота в отношении 10:5:1 (об/об). Нуклеотиды экстрагировали 2 мл дистиллированной воды в кипящей водяной бане в течение 30 минут. Экстракт доводили до 2 мл, из него брали I мл, наносили на фильтр и высушивали. Радиоактивность измеряли жидкостным сцинтилляционным счетчиком SL-30 ("Intertecnique").
Удельную активность бесклеточного экстракта выражали как нМ нуклеотида (AMP, GMP, ADP, GDP, или ATP, GTP) в расчете на 1 мг белка, который образовался за соответствующее время инкубации (обычно 30 минут). Количество нуклеотидов в нМ рассчитывали, исходя из распределения в них радиоактивности. При этом в случае использования Реакционных смесей №1 - №5 учитывали количество основания, в случае смеси №3 - количество AMP до начала реакции.
Результаты и обсуждение
Ранее было показано (Санданов и др., 1981), что в клетке и в культуральной жидкости штаммов продуцентов накапливается большое количество (до 4 мг/мл) пентозофосфатов (Р-5-Ф, ФРПФ) (рис. 1). Также было показано, что ФРПФ используется в аденинфосфорибозилтрансферазной реакции с образованием AMP. При этом была использована реакционная смесь №1, состоящая из С14-аденина, ФРПФ, MgCl2-буфера и экстракта энзимов
Было сделано наблюдение о том, что если в реакционной смеси №1 заменить Р-5-Ф и ATP (создавая таким образом реакционную смесь № 2), то в этих измененных условиях также интенсивно происходило образование AMP. Образование данного нуклеозидмонофосфата можно объяснить ФРПФ-синтетазной реакцией, которая активно протекает в клетках иссле-_ , _ —— „ дуемых микроорганизмов по схеме: Р-5-Ф + ATP Mg AMP + ФРПФ. Далее: аденин + ФРПФ ^ AMP + пирофосфат. Однако наряду с AMP происходит синтез значительных количеств ADP и ATP, который трудно было объяснить.
Таблица 1
Испытание Р-5-Ф в качестве источника рибозильной части ATP
|
Реакционная смесь |
Основные компоненты реакционной смеси |
Удельная активность экстракта, нМ/мг |
||
|
С14-ATP |
С14-ADP |
С14-AMP |
||
|
Р-5-Ф, ATP. |
28,6 (±2,9) |
67,4(±3,8) |
108 (±9,9) |
|
|
Смесь без Р-5-Ф |
Следы |
Следы |
Следы |
|
|
Смесь №2 без ATP |
135 (±) |
76,9 (±6,1) |
24,3 (±1,8) |
|
|
Смесь №2 без аденина |
Следы |
Следы |
Следы |
|
Исходя из этого наблюдения, мы попытались определить роль отдельных компонентов реакционной смеси №2, ставили опыт с бесклеточным экстрактом, в вариантах которого последовательно исключали из состава реакционной смеси тот или иной компонент. Для получения бесклеточного экстракта использовали двухсуточные культуры Corynebacterium flavum ВСТИ 301, Corynebacterium ammoniagenes.
Как видно из таблицы 1, в реакционной смеси №3 (которая, в отличие от смеси №2, не содержала Р-5-Ф) обнаруживаются следовые количества различных нуклеозидфосфатов. Это, по-видимому, объясняется дефицитом или отсутствием ФРПФ, который образуется в реакции пирофосфориллирования Р-5-Ф за счет энергии ATP (ФРПФ-синтетазная реакция).
В реакционной смеси № 4 (которая, в отличие от смеси №2, не содержала ATP) наблюдался синтез нуклеозидфосфатов, в том числе значительных количеств ATP.
В состав реакционной смеси № 4, кроме аденина, входили только Р-5-Ф, ионы магния и бесклеточный экстракт. Поскольку, в данном случае, происходит сэлвидж-синтез нуклеозидфосфатов, это свидетельствует о том, что в данной смеси, содержащей бесклеточный экстракт, происходят определенные процессы, которые обусловливают образование из Р-5-Ф ATP, необходимого для синтеза ФРПФ в ФРПФ-синтетазной реакции. Таким образом, ATP не является необходимым компонентом реакционной смеси, когда используется бесклеточный экстракт.
Аналогичный результат был получен при ферментации гуаниновых нуклеозидфосфатов с помощью Corynebacterium flavum. Так, при использовании реакционной смеси №4 были получены следующие данные: С14-GTP-131,0, С14-GDP-55,1 и С14-GMP – 53,1 нМ на 1 мг белка.
Для среды № 4 были определены оптимальные концентрации субстратов: для Р-5-Ф -357 мкМ и для аденина – 700 мкМ. Оптимальное значение рН трис-HCl -буфера для образования ATP в этой смеси составляло около 8,0.
Сравнение состава реакционной смеси №1 со смесью № 4 показывает, что единственное их отличие заключается в рибозофосфатах. Если в смеси №1 (содержащей ФРПФ) происходит образование только AMP, то в среде №4 (содержащей Р-5-Ф) – синтез нуклеозидфосфатов, включая ATP. Такой результат (который в определенной мере был неожиданным, поскольку Р-5-Ф является более простым соединением, чем ФРПФ) наводил на мысль, что Р-5-Ф является не только источником рибозильной части нуклеотидов, но и субстратом процессов, обеспечивающих фосфориллирование нуклеозидмонофосфата до нуклеозидтрифосфата (например, AMP до ATP).
Данное предположение было проверено с использованием реакционной смеси №6, состоящей из Р-5-Ф, С14-AMP или С14-GMP, трис-HCl-буфера, MgCl 2 и бесклеточного экстракта. В первую очередь было изучено влияние различных концентраций Р-5-Ф на образование ATP у коринеформных бактерий (табл. 2).
Таблица 2
Влияние концентрации Р-5-Ф на образование пуриновых нуклеозидди- b трифосфатов у Corynebacterium flavum ВСТИ 301 и Corynebacterium ammoniagenes ATCC 6872
|
№ варианта |
Р-5-Ф мкМ |
Удельная активность экстракта, нМ/мг, 30мин |
|||
|
С14-ADP |
С14-GDP |
С14-ATP |
С14-GTP |
||
|
1 |
0 |
25,2 |
20,8 |
40,7 |
21,6 |
|
2 |
5 |
75,2 |
36,9 |
62,0 |
30,9 |
|
3 |
10 |
97,8 |
45,6 |
74,0 |
40,6 |
|
4 |
15 |
72,6 |
32,4 |
61,2 |
31,7 |
*)Использована реакционная смесь № 6 состава: Р-5-Ф, концентрация указана в таблице, MgCl 2 5 мкМ, трис-HCl -буфер (рН 8,0) 10 мкМ, AMP - 0,3 мкМ, С14-AMP 12,5х105 имп/мин и экстракт 1,2 мг по белку в конечном объеме 1 мл. Радиоактивность на единицу веса продукта (ADP, ATP) составляла 4,18х103 имп/мин на 1 нМ. В случае синтеза GTP использовался GMP, С14-GMP.
Обнаружилась достаточно четкая зависимость степени фосфориллирования от концентрации Р-5-Ф. Наряду с этим наблюдался заметный синтез нуклеозидди- и трифосфатов в контрольных образцах, куда не добавляли Р-5-Ф. Это, очевидно, связано с наличием в бесклеточном экстракте доноров макроэргических фосфатных групп (например, полифосфатов, пентозофосфатов).
Зависимость фосфориллирования нуклеозидмонофосфата от концентрации субстрата указывает на возможную роль гликолиза, которая обнаруживается при использовании бесклеточного экстракта. Известно, что фосфоглюконатный путь, одним из промежуточных продуктов которого является Р-5-Ф, на одном из этапов может перейти в гликолитический, т.е. Р-5-Ф может стать субстратом гликолиза, энергетический эффект которого в данном случае обеспечивает фосфориллирование нуклеозидмонофосфата. Для проверки этого предположения был поставлен опыт с реакционной смесью №4, в которой вместо Р-5-Ф была взята глюкоза (табл. 3).
Таблица 3
Влияние концентрации глюкозы на образование нуклеозидфосфатов пуринового ряда бесклеточным экстрактом C.flavum ВСТИ 301
|
№ варианта |
Глюкоза, мкМ |
Удельная активность экстракта, нМ/мг, 30 мин |
|||||
|
AMP |
GMP |
ADP |
GDP |
ATP |
GTP |
||
|
1 |
0 |
1,2 |
1,3 |
3,1 |
2,8 |
14,6 |
12,1 |
|
2 |
2 |
3,2 |
1,7 |
5,2 |
4,1 |
26,0 |
14,2 |
|
3 |
4 |
7,1 |
3,7 |
10,1 |
6,4 |
44,0 |
26,4 |
|
4 |
6 |
8,2 |
4,5 |
11,0 |
5,9 |
50,2 |
28,7 |
|
5 |
8 |
7,4 |
3,4 |
9,8 |
4,3 |
42,1 |
22,6 |
|
6 |
10 |
2,1 |
1,5 |
4,8 |
4,2 |
26,5 |
14,8 |
Как видно из таблицы 3, наблюдалось заметное образование нуклеозидфосфатов в случае замены Р-5-Ф глюкозой. Наиболее высокий уровень синтеза ATP и GTP обнаруживается при концентрации глюкозы 6 мкМ.
Образование нуклеотидов при добавлении глюкозы, особенно характерная зависимость синтеза от концентрации гексозы, однозначно свидетельствуют об участии гликолиза в фос-фориллировании нуклеозидмонофосфатов в нуклеозидди- и трифосфаты.
Проведенные нами опыты показали, что в реакционной смеси №4 образование ATP происходит через AMP. Так, в опыте по исследованию влияния продолжительности инкубирования на образование нуклеозидфосфатов было показано возрастание количества AMP по мере увеличения времени инкубирования. Очевидно, это обусловлено ингибированием с помощью ATP киназных реакций, происходящих по схеме: AMP ↔ ADP ↔ ATP.
Количество AMP также возрастало в присутствии NaF, являющегося ингибитором гликолиза. Ингибирующий эффект NaF на фосфориллирование AMP до ATP усиливался в присутствии фосфатов (табл. 4).
Таблица 4
Влияние фторида натрия и фосфатов на образование нуклеозидфосфатов бесклеточным экстрактом С.flavum ВСТИ 301
|
Буфер |
NaF, 100мкМ |
Удельная активность экстракта, нМ/мг белка, 30 мин |
||
|
C14-ATP |
С14-ADP |
С14-AMP |
||
|
Трис-HCl-буфер, pH 8,0 |
- |
96 |
102 |
29 |
|
Трис-HCl-буфер, pH 8,0 |
+ |
21,0 |
36,1 |
42,8 |
|
Трис-HCl-буфер, pH 9,0 |
+ |
30,2 |
61,2 |
71,5 |
|
Na-фосфатный буфер, 10мкМ, pH 7,4 |
- |
22,7 |
58,6 |
174,1 |
|
Na-фосфатный буфер, 10мкМ, pH 7,4 |
+ |
9,1 |
25,7 |
98,7 |
Заключение
В работе показана взаимосвязь энергетического обеспечения сэлвидж-синтеза нуклеозидфосфатов у коринеформных бактерий с процессом гликолиза.


