Особенности адгезивных свойств аортальных полулуний и атеросклеротических бляшек у больных кальцинирующим аортальным стенозом
Автор: Гуляев Николай Иванович, Жуков Михаил Валерьевич, Куранов Георгий Леонидович, Борисов Юрий Анатольевич, Суглобова Елена Дмитриевна, Ястребов Сергей Гурьевич, Кузнецов Валерий Валентинович, Перемышленко Алексей Сергеевич, Гордиенко Александр Волеславович, Костина Ольга Вячеславовна, Пелешок Андрей Степанович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
С целью изучения механизмов формирования первичного ядра кальцификации в матриксе аортальных полулуний исследованы адгезивные свойства эндотелиальной поверхности, субэндотелиальных структур аортальных полулуний и атеросклеротической бляшки основания аорты. Материалы и методы. Исследованы 10 клапанов аорты и 10 участков корня аорты (в т.ч. участки с атеросклеротической бляшкой на стадии атероматоза без повреждения покрышки), взятых от пациентов без заболеваний сердца, а также 16 клапанов аорты, забранных у больных с тяжелой стадией аортального стеноза интраоперационно. С помощью рентгенодифракционного анализа выполнено исследование химического состава депозитов солей кальция аортальных полулуний. Изучение адгезивных свойств аортальных полулуний и атеросклеротических бляшек к частицам гидроксиапатита (ГА) проведено методом атомно-силовой микроскопии с использованием специализированных зондов с ГА. Результаты. В результате исследования химического состава кальцинатов аортальных полулуний определено, что их основу составляет ГА. Показано, что сила адгезии эндотелия основания аорты по отношению к фосфату кальция при формировании в этой области атеросклеротической бляшки увеличивается в 4 раза, что указывает на развитие дисфункции эндотелия. При повреждении эндотелия сила адгезии субэндотелиального пространства возрастает в 14-23 раза. Заключение. Полученные результаты свидетельствуют о патогенетической значимости в развитии кальциноза аортального клапана и корня аорты таких факторов, как дисфункция эндотелия, изменение его адгезивных свойств и обнажение субэндотелиальных структур. Результаты исследований демонстрируют эффективность использования разработанных специализированных зондов на основе ГА для моделирования процессов образования кальцийсодержащих структур клапана аорты.
Кальцинирующий аортальный стеноз, патогенез, атомно-силовая микроскопия, рентгенодифракционный анализ, сканирующая электронная микроскопия, кальциноз, атеросклеротическая бляшка, адгезия, эндотелий, гидроксилапатит (гидроксиапатит)
Короткий адрес: https://sciup.org/14113255
IDR: 14113255 | УДК: 616-092 | DOI: 10.23648/UMBJ.2017.25.5242
Текст научной статьи Особенности адгезивных свойств аортальных полулуний и атеросклеротических бляшек у больных кальцинирующим аортальным стенозом
Введение. В течение последних лет в России наметился рост средней продолжительности жизни, а вместе с этим и рост количества больных пожилого возраста с кальцинозом клапана аорты. Около 30 % пожилых людей имеют эхокардиографические и рентгенологические признаки склероза аортального клапана, ранние и субклинические формы кальцинирующей болезни аортального клапана.
Несмотря на повышенный интерес к этой проблеме, процесс формирования депозитов солей кальция в структурах аортального клапана остается в полной мере не изученным. В настоящее время доказано участие в регуляции отложения фосфатов кальция более 30 различных биологически активных соединений белковой или неорганической природы, ряда фенотипически измененных клеток, а также мембранно-везикулярных структур [1, 3]. При этом попытки терапевтического воздействия на эти звенья не привели к значимому замедлению формирования депозитов кальция. Следовательно, существуют некие дополнительные механизмы отложения солей кальция в экстрацеллюлярном матриксе клапана аорты. Не оспаривая доказанную в многочисленных исследованиях роль механизма активного накопления нерастворимых солей кальция в структуре аортальных полулуний, следует отметить, что в формирование данных отложений могут вносить вклад и различные физико-химические процессы. Как известно, при рН>4,2 единственным термодинамически стабильным фосфатом кальция в водном растворе является гидроксилапатит (ГА) [4], который идентифицируется в депозитах солей кальция артерий человека [3, 4]. При этом механизмы формирования первичного «ядра» ГА в межуточной ткани до настоящего времени остаются недостаточно изученными.
В медицинских исследованиях часто имеется необходимость получения не только визуальных данных о биологических объектах, но и информации о топологических свойствах поверхности, включая силу адгезии, шероховатость, модули упругости и иные характеристики объектов [6, 7]. Происходит постепенная переориентация на нано-размерные области изучения поверхности, в т.ч. клеточный и субклеточный уровни исследования.
Таким образом, намечается переход от оптических методов исследования к более точным и функциональным методам изучения тонкой структуры нативных биообъектов, наиболее развитым из которых является атомно-силовая микроскопия (АСМ) [8–11]. Это вызвано необходимостью в многостороннем моделировании и последующем установлении процессов, протекающих в организме, включая изучение новых болезней и выработку лекарственных средств к ним.
Одной из актуальных и мало изученных проблем, к решению которой можно подойти с помощью АСМ, является кальцинирующее поражение аортальных полулуний человека. Информация о топологии клапана и силе адгезии ГА к его поврежденным участкам важна для понимания процессов инициации формирования депозитов кальция в матриксе полулуний.
Цель исследования. Выявление возможных механизмов формирования первичного ядра кальцификации в матриксе субэндотелиального слоя, базирующихся на адгезивных свойствах эндотелия, субэндотелиальных структур аортальных полулуний и атеросклеротической бляшки основания аорты.
Материалы и методы. Адгезивные свойства эндотелия и субэндотелиальных структур клапана аорты были изучены на 16 клапанах с тяжелой стадией аортального стеноза (рис. 1) при протезировании, а также на 10 клапанах аорты и стенках корня аорты (в т.ч. участки с атеросклеротической бляшкой на стадии атероматоза без повреждения покрышки), взятых от пациентов без заболеваний сердца. Весь исследуемый материал помещался в 0,9 % физиологический раствор хлорида натрия. Изучение структур методом АСМ проводилось в течение 6 ч с момента забора биологического материала.
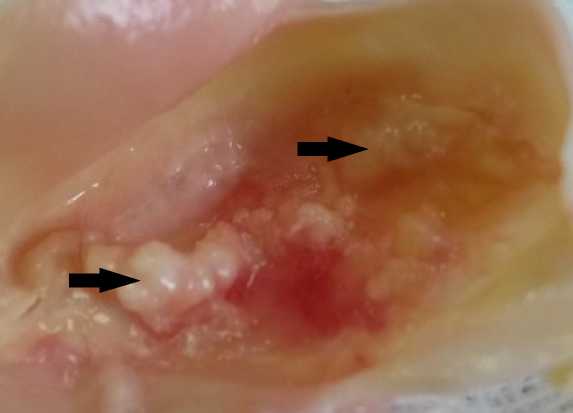
Рис. 1. Биоптат аортального полулуния. Больной К., 64 года, тяжелый аортальный стеноз. Крупные отложения депозитов кальция (стрелки)
В процессе исследования микроразмер-ной морфологии, элементного и фазового состава депозитов солей кальция с выделением субмикронных частиц кальцината использовался метод сканирующей электронной микроскопии (СЭМ) и энергодисперсионной рентгеновской спектроскопии.
Изучение адгезивных свойств аортальных полулуний и атеросклеротических бляшек к частицам ГА проводилось методом АСМ с использованием специализированных зондов с ГА. Создание зондов с ГА проводилось путем закрепления частицы ГА на вершине пирамиды стандартного кантилевера (рис. 2) с использованием полимерного адгезива, отверждаемого под действием УФ-излучения.
Поиск и закрепление ГА-частиц на вершине зонда осуществлялись с применением метода АСМ. Контроль параметров зондовых датчиков на основе ГА велся с помощью метода СЭМ.

(а)
Рис. 2. СЭМ-изображение стандартного зондового датчика до (а) и после (б) переноса ГА

(б)
Изучение адгезивных свойств аортального клапана к специализированным зондам на основе ГА проводилось в состоянии образца, близком к нативному (образец находился во влажном состоянии). Закрепление объекта исследования осуществлялось путем механического закрепления и растягивания участка клапана на слюдяной подложке. Измерение топологии проводилось в полуконтактном режиме для снижения инвазивности метода, тогда как кривые отвода для определения сил адгезии измерялись в контактном режиме АСМ. Для исследования свойств внутренней области клапана проводился надрез его поверхности.
Для повышения объективности и согласованности результатов проводилось свыше 500 последовательных измерений в случайных точках на поверхности различных участков сердечного клапана и атеросклеротической бляшки стенки аорты в зоне с общей площадью около 100 мм2. Сравнительные исследования выполнялись с использованием стандартных зондов.
Сила адгезии определялась на участке кривой отвода (рис. 3), отвечающей за прилипание зонда к поверхности образца (отрезок АВ на кривых отвода). Отклонение зонда, обусловленное силами адгезии, устанавливалось по длине проекции отрезка АВ на ось X (отрезок А'В').
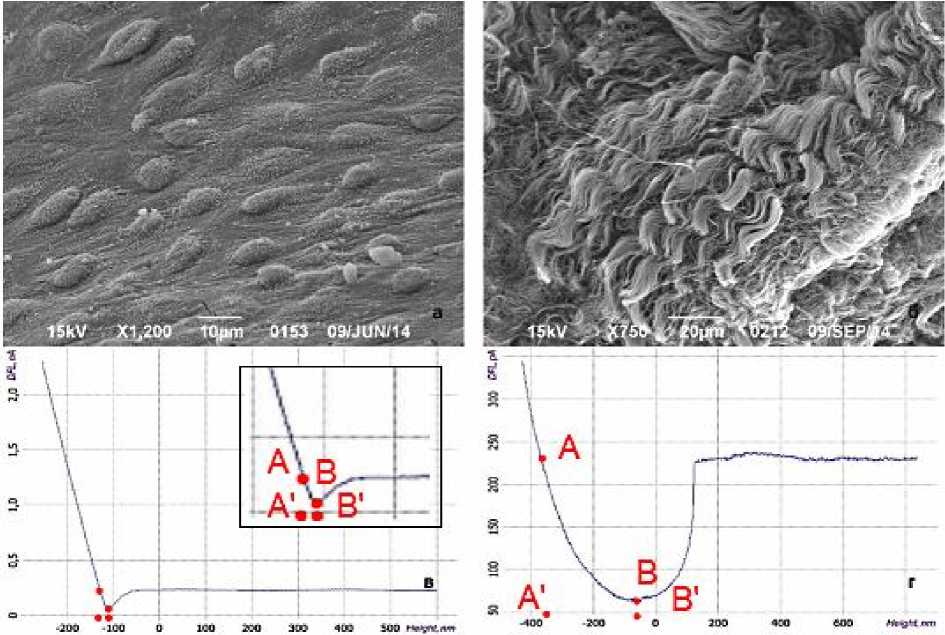
Рис. 3. Поверхность эндотелия аортальных полулуний (а) и субэндотелиального слоя (б), сканирующая электронная микроскопия. Характерные кривые отвода, полученные при АСМ на эндотелии (в) и субэндотелиальном слое (г) аортального клапана с использованием специализированных ГА-зондов
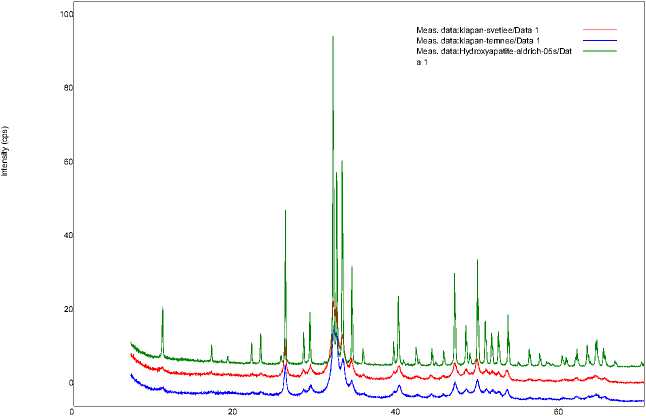
Результаты. При исследовании минерального состава отложений в аортальных полулуниях методом рентгенодифракционного анализа регистрировали депозиты солей кальция в виде гидроксилапатита с элемен- тами аморфной фазы фосфата кальция, возможно, имеющими незначительные замещения карбонатными группами, которые не изменяют параметры кристаллической решетки [3, 4]. На рис. 4 представлены рентгенодиаф- рактограммы (XRD-спектры) двух образцов кальцината в сравнении со спектром синтетического ГА. Полуколичественный элементный состав отложений оценивали по энергодисперсионным спектрам (EDX). Соотношение количеств атомов кальция и фос- фора составляло в среднем 1,73 (в стехиометрическом ГА эта величина равна 1,67). Таким образом, результаты XRD- и EDX-исследований позволяют утверждать, что изучаемые нами кальцинаты представляют собой в основном ГА.
2-theta (deg)
Рис. 4. Сравнение XRD-спектров образцов кальцината аортальных полулуний и синтетического ГА
Результаты экспериментов показали, что в области неповрежденного эндотелия (рис. 3а) на аортальной и желудочковой поверхностях аортальных полулуний значение Z составило 22,5±2,5 нм, что соответствует средней силе адгезии 56,7 нН (рис. 3в). Аналогичные результаты были получены для неповрежденного эндотелия корня аорты. Величины тех же параметров, определенные для субэндотелиального слоя (рис. 3б), оказались на порядок выше и составили 300± ±20 нм и 850 нН соответственно (рис. 3г). Следует отметить, что кривые адгезии имели высокую степень совпадения при многократных исследованиях различных участков сердечного клапана. Наиболее характерные кривые адгезии представлены на рис. 3в, г. Как видно из данных, представленных на рис. 3, для кривой отвода в случае субэндотелиального слоя, в отличие от неповрежденного эндотелия, характерен плавный переход от нижней точки В (прилипание) к начальному положению кантилевера (горизонтальная линия напротив точки А) в правой части кривой (рис. 3г), что объясняется постепенным отлипанием зонда от внутренней поверхности клапана при отводе. Аналогично с использованием стандартного и специализированного зондов выполнены исследования силы адгезии поверхности эндотелия и субэндотелиального слоя атеросклеротической бляшки синуса Вальсальвы (стадия атероматоза). Полученные результаты представлены в табл. 1.
Обсуждение. По совокупности наблюдений можно утверждать, что степень адгезии различных материалов к эндотелию и субэндотелиальному слою изменяется в широком диапазоне (табл. 1). Следовательно, силу адгезии необходимо измерять, используя не стандартные АСМ-зонды (как правило, кремниевые), а специализированные, воспроизводя при их помощи непосредственный контакт тех материалов, силу адгезии которых необходимо изучить.
Таблица 1
|
Специализированный ГА-зонд |
Стандартный АСМ-зонд (кремний, серия NSG01) |
|||
|
Эндотелиальная поверхность |
Субэндотелиальная область |
Эндотелиальная поверхность |
Субэндотелиальная область |
|
|
Неизмененное аортальное полулуние |
57 |
850 |
3238 |
1114 |
|
Холестериновая бляшка стенки корня аорты (синус Вальсальвы) |
191 |
1322 |
244 |
637 |
Величина силы адгезии аортального полулуния и атеросклеротической бляшки синуса Вальсальвы, нН
Исследование силы адгезии специализированным зондом показало, что ее значение минимально у неизмененного эндотелия. При этом показатели силы адгезии эндотелия аортальных полулуний не отличались от таковых в области стенки аорты синусов Вальсальвы. При формировании атеросклеротической бляшки на стадии атероматоза формируется дисфункция эндотелия покрышки, что проявляется в виде увеличения силы адгезии почти в 4 раза. При повреждении покрышки степень адгезии структур ядра бляшки в от- ношении фосфата кальция возрастает более чем в 23 раза – до 1322 нН (рис. 5), в то же время при повреждении неизмененного эндотелия аортальных полулуний сила адгезии увеличивается в 14 раз. Следовательно, субэндотелиальные структуры обладают крайне высоким сродством по отношению к ионам кальция и остатку фосфорной кислоты, что предопределяет высокий потенциал развития кальциноза при микроповреждении и дисфункции эндотелия [12].
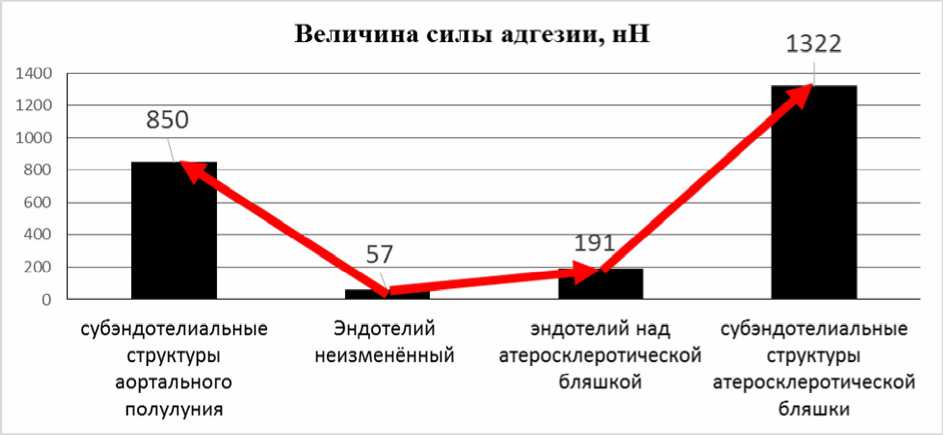
Рис. 5. Характеристика адгезивных свойств неизмененного эндотелия, эндотелия над атеросклеротической бляшкой (неповрежденная бляшка), субэндотелиальных структур аортального полулуния и атеросклеротической бляшки в отношении ГА
Известно, что эндотелий и соединительная ткань аортальных полулуний непрерывно подвергаются высокоэнергетическому гидро- динамическому воздействию потоков крови со значительным градиентом давления, что приводит к выраженной разнонаправленной деформации структуры полулуний. Все это в совокупности с часто наблюдаемым изменением качественного и количественного состава межклеточного матрикса аортальных полулуний формирует предпосылки к повреждению и нарушению функциональной активности эндотелия, обнажению субэндотелиальных структур. В свою очередь контакт «обнаженных» сульфатированных гликопротеинов и коллагеновых волокон с ионами кальция плазмы крови может приводить к инициированию формирования кристаллических и кристаллоподобных структур непосредственно в матриксе клапана [13].
Следует отметить, что при переходе венозной крови в артериальную в малом круге кровообращения происходит смещение рН в щелочную сторону (7,35–7,45) с развитием целого каскада физико-химических процессов. С одной стороны, при увеличении рН артериальной крови снижается концентрация протонов водорода и, следовательно, облегчается контакт ионов кальция и фосфорилированных боковых цепей аминокислотной основы белка (в рамках механизма конкуренции за связывание с депротонированным гидроксилом остатка фосфорной кислоты между протонами водорода и ионами кальция). С другой стороны, низкая скорость потока крови в синусах Вальсальвы создает предпосылки для формирования локальной «концентрационной пересыщенности» и образования относительно устойчивых малорастворимых средних солей – фосфатов кальция [Ca(OH)]3PO4. При этом на начальном этапе образуются частицы размером около 1 нм, что соответствует размеру ионного ассоциата Ca9(PO4)6 [14]. В свою очередь ионные ассоциаты при наличии благоприятных условий (денудация – обнажение субэндотелиального слоя при повреждении эндотелия) и с учетом высокого адгезивного потенциала субэндотелиального слоя аор- тальных полулуний (табл. 1) могут фиксироваться во внеклеточном матриксе и формировать ядра нуклеации ГА.
В дальнейшем путем пассивного физикохимического процесса на образовавшемся «ядре» формируется аморфный фосфат кальция, являющийся предшественником образования ГА [14]. Данному процессу способствует отрицательный заряд поверхности кристаллов ГА в щелочной среде, придающий им способность сорбировать ионы Са2+ и СаОН+ из плазмы [15], что обеспечивает рост кристаллов в межуточной ткани клапана.
Заключение. Таким образом, результаты исследований свидетельствуют об эффективности использования разработанных специализированных зондов на основе ГА для моделирования процессов формирования кальцийсодержащих элементов в структуре сердечного клапана и стенки аорты. Разнообразие патологических процессов, протекающих в субэндотелиальном слое, ускоряет формирование дисфункции эндотелия, что подтверждается статистически значимым ростом его адгезивных свойств. Установлено, что сила адгезии фосфата кальция в области субэндотелиальных структур с элементами повреждения многократно выше, чем над неизмененным эндотелием. Полученные факты в комплексе с «классическими» патогенетическими механизмами подтверждают возможность формирования первичного ядра нуклеации ГА в очагах повреждения эндотелия.
Следовательно, можно считать, что в минерализации участков, непосредственно контактирующих с кровью, важную роль играют пассивные физико-химические процессы, а нормальное состояние и функционирование эндотелия является одним из ключевых факторов в предотвращении инициации процесса кристаллообразования во внеклеточном матриксе как аортального клапана, так и стенки аорты.
Список литературы Особенности адгезивных свойств аортальных полулуний и атеросклеротических бляшек у больных кальцинирующим аортальным стенозом
- Агеев Ф.Т., Баринова И.В., Серединина Е.М., Орлова Я.А., Кузьмина А.Е. Механизмы формирования кальцификации артерий. Кардиологический вестник. 2012; 7 (2): 57-64.
- Efstratiadis G., Koskinas K., Pagourelias E. Coronary calcification in patients with end-stage renal disease: a novel endocrine disorder? Hormones. 2007; 6 (2): 120-131.
- Prieto R.M., Gomila I., Söhnel O., Costa-Bauza A., Bonnin O., Grases F. Study on the structure and composition of aortic valve calcific deposits: Etiological aspects. Journal of Biophysical Chemistry. 2011; 2 (1): 19-25.
- Вересов А.Г., Путляев В.И., Третьяков Ю.Д. Химия неорганических биоматериалов на основе фосфатов кальция. Российский химический журнал (Журнал Российского химического общества им. Д.И. Менделеева). 2004; XLVIII (4): 52-64.
- Пухов Д.Э., Васильев С.В., Зотов А.С., Ильин М.В., Рудый А.С. Микроморфология, состав, особенности локализации минеральных отложений створок аортальных клапанов по данным сканирующей электронной микроскопии и рентгенодифракционного анализа. Вестник Национального медико-хирургического центра им. Н.И. Пирогова. 2014; 9 (1): 23-30.
- Lim K.P., Tan L.P. Interaction force measurements for the design of tissue adhesives. Acta Biomaterialia. 2009; 5, iss. 1: 84-92.
- Lisa Manning M., Ramsey A. Foty, Malcolm S. Steinberg, and Eva-Maria Schoetz. Coaction of intercellular adhesion and cortical tension specifies tissue surface tension. PNAS. 2010; 107 (28): 12517-12522.
- Siamantouras E., Hills C.E., Younis M.Y., Squires P.E., Liu K.K. Quantitative investigation of calcimimetic R568 on beta cell adhesion and mechanics using AFM single-cell force spectroscopy. FEBS Lett. 2014; 588 (7): 1178-1183.
- Zhukov M.V., Kukhtevich I.V., Levichev V.V., Mukhin I.S., Golubok A.O. Specialized probes with nanowhisker structures for scanning probe microscopy. J. Phys.: Conf. Ser. 2014; 541 (1): 012042 (6pp).
- Дедков В.Г., Дедкова Е.Г. Контактная атомно-силовая спектроскопия биологических тканей. Письма в ЖТФ. 2010; 36 (3): 76-81.
- Benoit M., Gaub H.E. Measuring cell adhesion forces with the atomic force microscope at the molecular level. Cells Tissues Organs. 2002; 172: 174-189.
- Гуляев Н.И. Дисфункция эндотелия у больных с дегенеративным стенозом клапана аорты: современное состояние проблемы. Клиническая медицина. 2015; 5: 37-42.
- Scott J.E. Structure and function in extracellular matrices depend on interactions between anionic glycosaminoglycans. Pathol. Biol. (Paris). 2001; 49 (4): 284-289.
- Omuna K., Ito A. Cluster Growth model for hydroxyapatite. Сhem. Mater. 1998; 10: 3346-3351.
- Казанова Т. Неорганические фосфатные материалы (пер. с япон.). Киев: Наукова думка; 1998: 17-109.


