Особенности активации апоптоза в клетках семенных канальцев крыс при азооспермии после воздействия бета-излучения в дозах 2 и 8 грэй
Автор: Демяшкин Г.А., Цибулевский А.Ю., Недорубов А.А., Батов М.А., Щекин В.И.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.29, 2021 года.
Бесплатный доступ
Развитие бесплодия у самцов крыс под воздействием высоких доз ионизированного излучения обусловлено не только прямым повреждением клеток, но и блоком дифференцировки и индукцией апоптоза созревающих сперматогоний. Однако литературные данные по активности биологических медиаторов внутреннего и внешнего пути апоптоза после облучения бета-частицами, в частности, разными эффективными дозами, крайне ограничены. Цель исследования: изучение молекулярно-биологических механизмов апоптоза в семенных канальцах самцов крыс после облучения электронами в дозе 2 и 8 грэй. Самцы крыс Wistar (220±20 г; 9 - 10 недель; n=40) были поделены на 3 группы: I - контрольная (n=10); II - облучение электронами, доза 2 грэй (n=15); III - облучение электронами, доза 8 грэй (n=15). На срезах семенников толщиной 8 мкм определяли экспрессию мРНК каспаз CASP8 и CASP9 методом полимеразной цепной реакции в режиме реального времени. Апоптотическую фрагментацию ДНК выявляли методом TUNEL c подсчетом TUNEL-позитивных ядер. На 50-й день после начала эксперимента обнаружили значительное число апоптотических клеток в группах крыс, подвергнутых ионизирующему облучению. Относительное количество TUNEL-положительных клеток сперматогенного эпителия в группе 8 грэй составило 56±1,2% по сравнению с группой 2 грэй - 37±0,9% (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Сперматогенез, апоптоз, каспазы, ф-излучение, крысы
Короткий адрес: https://sciup.org/143178009
IDR: 143178009 | DOI: 10.20340/mv-mn.2021.29(3).558
Текст научной статьи Особенности активации апоптоза в клетках семенных канальцев крыс при азооспермии после воздействия бета-излучения в дозах 2 и 8 грэй
Демяшкин Г.А., Цибулевский А.Ю., Недорубов А.А., Батов М.А., Щекин В.И. Особенности активации апоптоза в клетках семенных канальцев крыс при азооспермии после воздействия бета-излучения в дозах 2 и 8 грэй. Морфологические ведомости. 2021;29(3):558. (3).558
Demyashkin GA,2Tsybulevsky AYu,1Nedorubov AA, Batov MA, Shchekin VI. The features of apoptosis activation in seminiferous tubule cells of rats with azoospermia after exposure of beta-radiation at doses of 2 and 8 Gray. Morfologicheskie Vedomosti - Morphological newsletter. 2021;29(3):570. (3).537
В экспериментальных исследованиях показано, что ионизирующее облучение семенников в дозах от 0,1 Грэй и выше инициирует развитие азооспермии, ведущей к временному или перманентному бесплодию [3]. Негативный эффект облучения на сперматогенный эпителий преимущественно обусловлен первичным повреждением клеточных структур и двухцепочечными разрывами ДНК. Наибольшую чувствительность к прямому повреждению проявляют активно пролиферирующие сперматогонии B, в то время как сперматогонии А менее чувствительны к ионизирующему излучению, но подвержены вторичному повреждению ДНК. Образующиеся в условиях облучения активные формы кислорода (далее -АФК), обладающие, как известно, выраженными цитотоксическими мутагенные свойствами, приводят к возникновению апурино-вых/апиримидиновых сайтов и одноцепочечным разрывам в молекулах ДНК [34]. Сохранившиеся после облучения спер-матогонии А могут достаточно быстро восстановить пул активно делящихся сперматогоний, количество которых будет достаточно для поддержания адекватного уровня сперматогенеза. Однако, часть сперматогоний подвергается блоку дифференцировки в течение длительного времени [5]. Накопление мутаций в «спя- щих» сперматогониях повышает вероятность нарушений пролиферации и дифференцировки на последующих этапах сперматогенеза. В случае индукции апоптоза в поврежденных клетках сперма-тогенного эпителия восстановление адекватного уровня сперматогенеза задерживается даже после снятия блока дифференцировки сперматогоний [3, 5-6].
Прямая связь между дозой облучения семенника и степенью его морфологических повреждений установлена достоверно, однако изменения пролифератив-но-апоптотического индекса подробно не исследовались. Является ли эффект отсроченной активации апоптоза в созревающих гамета на разных этапах сперматогенеза дозозависимым и если да, то в какой степени, остается неизученным. Также неизвестно, какой путь апоптоза преимущественно обуславливает отсроченную гибель после восстановления активности сперматогоний.
Цель исследования: изучение особенностей молекулярно-биологических механизмов активации апоптоза в семенных канальцах самцов крыс после облучения электронами в дозе 2 и 8 Грэй.
Материалы и методы исследования. В настоящем исследовании для первичной оценки апоптоза клеток спермато-генного эпителия крыс после облучения дозами в 2 и 8 Грэй применяли метод TUNEL c проведением иммунофлюорес-центной микроскопии. Также определяли экспрессию мРНК каспазы-8 (далее -CASP8) и каспазы-9 (далее - CASP9) для определения активности наружного и внутреннего путей апоптоза, соответственно. Самцов крыс Wistar (220±20 грамм; возраста 9-10 недель; n=40) содержали в виварии при контролируемой температуре (21°C) и световом периоде со свободным доступом к воде и корму. Животные были случайным образом поделены на 3 группы: I - контрольные (n=10); II - подвергнутые облучению электронами в дозе 2 Грэй (n=15); III - подвергнутые облучению электронами в дозе 8 Грэй (n=15).
Крысам I группы вводили 0,9% физиологический раствор NaCl интраперитонеально на протяжении всего эксперимента. Животных II и III групп (n=30) под- вергали однократному прицельному облучению электронами тазово-брюшного сегмента с использованием линейного акселератора («NOVAC-11», мощность дозы 1 Грэй/мин) в первый день эксперимента в дозах 2 Грэй и 8 Грэй, соответственно. Животных всех групп выводили из эксперимента путем введения высоких доз анестетика на 50-е сутки.
Все манипуляции осуществляли согласно Международным рекомендациям по проведению медико-биологических исследований с использованием животных (ЕЭС, Страсбург, 1985), Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ЕЭС, Страсбург, 1986), Руководствам по проведению медико-биологических исследований по уходу и использованию лабораторных животных (ILAR, DELS) и Правилам лабораторной практики и приказу Министерства здравоохранения РФ № 199н от 01.04.2016 «Об утверждении правил лабораторной практики», исследования были также одобрены локальным этическим комитетом.
Срезы, полученные из фрагментов семенников, фиксировали в 4% растворе параформальдегида в фосфатно-солевом буфере (далее - PBS) 15-20 минут при 20°C, после чего обрабатывали 100 мкл раствором протеиназы K с концентрацией 20 мкг/мл и инкубировали в течение 10 минут при комнатной температуре. Затем проводили отмывку, погрузив предметные стекла в PBS на 5 минут при комнатной температуре. Далее добавляли 50 мкл окрашивающего раствора TdT (ThermoFisher, USA) и инкубировали 60 минут при 37°C. Затем проводили удаление рабочего раствора TdT и промывание в PBS. Далее добавляли монтажную среду с DAPI (ThermoFisher, USA) и контролировали, применяя флуоресцентный микроскоп и регулируя интенсивность флуоресценции набором фильтров FITC.
Фрагменты аутоптатов семенников помещали в стабилизирующий раствор и хранили при -70°C до проведения исследования. Образцы подвергали гомогенизации согласно стандартному протоколу. Экстракцию тотальной РНК производили с использованием набора готовых реакти- вов RNeasy Plus Mini Kit (QIAGEN, Нидерланды). Синтез комплементарной ДНК (кДНК) осуществляли с помощью SuperScript™ VILO™ Master Mix (Invitrogen). Выделенные кДНК подверглись полимеразной цепной реакции в реальном времени (далее - ПЦР-РВ) с использованием готовой смеси реагентов Absolute Blue QPCR Mix (Thermo Scientific, США) с SYBR Green I. ПЦР-РВ проводилась с использованием StepOne System (Applied Biosystems, CША) и штатного программного обеспечения.
Анализ экспрессии генов проведен с использованием метода определения порогового цикла (Ct) и вычисления относительной экспрессии генов согласно протоколу [7]. Контроль выполнен относительно референсного гена домашнего хозяйства GAPDH. Подбор праймеров был осуществлен на основании общедоступных материалов о последовательностях ДНК и мРНК генов в базе данных NCBI с использованием Primer-BLAST. Сравнение между группами проводилось с использованием однофакторного дисперсионного анализа ANOVA со статистической значимостью на уровне p<0,05.
Результаты исследования и обсуждение. Апоптотический статус в образцах семенников крыс оценивали в группе контроля, 2 Грэя и 8 Грэй. Во всех группах апоптотическая фрагментация ДНК обнаруживались в пределах сперма-тогенного эпителия преимущественно в сперматоцитах. В группе 8 Грэй относительное количество TUNEL-положительных клеток в сперматогенном эпителии семенных канальцев на 21 сутки было значительно достоверно выше (p<0,01) группы 2 Грэя, 56±1,2% и 37±0,9%. В контрольной группе регистрировали 10±1,1% TUNEL-положительных клеток (рис. 1).
Относительная экспрессия CAPS9 была статистически значимо выше в экспериментальных группах по сравнению с контролем (p<0,01). В группе 8 Грэй экспрессия CASP9 была выше, чем в группе 2 Грэя (5,83±0,48 против 4,1±0,41; p<0,01). Экспрессия CASP8 статистически значимо не отличалась между контрольной и экспериментальными группами (рис. 2).
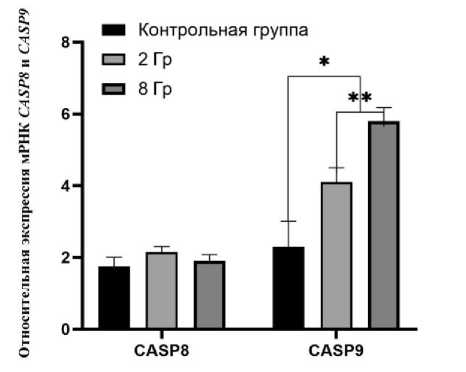
Рис. 2. Диаграмма относительной экспрессии мРНК CASP8 и СASP9 в образцах семенных канальцев крыс контрольной группы и после воздействия ионизирующего излучения (в условных единицах). Обозначения: * – статистически значимая разница между контрольной и экспериментальными группами; ** – статистически значимая разница между группами 2 Грея и 8 Грэй.
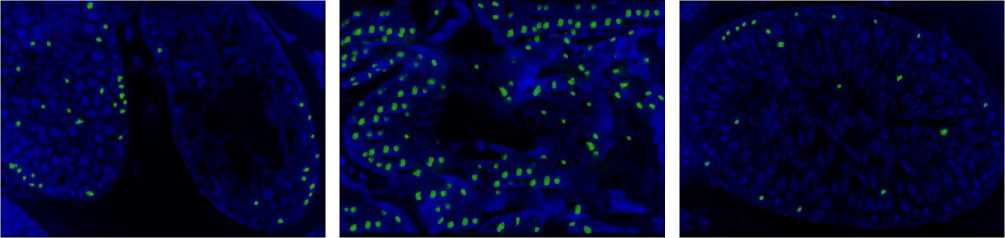
а б в
Рис. 1. TUNEL-позитивные клетки в семенных канальцах крыс после облучения дозами 2
Грэя (а), 8 Грэй (б) и в контрольной группе (в). Окр.: флюоресцентная микроскопия. Ув.:
х400.
Митохондрии, как известно, являются основным источником АФК в клетках. Окислительный стресс и сопряженная с ним гиперпродукция АФК непосредственно связаны с индукцией апоптоза во многих типах клеток, в том числе и спер-матогенного эпителия [1]. Кроме того, оксид азота действует на митохондрии и индуцируя митохондриально-зависимый апоптоз способствует гибели сперматого-ний А при старении у крыс [11-12]. Таким образом, нормализация функции митохондрий может привести к существенному снижению уровня АФК в клетках.
Ряд ключевых событий в период апоптоза, вызванного ионизирующим излучением, связаны с изменением митохондриальной активности и их целостности: снижением производства АТФ, увеличением выработки АФК, увеличением проницаемости митохондриальной мембраны, а также высвобождением цитохрома С, апоптоз-индуцирующего фактора и, наконец, каспаз в цитоплазму клетки. Все эти изменения обуславливают нарушение функции и структурное повреждение митохондрий [13].
Принимая во внимание преимущественное влияние ионизирующего излучения на митохондрии, предполагалось получение результатов, указывающих на преимущественную активации внутреннего пути апоптоза в этих условиях, что характеризуется повышением экспрессии CASP9. Отсутствие значимой активации CASP8, вероятнее всего, связано с иммунной привилегированностью сперматоген-ного эпителия и отсутствием значимого влияния внешнего пути на индукцию апоптоза в клетках сперматогенного эпителия. Также в ряде исследований установлена корреляция между снижением активности антиапоптотического гена BCL-2 и повышением экспрессии CASP9, что указывает на необходимость изучения про- и антиапоптотического соотношения экспрессии ключевых генов под воздействием ионизирующего излучения [14].
Результаты реакции, полученной методом TUNEL, указывают на дозозависимый характер активации апоптоза в сперматогониях и сперматоцитах при воз- действии бета-излучения, однако не исключено, что избыточная активация апоптоза при более высоких дозах излучения является не только следствием накопления ошибок ДНК, но и прямым повреждающим действием на клеточные структуры. На это указывает значительное изменение структуры семенника после облучения в дозе 8 Грэй. Очевидно, что для всесторонней оценки возможности и сроков восстановления сперматогенного эпителия под воздействием различных доз ионизирующего излучения необходимо дальнейшее углубленное исследование.
Заключение. В проведенном нами исследовании получены данные, свиде- тельствующие о дозозависимом эффекте бета-излучения на индукцию апоптоза в семенных канальцах крыс. Установлено, что преимущественная активация апоптоза после воздействия бета частиц обусловлена внутренним путем и, вероятно, связана с нарушение целостности и функции митохондрий. Повышение экспрессии CASP9 в группе крыс с наибольшей лучевой нагрузкой по сравнению с группой животных с меньшей дозой облучения указывает на возможную корреляцию между поглощенной дозой ионизирующего излучения и степенью повреждения митохондрий.


