Особенности формирования химического состава воды р. Бира
Автор: Коган Р.М., Рыжкова Л.О.
Журнал: Региональные проблемы @regionalnye-problemy
Рубрика: Биология. Экология. Геоэкология
Статья в выпуске: 2 т.14, 2011 года.
Бесплатный доступ
Исследовано влияние природных и антропогенных факторов на формирование химического состава воды р. Бира.
Поверхностные воды, химический состав, загрязнение, тяжелые металлы
Короткий адрес: https://sciup.org/14328784
IDR: 14328784 | УДК: 556.531
Текст научной статьи Особенности формирования химического состава воды р. Бира
Исследовано влияние природных и антропогенных факторов на формирование химического состава воды р. Бира. Ключевые слова: поверхностные воды, химический состав, загрязнение, тяжелые металлы.
Река Бира является одной из основных водных артерий на территории Еврейской автономной области (ЕАО), на её берегах расположено значительное количество населенных пунктов. Воды реки используются в хозяйственно-бытовых и питьевых целях, но существующая система мониторинга не позволяет полностью оценить ее экологическое состояние, поэтому нами проведено исследование факторов, влияющих на химический состав воды в данном водотоке в различные сезоны и в точках, входящих и не входящих в систему регионального мониторинга.
Материалы, использованные в работе: данные Бассейнового управления по ЕАО, Управления природных ресурсов по ЕАО, ФГУ «Центра гигиены и эпидемиологии в Еврейской автономной области»; данные собственных анализов проб воды.
Отбор проб проводился в 2008-2010 гг. в весенний и осенний периоды. Расположение точек и их нумерация приведены на рис. 1, 2.
Показатели качества воды: кислотность, жесткость, содержание растворенного кислорода, тяжелых металлов (ТМ), фторидов, хлоридов, сульфатов, нитратов определены по стандартным методикам [8, 9, 12]
Расчет распределения металлов между сосуществующими формами основан на методе материального баланса:
См=[Мю+]++Е (1) 1
где См - суммарная концентрация растворимых форм металлов; [Мт+] - концентрация ионов металла, не связанных в комплексные соединения; [ML]11" концентрация комплексных соединений металла с лигандами [6].
Мольная доля свободных ионов (a[Mm+j) может быть рассчитана по следующим уравнениям:
"ик™’ (2)
ф = 1 + А[т]+аЫ2+... + аЫ+
+ рКТ pKWXlT рМ , (3)
где ^п - константа устойчивости комплексного соеди нения [ML]11", Ф - функция Фронеуса, Ln - концентрация комплек сообразующих лигандов.
Мольная доля (%) каждого комплексного соединения металла (a[ML]n) определена делением соответствующего ей /?п [LJn на Ф:
Б [л Г
“и » 'т (4)
Содержание ионов Н+ и ОН" рассчитано исходя из ионного произведения воды (Kw):
Kw =[Н+] + [ОН- ] (4); [Н+]= 10"рн; [ОН ]= 10"р°н. (5)
Нумерация точек отбора проб: 1. р. Кульдур (до слияния с р. Кимкан), 2. р. Кимкан (до слияния с р. Кульдур), 3. р. Кульдур (с. Двуречье, слияние рек Кульдур и Кимкан), 4. р. Бира (и. Биракан), 5. р. Биракан, 6. р. Бира (и. Теплоозерск), 7. р. Каменушка, 8. р. Никита, 9. р. Саг-ды-Бира, 10. р. Трек, 11. р. Кирга, 12. р. Бира (с. Раздольное), 13. р. Бира перед г. Биробиджаном.
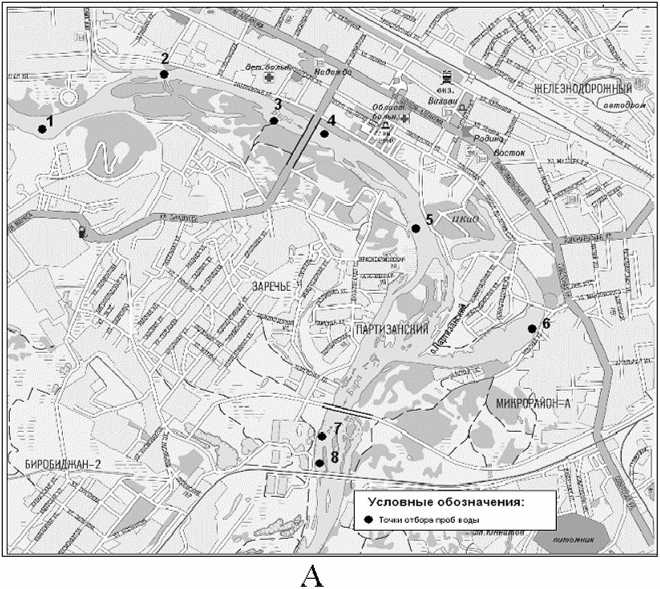
А. Точки регионального мониторинга: 1. Августовский водозабор, 2. Аремовский водозабор, 3. Водозабор Сопка, 4. Спасательная станция, 5. ПКиО, 6. Ул. Невская, 7. Выше сброса сточных вод с ГОСК, 8. Ниже сброса сточных вод с LOCK.
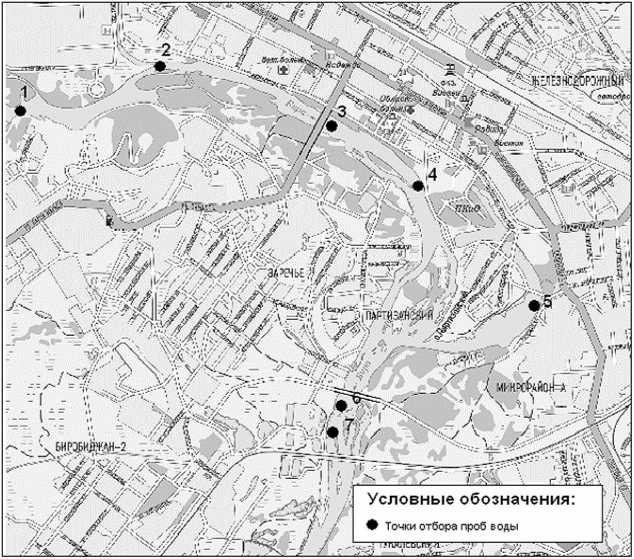
Б. Точки вне системы регионального мониторинга: 1. Район ДСМ, 2. Начало и. Бумагина; 3. После моста на п. Сопка, 4. Очистные сооружения, 5. Ул. Невская; 6. Район нового моста до спуска сточных вод, 7. Район нового моста после спуска сточных вод.
Основные результаты
Химический состав поверхностных вод реки Бира и ее притоков формируется под влиянием своеобразных природных условий, наличием сложной системы проток, рукавов и водоемов, рудоносных и коллекторнодренажных вод, гидрометеорологических условий, характерных для каждого периода, на которые накладывается антропогенное загрязнение. Расположение в Уссурийской геохимической провинции и наличие месторождений и рудопроявлений полезных ископаемых в пределах площади водосбора могут влиять на содержание в воде неорганических соединений, которое увели-
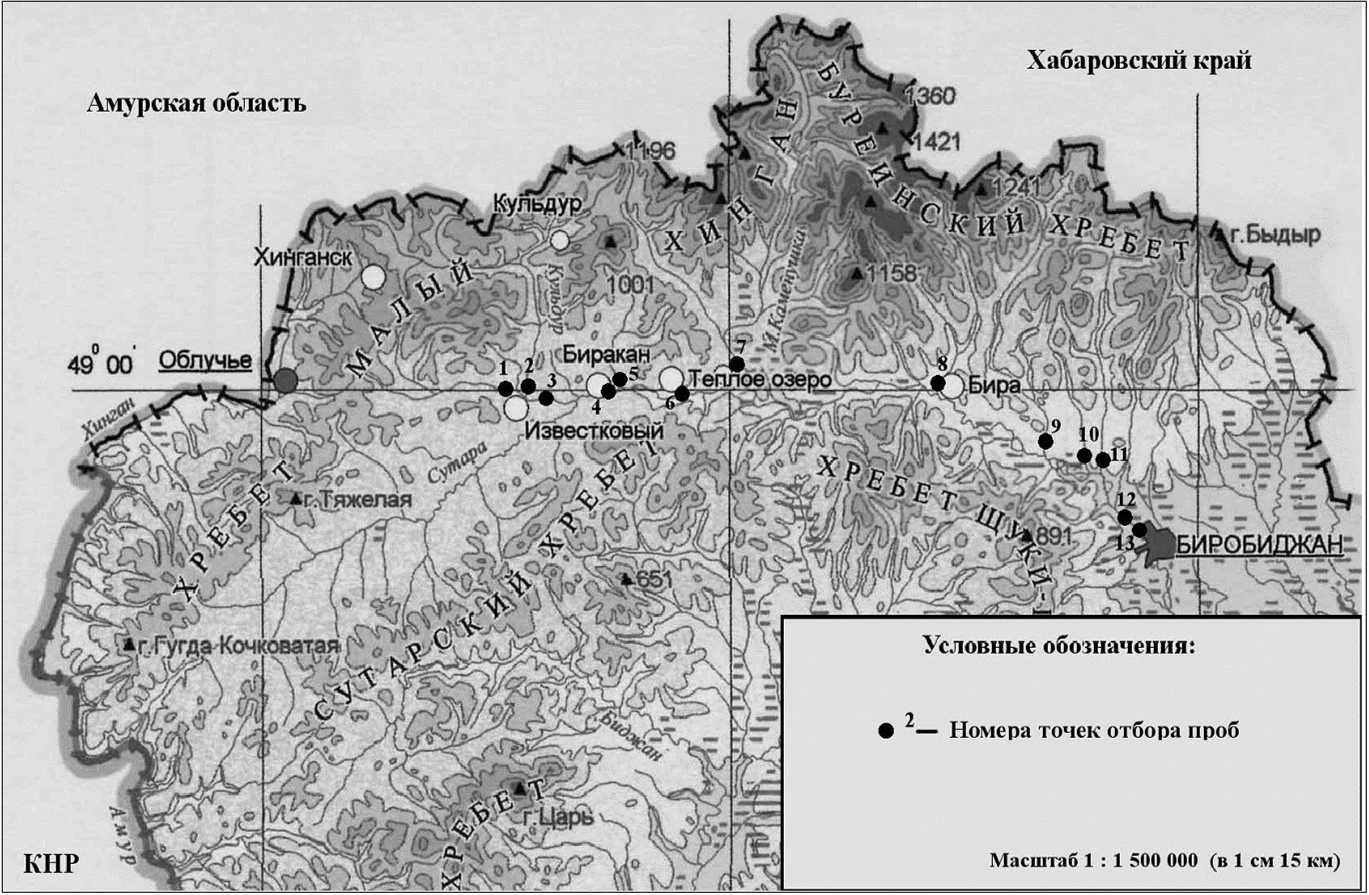
Рис 1. Точки отбора проб воды в р. Бира от истока до г. Биробиджана и в притоках
чивается в результате процессов химического выветривания горных пород, сопровождающихся их механическим разрушением и растворением [И]. Месторождения, которые могут являться источником загрязнения исследуемого водотока различными соединениями металлов - продуктов транзита и деструкции основного сырья и сопутствующих соединений, представлены в табл. 1.
Антропогенная составляющая со сточными, снего выми и дождевыми водами (табл. 2) обусловливает дополнительное загрязнение ТМ, азотом аммонийным, органическими и взвешенными веществами, большинство из которых относится к Ш классу токсичности [6].
В связи с неравномерным распределением природных и антропогенных источников определение химического состава воды в р. Бира проведено отдельно от истоков до г. Биробиджана (табл. 3, 4) и на территории города (табл. 5).
Б
Рис 2. Точки отбора проб воды в р. Бира на территории с Биробиджана
Минерально-сырьевые источники загрязнения вод р. Бира [2, 10]
|
Месторождение |
Основное сырье |
Сопутствующие соединения |
|
Мало-Хинганский железорудный район |
Железистые кварциты: гематитовые (Fe2O3), магнетитовые (Fe2O3*FeO), магнетит-гематитовые, окисно-раунитовые (Mn2O3*nSiO2), окисно-карбонатные (родахрозит МпСО3), гаусманитовые (МпО*Мп2О3), а также окисные и полуокисные руды с псиломеланом (тМпО*МпО2*пН2О), пиролюзитом (МпО2) и лимонитом (FeOOH) |
Оксиды алюминия, кремния, магния, марганца, молибдена, кальция. |
|
Хинганское месторождение олова |
Касситерит (SnO2) |
Сульфиды железа (пирит), свинца (галенит), цинка (сфалерит), меди (халькопирит, борнит), мышьяка, железа. Оксиды железа (III), магния и титана. Карбонаты кальция и свинца. |
|
Сутарский золотоносный район |
Золото (Ап) |
Оксиды алюминия, железа, иттрия, ниобия и титана. Соли магния, цезия и циркония. |
|
Лондоковское месторождение известняков |
Кремнезем (SiO2), глинозем (А12О3), карбонат кальция (СаСО3) |
Оксиды алюминия, железа, кальция, кремния и марганца. |
|
Лондоковское месторождение цементных и флюсовых известняков |
Оксиды кальция, карбонаты кальция и магния |
Оксиды алюминия, железа, кремния, марганца, титана, фосфора. |
|
Торфяные месторождения |
Торф |
Оксиды железа, кальция, фосфора, серы; азотсодержащие соединения. |
Как видно из данных, приведенных в табл. 3, 4, вода очень мягкая, кислотность варьируется от слабо кислой до нейтральной, в большинстве точек отбора наблюдается повышенное содержание железа, в некоторых точках - марганца. Тенденция увеличения содержания ТМ от истоков до г. Биробиджана может быть связана с внесением их с притоками, протекающими в районах месторождений р. Кимкан (№ 1) или с населенными пунктами на реках Трек (№ 10), Кирга (№ 11), Бира (№ 6 и 12).
На территории г. Биробиджана основными природ-
Та блиц а 2
Сброс загрязняющих веществ в р. Бира на территории г. Биробиджана
|
Год |
Загрязнители, т |
||||||||||||
|
ч о к ^ К и |
о л и и и m |
эк к эК § О 2 1 о < |
S л & К К |
л R 8 2 3 Cl, К |
о |
и |
и |
3 к & к К |
эК К ю о Cl, О ^ О О е |
m и |
я о Cl, X |
||
|
1998 |
0,16 |
0,17 |
69,05 |
235,00 |
25,39 |
3,91 |
- |
- |
0,78 |
- |
- |
- |
- |
|
1999 |
0,15 |
0,17 |
68,40 |
219,00 |
4,18 |
- |
- |
0,01 |
- |
- |
0,38 |
- |
- |
|
2000 |
0,21 |
0,16 |
50,35 |
143,45 |
25,65 |
2,95 |
0,08 |
0,02 |
1,90 |
12,70 |
0,67 |
0,02 |
0,14 |
|
2001 |
0,29 |
0,19 |
62,40 |
169,46 |
34,91 |
3,49 |
0,01 |
0,01 |
0,86 |
0,20 |
0,01 |
0,05 |
|
|
2002 |
0,16 |
0,16 |
53,43 |
173,60 |
34,77 |
2,98 |
0,04 |
0,10 |
1,74 |
31,62 |
0,20 |
- |
0,20 |
|
2003 |
0,13 |
0,13 |
51,26 |
217,00 |
33,06 |
5,00 |
0,10 |
- |
1,63 |
28,81 |
- |
- |
0,10 |
|
2004 |
0,15 |
0,19 |
66,81 |
278,98 |
- |
4,27 |
0,05 |
0,12 |
2,64 |
2,36 |
- |
0,15 |
|
|
2005 |
0,20 |
0,18 |
53,27 |
183,37 |
- |
5,22 |
0,07 |
0,02 |
3,04 |
97,08 |
1,40 |
- |
0,06 |
|
2006 |
0,20 |
0,16 |
14,24 |
28,01 |
278,90 |
5,79 |
0,08 |
0,59 |
3,70 |
1276,00 |
1,32 |
- |
0,14 |
|
2007 |
0,16 |
0,15 |
18,54 |
276,31 |
- |
4,45 |
0,08 |
0,40 |
2,49 |
14,24 |
0,50 |
- |
0,09 |
|
2008 |
0,21 |
0,14 |
42,53 |
208,62 |
2,29 |
5,61 |
0,10 |
- |
2,68 |
13,77 |
1,29 |
- |
|
Примечание; Данные Бассейнового управления по ЕАО
Содержание поллютантов в р. Бира от истока до г. Биробиджана, мг/дм3
|
№ |
рн |
Жесткость |
Фториды |
Железо |
Марганец |
Медь |
Кальций |
Магний |
Никель |
|
1 |
7,3 |
0,70 |
0,34 |
0,292 |
0,065 |
0,011 |
8,0 |
3,6 |
< 0,003 |
|
2 |
7,3 |
0,80 |
0,23 |
0,610 |
0,219 |
0,010 |
10,0 |
3,6 |
< 0,003 |
|
3 |
7,4 |
0,50 |
0,48 |
0,049 |
0,014 |
0,012 |
8,0 |
1,2 |
< 0,003 |
|
4 |
7,4 |
0,70 |
0,33 |
0,723 |
0,081 |
0,012 |
10,0 |
2,4 |
< 0,003 |
|
5 |
6,9 |
1,50 |
0,41 |
0,343 |
0,034 |
0,005 |
<1 |
<1 |
< 0,003 |
|
6 |
6,8 |
0,80 |
0,37 |
0,347 |
0,069 |
0,010 |
10,0 |
3,6 |
< 0,003 |
|
7 |
7,3 |
0,50 |
0,30 |
0,083 |
0,016 |
0,004 |
8,0 |
1,2 |
< 0,003 |
|
8 |
6,8 |
0,60 |
0,43 |
0,241 |
0,037 |
0,006 |
8,0 |
2,4 |
< 0,003 |
|
9 |
7,5 |
0,60 |
0,28 |
0,251 |
0,025 |
0,018 |
6,0 |
3,6 |
< 0,003 |
|
10 |
7,5 |
0,70 |
0,35 |
0,461 |
0,037 |
0,006 |
8,0 |
3,6 |
< 0,003 |
|
И |
7,3 |
0,60 |
0,41 |
0,573 |
0,039 |
0,009 |
6,0 |
3,6 |
< 0,003 |
|
12 |
7,5 |
0,70 |
0,30 |
0,451 |
0,040 |
0,004 |
6,0 |
4,8 |
< 0,003 |
|
13 |
7,3 |
0,60 |
0,37 |
0,546 |
0,071 |
0,009 |
6,0 |
3,6 |
< 0,003 |
Примечание: 1. Нумерация точек указана на рис. 1; 2. Жесткость измерена в градусах; 3. Данные 2010 г. 4. Анализ проведен ФГУЗ «ЦГ и Э в ЕАО»
ными загрязнителями также являются железо и марганец, причем концентрация железа намного выше, чем марганца; техногенными - медь и никель, преобладающими анионами - сульфаты, хлориды и нитраты. Содержание поллютантов варьируется по годам, в зависимости от точек поступления сточных вод (фрагмент приведен в табл. 5) и от фаз гидрологического режима (табл. 6).
Например, весной 2009 г. в связи с повышением уровня воды происходит уменьшение концентрации природных загрязнителей по сравнению с осенним периодом 2008 г. Другая зависимость наблюдается для техногенных элементов, поскольку наряду с изменением гидрологического режима их поступление со сточными водами неравномерно в течение года.
Содержание некоторых соединений, например ТМ, определяется не только суммарным количеством поступлений от природных и антропогенных источников, но и сложными химическими превращениями, основными из которых являются окислительно-восстановительные процессы и образование комплексных соединений с неорганическими и органическими лигандами.
Например, наблюдается сложная и неоднозначная зависимость между содержанием двух- и трехвалентного железа и такими параметрами, как кислотность, окис-
Та блиц а 4
Содержание поллютантов в воде в р. Бира от истока до г. Биробиджана в единицах ПДКвр
|
№ |
Фториды |
Железо |
Марганец |
Медь |
Кальций |
Магний |
Никель |
|
1 |
0,22 |
0,97 |
0,65 |
0,011 |
0,26 |
0,18 |
<0,03 |
|
2 |
0,15 |
2,03 |
2,19 |
0,010 |
0,33 |
0,18 |
<0,03 |
|
3 |
0,32 |
0,16 |
0,14 |
0,012 |
0,26 |
0,06 |
<0,03 |
|
4 |
0,22 |
2,41 |
0,81 |
0,012 |
0,33 |
0,12 |
<0,03 |
|
5 |
0,27 |
1,13 |
0,34 |
0,005 |
<0,033 |
<0,05 |
<0,03 |
|
6 |
0,25 |
1,156 |
0,69 |
0,010 |
0,33 |
0,18 |
<0,03 |
|
7 |
0,20 |
0,27 |
0,16 |
0,004 |
0,26 |
0,06 |
<0,03 |
|
8 |
0,28 |
0,803 |
0,37 |
0,006 |
0,26 |
0,12 |
<0,03 |
|
9 |
0,18 |
0,836 |
0,25 |
0,018 |
0,21 |
0,18 |
<0,03 |
|
10 |
0,23 |
1,536 |
0,37 |
0,006 |
0,26 |
0,18 |
<0,03 |
|
И |
0,27 |
1,91 |
0,39 |
0,009 |
0,21 |
0,18 |
<0,03 |
|
12 |
0,20 |
1,503 |
0,40 |
0,004 |
0,21 |
0,24 |
<0,03 |
|
13 |
0,25 |
1,82 |
0,71 |
0,009 |
0,21 |
0,18 |
<0,03 |
Примечание: 1. Нумерация точек указана на рис. 1
Среднегодовая концентрация некоторых загрязнителей в воде р. Бира на территории г. Биробиджана 2007-2009 гг.
|
№ точек отбора проб |
Концентрация, мг/дм3 |
||||||||
|
рн |
Железо |
Марганец |
Фториды |
Аммиак |
Сульфаты |
Хлориды |
Нитриты |
Нитраты |
|
|
1 |
7,3 |
0,41-0,87 0,600 |
0,03-0,04 0,033 |
0,12-0,44 0,230 |
3,6-0,32 1,670 |
2,00-16,40 11,400 |
2,00-2,50 2,300 |
0,005-0,007 0,0056 |
0,40-1,20 0,730 |
|
2 |
7,4 |
0,37-0,48 0,440 |
0,01-0,02 0,016 |
0,13-0,30 0,220 |
0,24-3,90 1,55 |
2,50-23,00 11,960 |
2,50-2,50 2,500 |
0,00-0,004 0,0012 |
0,40-1,40 0,860 |
|
3 |
7,5 |
0,23-0,52 0,370 |
0,04-0,09 0,046 |
0,02-0,54 0,360 |
0,28-0,45 0,370 |
10,3-21,6 15,50 |
0,40-11,00 5,130 |
0,07-0,012 0,010 |
0,85-1,60 1,280 |
|
4 |
7,3 |
0,35-0,47 0,370 |
0,03-0,06 0,043 |
0,12-0,28 0,180 |
0,27-0,38 0,320 |
0,35-8,50 4,100 |
2,00-4,00 2,800 |
0,01-0,016 0,012 |
0,40-1,80 0,966 |
|
5 |
7,3 |
0,25-0,37 0,311 |
0,03-0,06 0,042 |
0,17-0,33 0,240 |
0,22-0,54 0,380 |
8,10-24,00 17,50 |
2,50-10,20 5,560 |
0,009-0,019 0,013 |
0,80-1,80 1,360 |
|
6 |
7,1 |
0,28- 0,90 0,500 |
0,02-0,04 0,036 |
0,21-0,33 0,220 |
0,29-0,47 0,390 |
3,00-19,4 11,400 |
2,00-10,00 4,800 |
0,007-0,011 0,009 |
0,30-1,25 0,680 |
|
7 |
7,3 |
0,20-0,47 0,350 |
0,03-0,08 0,043 |
0,14-0,32 0,220 |
0,23-6,80 2,45 |
2,60-18,70 10,700 |
2,50-4,00 3,000 |
0,00-0,007 0,0046 |
2,60-10,70 4,900 |
|
8 |
7,1 |
0,40-0,61 0,520 |
0,03-0,1 0,007 |
0,13-0,19 0,160 |
4,51-7,30 4,96 |
4,10-32,70 16,800 |
4,10-7,50 5,860 |
0,031-0,138 0,081 |
2,30-5,70 3,530 |
Примечание: 1. Данные ФГУЗ «ЦГиЭ в ЕАО», 2. Числитель - минимальные и максимальные, знаменатель - средние значения лителвно-воостановителвный потенциал и содержание кислорода. При этом восстановление железа (Ш) до железа (П) происходит не в области положительных значений ЕН, а при небольшом положительном потенциале и насыщении воды кислородом (рис. 3).
К факторам, которые регулируют концентрацию ТМ в природных водах, их химическую реакционную способность, биологическую доступность и токсичность, относятся не только валовое содержание, но и доля сво бодных и связанных форм металла, поскольку они имеют различные этоксикологические свойства. Их распределение зависит от концентрации органических и неорганических лигандов (в основном сульфат, хлорид и гидроксил ионов (табл. 5)) и прочности соответствующих комплексных соединений [4, 5, 7].
Расчет мольных долей (%) сульфатов, находящихся в равновесии с ионами металлов, в интервале концентраций, приведенных в табл. 5, показывает, что значитель-
Та блиц а 6
Содержание тяжелых металлов в р. Бира на территории г. Биробиджана, мг/дм3/единицы ПДКвр
|
№ пробы |
Медь |
Никель |
Железо общее |
Марганец |
|
Осень (07.10.08 г.) |
||||
|
1 |
0,030/0,03 |
0,300/3,0 |
3,464/11,5 |
0,904/9,0 |
|
2 |
0,010/0,01 |
0,228/2,2 |
3,128/10,4 |
0,503/5,0 |
|
3 |
0,001/0,01 |
0,294/ 2,9 |
3,040/10,3 |
0,400/3,7 |
|
4 |
0,007/0,001 |
0,346/3,4 |
3,390/11,3 |
0,420/4,0 |
|
5 |
0,015/0,02 |
0,079/0,8 |
3,104/10,3 |
0,654/6,5 |
|
6 |
0,015/0,02 |
0,117/1,2 |
1,021/3,4 |
0,616/6,0 |
|
7 |
0,034/0,03 |
0,292/2,9 |
3,900/13 |
1,268/12,7 |
|
8 |
0,060/0,06 |
0,267/2,6 |
3,265/10,8 |
2,505/25,0 |
|
Среднее |
0,02/0,02 |
0,24/2,3 |
3,04/10,1 |
0,50/9,00 |
|
Весна (25.04.09 г.) |
||||
|
1 |
0,045/0,05 |
0,165/1,6 |
0,557/1,9 |
0,052/0,5 |
|
2 |
0,055/0,05 |
0,300/3,0 |
0,620/2 |
0,062/0,6 |
|
3 |
0,766/0,76 |
0,640/6,4 |
0,610/2 |
0,084/0,8 |
|
4 |
0,066/0,07 |
0,545/5,5 |
0,537/1,8 |
0,120/1,2 |
|
5 |
0,0408/0,04 |
0,570/5,7 |
0,354/1,2 |
0,124/1,2 |
|
6 |
0,020/0,02 |
0,600/6,0 |
0,371/1,23 |
0,494/5,0 |
|
7 |
0,034/0,03 |
0,387/3,8 |
0,437/1,5 |
0,114/1,1 |
|
8 |
0,024/,0,02 |
0,890/8,9 |
0,385/1,3 |
0,126/1,3 |
|
Среднее |
0,13/0,13 |
0,50/5,1 |
0,47/1,6 |
1,30/1,5 |
Примечание: точки отбора проб указаны на рис. 2 А
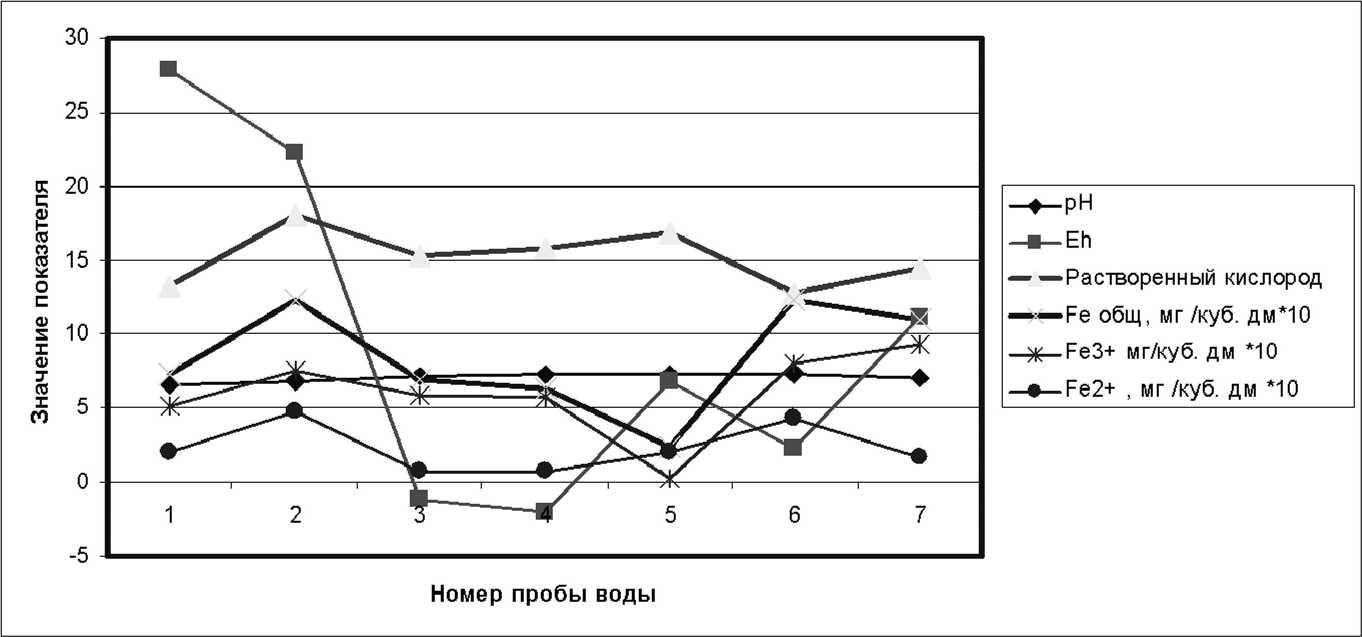
Рис. 3. Влияние кислотности, растворенного кислорода и окислительно-восстановительного потенциала на соотношение между Ге (11) и Ге (111) в воде р. Бира, Точки отбора проб указаны на рис 2 Б
ное количество железа (Ш) может находиться как в виде свободных ионов, так и в форме положительно заряженных комплексов, в то время как двухвалентные ионы (Fe2+, Mn2+, Cu2+, Ni2+) практически остаются в ионном виде (табл. 7).
Отличие в комплексообразовании металлов, находящихся в различной степени окисления, подтверждено расчетом соотношений форм хлоридных комплексов. Показано, что железо (Ш) в отличие от металлов со степенью окисления, равной двум, может образовывать моно- и бикомплексы комплексы (табл. 8).
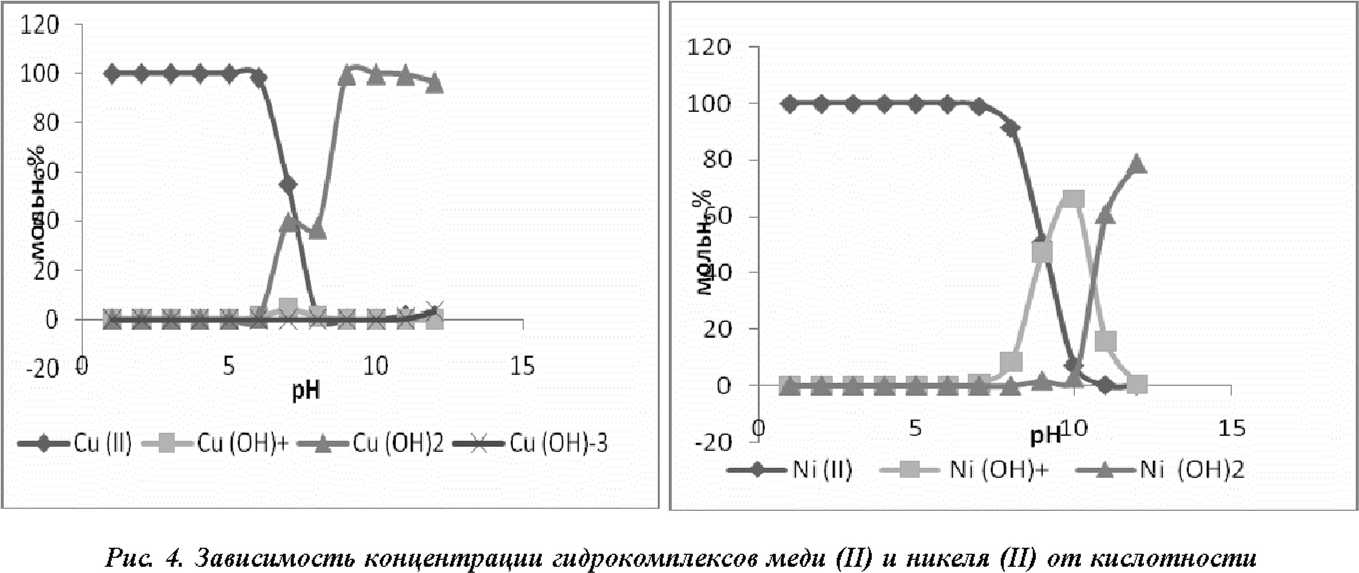
На соотношение между гидроксокомплексами влия ет кислотность среды. Например, железо (Ш) образует аквакомплексы только в кислой среде; по мере уменьшения кислотности увеличивается концентрация всех гидроксокомплексов, достигая своего предельного для каждого соединения значения при определенном pH. Железо (П) и марганец (П) могут существовать в виде аквакомплексов при широком значении pH, а гидроксо-комплексы возможны только в щелочной среде (10-13 pH) [3]. Аналогичная закономерность наблюдается для меди (П) и никеля (П) (рис. 4).
Расчеты, проведенные с использование функции Фронеуса (уравнения 2-5), показали, что при значениях
Таблица 7
Мольные доли сульфатов, находящихся в равновесии с ионами металлов
|
304"2104 моль/дм3 |
Fe3+ |
Fe(SO4)+ |
Fe2+ |
Mn2+ |
Mn(SO4) |
Cu2+ |
CuSO4 |
Ni2+ |
Ni SO4 |
|
0,5 |
66,5 |
33,3 |
99,0 |
99,0 |
1,0 |
99,86 |
1,13 |
98,9 |
1,0 |
|
1,0 |
49,9 |
49,9 |
98,0 |
98,0 |
2,0 |
97,7 |
2,24 |
97,5 |
2,04 |
|
1,5 |
38,6 |
61,2 |
96,9 |
96,9 |
3,0 |
96,6 |
3,32 |
96,9 |
3,0 |
|
2,0 |
33,3 |
66,5 |
96,1 |
96,1 |
3,8 |
95,6 |
4,80 |
95,9 |
4,6 |
|
2,5 |
28,4 |
71,3 |
95,2 |
95,2 |
4,8 |
94,5 |
5,41 |
95,0 |
4,9 |
|
3,0 |
23,9 |
75,4 |
94,0 |
94,0 |
5,9 |
93,5 |
5,60 |
94,1 |
5,9 |
|
4,0 |
19,9 |
79,6 |
92,6 |
92,6 |
7,3 |
91,6 |
8,4 |
92,3 |
7,6 |
Таблица 8
Мольные доли хлоридов, находящихся в равновесии с ионами металлов
|
C1-, моль/дм3 *104 |
Fe3+ |
FeCT2" |
FeCl’^ |
FeCl3 |
Fe2+ |
FeCl2 |
Mn2+ |
MnCl2 |
Cu2+ |
CuCl2 |
|
0,5 |
0 |
0 |
99,90 |
0 |
99,00 |
0,20 |
99,00 |
0 |
99,99 |
0 |
|
1,0 |
0 |
0 |
99,90 |
0 |
99,50 |
0,45 |
99,12 |
0,10 |
99,98 |
0,01 |
|
1,5 |
0 |
0 |
99,90 |
0 |
99,80 |
0,11 |
99,24 |
0,78 |
99,98 |
0,01 |
|
2,0 |
0 |
0 |
99,90 |
0 |
99,97 |
0,25 |
99,28 |
0,65 |
99,97 |
0,01 |
|
2,5 |
0 |
0 |
99,90 |
0 |
99,98 |
0,01 |
99,68 |
0,30 |
99,97 |
0,01 |
кислотности, характерных для р. Бира (табл. 5), преимущественной формой миграции железа (Ш) являются аквакомплексы Fe3+*nH2O, при pH около 7 (ниже сброса сточных вод) возможно появление и выпадение нейтральных гидроксидов Fe(OH)3; кроме того, во всех точках отбора проб вероятно образование метастабильной формы Fe(SO4)+. Двухвалентные ионы железа, марганца и никеля могут существовать в основном в виде аквакомплексов, в то время как для Си(П) возможно примерно одинаковое количество аквакомплексов и нейтральных гидроксидов.
Полученные результаты отражают только общую тенденцию соотношения между формами ТМ в исследованном водоеме, поскольку не учтено их взаимодействие с органическими лигандами, способность к образованию смешенных комплексов с различными анионами и конкурирующее взаимодействие между металлами. Тем не менее следует считать, что на формирование экотоксикологической ситуации в р. Бира в большой степени могут влиять гидроксиды трехвалентного железа и двухвалентной меди, которые оказывают вредное воздействие на мальков рыб, осаждаясь на жабрах, а также растворимые комплексы железа и марганца, обладающие раздражающими, мутагенными и канцерогенными свойствами, поражающие центральную нервную систему [1].
Список литературы Особенности формирования химического состава воды р. Бира
- Грушко Я.М. Вредные неорганические соединения в промышленных сточных водах. Л.: Химия, 1979. 160 с.
- Коган Р.М. Антропогенные загрязнители территории Еврейской автономной области. Владивосток: Дальнаука, 2001. 164 с.
- Коган Р.М., Рыжкова Л.О. Влияние форм нахождения природных загрязнителей в поверхностных водах р. Бира//Региональные проблемы. 2010. Т. 13, № 2. С. 89-91.
- Леонова Г.А. Химические формы тяжелых металлов в воде Новосибирского водохранилища: оценка их биодоступности и потенциальной экологической опасности для планктона//Химия в интересах устойчивого развития. 2006. № 5. С. 453 -465.
- Линник П.Н., Набиванец Б.И. Формы миграции металлов в пресных водоемах. Л.: Гидрометеоиздат, 1988. 269 с.
- Линник Р.П., Запорожец О.А Сравнительная оценка расчетных и экспериментальных данных о сосуществующих формах железа, кобальта и никеля в пресных поверхностных водах//Экологическая химия. 2003. № 12(2). С. 79-92.
- Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.
- Лурье Ю.Ю. Унифицированные методы анализа вод. М.: Химия, 1973. 376 с.
- Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. 4 изд. М.: Химия, 1974. 385 с.
- Онихимовский В.В., Беломестных Ю.С. Полезные ископаемые Хабаровского края (перспективные для освоения месторождения и проявления). Хабаровск: Хабаровская краевая типография, 1996. 484 с.
- Природные ресурсы Еврейской автономной области. Биробиджан: ИКАРП ДВО РАН, 2004. 112 с.
- Федорова А.И. Практикум по экологии и охране окружающей среды. М.: Владос, 2001. 283 с.


