Особенности функциональной активности эффекторов врожденного иммунитета онкологических больных на фоне сепсиса
Автор: Анисимова Н.Ю., Громова Е.Г., Кузнецова Л.С., Плужникова Н.А., Киселевский М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (45), 2011 года.
Бесплатный доступ
Проведена сравнительная оценка цитотоксической и фагоцитарной активности лейкоцитов крови онкологических больных с сепсисом, без признаков системного гнойно-воспалительного процесса и здоровых доноров. Функциональная реактивность эффекторов врожденного иммунитета оценивалась по уровню активности натуральных киллеров крови, поглотительной активности (стимуляция гранулами латекса), спонтанного и стимулированного НСТ-теста. Не выявлено достоверных отличий между уровнем функциональной активности лейкоцитов здоровых доноров и больных со злокаче- ственными новообразованиями без признаков гнойно-септических осложнений. Однако при сепсисе у онкологических больных наблюдается гиперактивация клеток-эффекторов врожденного иммунитета, что можно рассматривать как важное звено в патогенезе органной и полиорганной недостаточности.
Сепсис, цитотоксическая активность, фагоцитоз, натуральные киллеры, нейтрофилы
Короткий адрес: https://sciup.org/14055913
IDR: 14055913 | УДК: 616-006:616.94:612.017
Текст научной статьи Особенности функциональной активности эффекторов врожденного иммунитета онкологических больных на фоне сепсиса
К настоящему времени накоплен обширный материал, характеризующий особенности иммунологического статуса онкологических больных с гнойно-септическими осложнениями [3, 5, 7]. Большинство их выявлено при изучении параметров гуморального иммунитета и, прежде всего, при оценке цитокинового статуса. В последние годы возрос интерес к изучению эффекторов врожденного иммунитета (натуральные киллеры (НК), гранулоциты и моноциты), играющих важнейшую роль в патогенезе сепсиса [12]. В частности, ряд исследователей указывает на нарастающую иммуносупрессию на фоне сепсиса, проявляющуюся снижением функ- циональной активности иммунокомпетентных клеток вследствие повышения содержания в крови иммуносупрессивных агентов (ИЛ-10), и снижения регуляторных пептидов (ИЛ-12) [3]. С другой стороны, многие исследователи получили данные, свидетельствующие о повышенной продукции у больных с сепсисом провоспалительных цитокинов (IL-8, TNFα, IL-6, IL-1β), в десятки раз превышающих их уровень у здоровых доноров [7, 9]. Логичным следствием этого феномена должно быть повышение функциональной активности, в первую очередь, эффекторов врожденного иммунитета. В условиях бактериемии и бактериальной ток- семии эти клетки обеспечивают естественную резистентность организма к инфекционным агентам. Однако их чрезмерная активация запускает каскадную гиперпродукцию медиаторов воспаления. Эти полипотентные биологически активные молекулы инициируют и опосредуют развитие системной воспалительной реакции [11].
Учитывая вышеизложенное, целью исследования явилась сравнительная оценка цитотоксической и фагоцитарной активности лейкоцитов крови онкологических больных с сепсисом, пациентов без признаков системного гнойно-воспалительного процесса и здоровых доноров.
Материал и методы
Забор крови у пациентов без осложнений (10 человек) проводили на 7–10-е сут после операции, у больных с сепсисом - после постановки соответствующего диагноза. Исследование клеточной активности начинали не позднее 30 мин после забора крови. У всех пациентов и доноров было получено информированное согласие на проведение научных исследований образцов крови.
НК-активность. Из крови на градиенте плотности фиколла – урографина выделяли моно-нуклеарные лейкоциты (МЛ), которые дважды отмывали центрифугированием в среде RPMI-1640 (ПанЭко, РФ). В качестве клеток-мишеней (КМ) использовали клетки эритромиелолейкоза
К-562. Подсчитывали количество живых эффекторных и опухолевых клеток в суспензиях с использованием трипанового синего (Sigma, USA). Для коинкубации клеток использовали 96-луночные планшеты (Nung, USA, или Costar, France). Концентрация К-562 в среде составляла 500000 кл/мл. Соотношение К-562 и клеток-эффекторов МЛ (КЭ) в среде соответствовало 1/2; 1/5 и 1/10. После коинкубации в течение 20-24 ч определяли индекс цитотоксической активности (ИЦА) натуральных киллеров с помощью колориметрического МТТ-теста, основанного на способности дегидрогеназ живых клеток восстанавливать 3-(4,5-Dimethyl-2-Thiazyl)-2,5-Diphenyl-2H-Tetrazolium Bromide (MTT) до фиолетовых кристаллов формазана, растворимых в диметилсульфоксиде [4].
Поглотительная активность. В качестве объектов фагоцитоза использовали суспензии гранул латекса (ПанЭко, РФ). Коинкубацию крови, стабилизированной гепарином, и латекса осуществляли в течение 45 мин. Готовили мазок, окрашивали его по Романовскому-Гимзе и проводили микроскопию с иммерсией. В каждом мазке посчитывали не менее 100 нейтрофилов, вычисляя фагоцитарный индекс (ФИ) - процент клеток, содержащих фагоцитированные объекты, а также фагоцитарное число (ФЧ) -количество гранул латекса в одном фагоците.
Метаболическая активность. Для изучения респираторного взрыва нейтрофилов in vitro использовали реакцию восстановления клетками нитросинего тетразолия (НСТ-тест), результат учитывали в условных единицах (у.е.) [1]. В ходе реакции нитросиний тетразолий восстанавливается до нерастворимого диформазана, откладывающегося в клетках в виде темносиних гранул. НСТ-тест проводили как при стимуляции нейтрофилов латексом (индуцированный НСТ-тест), так и без нее (спонтанный НСТ-тест) [2].
Статистический анализ. Описательная статистика групп представлена в формате: значения медианы, 25-го и 75-го квартилей (медиана, 25 % ÷ 75 %). Сравнительный статистический анализ значений изучаемых показателей опытной и контрольной групп проведен с использованием U-критерия Манна-Уитни. Различия считались статистически значимыми при р<0,05. Расчеты проведены с использованием пакета программ Statistica 6.0 (StatSoft, USA).
Результаты и обсуждение
Исследование НK-активности МЛ крови. В ходе данного исследования проводилась сравнительная оценка НK-активности МЛ крови здоровых доноров и онкологических больных с сепсисом и без признаков гнойно-септических осложнений. Определение значений индекса цитотоксической активности (ИЦА) осуществляли при различном соотношении КМ/КЭ: 1/10; 1/5; 1/2.
Полученные данные (рис. 1) свидетельствуют о том, что статистически значимых различий значений НК-активности здоровых доноров и пациентов со злокачественными новообразованиями без осложнений не выявлено (р>0,05). Медианные показатели ИЦА МЛ в обеих группах соответствовали 57 % и 58 %, р=0,902 (соотношение КМ/КЭ - 1/10); 36 % и 32 %, р=0,862 (соотношение КМ/КЭ – 1/5); 17% и 20 %, р=0,890 (соотношение КМ/КЭ – 1/2). Однако у больных с сепсисом было отмечено существенное повышение цитотоксической активности МЛ. Значения ИЦА в этой группе соответствовали 67 (48÷82) % при соотношении КМ/КЭ 1/10, 53 (33÷74) % при соотношении КМ/КЭ 1/5, 44 (23÷70) % при соотношении КМ/ КЭ 1/2. Различия с соответствующими показателями здоровых лиц и пациентов без осложнений были статистически значимыми.
Фагоцитарная активность. Показатели поглотительной активности нейтрофилов (ФИ, ФЧ) онкологических больных с сепсисом были значимо выше соответствующих показателей здоровых доноров – р=0,021; р=0,015 соответственно (таблица). Функциональная активность нейтрофилов онкологических больных без
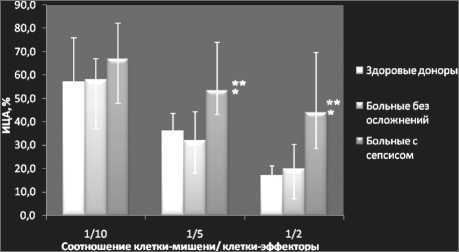
Рис. 1. Параметры НK-активности онкологических больных без признаков гнойно-септических осложнений и на фоне сепсиса в сравнении со здоровыми донорами. Приведены значения индекса цитотоксической активности (ИЦА)
(медиана, 25 %÷75 %) при различном соотношении клеток-мишеней и клеток-эффекторов (1/10; 1/5; 1/2).
Примечание: * – различия статистически значимы по сравнению с контрольной группой (p<0,05);
** – различия статистически значимы по сравнению с группой пациентов без осложнений (p<0,05) осложнений по этим показателям не отличались от таковой для доноров.
Аналогичные результаты были получены при проведении НСТ-теста, характеризующего метаболическую активность гранулоцитов. По данному показателю базальная активность нейтрофилов крови больных с сепсисом, исследованная в спонтанном НСТ-тесте, была значительно выше, чем у больных без осложнений (р=0,014) и здоровых доноров (р=0,001). Параметры индуцированного НСТ-теста у больных с осложнениями также повышены, но различия между группами не столь велики (р=0,0401 в сравнении с показателями больных без осложнений, р=0,034 в сравнении с контролем). В то же время способность клеток к активации у больных с сепсисом снижена, так как различие значений результатов индуцированного и спонтанного теста в этой группе не достоверно
Параметры фагоцитарной активности в сравниваемых группах
Таблица
|
Параметры фагоцитарной активности |
Здоровые доноры (контроль) |
Онкологические больные |
|
|
Без осложнений |
С сепсисом |
||
|
ФИ, % |
28 (21÷33) |
30 (20÷46) |
76* (72÷97) |
|
ФЧ, гранулы латекса |
6 (3÷7) |
7 (5÷15) |
38* (29÷52) |
|
НСТ-тест спонтанный, у.е. |
0,15 (0,09÷0,32) |
0,52 (0,28÷0,70) |
2,35* (1,90÷2,50) |
|
НСТ-тест индуцированный, у.е. |
1,20** (1,10÷1,31) |
1,41** (1,28÷1,60) |
2,50* (2,20÷2,81) |
Примечание: * – статистически значимые отличия по сравнению с контрольной группой (p<0,05); ** – результаты индуцированного НСТ-теста статистически значимо отличаются от результатов спонтанного НСТ-теста (p<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №3 (45)
(p=0,072), тогда как у здоровых доноров и у больных без осложнений метаболическая активность после стимуляции достоверно возрастает (медиана увеличилась в 7,7 раза (р=0,039) и 2,8 раза (р=0,045) соответственно).
В результате проведенных исследований не было выявлено статистически значимых отличий между уровнем функциональной активности НК и нейтрофилов здоровых доноров и больных со злокачественными новообразованиями без признаков гнойно-септических осложнений. В обеих этих группах отмечалась сходная реактивность нейтрофилов на индукцию фагоцитоза – наблюдалось значительное возрастание метаболической активности гранулоцитов, свидетельствующее о готовности клеток к завершенному фагоцитозу. Однако если у здоровых доноров соотношение значений индуцированного НСТ-теста к спонтанному соответствовало 7,7, то у онкологических больных без осложнений этот показатель был ниже и соответствовал 2,2.
Проведенное исследование позволило установить, что активность эффекторов врожденного иммунитета у пациентов с сепсисом значительно отличалась по исследованным параметрам от групп сравнения. В частности, было установлено значительное повышение НК-активности МЛ (до 39 %) по сравнению со здоровыми донорами и больными без осложнений. Эти данные соответствуют результатам других авторов, сообщавших ранее о повышении уровня активности НК у больных с сепсисом [5]. Отмеченное явление связывалось с повышением в крови больных с тяжелым сепсисом и септическим шоком уровня IL-12, усиливающего цитотоксичность НK-клеток и T-киллеров, и индукцию гранзимов А и В - эффекторных молекул, опосредующих цитотоксичность [12].
Показатели поглотительной активности нейтрофилов онкологических больных с сепсисом (ФИ и ФЧ) также были достоверно выше соответствующих показателей здоровых доноров (в 2,6 раза и в 6,3 раза соответственно). Было установлено, что результаты спонтанного НСТ-теста, позволяющего оценить степень активации кислородзависимых механизмов киллинга фагоцитов in vitro, значительно выше, чем у больных без осложнений и здоровых доноров (в 5–15 раз), и, следовательно, свидетельствуют о высокой степени активации внутриклеточных бактерицидных систем при сепсисе. Это может являться следствием увеличения продукции провоспалительных цитокинов, в особенности ИЛ-8 – ключевого цитокина, участвующего в рекрутировании нейтрофилов к месту воспаления и стимулирующего их активность [6]. Известно, что с помощью НСТ-теста регистрируется интенсивность кислородного (респираторного) взрыва, когда в фагоците инициируется кис-лородзависимый киллинг. Посредством этого механизма активируется НАДФ-Н-оксидаза, которая катализирует восстановление молекулярного кислорода до супероксидного радикала, что приводит к появлению в фагоците активных форм кислорода – чрезвычайно токсичных для клеток веществ (супероксид-анион радикал, перекись водорода, радикал гидроперекиси и др.). Перекись водорода в сочетании с миелопероксидазой (ферментом первичных гранул нейтрофилов) и ионами галогенов образует мощную бактерицидную систему, убивающую бактерии за счет галогенирования их клеточной стенки [13]. Однако фагоциты секретируют эти эндогенные биологически активные вещества в межклеточную среду, где они оказывают повреждающее действие, в том числе и на собственные ткани, и, таким образом, участвуют в формировании органной (полиорганной) недостаточности [10]. Ряд проведенных ранее исследований позволяет сделать вывод о том, что в основе формирования синдрома полиорганной дисфункции при критических состояниях лежит повреждение эндотелия сосудов, вызванное биологически активными молекулами, высвобождаемыми иммунокомпетентными клетками, стимулированными микробными продуктами. Поэтому выявленную нами гиперактивацию клеток-эффекторов врожденного иммунитета (нейтрофилов, НК) можно рассматривать как важное звено в патогенезе органной и полиор-ганной недостаточности.
Механизм кислородзависимого киллинга более сложный и энергозатратный, чем кисло-роднезависимого [8]. Поэтому неудивительно, что бактерицидный потенциал клетки может быть исчерпан довольно быстро. Это является одним из возможных объяснений установленного в настоящей работы снижения способности к дополнительной стимуляции in vitro кислород-зависимого фагоцитоза нейтрофилов больных c сепсисом. Очевидно, что в этих условиях на фоне сохранения поглотительной способности будет наблюдаться эффект незавершенного фагоцитоза. Подобная иммунокомпрометирован-ность организма на фоне наличия бактериемии вследствие транслокации микроорганизмов из очага воспаления или желудочно-кишечного тракта создает условия для быстрого развития септицемии и повышает вероятность летального исхода.
Таким образом, представленные материалы дают основания считать, что при развитии сепсиса наблюдается 2 этапа состояния эффекторов врожденного иммунитета: 1) начальный период повышенной активности, направленный на удаление микроорганизмов, при этом чрезмерная активация иммуноцитов может приводить к повреждению клеток самого организма и, следовательно, способствовать развитию органной и полиорганной недостаточности; 2) период истощения активационных механизмов, вероятным итогом которого может явиться иммунопаралич и присоединение вторичной инфекции.


