Особенности гормонального и липидного спектра у девочек с синдромом Шерешевского-Тернера и множественным дефицитом гормонов аденогипофиза в узбекской популяции
Автор: Ибрагимова Н.Ш.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-2 т.26, 2011 года.
Бесплатный доступ
В исследовании приняли участие 54 девочки с СШТ (36 девочек с моносомией и 18 девочек с мозаицизмом) и 38 девочек с множественным дефицитом гормонов аденогипофиза (МДГА) в возрасте от 12 до 18 лет. У пациенток с МДГА отмечалась наиболее выраженная задержка роста по сравнению с девочками с СШТ и контрольной группы и выявлено достоверное снижение гормонов (эстрадиола, ИФР1, ИФРСБ3 и СТГ) у пациенток с МДГА и СШТ с прямой корреляцией между уровнем ИФР1 и СТГ и содержанием эстрадиола. У девочек с МДГА наблюдаются более выраженные нарушения липидного обмена и выявлена обратная корреляции между уровнем ИФР1 и ОХС, а также ХСЛПНП. У девочек с СШТ узбекской популяции уровень ОХС и ХС ЛПНП выше контрольных значений наблюдался в 24,1% и 20,4% случаев, а также обнаружена прямая положительная корреляционная зависимость между уровнем ИФР1 и ОХС.
Синдром шерешевского-тернера, множественный дефицит гормонов аденогипофиза, задержка роста, нарушения липидного обмена, ифр-1
Короткий адрес: https://sciup.org/14919653
IDR: 14919653 | УДК: 616.43;61:577.1
Текст научной статьи Особенности гормонального и липидного спектра у девочек с синдромом Шерешевского-Тернера и множественным дефицитом гормонов аденогипофиза в узбекской популяции
Проблема роста и развития ребенка – одна из актуальных проблем детской эндокринологии. В структуре детских эндокринных заболеваний одно из ведущих мест занимает проблема задержки физического развития (ЗФР). Рост ребенка зависит от многих факторов и является важным показателем его здоровья. Для нормального физического развития ребенка необходимо: полноценное питание, занятия спортом, нормальный сон, психоэмоциональное окружение, нормальный гормональный баланс.
На сегодняшний день в Республике Узбекистан насчитывается около 3000 детей с различными формами низкорослости. Наиболее распространенные формы задержки роста, встречающиеся в Узбекистане, это конституциональная ЗФР, соматотропный гормон недостаточ- ность (СТН), множественный дефицит гормонов аденогипофиза (МДГА), а также различные наследственные заболевания.
Каждая форма низкорослости сопровождается различными нарушениями гормонального статуса и метаболическими изменениями.
По данным различных авторов, у детей с синдромом Шерешевского–Тернера (СШТ) наблюдаются различной степени выраженности нарушения гормонального статуса и липидного обмена [4, 10]. Известно, что влияние на ЛПНП осуществляется через регуляцию экспрессии печеночных рецепторов к ЛПНП. Активность ЛПНП-рецеп-торов также находится под гормональным контролем. Так, эстрогены, гормон роста могут стимулировать экспрессию ЛПНП и снижать уровень ЛПНП в крови. Присутствие гормона роста необходимо для стимулирующего эффекта больших доз эстрогенов на экспрессию ЛПНП-рецепто- ров, а также для поддержания резистентности ЛПНП-ре-цепторов к подавлению холестерином, поступающим с пищей.
Уровень инсулиноподобных факторов роста в сыворотке крови, главным образом ИФР-1, является интегрированным показателем и коррелирует с содержанием СТГ, косвенно отражая его эндогенную секрецию. Содержание ИФР-1 и его основного связывающего белка 3-го типа (ИФРСБ-3) отражает не только абсолютный уровень гормона роста (ГР) в крови, но и его биологическую активность [3].
Мощным липолитическим гормоном, который повышает окисление жиров как источника калорий и мобилизует свободные жирные кислоты из жировых депо, является гормон роста. Он оказывает прямое действие на клетки жировой ткани (адипоциты), стимулируя их дифференцировку на стадии предшественников, повышая их количество, а также влияет на метаболизм липопротеинов, транспортной системы липидов, и, в частности, холестерина.
У девочек в пубертатном периоде происходит 1,5–3-кратное увеличение пульсовой секреции гормона роста и соответствующее ей 3-кратное увеличение синтеза ИФР-1 с пиком в 14,5 лет [7]. Этот феномен объясним с позиции возможного действия эстрогенов в качестве модулятора активности гормона роста [8]. В свете вышеизложенного несомненный интерес представляет изучение влияния гормонов на метаболические нарушения у девочек узбекской популяции с СШТ и МДГА.
Материал и методы
В РНПМЦ Эндокринологии МЗ РУз было обследовано 54 девочки с СШТ (36девочек с моносомией и 18 девочек с мозаицизмом) и 38 девочек с множественным дефицитом гормонов аденогипофиза (МДГА) в возрасте от 12 до 18 лет.
Сбор анамнеза, клинический осмотр девочек с СШТ и МДГА и оценка параметров физического и полового развития, забор крови для определения ростовых факторов, гормонального и биохимического исследования крови проводились во время скринингового визита. Оценку полового развития проводили согласно классификации Tanner [1968]. Для оценки степени отклонения роста пациента от среднего роста в популяции рассчитывали коэффициент стандартного отклонения SDS (Standard Deviation Score) по формуле: SDS=X–X’/SD, где X – рост пациента, X’ – средний конечный рост для данного пола, SD – стандартное отклонение для данного пола.
Всем девочкам проводили УЗИ органов малого таза. Для комплексной оценки физиологической зрелости девочек проводили анализ степени созревания скелета по данным рентгенографии кистей рук с лучезапястными суставами с определением костного возраста, который оценивали по нормам с использованием атласа рентгенограмм Greulich и Pyle. Липидный профиль определяли по значениям общего холестерина (ОХС), ТГ и ХС ЛПВП в сыворотке крови. Показатели ХС липопротеидов низкой плотности (ХС ЛПНП) рассчитывали по формуле W. Friedwald [1972]: ХС ЛПНП=ОХС – (ТГ/2,2+ХСЛПВП), моль/л. Коэффициент атерогенности определяли по формуле: (ОХС-ХСЛПВП)/ХСЛПВП.
В сыворотке крови уровень фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и эстрадиола (Э), пролактина (ПРЛ), кортизола, ИФР-1, ИФРСБ-3 и СТГ в моче определяли радиоиммунологичес-ким методом наборами “Иммунотек” (Чехия) и “Incstar Corporation”, (США). Гормональные исследования выполнены в радиоиммунной лаборатории РСНПМЦ Эндокринологии МЗ РУз.
Контрольную группу составили 24 девочки в возрасте от 12 до 18 лет (средний возраст – 14,6±1,36 лет). Рост и половое развитие соответствовало возрастным нормам.
Статистическая обработка результатов исследования проводилась с использованием пакета STATISTICA (версия 6.0). Данные приведены в виде средних арифметических значений и ошибки средней (M±m). Для сравнения качественных показателей использовался критерий χ 2 (хи-квадрат). Данные в тексте и таблицах представлены в виде Ме {25; 75} (Ме – медиана; 25 и 75 – перцентили). Для каждого показателя рассчитывали 95% доверительный интервал (ДИ), минимальное (min) и максимальное (max) значения. Критический уровень значимости для проверки статистических гипотез при сравнении групп принимался менее 0,05.
Результаты и обсуждение
Средний возраст у девочек СШТ составил 14,4±0,24 лет (Ме-14 лет {12; 15}) и МДГА средний возраст – 12,9±0,24 лет (Ме-13 лет {12;14}).
При изучении данных анамнеза обращала на себя внимание высокая частота антенатальной и перинатальной патологии у больных с СШТ и МДГА. Неблагополучное течение беременности и родов достоверно чаще отмечалось у 32 (84,2%) матерей девочек с МДГА (при СШТ у 30 (55,6%) – χ 2=7,08; p=0,008). Наиболее частыми осложнениями беременности были угроза невынашивания, анемия, гестозы – факторы, приводящие к развитию внутриутробной гипоксии плода. В близкородственном браке состояли родители 75% обследуемых девочек (84,2% – СШТ, 68,5,% – МДГА). Акушерский анамнез выявил тяжелый токсикоз в I и во II половине беременности у 45,7% матерей, угрозу выкидыша в I половине беременности у 25%, вакуум–экстракцию у 20,7% детей. С ягодичным предлежанием родились 30,4% детей, с ножным предлежанием – 20%, в асфиксии – 50% девочек, причем в группе с МДГА таковых больше в 2 раза. Перинатальная энцефалопатия зафиксирована у 81,6% больных с МДГА. Гипоксическое поражение ЦНС, как следствие осложненного течения беременности и родов у матерей, наблюдалось у 22 (57,9%) девочек с МДГА. Подобные изменения встречались в группе сравнения в 1,5–2 раза реже. Среди новорожденных, родившихся недоношенными (до 36 недель), 19 детей (50,0%; p=0,05) были из группы с СШТ и 15 (27,8%) девочек из группы с МДГА. Внутриутробную гипотрофию имели 29 (76,3%) девочек с СШТ (больше при моносомии), тогда как при МДГА таковая наблюдалась только у 22 (40,7% – χ 2=10,0; p=0,002) пациенток.
У девочек СШТ узбекской популяции выявили следу- ющие врожденные пороки: ВПС, мочеполовой системы, поражения слуха, олигофрению, косоглазие, нарушения со стороны костно-суставной системы. Варианты встречаемости хромосомных аберраций у девочек СШТ узбекской популяции представлены на рисунке 1.
Анализ результатов кариотипа 54 девочек с СШТ узбекской популяции выявил следующие варианты мозаицизма – 45ХО/46ХХ – в 24,1% случаев, 46Х, i(Xq) – 18,4% и 45Х0 /46Х, i(Хq) – в 7,4% случаев.
Диагноз СШТ впервые был поставлен в возрасте 10– 13 лет у 16 (29,6%) девочек и в 14–15 лет – у 38 (70,4%) пациенток. Средний возраст постановки диагноза – 14,6±0,21 лет, это связано с низким уровнем диагностики СШТ в регионах республики и, возможно, отсутствием сети медико-генетического консультирования, где проводили бы исследования кариотипа у всех девочек с задержкой роста.
У пациенток с СШТ SDS роста варьировал от –4,2 до –2,8 среднее значение составляло –3,78±0,01. Костный возраст (КВ) отставал от хронологического в среднем на 2,19±0,10 года. У девочек с МДГА отмечалась наиболее выраженная задержка роста, SDS роста варьировал от –6,9 до –4,7 (в среднем –5,69±0,11). Разница между КВ и хронологическим возрастом (ХВ) соответствовала 5,84±0,12 года. Индекс оссификации (КВ/ХВ) у девочек с МДГА достоверно ниже, чем у девочек с СШТ (табл. 1).
Наши наблюдения показали, что костный возраст девочек сравниваемых групп, в отличие от хронологического, имел статистически значимые различия. У девочек СШТ с моносомией дефицит роста наблюдался в 100% случаев (SDS –2,84±0,14; Ме – –2,9), а при мозаицизме в 97,1% случаев (SDS –2,74±0,12; Ме – –2,8). Половое развитие у девочек СШТ соответствовало Таннер I ст. – 36 (66,6%), II ст. – 15 (27,7%) и III ст. – 5 (9,3%), у девочек с МДГА – Таннер I ст. – 38 (100%). Данные о физическом развитии обследованных девочек представлены в таблице 1.
Результаты проведенных гормональных исследований показали, достоверно высокий уровень содержания ЛГ и ФСГ у девочек с СШТ по отношению к контролю на фоне низкого уровня эстрадиола, СТГ, ИФР-1 и ИФРСБ-3. У пациенток с МДГА уровень гонадотропных гормонов, эстрадиола, СТГ, ИФР-1 и ИФРСБ-3 был статистически значимо ниже показателей контрольной группы и группы с СШТ (табл. 2). Анализ полученных данных свидетельствует о патогенетических нарушениях в системе гипоталамус -гипофиз- гонады у девочек МДГА и гипофиз-гонады у пациентов с СШТ.
В ходе проведенных гормональных исследований явлена прямая корреляция между уровнем ИФР-1 и СТГ (r=0,39), а также содержанием эстрадиола (r=0,53). Содержание кортизола и пролактина у девочек с СШТ находилось в пределах контрольных показателей, а у пациенток с МДГА достоверно ниже (табл. 2). Изменения спектра липопротеидов сыворотки крови у девочек с СШТ узбекской популяции характеризуются статистически значимо повышенными концентрациями общего холестерина, ХСЛПНП и нормальными значениями уровня ТГ и
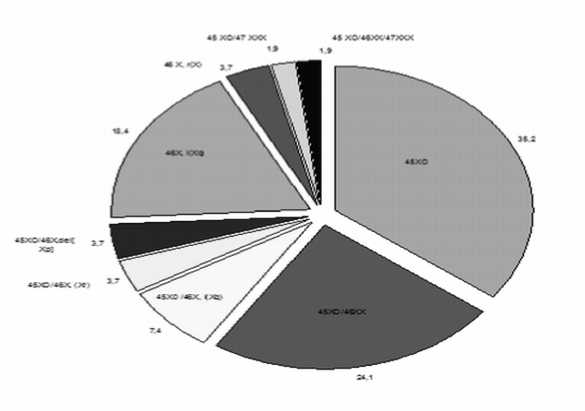
Рис. 1. Варианты встречаемости хромосомных аберраций у девочек СШТ узбекской популяции
Таблица 1
Клиническая характеристика больных
|
Показатели, единицы измерения |
Контроль (n=24) |
СШТ (n=54) |
МДГА (n=38) |
|
Рост, см |
159,3±2,12; Ме – 159,0; {152,0; 164,5} |
130,7±0,71; Ме – 132,8; {126,9; 135,0} |
123,5±0,44; Ме – 123,8 {122; 125,5}; Р=0,0001 |
|
95% ДИ (min–max) |
4,15 (149,0–170,0) |
1,39 (120,0–137,0) |
0,86 (116,0–127,0) |
|
SDS роста |
–0,42±0,06; Ме – –0,4 {–0,5; –0,3} |
–3,78±0,01; Ме – –2,8 {–3,2; –2,2} |
–5,69±0,11; Ме – –5,7 {–6,2; –4,98}; Р=0,0001 |
|
95% ДИ (min–max) |
0,11 (–0,7 – –0,2) |
0,18 (–1,8 – –4,2) |
0,21 (–6,9 – –4,7) |
|
ХВ, лет |
13,6±0,36; Ме – 13,5 {12,8; 15,0} |
13,4±0,24; Ме – 13 {12; 15} |
12,9±0,24; Ме – 13 {12; 14} |
|
95% ДИ (min–max) |
0,70 (12,0–15,0) |
0,47 (11,0–16,0) |
0,47 (11,0–16,0) |
|
КВ, лет |
13,3±0,39; Ме – 13,1 {12,3; 14,8} |
11,2±0,25; Ме – 11 {9,3; 12} |
7,11±0,28; Ме – 7{6;8}; Р=0,0001 |
|
95% ДИ (min–max) |
0,77 (11,4–14,9) |
0,50 (8,0–15,0) |
0,56 (4,0–11,0) |
|
КВ/ХВ |
0,98±0,004; Ме – 0,98 {0,97; 0,99} |
0,83±0,01; Ме – 0,82 {0,8; 0,88} |
0,54±0,01; Ме – 0,54 {0,5; 0,61}; Р=0,0001 |
|
95% ДИ (min–max) |
0,01 (0,95–0,99) |
0,02 (0,73–0,94) |
0,24 (5,0–7,0) |
|
ОТ/ОБ |
0,75±0,01; Ме – 0,76 {0,73; 0,78} |
0,81±0,01; Ме – 0,82 {0,79; 0,85}; |
0,88±0,01; Ме – 0,88 {0,85; 0,91}; Р=0,0001 |
|
95% ДИ (min–max) |
0,02 (0,7–0,82) |
0,01 (0,7–0,89) |
0,01 (81,0–0,93) |
|
ИМТ, кг/м2 |
17,4±0,30; Ме – 17,3 {16,7; 17,9} |
25,2±0,54; Ме – 25,3 {22,2; 27,2} |
30,3±0,50; Ме – 29,9 {28,0; 31,5}; Р=0,0001 |
|
95% ДИ (min–max) |
0,58 (15,6–19,1) |
1,05 (17,0–32,9) |
0,97 (25,4–39,6) |
Таблица 2
Показатели гормонального исследования у девочек с СШТ и МДГА узбекской популяции
|
Показатели, единицы измерения |
Контроль (n=24) |
СШТ (n=54) |
МДГА (n=38) |
|
ЛГ, МЕ/л ; 95% ДИ (min–max) ФСГ, МЕ/л ; 95% ДИ (min–max) Эстрадиол, pg/ml; 95% ДИ (min–max) Кортизол, нмоль/л; 95% ДИ (min–max) Пролактин, нг/мл; 95% ДИ (min–max) ИФР-1, pg/ml; 95% ДИ (min–max) ИФРСБ-3, pg/ml; 95% ДИ (min–max) СТГ pg/ml; 95% ДИ (min–max) |
4,49±0,37 3,28±0,38 145,1±20,1 253,9±7,27 235,9±23,3 128,5±2,51 1875,5±45,3 3,10±0,14 |
9,2±0,18 *; 0,35 (6,4–11,5) 8,58±0,30*; 0,59 (5,6–11,3) 79,5±1,50*; 2,93 (65,0–101,0) 241,6±2,89; 5,66 (201,0–272,0) 209,0±4,74; 9,29 (157,0–246,0) 60,8±1,05*; 2,06 (51,3–75,9) 474,4±5,14*; 10,1 (432,5–572,4) 1,15±0,01*; 0,02 (1,01–1,27) |
1,89±0,11* ↓ ; 0,22 (1,01–3,15) 1,02±0,02 * ↓ ; 0,04 (0,56–1,22) 55,2±1,02* ↓ ; 2,01 (42,0–65,0) 191,4±3,30* ↓ ; 6,47 (161,0–229,0) 168,1±2,71* ↓ ; 5,31 (133,0–199,0) 50,2±1,65* ↓ ; 2,64 (31,7–57,1) 325,7±7,02* ↓ ; 13,8 (188,2–371,6) 0,82±0,04* ↓ ; 0,09 (0,35–1,36) |
Примечание: * – статистическая значимость по отношению к контролю; ↓ – по отношению к группе СШТ.
Таблица 3
Показатели липидного спектра у девочек с СШТ и МДГА узбекской популяции
|
Показатели, единицы измерения |
Контроль (n=24) |
СШТ (n=54) |
МДГА (n=38) |
|
ОХС, ммоль/л; 95% ДИ (min–max) |
4,08±0,20 |
4,46±0,08*; 0,16 (3,01–6,01) |
5,14±0,14* ↑ ; 0,28 (4,01–7,32) |
|
ТГ, ммоль/л; 95%ДИ (min–max) |
1,09±0,08 |
0,92±0,04; 0,08 (0,35–1,42) |
1,21±0,01* ↑ ; 0,03 (1,01–1,36) |
|
ХСЛПВП, ммоль/л; 95% ДИ (min–max) |
1,28±0,09 |
1,38±0,04; 0,07 (1,01–1,78) |
0,99±0,07* ↓ ; 0,13 (0,35–1,95) |
|
ХСЛПНП, ммоль/л; 95% ДИ (min–max) |
2,31±0,14 |
2,67±0,08*; 0,16 (0,97–4,06) |
3,07±0,14* ↑ ; 0,28 (2,25–5,75) |
|
Примечание: – статистическая значимость по отношению к контролю; |
↓↑ – по отношению к группе СШТ. |
||
ХСЛПВП. У девочек с МДГА наблюдаются более выраженные нарушения липидного обмена: более высокие уровни ОХС, ТГ и ХСЛПНП и сниженные ХСЛПВП (табл. 3).
У девочек с СШТ уровень ОХС и ХС ЛПНП выше контрольных значений наблюдался в 24,1 и 20,4% случаев. Полученные результаты наших исследований у девочек узбекской популяции подтверждают данные других авторов [1, 2].
У пациенток с МДГА эти показатели были выше контроля соответственно в 47,4 и 42,1% случаев. Частота повышенного уровня ОХС и ХС ЛПНП была достоверно ( χ 2=4,26; p=0,04) выше у больных МДГА. Кроме того, у девочек с МДГА установлено наличие обратной корреляции между уровнем ИФР-1 и ОХС (r=–0,42), а также ХСЛПНП (r=–0,49), тогда как у пациенток с СШТ – прямая положительная корреляционная зависимость между уровнем ИФР-1 и ОХС (r=0,44).
Выводы
-
1. У пациенток с МДГА (–5,69±0,11 SDS) отмечалась наиболее выраженная задержка роста по сравнению с девочками с СШТ (–3,78±0,01 SDS) и контрольной группы.
-
2. Выявлено достоверное снижение гормонов (эстрадиола, ИФР-1, ИФРСБ-3 и СТГ) у пациенток с МДГА и СШТ. У девочек с МДГА по сравнению с девочками с СШТ обнаружено достоверное снижение гормонов. Установлена прямая корреляция между уровнем ИФР-1 и СТГ и содержанием эстрадиола.
-
3. У девочек с МДГА наблюдаются более выраженные нарушения липидного обмена соответственно в 47,4 и 42,1% случаев, а также достоверное повышение уровня ОХС и ХС ЛПНП ( χ 2=4,26; p=0,04). Кроме того, у девочек с МДГА узбекской популяции выявлена обрат-
- ная корреляции между уровнем ИФР-1 и ОХС (r= –0,42), а также ХСЛПНП (r=–0,49).
-
4. У девочек с СШТ узбекской популяции уровень ОХС и ХС ЛПНП выше контрольных значений наблюдался в 24,1 и 20,4% случаев, а также обнаружена прямая положительная корреляционная зависимость между уровнем ИФР-1 и ОХС (r=0,44).
-
5. У больных с МДГА и СШТ необходимо проводить исследования липидного спектра и своевременно проводить коррекцию липидного обмена.
Список литературы Особенности гормонального и липидного спектра у девочек с синдромом Шерешевского-Тернера и множественным дефицитом гормонов аденогипофиза в узбекской популяции
- Панкратова М.С. Ростовые и метаболические эффекты терапии рекомбинантным гормоном роста и половыми стероидами у девочек с синдромом Шерешевского-Тернера: автореф. дис. … канд. мед. наук. -М., 2009. -24 с.
- Панкратова М.С., Петеркова В.А. Синдром Шерешевского-Тернера в практике педиатра-эндокринолога//Педиатрия. -2009. -Т. 87, № 4. -С.115-121.
- Чикулаева О.А., Безлепкина О.Б., Петеркова В.А. Результаты 36-летнего применения гормона роста у детей с соматотропной недостаточностью//Педиатрия. -2008. -Т. 87, № 5. -С. 25-30.
- Bakalov V., Van P., Baron J. et al. Growth hormone therapy and bone mineral density in Turner syndrome//J. Clin. Endocrinol. Metab. -2004. -Vol. 89. -Р. 4886-4889.
- Bondy C. Care of girls and women with Turner syndrome: a guideline of the the Turner syndrome consensus study group//J. Clin. Endocrin. Metab. -2006. -Vol. 10. -P. 1310-1374.
- Gravholt C. Aspects of the treatment of Turner syndrome//Expert. Opin. Pharmacother. -2004. -Vol. 2 (10). -P. 1633-1647.
- Juul A., Bang P., Hertel N. Serum insulin like growth factor I in 1030 healthy children, adolescents, and adults: relation to age, sex, stage of puberty, testicular size, and body mass index//JCE&М. -1994. -Vol. 78 (3). -Р. 744-752.
- Leung K., Johannsson G., Leong G. Estrogen regulation of growth hormone action//Endocr. Rev. -2004. -Vol. 25 (5). -Р. 693-721.
- Ranlce M., Lindberg A., Chatelain P. Prediction of long term response to recombinant human growth hormone (GH) in Turner syndrome: development and validation of mathematical models//J. Clin. Endocrinol. Metab. -2000. -Vol. 85. -Р. 4212-4218.
- Saenger P., Albertsson Wikland K., Conway G. Fifth International Symposium on Turner syndrome. Recommendations for the diagnosis and management of Turner syndrome//J. Clin. Endocrinol. Metab. -2001. -Vol. 86. -Р. 3061-3069.
- Sybert V., McCauley E. Turner's syndrome//N. Engl. J. Med. -2004. -Vol. 351. -Р. 1227-1238.


