Особенности хронической сердечной недостаточности на фоне тромбоцитопении у лиц, инфицированных вирусом иммунодефицита человека
Автор: Горячева О.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Общий контекст исследования посвящен изучению особенностей течения хронической сердечной недостаточности (ХСН) у лиц, инфицированных вирусом иммунодефицита человека (ВИЧ), в рамках одномоментного скринингового клинического исследования.Цель: определить особенности течения ХСН у ВИЧ-инфицированных больных в зависимости от наличия тромбоцитопении (ТП).Материал и методы. В условиях многопрофильного стационара в течение 4 лет обследованы 240 больных с ВИЧ-инфекцией, среди которых выделена когорта больных с ХСН (160 человек), в дальнейшем разделенная на группы больных с ТП (107 человек) и без ТП (53 человека). Больным проведен одинаковый объем исследований, включающий эхокардиографию, неинвазивную артериографию, развернутое лабораторное обследование.Результаты. ТП у больных с ХСН и ВИЧ-инфекцией чаще встречается у курящих и лиц с вероятной алкогольной зависимостью и сопряжена с гемодинамическими нарушениями в виде более высоких цифр систолического (САД) и диастолического артериального давления (ДАД), увеличением левого предсердия. При ТП выше значения NT-proBNP плазмы крови, а в сыворотке крови - тканевого ингибитора металлопротеиназ-1 (TIMP-1), мочевины, билирубина, при этом концентрация ионов натрия и калия сыворотки крови ниже. Анемия и лейкопения чаще встречались в группе больных с ТП. Больные с ТП более привержены приему ингибиторов протеазы (ИП) и нестероидных противовоспалительных препаратов (НПВП).Заключение. Частота выявления ХСН у больных с ВИЧ-инфекцией на фоне ТП почти в 2 раза выше и чаще сопровождается дилатацией левого предсердия, более высокими цифрами АД, ростом TIMP-1 и снижением концентрации ионов калия в сыворотке крови. Концентрация NT-proBNP плазмы крови имеет тесную обратную корреляционную связь с количеством тромбоцитов у больных с ХСН и ТП, а наличие тяжелой ТП ≤ 30 × 109 клеток/л в 10,8 раза увеличивает шансы развития ХСН с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ). Курение, возможная алкогольная зависимость и приверженность к приему ИП и НПВП являются значимыми факторами, связанными с развитием ТП у ВИЧ-инфицированных с ХСН.
Хроническая сердечная недостаточность, тромбоцитопения, вич-инфекция, артериальное давление, nt-probnp
Короткий адрес: https://sciup.org/149144772
IDR: 149144772 | УДК: 616.155.294-02:616.12-008.46-036.12:[616.98:578.828HIV] | DOI: 10.29001/2073-8552-2024-39-1-126-134
Текст научной статьи Особенности хронической сердечной недостаточности на фоне тромбоцитопении у лиц, инфицированных вирусом иммунодефицита человека
Тромбоцитопения (ТП) – патологическое состояние, характеризующееся снижением количества тромбоцитов ниже 150 × 109/л [1]. ТП проявляется вследствие нескольких причин: снижения образования тромбоцитов, секвестрации тромбоцитов или повышенного разрушения тромбоцитов, при этом клиническая картина может варьировать от случайной находки до явного кровотечения. Причинами ТП могут быть вирусные инфекции, злокачественные новообразования, заболевания печени, аутоиммунные заболевания, синдром диссеминированного внутрисосудистого свертывания, беременность, прием лекарств и нарушения свертывания крови. ТП является частым гематологическим расстройством у лиц, инфицированных вирусом иммунодефицита человека (ВИЧ) и может быть первым симптомом ВИЧ-инфекции, а также может появляться вследствие приема антиретровирусной терапии (АРТ) [2].
Поражение сердечно-сосудистой системы при ВИЧ-инфекции является значительным, в литературе описан фенотип ВИЧ-ассоциированной кардиомиопатии, развитие которого обусловлено прямым вирусным повреждением миокарда с развитием апоптоза кардиомиоцитов и фибробластов [3]. Известно, что как ТП, так и ВИЧ-ассоциированная кардиомиопатия формируются в том числе за счет прямого цитотоксического действия вируса. Представляет клинический интерес взаимосвязь течения хронической сердечной недостаточности (ХСН) и ТП у больных с ВИЧ-инфекцией.
Частота встречаемости ХСН среди ВИЧ-инфицированных феноменальна. Эпидемиологические исследования показали, что риск развития ХСН у больных с ВИЧ-инфекцией на 50% и более выше, чем у больных без данной патологии, даже после поправки на другие факторы риска ее возникновения [4].
Цель исследования: определить особенности течения ХСН у ВИЧ-инфицированных больных в зависимости от наличия ТП.
Материал и методы
Исследование планировалось и выполнялось в соответствии с принципами Хельсинкской декларации и стандартами надлежащей клинической практики (GCP) и носило характер одномоментного, скринингового, клинического исследования. С 2019 по 2022 гг. в условиях многопрофильного стационара г. Перми обследованы 240 человек с ВИЧ-инфекцией, среди которых у 160 больных была выявлена ХСН. Автором лично был осуществлен отбор пациентов, проведены трансторакальная эхокардиография, неинвазивная артериография аппаратом TensioMed ArterioGraph 24 (Великобритания), определена тяжесть ХСН по шкале оценки клинического состояния больных с ХСН в модификации В.Ю. Мареева (ШОКС), тесту шестиминутной ходьбы (ТШХ), а также в лабораторию были направлены образцы крови и мочи.
Диагноз ХСН устанавливался при наличии соответствующих клинических признаков и симптомов, структурных изменений сердца, признаков систолической или диастолической дисфункции и повышения N-концевого мозгового натрийуретического пропептида более 125 пг/мл в соответствии с киническими рекомендациями Российского кардиологического общества 2020 г. пересмотра.
Эхокардиография проводилась на аппарате VIVID T8 (GE Healthcare, США) по методике, рекомендованной Европейским и Американским обществом эхокардиографии [5]. Фракция выброса (ФВ) левого желудочка (ЛЖ%) определялась по методу Simpson. Диастолическая дисфункция ЛЖ рассчитывалась по данным трансмитрального диастолического потока в режиме постоянного и импульсно-волнового допплера, а также тканевой допплерографии. Гипертрофия ЛЖ (ГЛЖ) определялась при увеличении индекса массы тела ЛЖ (ИММЛЖ) у мужчин более 115 г/м2, у женщин более 95 г/м2. Легочная артериальная гипертензия (ЛАГ) определялась как повышение среднего давления в легочной артерии (СДЛА) более 25 мм рт. ст. в покое в процессе эхокардиографии.
Критериями включения в исследование были наличие подтвержденной ХСН, стабилизация состояния по терапевтическому заболеванию, потребовавшему госпитализации, обязательное наличие ВИЧ-инфекции, согласие больного на участие в исследовании. Критериями невключения в исследование были острая декомпенсация ХСН; острая сердечная недостаточность; злокачественные новообразования; острые состояния, требующие хирургического вмешательства; когнитивные расстройства; социальная депривация и отказ больного от подписания информированного добровольного согласия для участия в исследовании.
Наличие ВИЧ-инфекции подтверждалось информацией об иммуноблоте. Вероятная алкогольная зависимость (ВАЗ) определялась по опроснику AUDIT в случае набора пациентом 20 и более баллов. Большинство пациентов с алкогольной зависимостью состояли на учете в наркологическом диспансере по употреблению алкоголя и психоактивных веществ. Всем больным проведено определение в плазме крови уровня N-терминального фрагмента мозгового натрийуретического пептида (NT-proBNP), а также выполнено традиционное обследование в объеме общих анализов крови и мочи, биохимического анализа с определением показателей печеночной, почечной функции, белка, глюкозы, показателей липидограммы и коагулограммы.
Помимо этого, в сыворотке крови больных методом иммуноферментного анализа на приборе Immulite 1000 (DPC,США) определялась концентрация тканевого ингибитора металлопротеиназ-1 (TIMP-1) с помощью реактивов компании Sanlong Biotech Co., Ltd, Китай.
Статистическая обработка полученных данных проведена с помощью статистических программ STATISTIСA 13.0 и SPSS STATISTICS версия 26. Проверка нормальности распределения количественных показателей проводилась по критериям Колмогорова – Смирнова и Шапиро – Уилка. В отсутствии нормального распределения количественные показатели описаны медианами и межквартильными промежутками, Me [ Q1; Q3 ]. Категориальные показатели представлены абсолютными ( n ) и относительными (в %) частотами встречаемости. Попарные межгрупповые сравнения количественных показателей в независимых группах пациентов выполнялись по критерию Манна – Уитни. Для сравнения категориальных показателей (частот встречаемости) в двух независимых группах использовались χ 2 – критерий Пирсона или точный критерий Фишера.
Для оценки взаимосвязи между уровнями тромбоцитов и NT-proBNP в плазме крови больных ХСН, инфицированных ВИЧ, использовался коэффициент корреляции Спирмена. Пороговый уровень значимости при проверке гипотез составлял р = 0,05.
Результаты
Проведен анализ встречаемости ХСН в когорте больных с ВИЧ-инфекцией (240 человек) в зависимости от наличия ТП (рис. 1). Выявлено, что у больных с ТП частота встречаемости ХСН почти в 2 раза выше, чем у больных без ТП ( p < 0,001) и составляет 82% у больных с ТП и 48% – без ТП.
Отношение шансов развития ТП у больных с ХСН составило 1,092; 95% доверительный интервал (ДИ) 0,609– 1,959, что свидетельствует о том, что развитие ХСН само по себе не является причиной развития ТП у ВИЧ-инфицированных, а эти два процесса могут развиваться параллельно. Относительный риск развития ТП у больных ХСН и ВИЧ-инфекцией составил 0,589, при этом 95% ДИ составил 0,476–0,729, чувствительность – 0,323, специфичность – 0,304%. Соответственно, риск развития ТП в случае ХСН выше в 1,7 раза.
Были проанализированы клинические показатели, характеризующие течение ХСН (табл. 1). Выявлено, что больные ХСН и ТП чаще курят ( р = 0,004), имеют возможную алкогольную зависимость ( р = 0,007) и более высокие цифры систолического (САД) ( р < 0,001) и диастолического артериального давления (ДАД) ( р = 0,003). Анемия также чаще встречается у больных с ТП ( р = 0,023). Число больных с гидротораксом было выше в группе с ТП ( р = 0,044).
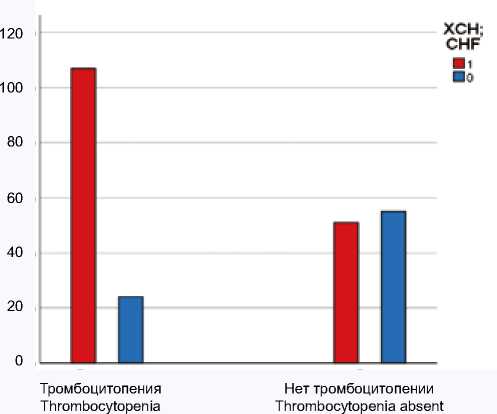
Рис. 1. Частота выявления хронической сердечной недостаточности у больных с ВИЧ-инфекцией в зависимости от наличия тромбоцитопении ( p < 0,05)
Примечание: ХСН – хроническая сердечная недостаточность.
Fig. 1. The frequency of CHF detection in patients with HIV infection, depending on the presence of thrombocytopenia ( p < 0.05)
Note: CHF – chronic heart failure, HIV – human immunodeficiency virus.
Таблица 1. Клинико-анамнестическая характеристика пациентов с ВИЧ-инфекцией и хронической сердечной недостаточностью в зависимости от наличия тромбоцитопении
Table 1. Clinical and anamnestic characteristics of patients with HIV infection and CHF, depending on the presence of thrombocytopenia
|
Показатели Indicators |
Пациенты с тромбоцитопенией Patients with thrombocytopenia n = 107 |
Пациенты без тромбоцитопении Patients without thrombocytopenia n = 53 |
р |
|
Возраст, лет, Me ; Q 25– Q 75 age, years, Me; Q 25– Q 75 |
37,0 [34,0; 40,0] |
36,0 [34,0; 40,0] |
0,843 |
|
Пол, мужской, n ( %) Sex, male, n ( %) |
63 (59) |
29 (55) |
0,616 |
|
Курение, n ( %) Smoking n ( %) |
82 (77) |
29 (55) |
0,004 |
|
ВАЗ, n ( %) PAD, n ( %) |
70 (65) |
23 (43) |
0,007 |
|
Наркопотребление, n ( %) Drug use, n ( %) |
86 (80) |
41 (77) |
0,657 |
|
ИМТ, кг/м2 ( Me; Q 25– Q 75) BMI, kg/m2 ( Me; Q 25– Q 75) |
19,65 [17,50; 21,60] |
20,06 [17,99; 23,24] |
0,080 |
|
САД офисное, мм рт. ст. SBP office, mm Hg |
126,00 [112,00; 146,00] |
112,00 [102,00; 130,00] |
< 0,001 |
|
ДАД, офисное, мм рт. ст. DBP office, mm Hg |
72,00 [64,00; 83,00] |
68,02 [55,00; 78,00] |
0,003 |
|
ИБС в анамнезе, n ( %) CAD in anamnesis, n ( %) |
23 (21 ) |
14 (26) |
0,487 |
|
Инфаркт миокарда в анамнезе, n ( %) Myocardial infarction, n ( %) |
1 (0,9) |
2 (4) |
0,212 |
|
АКШ и ЧКВ в анамнезе, n ( %) CABG and PCI in anamnesis, n ( %) |
0 (0) |
1 (2) |
0,154 |
|
Клапанные пороки сердца в анамнезе, n ( %) Valvular heart diseases in anamnesis, n ( %) |
33 (31) |
10 (19) |
0,107 |
|
Фибрилляция предсердий в анамнезе, n ( %) Atrial fibrillation un anamnesis, n ( %) |
3 (3) |
2 (4) |
0,740 |
|
Ишемический инсульт или ТИА в анамнезе, n ( %) Ischemic stroke or TIA in anamnesis, n ( %) |
3 (3) |
1 (2) |
0,726 |
|
Сахарный диабет, n ( %) Diabetes mellitus in anamnesis, n ( %) |
5 (5) |
3 (6) |
0,787 |
|
Желудочковые нарушения ритма сердца, n ( %) Ventricular heart abnormalities, n ( %) |
43 (40) |
19 (36) |
0,596 |
|
ТШХ, м 6-minute walk test, m |
400,00 [350,00; 450,00] |
400,00 [320,00; 500,00] |
0,734 |
|
ШОКС, баллы Scale for assessing the clinical condition of a patient with CHF |
5,00 [5,00; 7,00] |
6,000 [4,00; 8,00] |
0,905 |
|
ФК ХСН FC CHF |
2,00 [2,00; 3,00] |
2,00 [2,00; 3,00] |
0,128 |
|
Легочная артериальная гипертензия, n ( %) Pulmonary artery hypertension, n ( %) |
55 (51) |
25 (47) |
0,614 |
|
Анемия, n ( %) Anemia, n ( %) |
91 ( 85) |
37 (70) |
0,023 |
Окончание табл. 1
End of table 1
|
Показатели Indicators |
Пациенты с тромбоцитопенией Patients with thrombocytopenia n = 107 |
Пациенты без тромбоцитопении Patients without thrombocytopenia n = 53 |
р |
|
Тромбоцитопения, n ( %) Thrombocytopenia, n ( %) |
107 (100) |
0 (0) |
– |
|
Асцит, n ( %) Ascites, n ( %) |
27 (25) |
9 (17) |
0,367 |
|
Гидроторакс, n ( %) Hydrothorax, n ( %) |
24 (22) |
5 (9) |
0,044 |
|
Перикардиальный выпот, n ( %) Pericardial effusion, n ( %) |
7 (6 ) |
4 (7) |
0,813 |
|
АРТ, n ( %) ART, n ( %) |
19 (18) |
7 (13) |
0,462 |
|
Неподавленная вирусная нагрузка, n ( %) Unsuppressed viral load, n ( %) |
87 (81) |
40 (75) |
0,390 |
|
ХВГС, n ( %) Chronic viral hepatitis C, n (%) |
80 (75) |
38 (72) |
0,678 |
Примечание: ВАЗ – вероятная алкогольная зависимость, ИМТ – индекс массы тела, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ИБС – ишемическая болезнь сердца, АКШ – аортокоронарное шунтирование, ЧКВ – чрескожные коронарные вмешательства, ТИА – транзиторная ишемическая атака, АРТ – антиретровирусная терапия, ФК ХСН – функциональный класс хронической сердечной недостаточности, ХВГС – хронический вирусный гепатит С.
Note: PAD – probable alcohol dependence, BMI – body mass index, SBP – systolic blood pressure, DBP diastolic blood pressure, CAD coronary heart disease; CABG coronary artery bypass grafting, PCI – percutaneous coronary interventions, TIA – transient ischemic attack, ART – antiretroviral therapy, FC CHF – functional class of chronic heart failure, CHC – chronic viral hepatitis C.
Полученные результаты свидетельствуют о более высокой приверженности к курению и ВАЗ у лиц с ТП. Наиболее значимая зависимость между группами больных с ТП и без нее обнаружилась по уровню САД, замеры которого регистрировались аппаратом неинвазивной артериографии TensioMed ArterioGraph 24 (Великобритания) непрерывно в течение 3 ч дневного времени суток в
состоянии покоя. На рисунке 2 изображены особенности распределения САД у ВИЧ-инфицированных в зависимости от наличия ТП и ХСН. Показано, что у больных с ТП и ХСН имеются более высокие цифры САД по сравнению с больными без ТП ( р < 0,001). При этом цифры САД у больных без ХСН в зависимости от уровня ТП существенно не различались.
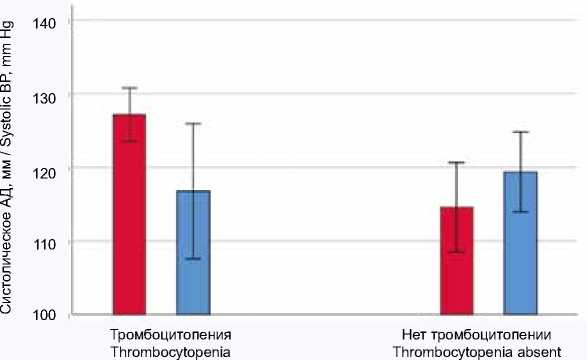
Рис. 2. Особенности значений систолического артериального давления у больных с ВИЧ-инфекцией ( n = 240) в зависимости от наличия тромбоцитопении и хронической сердечной недостаточности (красные столбцы – есть ХСН, голубые столбцы – нет ХСН)
Примечание: АД – артериальное давление, ХСН – хроническая сердечная недостаточность.
Fig. 2. Features of systolic blood pressure values in patients with HIV infection (n = 240) depending on the presence of thrombocytopenia and chronic heart failure (red bars - have CHF, blue bars – no CHF) Note: CHF – chronic heart failure, HIV – human immunodeficiency virus.
В таблице 2 представлены показатели эхокардиографии в зависимости от наличия ТП у больных с ХСН и ВИЧ-инфекцией. При ТП значимо больше значение индекса объема левого предсердия ( р = 0,018). При этом частота сердечных сокращений (ЧСС) покоя при ТП была ниже ( р = 0,015). По всем остальным показателям эхокардиографии значимых различий не получено.
Результаты лабораторных исследований представлены в таблице 3. Концентрация NT-proBNP плазмы крови была значительно выше в группе больных с ТП ( р < 0,001). У больных с ТП в сыворотке крови была
выше концентрация мочевины ( р = 0,018), активность аспартатаминотрансферазы (АСТ) ( р = 0,008), концентрация TIMP-1 ( р = 0,005). Концентрация сывороточного железа у больных с ТП в сыворотке крови была выше ( р < 0,001), а концентрация ферритина ( р < 0,001) значительно ниже, чем у больных без ТП. Уровень гемоглобина был ниже в группе больных с ТП ( p < 0,001), а лейкоцитоз был более высоким у больных без ТП ( р = 0,001). Концентрация ионов натрия и калия в сыворотке крови была ниже у больных с ТП ( р = 0,033 и р < 0,001 соответственно).
Таблица 2. Данные эхокардиографии у больных с хронической сердечной недостаточностью и ВИЧ-инфекцией в зависимости о наличия тромбоцитопении
Table 2. Echocardiographic data in patients with CHF and HIV infection, depending on the presence of thrombocytopenia
|
Показатели Indicators |
Пациенты с тромбоцитопенией Patients with thrombocytopenia n = 107 |
Пациенты без тромбоцитопении Patients without thrombocytopenia n = 53 |
P |
|
ЧСС покоя, уд/мин HR, beats per min |
81,00 [71,00; 90,00] |
85,00 [77,00; 99,00] |
0,015 |
|
КСО ЛЖ, Final systolic volume of LV |
41,00 [32,00; 51,00] |
35,00 [22,00; 62,00] |
0,242 |
|
КДО ЛЖ Final diastolic volume of LV |
97,00 [83,00; 118,00] |
89,00 [78,00; 108,00] |
0,176 |
|
Среднее ДЛА, мм рт. ст. Mean pressure in the pulmonary artery, mm Hg |
28,50 [15,90; 40,00] |
21,00 [14,00; 36,20] |
0,236 |
|
ФВ ЛЖ, % LV EF, % |
55,082 ± 11,374 |
56,326 ± 12,149 |
0,569 |
|
ФВ ЛЖ < 40%, n(%) |
13 (12) |
0 (0) |
0,003 |
|
Е/А ЛЖ |
1,22 [1,00; 1,69] |
1,15 [0,95; 1,55] |
0,966 |
|
IVRT ЛЖ, мс |
84,00 [66,00; 112,00] |
82,00 [68,00; 100,00] |
0,525 |
|
Е/e’ |
6,98 [5,49; 17,80] |
7,00 [4,81; 17,90] |
0,239 |
|
Диастолическая дисфункция ЛЖ, n ( %) Diastolic dysfunction of the LV, n ( %) |
52 (48) |
28 (53) |
0,353 |
|
ИОЛП, мл/м2 LVMI, ml/m2 |
37,54 [27,90; 54,76] |
31,74 [25,51; 39,73] |
0,018 |
|
ИММЛЖ, г/м2 Left ventricular myocardial mass index, g/m2 |
139,00 [111,00; 177,00] |
140,00 [103,13; 162,00] |
0,652 |
|
ГЛЖ, n ( %) LVH, n ( %) |
58 (54) |
25 (47) |
0,327 |
Примечание: ХСН – хроническая сердечная недостаточность, ЧСС – частота сердечных сокращений, ТШХ – тест шестиминутной ходьбы, ШОКС – шкала оценки клинического состояния, ФВ ЛЖ – фракция выброса левого желудочка, E – максимальная скорость раннего наполнения ЛЖ, A – максимальная скорость позднего наполнения ЛЖ, IVRT – время изоволюмического расслабления ЛЖ, e’ – ранняя диастолическая скорость движения фиброзного кольца, ИММЛЖ – индекс массы миокарда ЛЖ, ГЛЖ – гипертрофия левого желудочка, ИОЛП – индекс объема левого предсердия.
Note: CHF – chronic heart failure, HIV - human immunodeficiency virus, HR – heart rate, LV EF – left ventricular ejection fraction, E – maximum early LV filling rate, A – maximum late LV filling rate, IVRT – LV isovolumic relaxation time, e’ – early diastolic velocity of the annulus, LVMI – left ventricle myocardial mass index, LVH – left ventricular hypertrophy.
Таблица 3. Результаты лабораторных исследований больных с хронической сердечной недостаточностью, инфицированных ВИЧ, в зависимости от наличия тромбоцитопении
Table 3. Results of laboratory studies of patients with chronic heart failure infected with HIV, depending on the presence of thrombocytopenia
|
Показатели Indicators |
Пациенты с тромбоцитопенией Patients with thrombocytopenia n = 107 |
Пациенты без тромбоцитопении Patients without thrombocytopenia n = 53 |
P |
|
АЛТ, ед/л ALT, u/l |
32,00 [17,00; 78,00] |
26,00 [18,00; 39,00] |
0,132 |
|
АСТ, ед/л AST, u/l |
54,00 [32,00; 115,00] |
37,00 [23,00; 58,00] |
0,008 |
|
Na+, ммоль/л |
141,00 [136,00; 144,00] |
142,00 [140,00; 144,00] |
0,033 |
|
К+, ммоль/л |
3,84 [3,50; 4,40] |
4,40 [3,90; 4,50] |
< 0,001 |
|
Билирубин общий, мкмоль/л Total bilirubin, mkmol/l |
13,00 [11,00; 28,00] |
11,00 [10,00; 14,00] |
0,004 |
|
Креатинин, ммоль/л Creatinine, mmol/l |
105,00 [84,00; 168,00] |
81,00 [63,00; 142,00] |
0,057 |
|
СКФ (CKD-EPI), мл/мин/1,73 м2 GFR, ml/min/1,73m2 |
57,50 [39,00; 100,00] |
90,00 [49,00; 118,00] |
0,140 |
|
CD4 кл/мкл |
170,00 [31,00; 300,00] |
165,00 [69,00; 300,00] |
0,113 |
|
СРБ сыворотки, мг/л Serum CRP, mg/l |
17,00 [12,00; 57,00] |
13,00 [0,00; 84,00] |
0,517 |
|
NT-proBNP плазмы крови, пг/мл Plasma NT-proBNP , pg/ml |
626,1 [309,30; 1844,40] |
395,33 [206,67; 767,00] |
< 0,001 |
|
TIMP-1 сыворотки, пг/мл Serum TIMP-1, pg/ml |
42,60 [19,05; 57,20] |
19,70 [14,40; 38,45] |
0,005 |
|
Цистатин С cыворотки крови, мкг/мл Serum Cystatin C, mcg/ml |
1,50 [0,96; 2,59] |
1,28 [0,77; 2,06] |
0,069 |
|
СКФ по цистатину С (CKD-EPI), мл/мин/1,73 м2 Cystatyn C-GFR (CKD-EPI) |
48,00 [23,00; 81,00] |
60,00 [32,00; 118,00] |
0,060 |
Окончание табл. 2
End of table 2
|
Показатели Indicators |
Пациенты с тромбоцитопенией Patients with thrombocytopenia n = 107 |
Пациенты без тромбоцитопении Patients without thrombocytopenia n = 53 |
р |
|
СОЭ, мм/ч ESR, mm/h |
41,0 [25,00; 60,00] |
40,00 [18,00; 59,00] |
0,830 |
|
Сывороточное железо, мкмоль/л Serum Iron, mcmol/l |
2,3 [1,20; 5,95] |
1,55 [1,10; 4,90] |
< 0,001 |
|
Ферритин, мкг/л Ferritin, mcg/l |
116,9 [57,00; 359,00] |
167 [85,00; 304,00] |
< 0,001 |
|
Тромбоциты, × 109/л Platelets, × 109/l |
107,00 [60,00; 148,00] |
285,00 [232,00; 350,00] |
< 0,001 |
|
Больные с тяжелой тромбоцитопенией ≤ 30 × 109/л Patients with severe thrombocytopenia ≤ 30 × 109 cells/l |
13 (12) |
0 (0) |
0,003 |
|
Эритроциты, × 1012/л RBC, × 1012/l |
3,32 [3,20; 3,60] |
3,00 [3,00; 3,85] |
0,245 |
|
Гемоглобин, г/л Hemoglobin, g/l |
90,00 [75,00; 111,00] |
100,00 [80,00; 114,00] |
< 0,001 |
|
Лейкоциты, × 109 кл/л WBC, × 109/l |
5,30 [3,60; 8,20] |
8,90 [6,30; 15,00] |
0,001 |
Примечание: АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, СКФ – скорость клубочковой фильтрации, СОЭ – скорость оседания эритроцитов, CD – кластер дифференциации антигенов, CKD-EPI – Chronic Kidney Disease Epidemiology Collaboration, СРБ – С-реактивный белок. NТ-proBNP – N-терминальный фрагмент мозгового натрийуретического пептида, TIMP-1 – тканевый ингибитор металлопротеиназ-1.
Note: HIV – human immunodeficiency virus, ALT – alanine aminotransferase, AST – aspartate aminotransferase, GFR – glomerular filtration rate, ESR – erythrocyte sedimentation rate, CD – antigen differentiation cluster, CKD-EPI – Chronic Kidney Disease Epidemiology Collaboration, CRP – C-reactive protein. NT-proBNP – N-terminal fragment of brain natriuretic peptide; TIMP-1 – tissue inhibitor of metalloproteinases-1; RBC – red blood cells; WBC – white blood cells.
Согласно полученным данным, одним из самых чувствительных показателей, продемонстрировавших значимые различия между группами, оказалась концентрация NT-proBNP в плазме крови, что указывает на связь ТП и формирования ХСН. Проведение корреляционного анализа между уровнем тромбоцитов в периферической крови и концентрацией NT-proBNP в плазме крови больных с ХСН, инфицированных ВИЧ, выявило статистически значимую по шкале Чеддока отрицательную взаимосвязь ( r = –0,633; р = 0,005), свидетельствующую о корреляции низких значений уровня тромбоцитов и высоких значений NT-proBNP плазмы крови. При сравнении частоты развития ХСН с низкой ФВ < 40% в зависимости от наличия тяжелой ТП ≤ 30 × 109 клеток были получены статистически значимые различия ( р = 0,003). Шансы развития ХСН с низкой ФВ увеличиваются у больных с тяжелой ТП в 10,8 раза (95% ДИ 2,66–43,34). Между сопоставимыми признаками имелась средняя связь (V = 0,290). Относительный риск при этом составил 7,7 (95% ДИ 2,61–23,25).
TIMP-1 сыворотки крови также продемонстрировала значимые различия при сравнении между группами. По литературным данным, ТIMP-1 значительно изменяет свою концентрацию при ГЛЖ, высокой ригидности артериальной стенки и является маркером ингибирования деградации коллагена в кардиомиоцитах и эндотелии сосудов [6]. Получена отрицательная средней тесноты корреляционная связь между концентрацией тромбоцитов и уровнем TIMP-1 в сыворотке крови ( r = –349; p < 0,001), отрицательная слабой тесноты связь между уровнем тромбоцитов и концентрацией калия в сыворотке крови больных с ХСН, инфицированных ВИЧ ( r = –0,277; р = 0,001). Иных значимых корреляционных зависимостей не выявлено.
В таблице 4 представлены данные, полученные во время проведения неинвазивной ангиографии аппаратом «TensioMed ArterioGraph 24». Результаты свидетельствуют о более высоких цифрах среднего АД ( р < 0,001), пульсового АД ( р = 0,004), пульсового давления в аорте
( р = 0,007) и САД в аорте ( р < 0,001) у больных с ТП на фоне ХСН и ВИЧ-инфекции. Данные показатели говорят об имеющейся взаимосвязи ТП и артериальной гипертензии. При этом индексы жесткости артериальной стенки у больных с ТП и без нее значимо не отличались.
Таблица 4. Показатели, характеризующие функциональное состояние артериальной стенки у больных с хронической сердечной недостаточностью, инфицированных ВИЧ, в зависимости от наличия тромбоцитопении, определенные методом неинвазивной артериографии
Table 4. Indicators characterizing the functional state of the arterial wall in patients with CHF infected with HIV, depending on the presence of thrombocytopenia, determined by the method of non-invasive arteriography
|
Показатели Indicators |
Пациенты с тромбоцитопенией Patients with thrombocytopenia n = 107 |
Пациенты без тромбоцитопении Patients without thrombocytopenia n = 53 |
р |
|
MAP, мм рт. ст. |
91,00 [84,00; 102,00] |
81,00 [73,00; 95,00] |
< 0,001 |
|
PP, мм рт. ст. |
51,00 [44,00; 58,00] |
44,00 [38,00; 52,00] |
0,004 |
|
AIX ao,% |
15,60 [2,90; 27,20] |
12,40 [2,10; 26,60] |
0,551 |
|
AIX br mean, ед |
–43,6 [ –68,70; –20,70] |
–49,90 [ –70,30; –21,70] |
0,551 |
|
PРao, мм рт. ст. |
41,00 [36,00; 48,00] |
35,00 [30,00; 45,00] |
0,007 |
|
PWao, м/с |
7,50 [6,70; 8,80] |
7,30 [6,30; 8,00] |
0,105 |
|
SBPao, мм рт. ст. |
110,0 [103,0; 139,0] |
102,0 [94,0; 110,0] |
< 0,001 |
Примечание: МАР – среднее артериальное давление, РР – пульсовое давление AIX ao,% – индекс аугментации в аорте, AIX br mean, ед. – индекс аугментации в плечевой артерии, PPao – пульсовое давление в аорте, PWao, м/с – скорость распространения пульсовой волны в аорте, рассчитываемые аппаратом «TensioMed ArterioGraph 24».
Note: CHF – chronic heart failure, HIV – human immunodeficiency virus, MAP – mean arterial pressure, PP – pulse pressure AIX ao,% – augmentation index in the aorta, AIX br mean, units – augmentation index in the brachial artery; PP ao – pulse pressure in the aorta, PWao, m/s is the speed of pulse wave propagation in the aorta, calculated by the TensioMed ArterioGraph 24 apparatus.
Были изучены особенности влияния проводимой терапии на возникновение ТП у больных с ХСН и ВИЧ-инфекцией в стационаре на день взятия в исследование. Выявлено, что больные с ТП чаще принимали нестероидные противовоспалительные препараты (НПВП) ( р = 0,043) и ингибиторы протеазы (ИП) ( р = 0,026). По остальным группам препаратов значимых различий получено не было. Изучался прием таких групп препаратов, как ингибиторы АПФ, антагонисты рецепторов ангиотензина, диуретики, бета-блокаторы, антагонисты минералокортикоидных рецепторов, ингибиторы протонной помпы, цефалоспорины, защищенные пенициллины, карбапе-немы, аминогликозиды, макролиды, противогрибковые препараты, нитромидазолы, сульфаниламиды, препараты железа, антиангинальные препараты, нуклеозидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы обратной транскриптазы,
Обсуждение
Частая встречаемость ТП наряду анемией в когорте больных с ВИЧ-инфекцией обусловлена прямым и опосредованным воздействием ВИЧ на костный мозг. Костный мозг является мишенью для медиаторов воспаления, высвобождаемых при инфекции, для вероятных условно-патогенных микроорганизмов, препаратов, применяемых при лечении ВИЧ-инфекции. Патофизиологическим механизмом формирования ТП у ВИЧ-инфицированных является неадекватная продукция тромбоцитов и/или аутоиммунно-опосредованное их разрушение [2]. Прямое и косвенное воздействие ВИЧ-инфекции на гемопоэтические клетки-предшественники нарушает гомеостаз костного мозга, влияя на пролиферацию и дифференцировку клеток в процессе кроветворения [4]. Кроме того, гемопоэтические клетки-предшественники экспрессируют рецепторы CD4- лимфоцитов, ускоряя развитие ТП у больных с ВИЧ-инфекцией. Известно, что ВИЧ-инфекция не только ведет к формированию тяжелого иммунодефицита, но и является мощным деструктивным фактором гематопоэза, вызывая развитие панцитопении. При этом не всегда имеется линейная зависимость между прогрессированием ВИЧ-инфекции и панцитопении [6]. Наиболее частой причиной ТП у ВИЧ-инфицированных является аутоиммунная тромбоцитопеническая пурпура, которая может проявляться на начальных стадиях заболевания [7]. Течение ТП у ВИЧ-инфицированных усугубляется при наличии сопутствующих вирусных заболеваний, таких как хронический вирусный гепатит С, цитомегаловирусная инфекция, а также при использовании миелосупрессивной терапии злокачественных новообразований [8]. Согласно нашим результатам, ТП у больных с ВИЧ-инфекцией является фактором, ассоциированным с ХСН, а вероятность развития ХСН у больных с ТП в 1,7 раза выше, чем у больных без ТП. Прослеживается взаимосвязь между ТП и концентрацией NT-proBNP плазмы крови, демонстрирующая значимой тесноты корреляцию высоких значений NT-proBNP и низкого уровня тромбоцитов периферической крови больных с ХСН, инфицированных ВИЧ. По литературным данным, наиболее значимыми факторами развития ТП у ВИЧ-инфицированных являются возраст, уровень CD4-Т лимфоцитов и прием АРТ [9]. В нашем исследовании оказались значимыми такие факторы, как курение и ВАЗ.
Тяжелая ТП у ВИЧ-инфицированных ассоциируется с высокой коморбидностью, снижением качества жизни и смертностью [6]. По нашим данным, у больных с тяжелой ТП в 10,8 раза возрастает риск развития ХСН с низкой ФВ ЛЖ.
ТП может осложняться развитием гемолитико-уремического синдрома – причины острого почечного повреждения, стимулирующего развитие диастолической кардиомиопатии [10]. ХСН в свою очередь также может способствовать развитию ТП, поскольку ее развитие и утяжеление сопряжено с развитием хронической болезни почек и снижением синтеза почечной порции тромбопоэ-тина [11]. Тромбопоэтин в большей степени образуется печенью и почками, после чего попадает в кровоток и стимулирует дифференцировку мегакариоцитов в костном мозге, увеличивая количество тромбоцитов в периферической крови [12]. Рецепторы к тромбопоэтину имеются не только на мембранах клеток крови, но и на мембранах кардиомиоцитов, нейронов, клетках эндотелия сосудов, а сам тромбопоэтин оказывает защитное влияние на клеточные мембраны этих клеток [13]. Тромбопоэтин дозозависимым образом снижает констрикцию коронарных артерий, вызванную эндотелином-1, а также способствует снижению контрактильности кардиомиоцитов и снижению активности их апоптоза, способствуя высвобождению оксида азота, TNF-α и интерлейкина 1-β [14].
Выбор TIMP-1 для исследования обусловлен желанием изучить изменения коллагенового матрикса на фоне ТП у больных с ХСН, инфицированных ВИЧ. Тканевый ингибитор металлопротеиназ-1 (TIMP-1) – маркер локального и системного фиброза, его уровень повышается в ткани келоидного рубца [15], а в сыворотке крови – при фибрилляции предсердий, аортальным стенозе, последнее связывают с интенсификацией фиброза кардиомиоцитов и повышением жесткости фиброзного кольца аортального клапана [16]. TIMP-1 повышается также при состояниях, сопровождающихся поражением микроцир-куляторного русла – заболеваниях пародонта [17], диабетической ретинопатии [18]. В нашей работе выявлено значимое увеличение концентрации TIMP-1 у больных с ТП на фоне ХСН и ВИЧ-инфекции, что может свидетельствовать об интенсификации процессов фиброза и коллагенообразования, а также поражении микроцирку-ляторного русла у больных с ХСН, инфицированных ВИЧ.
Известно, что концентрация тромбоцитов коррелирует с концентрацией ионов калия в сыворотке крови, соответственно, высокое содержание тромбоцитов сопровождается гиперкалиемией, а низкое – гипокалиемией [19]. Полученные в нашем исследовании более низкие концентрации ионов калия сыворотки крови у больных с ТП закономерны. Употребление ИП и НПВП чаще встречается у больных с ТП, при этом описано негативное влияние данных групп препаратов на гемопоэз, а именно на формирование анемии и ТП [3].
У больных с ТП увеличение объема левого предсердия значимо чаще встречалось в нашем исследовании, что является признаком, косвенно указывающим на развитие диастолической дисфункции, и повышает риски возникновения фибрилляции предсердий. ТП уменьшает риск возникновения ишемических инсультов у больных с неклапанной фибрилляцией предсердий, а дилатация левого предсердия – это компенсаторный механизм, необходимый для поддержания ударного объема на ранних стадиях диастолической дисфункции ЛЖ, отражающий продолжительный характер гипертензии левого предсердия и высокого давления наполнения ЛЖ. Модификация диастолических свойств позволяет ЛЖ работать при более высоком давлении наполнения во время диастолы; следовательно, относительный вклад насоса левого предсердия в наполнение ЛЖ увеличивается до тех пор, пока не будут достигнуты пределы резерва преднагрузки левого предсердия [20].
Выводы
Частота выявления ХСН у больных с ВИЧ-инфекцией на фоне ТП почти в 2 раза выше и чаще сопровождается дилатацией левого предсердия, ростом TIMP-1 сыворотки крови, более высокими цифрами АД и снижением концентрации ионов калия в сыворотке крови.
Концентрация NT-proBNP плазмы крови имеет тесную обратную корреляционную связь с количеством тромбоцитов у больных ХСН и ТП, а наличие тяжелой ТП ≤ 30 × 109 клеток/л в 10,8 раза увеличивает шансы развития ХСН с низкой ФВ ЛЖ.
Курение, ВАЗ и приверженность к приему ИП и НПВС являются значимыми факторами, связанными с развитием ТП у ВИЧ-инфицированных с ХСН.
Список литературы Особенности хронической сердечной недостаточности на фоне тромбоцитопении у лиц, инфицированных вирусом иммунодефицита человека
- Greenberg E.M., Kaled E.S. Thrombocytopenia. Crit. Care Nurs. Clin. North Am. 2013;25(4):427-434. https://doi.org/10.1016/j.ccell.2013.08.003.
- Talargia F., Getacher L. Thrombocytopenia and associated factors among HIV infected patients in pre- and post-anti-retroviral therapy, North East Ethiopia. J. Blood Med. 2021;12:741-748. https://doi.org/10.2147/JBM.S323086.
- Belkin M.N., Uriel N. Heart health in the age of highly active antiretroviral therapy: a review of HIV cardiomyopathy. Curr. Opin. Cardiol. 2018;33(3):317-324. https://doi.org/10.1097/HCO.0000000000000513.
- Freiberg M.S., Chang C.H., Skanderson M., Patterson O.V., DuVall S.L., Brandt C.A. et al. Association between HIV infection and the risk of heart failure with reduced ejection fraction and preserved ejection fraction in the antiretroviral therapy era: Results from the veterans aging cohort study. JAMA Cardiol. 2017;2(5):536-546. https://doi.org/10.1001/jamacardio.2017.0264.
- Barberato S.H., Romano M.M.D., Beck A.L.S., Rodrigues A.C.T., Almeida A.L.C., Assunção B.M.B.L. et al. Position statement on indications of echocardiography in adults - 2019. Arq. Bras. Cardiol. 2019;113(1):135- 181. https://doi.org/10.5935/abc.20190129.
- Durandt C., Potgieter J.C., Mellet J., Herd C., Khoosal R., Nel J.G. et al. HIV and haematopoiesis. S. Afr. Med. J. 2019;109(8b):40-45. https://doi.org/10.7196/SAMJ.2019.v109i8b.13829.
- Karki S., Deenadayalan V., Atluri R., Soon-Shiong R. Impact of thrombocytopenia on the outcomes of patients admitted with heart failure: Analysis of the National Inpatient Sample. Circulation. 2023;147:AP585. https://doi.org/10.1161/circ.147.suppl_1.P585.
- Nascimento F.G., Tanaka P.Y. Thrombocytopenia in HIV-infected patients. Indian. J. Hematol. Blood Transfus. 2012;28(2):109-111. https://doi.org/10.1007/s12288-011-0124-9.
- Kyeyune R., Saathoff E., Ezaamama A.E., Löscher T., Fawzi W., Guwatudde D. Prevalence and correlates of cytopenias in HIV-infected adults initiating highly active antiretroviral therapy in Uganda. BMC Infect. Dis. 2014;14(1):496. https://doi.org/10.1186/1471-2334-14-496.
- Alkholifi F.K., Abdi S.A.H., Qadri M. Global prevalence and associated clinical markers of thrombocytopenia in people living with HIV: Evidence from meta-analysis. Clin. Pract. 2022;12(6):867-875. https://doi.org/10.3390/clinpract12060091.
- Poulton J., Taylor C.M., De Giovanni J.V. Dilated cardiomyopathy associated with haemolytic uraemic syndrome. Br. Heart J. 1987;57(2):181- 183. https://doi.org/10.1136/hrt.57.2.181.
- Hitchcock I.S., Hafer M., Sangkhae V., Tucker J.A. The thrombopoietin receptor: revisiting the master regulator of platelet production. Platelets. 2021;32(6):770-778. https://doi.org/10.1080/09537104.2021.1925102.
- Xiao B., Ye J.Y., Xu Y., Yang M. [Molecular mechanism of thrombopoietin signal pathways and its new effects]. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2013;21(1):254-257. (In Chinese). https://doi.org/10.7534/j.issn.1009-2137.2013.01.052.
- Lupia E., Goffi A., Bosco O., Montrucchio G. Thrombopoietin as biomarker and mediator of cardiovascular damage in critical diseases. Mediators Inflamm. 2012;2012:390892. https://doi.org/10.1155/2012/390892.
- Simon F., Bergeron D., Larochelle S., Lopez-Vallé C.A., Genest H., Armour A. et al. Enhanced secretion of TIMP-1 by human hypertrophic scar keratinocytes could contribute to fibrosis. Burns. 2012;38(3):421-427. https://doi.org/10.1016/j.burns.2011.09.001.
- Fragao-Marcues M., Miranda I., Martins D., Barroso I., Mendes C., Pereira-Neves A. et al. Atrial matrix remodeling in atrial fibrillation patients with aortic stenosis. BMC Cardiovasc. Disord. 2020;20(1):468. https://doi.org/10.1186/s12872-020-01754-0.
- de Brouwer P., Bikker F.J., Brand H.S., Kaman W.E. Is TIMP-1 a biomarker for periodontal disease? A systematic review and meta-analysis. J. Periodontal. Res. 2022;57(2):235-245. https://doi.org/10.1111/jre.12957.
- Jayashree K., Yasir M., Senthilkumar G.P., Ramesh Babu K., Mehalingam V., Mohanraj P.S. Circulating matrix modulators (MMP-9 and TIMP1) and their association with severity of diabetic retinopathy. Diabetes Metab. Syndr. 2018;12(6):869-873. https://doi.org/10.1016/j.dsx.2018.05.006.
- Mäkelä K., Kairisto V., Peltola O., Hollmén T., Virtanen A., Pulkki K. et al. Effect of platelet count on serum and plasma potassium: evaluation using database information from two hospitals. Scand. J. Clin. Lab. Invest. Suppl. 1995;222:95-100. https://doi.org/10.3109/00365519509088455.
- Carpenito M., Fanti D., Mega S., Benfari G., Bono M.C., Rossi A. et al. The central role of left atrium in heart failure. Front. Cardiovasc. Med. 2021;8:704762. https://doi.org/10.3389/fcvm.2021.704762.


