Особенности инотропной реакции миокарда пациентов с ишемической болезнью сердца в связи с заготовкой аутокрови
Автор: Подоксенов Ю.К., Афанасьев С.А., Кондратьева Д.С., Свирко Ю.С., Шипулин В.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология, реаниматология и перфузиология
Статья в выпуске: 2 т.10, 2006 года.
Бесплатный доступ
Заготовка аутокрови запускает механизмы стимуляции симпатической нервной системы, избыточная активность которой может ухудшить метаболизм миокарда. В исследованиях на перфузируемых мышечных полосках, выделенных из биоптатов ушка правого предсердия при выполнении операций коронарного шунтирования с использованием искусственного кровообращения (ИК), изучалось влияние заготовки больших объемов аутокрови (около 35 % от объема циркулирующей крови) у 10 больных ИБС. Контрольную группу составили 10 пациентов, оперированных с применением препаратов донорской крови. Полученные результаты свидетельствуют о том, что нет различий в хроноинотропной реакции миокарда у пациентов двух групп.
Короткий адрес: https://sciup.org/142233336
IDR: 142233336
Текст научной статьи Особенности инотропной реакции миокарда пациентов с ишемической болезнью сердца в связи с заготовкой аутокрови
Опыт отечественных и зарубежных клиник свидетельствует, что посттрансфузионные реакции, иммунологические конфликты и инфици-рованность донорской крови могут оказывать иногда весьма выраженное отрицательное воздействие на организм пациентов, негативно влияя на исход операции [3, 6]. В связи с этим озабоченность по поводу необходимости использования гемотрансфузий в кардиохирургии растет день ото дня. Одним из простых и доступных кровесберегающих мероприятий является заготовка аутокрови у пациентов в предоперационном и предперфузионном периодах. Предложенные в настоящее время методики, в том числе и используемые в нашей клинике, позволяют проводить заготовку достаточно большого количества аутокрови - примерно 35% от объема циркулирующей крови (ОЦК) [3, 4, 6, 13]. Главная проблема, с которой сталкивается врач-трансфузиолог, проводящий аутодонорские мероприятия у пациентов с ИБС, -это коронарная и сердечная недостаточность, нередко сопровождающаяся нарушениями сердечного ритма [1,8]. Особенно высок риск прогрессирования коронарной и сердечной недостаточности у пациентов со сниженной фракцией выброса до 40% и ниже, с нестабильной стенокардией, с недавними инфарктами миокарда [6]. Это связано с тем, что процедура заготовки аутокрови оказывает стимулирующее действие на активность симпатической составляющей вегетативной нервной системы. Известно, что избыточная активность симпатоадреналовой регуляции провоцирует увеличение сократимости миокарда и повышение частоты сердечных сокращений, что на фоне сохраняющейся коронарной недостаточности может дополнительно ухудшить метаболизм миокарда [7]. Установлено, что при ИБС клетки сердечной мышцы претерпевают значительные изменения, затрагивающие работу систем, ответственных за внутриклеточные осцилляции ионов кальция и энергетический метаболизм [9, 14]. В связи с существованием таких нежелательных последствий перед нами возникла задача - выяснить характер влияния заготовки аутокрови у пациентов с ИБС на хроноинотроп-ные реакции миокарда.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на интраоперационно полученном материале (мышечные полоски из ушка правого предсердия) 20 больных с диагнозом: хроническая коронарная недостаточность, стенокардия напряжения III-IV класса по Канадской классификации, с мультисосудистым поражением коронарных артерий. Средний возраст пациентов составлял 52,6±2,2 года. Фракция выброса ЛЖ составляла 49,4±18,1%. Всем пациентам выполнялась операция аортокоронарного шунтирования с использованием искусственного кровообращения. Десяти пациентам в предоперационном периоде производили двукратную заготовку аутокрови (до 15% объема циркулирующей крови) и предперфузионную заготовку аутокрови (до 20% ОЦК). Контрольную группу составили 10 пациентов с аналогичной патологией, оперированных на фоне традиционного подхода. Больные основной и контрольной групп по возрасту, полу, фракции выброса ЛЖ, степени легочной гипертензии, сопутствующей патологии, длительности ИК и ишемии миокарда, количеству наложенных анастамозов достоверно не различались.
Показаниями к заготовке аутокрови считали планируемую операционную кровопотерю более 10% ОЦК [6]. Двукратную предоперационную заготовку аутокрови в объеме до 15% ОЦК производили «прыгающим методом»: первый забор крови (до 10% ОЦК) выполняли за 2 дня до операции, второй (5% ОЦК) - за день до операции; вторую эксфузию компенсировали вливанием ранее заготовленной аутокрови. Предпер-фузионный забор аутокрови (до 20% ОЦК) выполняли перед началом ИК. Подробное описание проводимых нами аутодонорских мероприятий было опубликовано ранее [4].
Из ушка правого предсердия, иссекаемого при подключении аппарата искусственного кровообращения, выделяли мышечные полоски с продольным расположением волокон и поперечным сечением не более 1 мм. Подготовленные мышцы размещали в термостабилизированной (36,0±0,5 °C) проточной камере объемом 1 мл. Сократительную активность изолированных мышечных препаратов оценивали в изометрическом режиме. Для этого один конец мышцы неподвижно фиксировали к стенке камеры, а второй прикрепляли к подвижному аноду механо-электрического преобразователя 6МХ1С. Система регистрации предварительно была откалибрована, для чего на анод механо-электрического преобразователя воздействовали нагрузкой в 1 г. Блок усиления был настроен таким образом, чтобы этой нагрузке соответствовал электрический сигнал, равный 1 В. Зафиксированные в камере мышцы с помощью микроманипуляторов натягивались до получения максимального инотропного ответа. Такое натяжение мышцы поддерживалось в течение всего периода адаптации (60 мин).
Перфузию мышц осуществляли раствором Кребса-Хензеляйта следующего состава (в ммоль): NaCl - 120; KCl - 4,8; CaCl2- 2,0; MgSO4 - 1,2; KH2PO4 - 1,2; NaHCO3 - 20,0; глюкоза - 10,0. Для оксигенации раствора использовали карбоген (О2 - 95%, СО2- 5%). Стимуляцию мышц проводили электрическими импульсами прямоугольной формы длительностью 5 мс, подаваемыми на два серебряных электрода, расположенных в перфузионной камере. Частота стимулирующих импульсов составляла 0,5 Гц.
Известно, что экстрасистолическое воздействие позволяет исследовать состояние элек тромеханического сопряжения в изолированных мышечных волокнах [5,10]. В своей работе для воздействия на системы, ответственные за внутриклеточный гомеостаз ионов кальция, мы использовали внеочередные экстрасистоличес-кие электрические импульсы в диапазоне 0,21,5 с [5, 10]. Амплитуда экстрасистолическо-го сокращения мышцы отражает возбудимость сарколеммы, а изменение амплитуды постэк-страсистолического сокращения характеризует способность саркоплазматического ретикулума (СР) аккумулировать ионы Са2+, дополнительно поступающие в миоплазму при внеочередном возбуждении [12]. Кривую изометрического сокращения мышечных полосок регистрировали при помощи усилителя биопотенциалов (УБФ4-03, Россия) и персонального компьютера с оригинальным пакетом прикладных программ.
Статистическую обработку результатов выполняли с применением интегрированной системы статистического анализа и обработки результатов Statistica 5.0. Нормальность распределения оценивали с использованием Shapiro-Wilk W-статистики. В качестве границы статистической значимости принимали значение p=0,05. Оценку статистической достоверности проводили с помощью непараметрических критериев t -test Wilcoxon и х2 [2].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведение исследований на мышечных полосках миокарда обеих групп больных ИБС показало, что внеочередные электрические импульсы, отстоящие по времени на 0,2-0,5 с от регулярного стимулирующего импульса, не вызывали экстрасистолического сокращения. Вероятно, отсутствие изменений цикла сокращение-расслабление связано с тем, что этот временной интервал совпадает с фазой абсолютной рефрактерности кардиомиоцитов. В нашем исследовании экстрасистолические сокращения мышечных полосок исследуемых групп больных удавалось зарегистрировать только в ответ на электрические импульсы, нанесенные через 0,75 с и более от начала регулярного стимула (рис.). Амплитуда инотропного ответа при 0,75 с экстрасистолическом воздействии составляла 32-55% от амплитуды регулярного цикла. Как видно из рис., с появлением экстрасистолического сокращения амплитуда по-стэкстрасистолического сокращения мышц резко снизилась. Известно, что внешний Са2+, дополнительно поступивший в клетку во время экстрасистолы, депонируется в СР и участву-
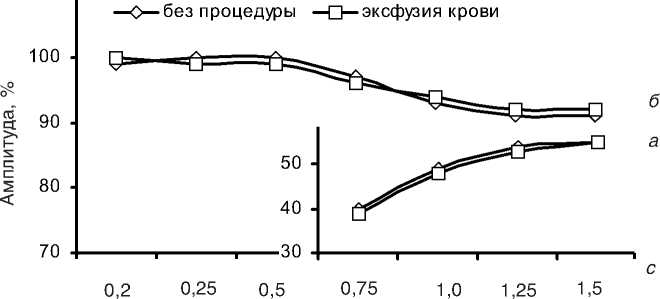
Изменение амплитуды экстрасистолических (а) и постэкстрасистолических (б) сокращений миокарда больных ИБС после проведения эксфузии аутокрови.
По оси ординат: амплитуда сокращений в процентах по отношению к амплитуде регулярного цикла. По оси абсцисс: время, через которое наносили внеочередной импульс.
ет в первом постэкстрасистолическом цикле сокращение-расслабление [10]. С этих позиций отсутствие увеличения амплитуды постэкстра-систолического сокращения, наблюдаемое нами при исследовании миокарда больных ИБС, свидетельствует о том, что СР кардиомиоцитов этих больных не способен аккумулировать ионы кальция, дополнительно вошедшие в миоплазму во время экстрасистолы, либо СР не успевает захватить достаточное количество этих ионов.
В нашем случае дополнительный стимулирующий импульс (экстрасистолу) вполне можно рассматривать как незавершенный переход к повышению частоты стимуляции. При этом выраженное снижение амплитуды постэкстра-систолического сокращения при появлении выраженного экстрасистолического сокращения хорошо согласуется с данными о том, что изолированный миокард больных ИБС проявляет отрицательную ритмоинотропную зависимость, в отличие от миокарда человека без ишемической патологии [11, 14].
Исследуемые мышечные полоски пациентов основной и контрольной групп практически не различались по характеру их экстра- и постэкстрасистолического инотропного ответа. Это обстоятельство дает основание говорить, что возбудимость кардиомиоцитов и работа механизмов, ответственных за работу внутриклеточных Са-транспортирующих систем при проведении мероприятий по заготовке аутокрови, принципиально не изменились. Хотя известны некоторые допущения при исследовании выделенной ткани in vitro [7], тем не менее полученные данные позволяют нам делать ответственный вывод о том, что используемый нами метод заготовки аутокрови не оказывает прямого отрицательного влияния на функциональное состояние сердечной мышцы больных ИБС.
Описанные в литературе негативные последствия заготовки аутокрови у больных ИБС [6], видимо, обусловлены гуморальными факторами. По этой причине заготовка аутокрови у пациентов с ИБС должна проводиться под постоянным врачебным контролем и включать клиническое наблюдение за пациентами в течение не менее 1 ч после процедуры. В нашем исследовании при таком наблюдении были отмечены следующие, характерные для этой процедуры явления: у двух пациентов снизилось артериальное давление, у трех развилась тахикардия, у двух усилилось потоотделение. Специального лечения эти симптомы не потребовали, и пациенты после наблюдения были отправлены в палаты.
ВЫВОДЫ
Применяемый нами метод предоперационной и предперфузионной заготовки аутокрови не изменяет характер экстра- и постэкстрасистолического инотропного ответа мышечных полосок; возбудимость кардиомиоцитов и работу механизмов, ответственных за работу внутриклеточных Са-транспортирующих систем и, таким образом, не оказывает прямого отрицательного влияния на функциональное состояние сердечной мышцы у пациентов с ИБС.
Список литературы Особенности инотропной реакции миокарда пациентов с ишемической болезнью сердца в связи с заготовкой аутокрови
- Беленков Ю. Н, Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. М.: Медиа Медика, 2000. 267 с.
- Боровиков В.П., Боровиков И.П. Statistica: Статистический анализ и обработка данных в среде Windows. М.: Филинъ, 1997. 608 с.
- Руководство по кардиоанестезиологии / Под ред. А.А. Бунатяна, Н.А. Трековой. М.: Медицинское информационное агентство, 2005. С. 198-209.
- Свирко Ю.С., Шипулин В.М., Подоксенов Ю.К. и др. // Патология кровообращения и кардиохирургия. 2004. № 4. С. 31-35.
- Соловьева О.Э., Мархасин В.С., Цыпьян П.Б., Келлер Б.Б. // Биофизика. 1999. 44 (2). С. 337-349.
- EDN: MPCHBH


