Особенности изменения числа фокусов белков уН2АХ и Rad51 в фибробластах кожи человека, подвергавшихся пролонгированному воздействию низкоинтенсивного рентгеновского излучения
Автор: Озеров И.В., Еремин П.с, Осипов А.Н., Еремин И.И., Цветкова А.Д., Гусева С.С., Иванова К.Ю., Гавриленко О.И., Пустовалова М.В., Сметанина Н.М., Грехова А.К., Лазарева Н.П., Пулин А.А., Максимова О.А., Гордеев А.В., Бушманов А.Ю., Котенко К.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Генетика
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
Цель: провести сравнительные исследования особенностей репарации двунитевых разрывов ДНК в клетках млекопитающих, подвергающихся острому и пролонгированному воздействию рентгеновского излучения с различной мощностью дозы. Материал и методы. Исследования выполнены на первичных культурах фи-бробластов, выделенных из биоптатов кожи здоровых добровольцев (женщины 29 и 30 лет). Облучение клеток проводили на рентгеновской биологической установке РУБ РУСТ-М1 (Россия) при температуре 37°С с мощностью дозы 400 мГр/мин (200 кВ, 2*2,4 мА, фильтр 1,5 мм AI) и 4 мГр/мин (50 кВ, 2*0,4 мА, фильтр 1,5 мм AI). Для анализа фокусов уН2АХ и Rad51 использовали иммуноцитохимическое окрашивание белков. Результаты. Проведено одновременное исследование кинетики формирования и деградации фокусов фосфорилированно-го гистона Н2АХ (уН2АХ) и ключевого белка гомологической рекомбинации Rad51 в клетках первичных фибро-бластов кожи человека, подвергавшихся острому и пролонгированному воздействию рентгеновского излучения с одинаковой накопленной дозой. Показано, что относительное число фокусов уН2АХ в пересчете на дозу облучения убывает с уменьшением мощности дозы, в то время как относительное число фокусов Rad51, наоборот, возрастает. Заключение. Полученные данные свидетельствуют о принципиальных различиях в соотношении вкладов негомологичного соединения концов и гомологической рекомбинации в репарацию ДНК в клетках, подвергавшихся острому или пролонгированному облучению.
Двунитевые разрывы днк, низкая мощность дозы, рентгеновское излучение, репарация днк, фибробласты
Короткий адрес: https://sciup.org/14918044
IDR: 14918044
Текст научной статьи Особенности изменения числа фокусов белков уН2АХ и Rad51 в фибробластах кожи человека, подвергавшихся пролонгированному воздействию низкоинтенсивного рентгеновского излучения
-
1Вв едение. Воздействие ионизирующего излучения на живые клетки приводит к образованию целого спектра разнообразных повреждений ДНК, включая двунитевые и однонитевые разрывы, повреждения азотистых оснований и сахарофосфатного остова. Двунитевые разрывы составляют относительно небольшую часть этих повреждений, но именно они являются основным триггером, определяющим дальнейшую судьбу клетки [1]. Клеточный ответ на воздействие ионизирующей радиации напрямую зависит от числа накопленных ДР ДНК и может включать такие процессы, как остановка клеточного цикла, активация процессов репарации ДНК и запуск программ клеточной гибели по путям апоптоза или ав-тофагии [2].
Принципиальные механизмы индукции и репарации ДР ДНК, образованных в результате воздействия острого облучения с мощностью более 200 мГр/мин, подробно изучены в широком диапазоне доз [1]. Однако клетки людей и других млекопитающих часто подвергаются длительному (пролонгированному)
воздействию излучения с низкой мощностью дозы. В то же время данные, касающиеся индукции и репарации ДНК при пролонгированном облучении с низкой мощностью дозы, весьма противоречивы и требуют дальнейшего изучения [3, 4]. В частности, важнейшим вопросом является выявление отличий в механизмах и кинетике накопления и репарации ДР ДНК в случае пролонгированного облучения по сравнению с острым.
Цель: сравнительное исследование особенностей репарации двунитевых разрывов ДНК в клетках млекопитающих, подвергающихся острому и пролонгированному воздействию рентгеновского излучения с различной мощностью дозы.
Материал и методы. Исследования выполнены на первичных культурах фибробластов, выделенных из биоптатов кожи здоровых добровольцев (женщины 29 и 30 лет). После подписания информированного согласия донору под местной анестезией 2%-ным раствором лидокаина проводился надрез кожи в заушной области и иссечение участка площадью 2×2 мм. Биоптат кожи помещался в транспортировочную среду (DMEM, содержащая 1 г/л D-глюкозы, 5% фетальной сыворотки крупного рогатого скота, антибиотики) и немедленно доставлялся в лабораторию.
Биоптаты подвергали ферментативной обработке коллагеназой II типа (Sigma, Австрия), и полученные суспензии одиночных фибробластов культивировали в течение 14 суток при 37°C, 5% CO 2 в стандартной культуральной среде DMEM с высоким содержанием глюкозы (4,5 г/л) (StemCell Technology, США) с добавлением 2 ммоль/л L-глутамина (StemCell Technology, США), 100 ед/мл пенициллина и 100 мг/мл стрептомицина (StemCell Technology, США) и 20% фетальной сыворотки крупного рогатого скота (Biological Industries, Израиль). В дальнейшем клетки снимали с поверхности флаконов 0,05%-ным раствором трипсина и пассеровали с плотностью 104 клеток/см2 в той же культуральной среде, но с уменьшенным до 10% содержанием фетальной сыворотки крупного рогатого скота. Клетки пассеровали при достижении культурой 80-90% монослоя. Замену среды осуществляли каждые трое суток. В работе использовали культуральную посуду фирмы Corning-Costar (США), реактивы фирмы Sigma (США).
Ранее заготовленные криопробирки с культурами клеток фибробластов быстро размораживали при 37°С, а затем, медленно перемешивая, добавляли по капле стандартную культуральную среду до объема 50 мл. Аликвоту клеточной суспензии отбирали для оценки жизнеспособности клеток на автоматическом счетчике клеток Countess (Invitrogen, США) согласно протоколу производителя. После разморозки жизнеспособность клеток во всех образцах составляла не менее 92%. Клетки культивировали в течение трех суток в полной среде.
В дальнейшем экспериментальные и контрольные культуры снимали с пластика раствором трипсина с 0,25% ЭДТА (StemCell Technology, США), инактивацию трипсина и отмывку клеток проводили в полной среде. Клетки пассеровали в 35 мм чашки Петри, на покровные стекла (SPL Lifesciences, Южная Корея). Для экспериментов использовали клетки в фазе экспоненциального роста (плотность клеточной популяции ~70%).
Облучение клеток проводили на рентгеновской биологической установке РУБ РУСТ-М1 (Россия) при температуре 37˚C с мощностью дозы 400 мГр/ мин (200 кВ, 2*2,4 мА, фильтр 1,5 мм Al), и 4 мГр/мин (50 кВ, 2*0,4 мА, фильтр 1,5 мм Al). После облучения клетки инкубировали в стандартных условиях СO2 инкубатора (37°C, 5% CO2) в течение 0,25-24 ч.
Клетки на покровных стеклах фиксировали 4%-ным параформальдегидом в фосфатно-солевом буфере (рН 7,4) в течение 20 мин при комнатной температуре, после чего дважды промывали, рН 7,4. Пермеабилизировали 0,3% Тритон-Х100 в фосфатно-солевом буфере, рН 7,4, содержащем 2% бычьего сывороточного альбумина для блокирования неспецифических взаимодействий. Слайды инкубировали с первичными антителами (мышиные моноклональные антитела к белку γН2АХ (Merck-Millipore, США) в разведении 1/400 и кроличьи поликлональные антитела к белку Rad51 (Merck-Millipore, США) в разведении 1/200) в фосфатно-солевом буфере (рН 7,4), содержащем 1 % бычьего сывороточного альбумина, в течение 1 ч при комнатной температуре. Затем слайды промывали фосфатно-солевым буфером (рН 7,4) и инкубировали при комнатной температуре в течение 1 ч с вторичными антителами IgG (H+L), конъюгированными с флуорохромами (антитела козы к белкам мыши, конъюгированные с Alexa Fluor 555 (Life Technologies, США), в разведении 1/1000 и антитела козы к белкам кролика, конъюгированные с
Alexa Fluor 488 (Merck-Millipore, США), в разведении 1/600) в фосфатно-солевом буфере (рН 7,4), содержащем 1 % бычьего сывороточного альбумина. Для окраски ДНК и предотвращения фотовыцветания использовали содержащую DAPI заключающую среду ProLong Gold (Life Technologies, США). Визуализацию, документирование и обработку иммунноцитохимических микроизображений осуществляли на люминесцентном микроскопе Nikon Eclipse Ni-U (Nikon, Япония), оснащенном видеокамерой высокого разрешения ProgRes MFcool (Jenoptik AG, Германия) с использованием наборов светофильтров DAPI (340– 380 нм возбуждение и 435–485 нм эмиссия) и Y-2E/C (540–580 нм возбуждение и 600–660 нм эмиссия). Анализировали не менее 200 клеток на точку. Для подсчета числа фокусов γН2АХ использовали программу Focicounter . Подсчет фокусов Rad51 производился визуально.
Статистический и математический анализ полученных данных проводился с использованием пакета статистических программ Statistica 8.0 (StatSoft). Результаты исследований представлены как среднее арифметическое результатов трех независимых экспериментов ± стандартная ошибка.
Результаты. В ходе исследования получены кинетики формирования и деградации фокусов гистона γН2АХ в клетках первичных фибробластов кожи человека после воздействия рентгеновского излучения в дозе 1 Гр с различными значениями мощности дозы (рис. 1). Показано, что после облучения с высокой мощностью дозы (400 мГр/мин) число фокусов γН2АХ достигает максимума через 30 мин, а затем наблюдается экспоненциальное снижение их числа практически до контрольного уровня (24 ч после облучения). При этом выделяются быстрая (до 2–4 ч), за время которой происходит уменьшение числа фокусов ~на 60-70%, и медленная фазы репарации (от 4 до 24 ч). В случае пролонгированного воздействия облучения (мощность дозы 4 мГр/мин) максимума не наблюдается и происходит постепенный экспоненциальный спад числа фокусов в течение суток. Необходимо отметить, что максимальная скорость деградации фокусов при всех исследованных значениях мощности дозы наблюдается в интервале между 1 и 2 ч после окончания облучения.
С целью исследовать вклад репарации ДР по механизму гомологической рекомбинации (ГР) в клетках, облученных с различными значениями мощ-
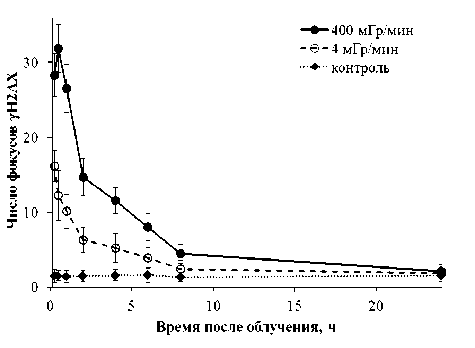
Рис. 1. Изменение числа фокусов γН2АХ в фибробластах кожи человека, облученных с высокой (400 мГр/мин) и низкой (4 мГр/мин) мощностью дозы рентгеновского излучения
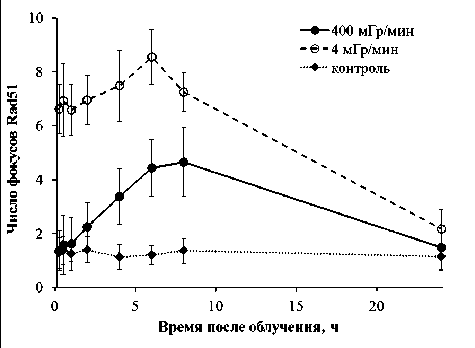
Рис. 2. Изменение числа фокусов Rad51 в фибробластах кожи человека, облученных с высокой (400 мГр/мин) и низкой (4 мГр/мин) мощностью дозы рентгеновского излучения ности дозы, были изучены кинетики образования фокусов Rad51, ключевого белка ГР (рис. 2).
Отличительной особенностью фокусов Rad51 от фокусов γН2АХ является то, что они присутствуют не во всех клетках. В случае острого режима облучения (400 мГр/мин) среднее число фокусов Rad51 в течение 1 ч было неотличимо от контрольного уровня, но через 2 ч начинало постепенно увеличиваться и достигало максимума через 6–8 ч после облучения, а затем снижалось. В случае пролонгированного режима (4 мГр/мин) число фокусов Rad51 было повышено по сравнению с контролем сразу после окончания облучения и сохранялось на высоком уровне на протяжении 8 ч. Это наблюдение может быть легко объяснено исходя из более высокой продолжительности облучения с малой мощностью дозы. Как следствие, к моменту окончания облучения начинается репарация по пути ГР тех разрывов, которые были индуцированы на начальных сроках облучения. Неожиданным, ранее не показанным результатом является увеличение числа фокусов Rad51 c уменьшением мощности дозы. На его основе можно сделать предварительный вывод о более высокой активности репарации по пути ГР в случае пролонгированного облучения по сравнению с острым.
Помимо изменения числа фокусов Rad51 при различных значениях мощности дозы облучения была проанализирована колокализация фокусов Rad51 с фокусами γН2АХ. Число колокализованных фокусов было максимальным через 4 ч после облучения. В этот момент число фокусов как γН2АХ, так и Rad51 имеет достаточную величину. Доля фокусов γН2АХ, колокализованных с фокусами Rad51, изменялась в пределах от 2 до 9% с тенденцией к увеличению при понижении мощности дозы, что отражает уже упомянутую закономерность по увеличению роли ГР с уменьшением мощности дозы. Доля фокусов Rad51 колебалась в интервале от 30 до 50% без ярко выраженной зависимости. Интересным наблюдением в данном случае является то, что далеко не все фокусы Rad51 колокализованы с фокусами γН2АХ. Это указывает на то, что процесс дефосфорилирования гистона γН2АX в области ДР может происходить до окончания его репарации по пути ГР.
Обсуждение. Полученные в работе данные свидетельствуют о том, что снижение мощности дозы облучения приводит к уменьшению количественного выхода фокусов γН2АХ в клетках в пересчете на дозу облучения. Ранее нами были получены аналогичные данные на фибробластах китайского хомяка линии V79 [7]. Этот эффект обусловлен тем, что облучение клеток при низкой мощности дозы происходит в течение длительного времени и число фокусов γН2АХ отражает результат двух одновременно текущих процессов: индукции ДР и их репарации. Следует отметить, что для дальнейшей судьбы клетки большое значение имеет корректность репарации ДР. Основными путями репарации ДР являются негомологичное соединение концов (НГСК) и ГР. Наибольший вклад в репарацию вносит относительно быстрый, но ведущий к образованию микроделеций процесс НГСК, ответственный за процессинг более чем 80% всех ДР, образованных в результате действия редко-ионизирующего излучения [8]. В отличие от НГСК, в процессе репарации ДР путем медленной, но более корректной ГР для восстановления поврежденного участка ДНК, содержащего ДР, в качестве матрицы используется неповрежденная сестринская хроматида, поэтому этот путь репарации активен только в S- и G2-фазах клеточного цикла.
Соотношение основных путей репарации, НГСК и ГР, в популяции облученных клеток является важным прогностическим параметром, который коррелирует с их радиочувствительностью. Показано, что изменение этого соотношения в опухолевых клетках может приводить к повышению их радиочувствительности [9]. По этой причине действие некоторых радиосенсибилизаторов опухолей направлено на смещение равновесия между путями репарации ДР ДНК. Кроме того, соотношение путей репарации ДР в облученных клетках коррелирует с уровнями клеточной гибели по путям апоптоза и автофагии [10]. В частности, недавно была показана корреляция между увеличением доли ГР и снижением уровня автофагии в мезенхимальных стволовых клетках, облученных малыми дозами рентгеновского излучения (40–160 мГр) [11]. Последнее особенно важно в свете подбора оптимальных режимов радиотерапии онкологических заболеваний. В этом случае необходимо максимизировать долю апоптоза и минимизировать уровень автофагии в популяции облученных раковых клеток, чтобы препятствовать возможному рецидиву за счет выживших автофагических клеток [12].
Результаты наших исследований свидетельствуют о том, что при низкой мощности дозы клетки в большей степени склонны к выбору более точного и безопасного, но и более медленного пути репарации — ГР, в то время как при остром облучении выбор делается в пользу более быстрого, хотя и повышающего риск возникновения отдаленных генетических последствий, механизма НГСК.
Заключение. В ходе работы впервые проведено одновременное исследование кинетики формирования и деградации фокусов γH2AX и ключевого белка гомологической рекомбинации Rad51 в клетках первичных фибробластов кожи человека, подвергавшихся острому и пролонгированному воздействию рентгеновского излучения с одной и той же накопленной дозой. Показано, что относительное число фокусов γH2AX в пересчете на дозу облучения убывает с уменьшением мощности дозы, в то время как относительное число фокусов Rad51, наоборот, возрастает. Полученные данные свидетельствуют о принципиальных различиях вкладов НГСК и ГР в репарацию ДР ДНК в клетках млекопитающих в зависимости от мощности дозы облучения.
Список литературы Особенности изменения числа фокусов белков уН2АХ и Rad51 в фибробластах кожи человека, подвергавшихся пролонгированному воздействию низкоинтенсивного рентгеновского излучения
- Vignard J, Mirey G, Salles B. lonizing-radiation induced DNA double-strand breaks: a direct and indirect lighting up. Ra-diother Oncol 2013; 108 (3): 362-369
- Rodriguez-Rocha H, Garcia-Garcia A, Panayiotidis M, Franco R. DNA damage and autophagy. Mutat Res 2011; 711 (1-2): 158-166
- Osipov AN, Buleeva G, Arkhangelskaya E, Klokov D. In vivo y-irradiation low dose threshold for suppression of DNA double strand breaks below the spontaneous level in mouse blood and spleen cells. Mutat Res 2013; 756 (1 -2): 141 -145
- Озеров И.В., Бушманов А.Ю., Анчишкина Н.А. и др. Индукция и репарация двунитевых разрывов ДНК в клетках линии V79 при длительном воздействии низкоинтенсивного у-излучения. Саратовский научно-медицинский журнал 2013; 9 (4): 787-791
- Kotenko KV, Bushmanov AY, Ozerov IV, et al. Changes in the number of double-strand DNA breaks in Chinese hamster V79 cells exposed to y-radiation with different dose rates. Int J Mol Sci 2013; 14 (7): 13719-13726
- Kakarougkas A, Jeggo PA. DNA DSB repair pathway choice: an orchestrated handover mechanism. Br J Radiol 2014; 87 (1035): 20130685
- Lim YC, Roberts TL, Day BW, et al. Increased sensitivity to ionizing radiation by targeting the homologous recombination pathway in glioma initiating cells. Mol Oncol 2014; 8 (8): 1603-16158.
- Bitomsky N, Hofmann TG. Apoptosis and autophagy: Regulation of apoptosis by DNA damage signalling -roles of p53, p73 and HIPK2. FEBS J 2009; 276 (21): 6074-6083
- Alessio N, Del Gaudio S, Capasso S, et al. Low dose radiation induced senescence of human mesenchymal stromal cells and impaired the autophagy process. Oncotarget 2014 Dec 11.
- Kuwahara Y, Oikawa T, Ochiai Y, et al. Enhancement of autophagy is a potential modality for tumors refractory to radiotherapy. Cell Death Dis 2011; 2: 177.


