Особенности изменения цитокинов в хронических гнойных ранах
Автор: Азизов Д.Т., Мирзаев К.К., Алейник В.А., Бабич С.М.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Основной раздел
Статья в выпуске: 11-1 (90), 2021 года.
Бесплатный доступ
Целью исследования было изучить особенности изменения содержания цитокинов в хронических гнойных ранах. В смывах послеоперационных и гнойных ран исследовали провоспалительные - интерлейкин-1бета (ИЛ-1бета), фактор некроза опухолей-α (TNF-α), и противовоспалительные - интерлейкин -10 (ИЛ-10), секреторные Ig A, а также трансформирующий фактор роста-β1 (TGF-β) методом ИФА. Получены следующие результаты: в послеоперационных ранах показатели провоспалительных интерлейкинов были ниже противовоспалительных интерлейкинов и транформирующего фактора β. В тоже время в хронических гнойных ранах отмечалось значительное увеличение провоспалительных интерлейкинов и снижение противовоспалительных интерлейкинов, а также транформирующего фактора β, по сравнению с таковыми данными послеоперационных ран. Тем самым, создается выраженное нарушение равновесия и отмечается дисбаланс цитокинов провоспалительных и противовоспалительных интерлейкинов. Это способствует снижению заживления и хронизации воспалительного процесса хронических гнойных ран.
Цитокины, чистые раны, хронические гнойные раны, провоспалительные интерлейкины, противовоспалительные интерлейкины, заживление ран, воспалительный процесс.
Короткий адрес: https://sciup.org/140261229
IDR: 140261229 | УДК: 616-001.4-002.3-08
Текст научной статьи Особенности изменения цитокинов в хронических гнойных ранах
Актуальность. Изучить роль провоспалительных и противовоспалительных цитокинов в активации или подавлении протеаз в раневой среде стремились многие исследователи. Цитокины - это небольшие белки (8-15 кДа), которые включают хемокины, колониестимулирующие факторы (CSF), интерфероны (IFN), интерлейкины (IL) и факторы некроза опухоли (TNF-a) и высвобождаются в ответ на повреждение тканей. Многие функции, выполняемые цитокинами, включают активацию фагоцитарных клеток, противовирусную и антипаразитарную активность, хемотаксис нейтрофилов и Т-клеток, рост колоний макрофагов и пролиферацию В- и Т-клеток. На отложение соединительной ткани во время процесса заживления ран может влиять TNF-a, поскольку этот цитокин влияет на синтез коллагена, матриксные металлопротеиназы ( ММП) и тканевых ингибиторов металлопротеиназ (ТИМП) [9]. Были подчеркнуты различия в уровнях провоспалительных цитокинов в раневых жидкостях между острыми и хроническими ранами человека [15].
С другой стороны, IL-1a, другой воспалительный цитокин, индуцировал продукцию как ММП, так и ТИМП [5]. Эти результаты, однако, варьировались в зависимости от источника используемых фибробластов и концентрации цитокинов, что указывает на более сложный эффект на модуляцию и регуляцию протеазы. Кроме того, [14] обнаружено, что противовоспалительный цитокин IL-10 влияет на активность ММП; Ил-10- / ' мыши продемонстрировали повышенную активность ММП, которая, в свою очередь, опосредует усиление индуцированного ишемией ангиогенеза через фактор роста эндотелия сосудов.
Помимо этого, цитокины представляют собой идеальную мишень для бактерий в преодолении иммунной системы хозяина, и было обнаружено, что ряд бактериальных протеаз способен разрушать цитокины и их рецепторы [10]. Протеазы также могут препятствовать активности ряда цитокинов, а также способны вызывать деградацию цитокинов [13]. Протеазы некоторых граммположительнх бактерий, также могут влиять на активность цитокинов, расщеплять предшественник IL-1 с получением биологически активного IL-1, являющегося медиатором воспаления [6]. Было обнаружено, что ряд протеаз разрушает IL-8 [7] . Учитывая, что IL-8 опосредует миграцию и активацию нейтрофилов, это может быть вредным для иммунного ответа хозяина. Протеазы, граммположительных бактерий, также могут нарушать функцию IL-8. Сериновые протеазы бактерий могут модулировать синтез IL-8 [11]
Кроме того функция бактериальных протеаз в преодолении иммунной системы хозяина заключается в деградации иммуноглобулинов хозяина [13]. Это может быть особенно вредным для хозяина, учитывая роль иммуноглобулинов в распознавании и способствовании нейтрализации вторгающихся микроорганизмов [1].
В совокупности все эти данные подчеркивают сложную природу регуляции и модуляции цитокинов и протеаз в раневой среде, что подчеркивает необходимость продолжения исследований с целью их терапевтической коррекции.
Цель исследования: изучить особенности изменения содержания цитокинов в хронических гнойных ранах.
Материал и методы. В работе были обследованы в первой группе 12 больных с послеоперационными ранами (контроль) и во второй группе 15 больных с гнойными ранами (опыт). У всех больных в диагнозе отсутствовали сердечно-сосудистые заболевания, диабет и метаболические изменения. Материал для исследования получали путем сбора смывов стерильным физиологическим раствором с поверхности послеоперационных и гнойных ран.
В составе смывов послеоперационных и гнойных ран исследовали провоспалительные - интерлейкин-1бета (ИЛ-1бета), фактор некроза опухолей-α (TNF-α), и противовоспалительных - интерлейкин -10 (ИЛ-10), методом ИФА с применением тест-систем ЗАО “Вектор-Бест”, а также трансформирующего фактора роста-β1 (TGF-β) методом ИФА с использованием тест-систем «DRG» Германия.
Полученные данные подвергались статистической обработке с использованием стандартных программ Microsoft Excel 2007 c вычислением средних величин (М), их ошибок (m), а также коэффициента достоверности разности средних величин Стьюдента-Фишера (t).
Результаты и их обсуждение. Проведенные исследования выявили, что средний показатель провоспалительного интерлейкина TNF-α в составе смывов послеоперационных ран (контрольной группы) составлял 15,7 ± 1,2 пг/мл, при этом в составе смывов гнойных ран (опытной группы) этот показатель находился на уровне 58,4 ± 5,4 пг/мл (Р<0,01). Эти результаты показывают, что исследования показателей TNF-α в составе смывов гнойных ран значительно и достоверно были выше аналогичных данных послеоперационных ран (Рис.). В тоже время результат исследования провоспалительного интерлейкина ИЛ-1 в составе смывов послеоперационных ран составлял 31,6 ± 2,8 пг/мл, а в составе смывов гнойных ран был равен 112,1 ± 10,4 пг/мл (Р<0,01). Этот результат так же был достоверно выше подобного показателя послеоперационных ран. Кроме того динамика изменения этого показателя была схожа с изменением сравнительных результатов TNF-α послеоперационных ран и гнойных ран (Рис.).
Помимо этого исследования противовоспалительного ИЛ-10 выявили, что средний показатель этого интерлейкина в составе смывов послеоперационных ран составлял 44,2 ± 4,1 пг/мл, а этот же показатель в составе смывов гнойных ран имел значения равные 31,9 ± 2,9 пг/мл (Р<0,05). Результаты этих исследований также демонстрируют, что показатели исследования ИЛ-10 в составе смывов гнойных ран, по сравнению с провоспалительными интерлейкинами имел обратную зависимость между послеоперационными и гнойными ранами находились достоверно ниже
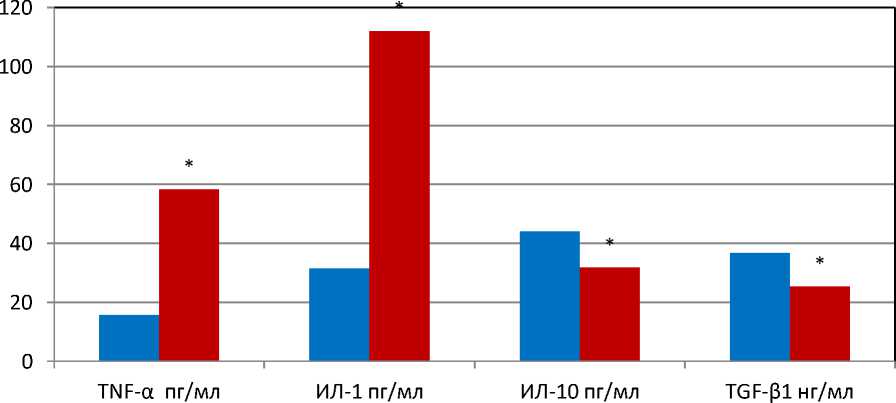
■ Послеоперационные раны ■ Гнойные раны
Рисунок. Изменение показателей TGF-β1, провоспалительных (TNF-α, ИЛ-1бета) и противовоспалительных (ИЛ-10) интерлейкинов смывов послеоперационных и гнойных ран.
* - достоверно отличающиеся величины относительно показателей послеоперационных ран.
подобных результатов послеоперационных ран (Рис.). Исследование TGF-β имеет важное значение, так как этот цитокин является регулятором провоспалительных и противовоспалительных интерлейкинов. В результате исследования этого цитокина было установлено, что в составе смывов послеоперационных ран он составлял 36,8 ± 3,2 нг/мл. В тоже время этот же показатель в составе смывов гнойных ран был равен 25,5 ± 2,3 нг/мл (Р<0,01). Из полученных данных исследования TGF-β можно заключить, что этот показатель так же был достоверно ниже подобного показателя послеоперационных ран. Кроме того динамика изменения этого результата была похожа изменению сравнительных результатов противовоспалительного ИЛ-10 интерлейкинов послеоперационных и гнойных ран (Рис.).
В целом полученные данные демонстрируют значительно выраженное увеличение провоспалительных интерлейкинов (ИЛ-1, TNF-α) в составе смывов хронических гнойных ран по сравнению с послеоперационными ранами и достоверное снижение противовоспалительного интерлейкина (ИЛ-10), а также трансформирующего фактора роста-β1 (TGF-β1).
Все это показывает, что большие количества IL-1β и TNF-α вызывают сильную продукцию хемокинов, что, в свою очередь, способствует массивной инфильтрации иммунных клеток, в частности нейтрофильных гранулоцитов. В конечном итоге это приводит к гнойным выделениям, клиническому ключевому признаку хронического гнойного воспаления. Кроме того, IL-1β и TNF-α усиливают секрецию ряда ферментов, разрушающих матрикс, что не только дополнительно поддерживает инфильтрацию тканевых иммунных клеток, но также способствует разрушению тканей, еще одной важной особенности хронического воспалительного заболевания. Локально продуцируемые IL-1β и IL-6 также, по-видимому, достигают кровотока и индуцируют продукцию сывороточного амилоида печенью, что отражается в заметно повышенных уровнях этого медиатора острой фазы в крови. Повышенные уровни IL-1β, TNF-α и сывороточного амилоида в крови являются признаком системного воспаления, которое часто может наблюдаться клинически у пациентов с хроническим воспалительным заболеванием [4].
Было показано, что лечение антителами против TNF-α подавляло избыточное воспаление и увеличивало образование грануляционной ткани, что приводило к ускорению заживления ран. Кроме того, системное введение нейтрализующих антител против TNF-α подавляло образование грануляционной ткани и замедляло заживление ран. Это указывает на то, что эффекты полной потери TNF-α в результате удаления гена и частичной инактивации цитокина нейтрализующим антителом на процесс заживления кожного повреждения различаются. Аналогичное несоответствие было зарегистрировано в других тканях. [2, 8].
Известно, что IL-10 ингибирует инфильтрацию нейтрофилов и макрофагов к месту повреждения. IL-10 также подавляет сверх экспрессию
CC-хемокинов (моноцитарный хемоаттрактантный белок-1, макрофагальный воспалительный белок-1α) и провоспалительных цитокинов (IL-1β, IL-6, TNF -α) in vivo. Предполагают, что IL-10 может играть важную регулирующую роль в фазовой инфильтрации нейтрофилов и макрофагов, а также в продукции цитокинов при воспалительной реакции заживления кожных ран [12]. Поэтому на основании полученных нами данных, уменьшение IL-10 в составе смывов хронических гнойных ран по сравнению с послеоперационными ранами может являться снижением конкурирующего влияния его на провоспалительные интерлейкины.
TGF-β синтезируют нейтрофилы, это важно для регуляции гуморального и врожденного иммунитета, включая стимуляцию макрофагов и лимфоцитов. Макрофаги продуцируют цитокины, факторы роста и ангиогенные факторы, которые регулируют пролиферацию фибробластов и ангиогенез. Макрофаги также продуцируют IL-1α, IL-1β, IL-6, IL-12 и TNF-α, которые важны для усиления воспаления, и стимулируют хемокины, которые вызывают рекрутирование лейкоцитов и стволовых клеток. Уменьшение экспрессии TGF-β1, снижение миграции и пролиферации кератиноцитов и усиление апоптоза кератиноцитов, что приводит к нарушению реэпителизации ран. TGF-β также привлекает макрофагов и фибробластов к участкам раны для улучшения заживления [3]. На основании этих данных можно предположить, что снижение TGF-β1 в хронических гнойных ранах может способствовать снижению привлечения макрофагов и фибробластов к участкам раны и тем самым ухудшению заживления хронических гнойных ран.
Выводы. В послеоперационных ранах показатели провоспалительных интерлейкинов были ниже противовоспалительных интерлейкинов и транформирующего фактора β. В тоже время в хронических гнойных ранах отмечалось значительное увеличение провоспалительных интерлейкинов и снижение противовоспалительных интерлейкинов, а также транформирующего фактора β, по сравнению с таковыми данными послеоперационных ран. Тем самым, создается выраженное нарушение равновесия и отмечается дисбаланс цитокинов провоспалительных и противовоспалительных интерлейкинов. Это способствует снижению заживления и хронизации воспалительного процесса хронических гнойных ран.
Список литературы Особенности изменения цитокинов в хронических гнойных ранах
- Engel, L. S., Hill, J. M., Caballero, A. R., Green, L. C., & O'Callaghan, R. J. Protease IV, a unique extracellular protease and virulence factor from Pseudomonas aeruginosa //Journal of Biological Chemistry. – 1998. – Т. 273. – №. 27. – С. 16792-16797.
- Fujita, M., Shannon, J. M., Morikawa, O., Gauldie, J., Hara, N., & Mason, R. J. Overexpression of tumor necrosis factor-α diminishes pulmonary fibrosis induced by bleomycin or transforming growth factor-β //American journal of respiratory cell and molecular biology. – 2003. – Т. 29. – №. 6. – С. 669-676.
- Hameedaldeen, A., Liu, J., Batres, A., Graves, G. S., & Graves, D. T. FOXO1, TGF-β regulation and wound healing //International journal of molecular sciences. – 2014. – Т. 15. – №. 9. – С. 16257-16269
- Hessam, S., Sand, M., Gambichler, T., & Bechara, F. G. Correlation of inflammatory serum markers with disease severity in patients with hidradenitis suppurativa (HS) //Journal of the American Academy of Dermatology. – 2015. – Т. 73. – №. 6. – С. 998-1005.
- Ito, A., Sato, T., Iga, T., & Mori, Y. Tumor necrosis factor bifunctionally regulates matrix metalloproteinases and tissue inhibitor of metalloproteinases TIMP) production by human fibroblasts //FEBS letters. – 1990. – Т. 269. – №. 1. – С. 93-95.
- Kapur, V., Topouzis, S., Majesky, M. W., Li, L. L., Hamrick, M. R., Hamill, R. J., ... & Musser, J. M. A conserved Streptococcus pyogenes extracellular cysteine protease cleaves human fibronectin and degrades vitronectin //Microbial pathogenesis. – 1993. – Т. 15. – №. 5. – С. 327-346.
- Koziel J., Potempa J. Protease-armed bacteria in the skin //Cell and tissue research. – 2013. – Т. 351. – №. 2. – С. 325-337.
- Kuroki, M., Noguchi, Y., Shimono, M., Tomono, K., Tashiro, T., Obata, Y., ... & Kohno, S. Repression of bleomycin-induced pneumopathy by TNF //The Journal of Immunology. – 2003. – Т. 170. – №. 1. – С. 567-574.
- Mast B. A., Schultz G. S. Interactions of cytokines, growth factors, and proteases in acute and chronic wounds //Wound Repair and Regeneration. – 1996. – Т. 4. – №. 4. – С. 411-420.
- Potempa J., Pike R. N. Corruption of innate immunity by bacterial proteases //Journal of innate immunity. – 2009. – Т. 1. – №. 2. – С. 70-87.
- Rudack, C., Sachse, F., Albert, N., Becker, K., & von Eiff, C. Immunomodulation of nasal epithelial cells by Staphylococcus aureus-derived serine proteases //The Journal of Immunology. – 2009. – Т. 183. – №. 11. – С. 7592-7601.
- Sato Y., Ohshima T., Kondo T. Regulatory role of endogenous interleukin-10 in cutaneous inflammatory response of murine wound healing //Biochemical and biophysical research communications. – 1999. – Т. 265. – №. 1. – С. 194- 199.
- Schmidtchen A., Wolff H., Hansson C. Differential proteinase expression by Pseudomonas aeruginosa derived from chronic leg ulcers //ACTA DERMATOVENEREOLOGICA-STOCKHOLM-. – 2001. – Т. 81. – №. 6. – С. 406-40.
- Silvestre, J. S., Mallat, Z., Tamarat, R., Duriez, M., Tedgui, A., & Levy, B. I. Regulation of matrix metalloproteinase activity in ischemic tissue by interleukin-10: role in ischemia-induced angiogenesis //Circulation research. – 2001. – Т. 89. – №. 3. – С. 259-264.
- Tarnuzzer R. W., Schultz G. S. Biochemical analysis of acute and chronic wound environments //Wound Repair and Regeneration. – 1996. – Т. 4. – №. 3. – С. 321-325.


