Особенности изменения содержания протеаз и ингибиторов протеаз в хронических гнойных ранах
Автор: Азизов Д.Т., Мирзаев К.К., Алейник В.А., Бабич С.М.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Основной раздел
Статья в выпуске: 11-1 (90), 2021 года.
Бесплатный доступ
В работе изучались особенности изменения содержания протеаз и ингибиторов протеаз в хронических гнойных ранах. Сделано заключение, что в послеоперационных ранах, показатели общей протеолитической активности и антипротеолитической активности существенно не отличаются, имеется равновесие между протеазами и ингибиторами протеаз, которое предположительно может регулироваться местными механизмами. В хронических гнойных ранах общая протеолитическая активность значительно выше этого же показателя послеоперационных ран. При этом антипротеолитическая активность значительно ниже общей протеолитической активности, а также ниже антипротеолитической активности послеоперационных ран, что создает выраженное нарушение равновесия между протеазами и ингибиторами протеаз и способствует хронизации воспалительного процесса в гнойных ранах с подключением, как местных, так и системных механизмов регуляции.
Протеазы, ингибиторы протеаз, послеоперационные раны, хронические гнойные раны, протеолитическая активность, антипротеолитическая активность.
Короткий адрес: https://sciup.org/140261228
IDR: 140261228 | УДК: 616-001.4-002.3-08
Текст научной статьи Особенности изменения содержания протеаз и ингибиторов протеаз в хронических гнойных ранах
Актуальность. Помимо клинических признаков инфекции (например, воспаления, гнойности и боли), для определения раневой инфекции исторически использовалось количество микроорганизмов. Однако все чаще признается, что не только высокий уровень бионагрузки вреден для заживления ран, но и вирулентность вторгающегося микроорганизма и иммунный статус хозяина могут повлиять на клинические исходы. Бактерии, такие как синегнойная палочка, золотистый стафилококк и эпидермальный стафилококк, разработали ряд факторов вирулентности, которые помогают им преодолевать защиту хозяина и размножаться в подлежащих мягких тканях. Более конкретно, бактериальные протеазы являются одним из таких факторов вирулентности, которые участвуют в стимулировании инвазии и разрушения ткани хозяина. Из-за сложности микроорганизмов протеазы могут негативно влиять на раневую среду, что приводит к замедленному заживлению ран. Полученные данные свидетельствуют о том, что протеазы могут играть важную роль в раневых инфекциях, способствовать развитию воспалительной реакции и препятствовать заживлению ран [11].
Бактериальные протеазы, способствуют индукции воспалительной реакции у хозяина. Было обнаружено, что протеазы, продуцируемые бактериями, активируют кининовую систему и разлагают кининогены, что впоследствии вызывает воспалительную реакцию в виде отека, покраснения и боли [ 9 ].
Подобно другим иммунологическим факторам, бактериальные протеазы также могут препятствовать фагоцитозу [7], способствуют снижению активности лейкоцитов [6] , ингибированию функции нейтрофилов и препятствию хемотаксиса [8] .
Бактериальные протеазы могут разрушать ряд биологически важных белков-хозяев, таких как компоненты комплемента C3 и C1q [4] , также предотвращать образование C5 путем разрушения C3 [10]. За счет чего нарушается опсонизация и фагоцитоз нейтрофилов, затрудняется или даже предотвращается [15].
Функция бактериальных протеаз в преодолении иммунной системы хозяина заключается в деградации иммуноглобулина хозяина [16] . Это может быть особенно вредным для хозяина, учитывая роль иммуноглобулинов в распознавании и способствовании нейтрализации вторгающихся микроорганизмов. Различные исследователи сообщили о влиянии протеаз на деградацию иммуноглобулинов, в том числе иммуноглобулина A (IgA) и иммуноглобулина G (IgG) [4].
Протеазы и их ингибиторы способствуют балансу между деградацией и отложением внеклеточного матрикса (ВКМ), создавая равновесие, необходимое для своевременного и скоординированного заживления кожных ран. Однако, когда этот баланс нарушается, раны переходят в хроническое состояние, характеризующееся обильным уровнем протеаз и пониженным уровнем ингибиторов протеаз [13].
Соотношения протеаз и их ингибиторов также использовались в качестве прогностических маркеров прогрессирования раны к заживлению. [14].
Многими исследователями подчеркивается ключевая роль протеаз в заживлении ран. Поэтому необходим контроль экспрессии протеаз в раневой среде и способов, которыми чрезмерная экспрессия и активация протеаз может привести к задержке процесса заживления кожных ран. Будущие исследования должны быть нацелены на изучение способов, с помощью которых протеазы могут быть нацелены в качестве альтернативного терапевтического подхода к лечению ран, а также для оценки преимуществ и недостатков использования раневых жидкостей для оценки прогрессирования раны с точки зрения протеолитической активности [13].
Цель исследования: изучить особенности изменения содержания протеаз и ингибиторов протеаз в хронических гнойных ранах.
Материал и методы. В работе были обследованы в первой группе 12 больных с послеоперационными ранами (контроль) и во второй группе 15 больных с гнойными ранами (опыт). У всех больных в диагнозе отсутствовали сердечнососудистые заболевания, диабет и метаболические изменения. Материал для исследования получали путем сбора смывов стерильным физиологическим раствором с поверхности послеоперационных и гнойных ран.
Общую протеолитическую активность в составе смывов определяли казеинолитическим методом по учету продуктов гидролиза казеина в единицах активности (Ед) по тирозину. Ингибиторную (анти-протеолитическую) активность полученных смывов определяли казеинолитическим тестом, по способности убывания активности 0,01% трипсина и 0,01% папаина, при инкубации их с исследуемыми образцами смывов по сравнению с образцами смывов с трипсином или папаином без инкубации. Ингибиторную активность выражали в ингибиторных единицах (ИЕд).
С целью степени выраженности протеолиза в ранах рассчитывался индекс протеолиза - соотношения протеолитической активности к антипротеолитической активности (ОПА/АПА).
Полученные данные подвергались статистической обработке с использованием стандартных программ Microsoft Excel 2007 c вычислением средних величин (М), их ошибок (m), а также коэффициента достоверности разности средних величин Стьюдента-Фишера (t).
Результаты и их обсуждение. Полученные данные показали (Рис.), что у пациентов с послеоперационными ранами средний показатель ОПА в составе смывов составлял 31,7±2,8 Ед/мл. В тоже время у больных с гнойными ранами этот показатель был достоверно выше, по сравнению с аналогичными результатами послеоперационных ран, и составлял 52,4±4,8 Ед/мл (Р<0,01). При этом показатель антипротеолитической активности
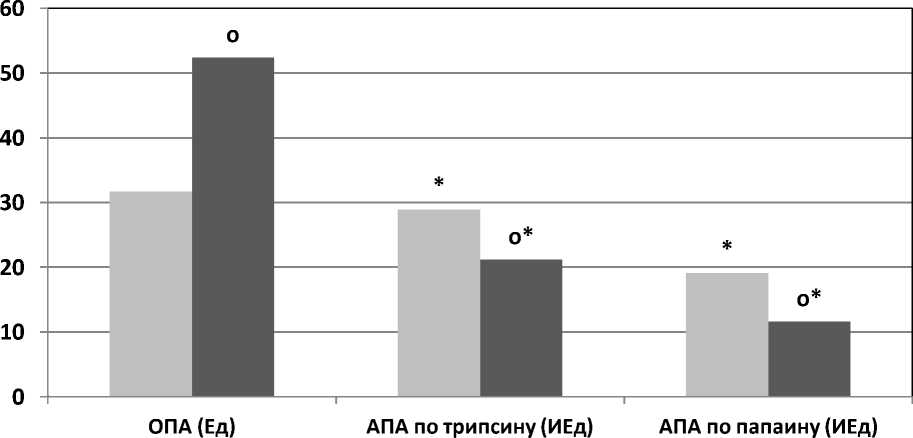
-
■ Послеоперационные раны ■ Гнойные раны
Рисунок. Изменение показателей общей протеолитической активности (ОПА) и антипротеолитической активности (АПА) смывов послеоперационных и гнойных ран.
-
* - достоверно отличающиеся величины относительно показателей ОПА гнойных ран.
о - достоверно отличающиеся величины относительно соответствующих показателей ОПА послеоперационных ран.
по трипсину в составе смывов послеоперационных ран составлял
28,9±2,5 ИЕд/мл, что было не существенно ниже ОПА в смывах послеоперационных ран, а индекс протеолиза ОПА/АПА по трипсину был также не существенно выше и равен 1,1±0,1. У больных с гнойными ранами показатель антипротеолитической активности по трипсину был достоверно ниже по сравнению с аналогичными результатами больных с послеоперационными ранами и составлял 21,2±1,9 ИЕд/мл (Р<0,05), , а также значительно ниже ОПА смывов гнойных ран. С учетом этих данных индекс протеолиза ОПА/АПА по трипсину находился на уровне 2,5±0,22, что было значительно выше такого же показателя в составе смывов послеоперационных ран. Результат антипротеолитической активности по папаину в составе смывов послеоперационных ран составлял 19,1±1,5 ИЕд/мл, этот показатель был значительно меньше антипротеолитической активности по трипсину, в связи с более низким содержанием ингибиторов протеаз связывающихся с папаином. По этой же причине увеличивался индекс протеолиза ОПА/АПА по папаину и был равен 2,7±0,24. В тоже время у больных с гнойными ранами антипротеолитическая активность по папаину была также значительно ниже антипротеолитической активности по трипсину и составляла 11,6±0,9 ИЕд/мл (Р<0,05), также это проявляется с более низким содержанием ингибиторов протеаз связывающихся с папаином. При этом индекс протеолиза ОПА/АПА при исследовании гнойных ран по папаину был равен 4,5, что было выше индекса протеолиза послеоперационных ран.
Предполагается, что трипсиноподобные сериновые протеазы в раневой среде связываются преимущественно с двумя ингибиторами a1 -ингибитором протеиназ (a1ИП) и a2-макроглобулином (a2М) — принципиально различным образом. Первый полностью инактивирует каталитическую функцию протеаз, а второй лишь ограничивает их способность расщеплять большинство высокомолекулярных субстратов. Кроме того, константа скорости реакции таких протеаз с a2М в 6 раз выше таковой с a1ИП, при этом образуется активный комплекс, способный гидролизовать специфические субстраты, что позволяет большей части поступающих в раневую среду энзимов связываться с a2М. Следует подчеркнуть, что цистеиновые протеиназы (папаин), в отличие от сериновых протеаз, связываются в основном с a2М, а a1ИП не играет существенной роли в блокировании активности протеиназ. Эти данные позволили сделать вывод о том, что сериновые и цистеиновые протеиназы, могу осуществлять свою функцию в связанном с a2М состоянии [1].
Ингибирующая способность трипсина может проявляться существенно за счет низкомолекулярных ингибиторов присутствующих в составе раневого смыва и альфа-1-антитрипсина, а ингибирующая способность папаина за счет высокомолекулярных ингибиторов альфа -1-антитрипсина и альфа 2-макроглобулина. Если учесть, что низкомолекулярным ингибитором, присутствующим в составе раневого смыва может являться секреторный лейкоцитарный ингибитор протеазы, который локально обеспечивает защиту и обладает выраженной противовоспалительной, антибактериальной и противогрибковой активностью. Тогда снижение ингибирующей активности по трипсину в смыве с выраженными проявлениями воспаления можно объяснить, как выраженную провоспалительную и микробную реакцию, проявляющуюся так же увеличением ОПА за счет снижения этого ингибитора. Увеличение ОПА в составе раневых смывов возможно так же связано с увеличением функциональной активности клеток продуцентов протеаз за счет хронического воспалительного процесса [2, 3].
Что касается ингибирующей способности папаина за счет высокомолекулярных ингибиторов в составе раневых смывов, то основными высокомолекулярными ингибиторами папаина могут являться альфа-1-антитрипсин и альфа 2-макроглобулин, которые вырабатываются печенью и осуществляют тормозное действие на протеазы во всех органах и тканях организма [2, 3]. Поэтому снижение ингибирующей способности папаина в составе раневых смывов можно расценивать как проявление системного характера на воспаление или, возможно, на степень хронизации воспалительного процесса.
Исходя из этого, полученные нами данные антипротеолитической активности по папаину и трипсину можно интерпретировать, следующим образом. В послеоперационных ранах, без выраженных проявлений воспаления, имеется равновесие между протеазами и ингибиторами протеаз, которое регулируется в большей степени местными механизмами. В тоже время в хронических гнойных ранах с выраженным воспалительным процессом, нарушено равновесие между протеазами и ингибиторами протеаз, за счет нарушения местных и системных механизмов.
Выводы. В послеоперационных ранах, показатели общей протеолитической активности и антипротеолитической активности существенно не отличаются, имеется равновесие между протеазами и ингибиторами протеаз, которое предположительно может регулироваться местными механизмами. В хронических гнойных ранах общая протеолитическая активность значительно выше этого же показателя послеоперационных ран. При этом антипротеолитическая активность значительно ниже общей протеолитической активности, а также ниже антипротеолитической активности послеоперационных ран, что создает выраженное нарушение равновесия между протеазами и ингибиторами протеаз и способствует хронизации воспалительного процесса в гнойных ранах с подключением, как местных, так и системных механизмов регуляции.
Список литературы Особенности изменения содержания протеаз и ингибиторов протеаз в хронических гнойных ранах
- Веремеенко К. Н., Кизим А. И., Досенко В. Е. a2-макроглобулин: структура, физиологическая роль и клиническое значение// Лаб. диагностика 2000, № 2, С. 3–9.
- Колесникова Е. В. Альфа-1-антитрипсиновая недостаточность: Современный взгляд на проблему //Сучасна гастроентерологія. – 2008. – Т. 2. – №. 40. – С. 93-98.
- Doumas S., Kolokotronis A., Stefanopoulos P. Anti-inflammatory and antimicrobial roles of secretory leukocyte protease inhibitor //Infection and immunity. – 2005. – Т. 73. – №. 3. – С. 1271-1274.
- Engel LS, Hill JM, Caballero AR, Green LC, O'Callaghan RJ. Protease IV, a unique extracellular protease and virulence factor from Pseudomonas aeruginosa. Journal of Biological Chemistry. 1998 Jul 3;273(27):16792-7.
- Engel LS, Hill JM, Moreau JM, Green LC, Hobden JA, O'Callaghan RJ. Pseudomonas aeruginosa protease IV produces corneal damage and contributes to bacterial virulence. Investigative ophthalmology & visual science. 1998 Mar 1;39(3):662-5.
- Hoge R, Pelzer A, Rosenau F, Wilhelm S. Weapons of a pathogen: proteases and their role in virulence of Pseudomonas aeruginosa. Current research, technology and education topics in applied microbiology and microbial biotechnology. 2010;2:383-95.
- Kharazmi A, Eriksen HO, Döring G, Goldstein W, Høiby N. Effect of Pseudomonas aeruginosa proteases on human leukocyte phagocytosis and bactericidal activity. Acta Pathologica Microbiologica Scandinavica Series C: Immunology. 1986 Nov;94(1‐6):175-9.
- Kharazmi A, Høiby N, Döring G, Valerius NH. Pseudomonas aeruginosa exoproteases inhibit human neutrophil chemiluminescence. Infection and immunity. 1984 Jun 1;44(3):587-91.
- Koziel J, Potempa J. Protease-armed bacteria in the skin. Cell and tissue research. 2013 Feb;351(2):325-37.
- Kuo CF, Lin YS, Chuang WJ, Wu JJ, Tsao N. Degradation of complement 3 by streptococcal pyrogenic exotoxin B inhibits complement activation and neutrophil opsonophagocytosis. Infection and immunity. 2008 Mar 1;76(3):1163-9.
- Lindsay S., Oates A., Bourdillon K. The detrimental impact of extracellular bacterial proteases on wound healing //International wound journal. – 2017. – Т. 4. – №. 6. – С. 1237-1247.
- McCarty S. M., Percival S. L. Proteases and delayed wound healing //Advances in wound care. – 2013. – Т. 2. – №. 8. – С. 438-447.
- McCarty S. M., Percival S. L. Proteases and delayed wound healing //Advances in wound care. – 2013. – Т. 2. – №. 8. – С. 438-447.
- Muller, M., Trocme, C., Lardy, B., Morel, F., Halimi, S., & Benhamou, P. Y. Matrix metalloproteinases and diabetic foot ulcers: the ratio of MMP‐1 to TIMP‐1 is a predictor of wound healing //Diabetic Medicine. – 2008. – Т. 25. – №. 4. – С. 419-426.
- Potempa J, Pike RN. Corruption of innate immunity by bacterial proteases. Journal of innate immunity. 2009;1(2):70-87.
- Schmidtchen A, Wolff H, Hansson C. Differential proteinase expression by Pseudomonas aeruginosa derived from chronic leg ulcers. Acta Dermatovenereologica-Stockholm-. 2001 Nov 1; 81(6) : 406-9.


