Особенности экспрессии цистеиновых катепсинов B/K/L/S/V/Z в биопротезах клапанов сердца, эксплантированных по причине дисфункции
Автор: Костюнин А. Е., Глушкова Т. В., Богданов Л. А., Кутихин А. Г., Овчаренко Е. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Обоснование. Биопротезы клапанов сердца (БП) подвержены протеолитической деградации в организме реципиентов, приводящей к развитию дисфункций этих медицинских изделий. Ранее было установлено, что в тканях функционирующих БП накапливаются агрессивные коллагеназы и эластазы семейства цистеиновых катепсинов, но пути их поступления в биоматериал остались неисследованными.Цель: изучить паттерны локализации катепсинов B/K/L/S/V/Z в створках БП и выявить пути их поступления в биоткань.Материал и методы. Нами изучено 5 БП, эксплантированных из митральной позиции при репротезировании клапанов. Средний срок функционирования БП составил 169 ± 31 мес. Посредством криотома готовили серийные срезы створок, отбирая сегменты с дегенеративными изменениями. В целях анализа состава и структуры биоматериала срезы окрашивали пентахромом по Расселу - Мовату. Для типирования инфильтрирующих БП клеток и детекции протеаз применяли иммуногистохимический метод, используя антитела к лейкоцитарным маркерам (CD3/19/45/68 и нейтрофильной миелопероксидазе) и катепсинам B/K/L/S/V/Z.Результаты. При макроскопическом изучении эксплантированных БП выявлены дегенеративные изменения в створчатом аппарате, представленные разрывами и макрокальцификацией. В ходе микроскопического анализа створок отмечены признаки разрыхления и фрагментации коллагеновых волокон в поверхностных слоях, а также отсутствие эластических волокон и мукополисахаридов. На участках с дегенеративными изменениями присутствовали макрофагальные инфильтраты. Положительное окрашивание на катепсин B отмечено только в цитоплазме макрофагов. Окрашивание на катепсины K/L/S/V/Z наблюдали и в солокализации с иммунными клетками, и в бесклеточной ткани.Заключение. Макрофаги, формирующие плотные инфильтраты в створках БП, производят все виды изученных катепсинов. Также катепсины K/L/S/V/Z обнаружены в бесклеточных участках ткани, что указывает на имбибицию этих протеаз из плазмы крови.
Биопротезы клапанов сердца, протеолитические ферменты, протеолиз, цистеиновые катепсины, структурная дегенерация клапана
Короткий адрес: https://sciup.org/149142831
IDR: 149142831 | УДК: 616.126-008.6-089.843-77:577.218 | DOI: 10.29001/2073-8552-2023-38-2-166-173
Текст научной статьи Особенности экспрессии цистеиновых катепсинов B/K/L/S/V/Z в биопротезах клапанов сердца, эксплантированных по причине дисфункции
the study was funded by the Russian Science Foundation, grant number 21-75-10107 “A multidisciplinary approach to the prevention of proteolytic degradation of epoxy-treated tissue heart valve prostheses” (Alexander Kostyunin) .
В последние десятилетия при протезировании несостоятельных клапанов сердца все чаще используют биологические протезы (БП), что обусловлено их специфическими преимуществами перед механическими аналогами [1–3]. Так, ввиду низкой тромбогенности БП, имплантация этих медицинских изделий не требует от реципиентов пожизненной антикоагулянтной терапии [4]. Вместе с тем БП недолговечны: согласно статистике от 20 до 50% имплантатов требуют замены через 15 лет функционирования [5] по причине структурной дегенерации (СД) биоматериала [6, 7].
Анализ современной литературы показывает, что за развитием СД стоит несколько синергически действующих механизмов [8, 9]. Одним из них является протеолитическая деградация БП, происходящая при участии протеаз, которые секретируются иммунными клетками или поступают в биоматериал из плазмы крови реципиента [10, 11].
Недавно нашей группой был произведен скрининговый анализ биоткани эксплантированных по причине дисфункций БП на предмет присутствия протеаз, распространенных в нативных тканях организма человека [12]. Результаты полуколичественной оценки продемонстрировали, что в створках БП содержатся высокие концентрации агрессивных коллагеназ и эластаз из семейства цистеиновых катепсинов, включая катепсины B/L/S/V/Z [12]. При этом пути их накопления в БП остались неизученными.
Важно подчеркнуть, что выявление источников агрессивных соединений, поступающих в биоматериал имплантатов, является первым шагом к разработке методов снижения темпов СД и повышения долговечности БП.
Цель работы: изучение паттернов локализации цистеиновых катепсинов B/K/L/S/V/Z в створках БП для определения источников этих протеаз.
Материал и методы
Материалом для настоящего исследования послужили 5 ксеноаортальных БП моделей «КемКор» и «ПериКор» (ЗАО «НеоКор»), ранее изученных нашей группой посредством дот-блоттинга [12]. Створчатый аппарат указанных моделей БП изготовлен из аортального комплекса свиньи, а обшивка каркаса представлена полиэфирной тканью или перикардом теленка соответственно. БП были иссечены из митральной позиции при репротезировании, средний срок их функционирования составил 169 ± 31 мес., средний возраст реципиентов на момент повторного вмешательства – 62 ± 10,5 лет. Во всех случаях клиническим показанием к первичному протезированию стала тяжелая митральная регургитация, замене БП – протезная недостаточность. Дополнительные клинические сведения о БП и их реципиентах приведены в таблице.
Таблица. Клиническая характеристика изученных биологических протезов клапанов сердца и их реципиентов
Table. Clinical characteristics of bioprosthetic heart valves and their recipients
|
Case 1 2 3 4 Клиническая характеристика пациентов Clinical characteristics of patients |
5 |
||||
|
Пол Gender |
Муж. Male |
Муж. Male |
Муж. Male |
Жен. Female |
Жен. Female |
|
Возраст при первичном протезировании, лет Age at primary valve replacement, years |
58 |
54 |
50 |
33 |
44 |
|
Возраст при повторном протезировании, лет Age at repeated valve replacement, years |
70 |
68 |
69 |
46 |
56 |
|
Артериальная гипертензия Arterial hypertension |
+ |
+ |
– |
+ |
+ |
|
Избыточный вес Overweight |
+ |
+ |
– |
+ |
+ |
|
Дислипедемия Dyslipidemia |
– |
– |
+ |
– |
– |
|
Сахарный диабет Diabetes mellitus |
+ |
– |
+ |
– |
– |
|
Клиническая характеристика биопротезов Clinical characteristics of bioprosthetic heart valves |
|||||
|
Срок функционирования, мес. Lifespan, months |
143 |
169 |
221 |
162 |
148 |
|
Недостаточность клапана Regurgitation |
+ |
+ |
+ |
+ |
+ |
|
Стеноз клапана Stenosis |
– |
– |
– |
– |
+ |
Иссеченные БП помещали в 0,9% раствор натрия хлорида и в течение 15 мин доставляли в лабораторию, где производили фотофиксацию и визуальную оценку дегенеративных изменений створчатого аппарата. После этого БП готовили к микроскопическому исследованию.
Для этого створки БП отделяли от каркаса и иссекали сегменты ткани с признаками дегенерации (разрывами или кальцификацией). Фрагменты створок помещали в криогель Neg-50 (Thermo Scientific) и с помощью криотома Microm HM 525 (Thermo Scientific) готовили серийные срезы толщиной 6 мкм, фиксируя их на предметные стекла.
Всего в ходе исследования нами изучено более 20 фрагментов ткани, взятых от 12 створок БП. В качестве группы сравнения и отрицательного контроля использовали створки интактного БП.
Для изучения состава и структуры ткани створок экс-плантированных БП применяли пентахромное окрашивание по Расселу – Мовату, используя коммерческий набор реактивов (ab245884, Abcam) в соответствии с протоколом производителя. Типирование клеток и детекцию протеаз осуществляли иммуногистохимическим методом с помощью набора NovoLink Polimer DS (RE7150-CE, Leica Biosystems) и антител к пан-лейкоцитарному маркёру CD45 (ab10558, Abcam, в разведении 1 : 4000), нейтрофильной миелопероксидазе (MPO) (ab208670, Abcam, 1 : 8000), маркеру макрофагов CD68 (ab227458, Abcam, 1 : 500), T-лимфоцитов CD3 (ab16669, Abcam, 1:1000), B-лимфоцитов CD19 (MA5-32544, Invitrogen, 1 : 1000), катепсину B (NBP2-67215, Novus, 1:100), K (PAA267Hu01, Cloud-Clone Corp., 1 : 500), L (PAA306Hu01, Cloud-Clone Corp., 1 : 500), S (PAB933Hu01, Cloud-Clone Corp., 1 : 1000), V (PAC970Hu01, Cloud-Clone Corp., 1 : 500) и Z (PAC969Hu01, Cloud-Clone Corp., 1 : 1000).
Перед выполнением иммуногистохимической реакции срезы 10 мин фиксировали в 4% параформальдегиде при комнатной температуре и после трехкратной отмывки (по 5 мин) в фосфатно-солевом буфере (ФСБ) (pH 7,4) на шейкере Polymax 1040 (Heidolph) при 30 об/мин 10 мин инкубировали в 1% растворе Triton Х-100 (рН 7,4) для пермеабилизации клеточных мембран. Далее срезы трижды отмывали в ФСБ и блокировали эндогенную пероксидазу 4% раствором пероксида водорода (Peroxidase Block) в течение 5 мин. После этого срезы дважды отмывали в ФСБ и в течение часа обрабатывали 0,4% солевым раствором казеина (Protein Block) для нейтрализации неспецифического связывания антител. Затем срезы инкубировали с первичными антителами, разведенными в 1% солевом растворе бычьего сывороточного альбумина (оптимальное разведение антител подбирали в ходе серийных окрашиваний образцов), при 4 °C в течение 20 ч. Трижды отмыв срезы в ФСБ, их 30 мин обрабатывали вторичными противокроличьими антителами, коньюгиро-ванными с пероксидазой хрена (Novolink Polymer). После трехкратной отмывки в ФСБ срезы помещали в 0,087% раствор диаминобензидина на 2 мин и 5 мин отмывали в бидистиллированной воде. Далее срезы 10 мин окрашивали гематоксилином из набора, 5 мин подсиняли в проточной воде, обезвоживали в трех сменах 95% этанола (по 5 мин) и 10 мин просветляли в ксилоле, наконец, заключая под покровное стекло посредством монтирующей среды Витрогель (БиоВитрум).
Микроскопию окрашенных срезов осуществляли посредством оптического микроскопа Axio Imager A1 (Zeiss), обработку изображений выполняли в программе Axio Vision (Zeiss).
Исследование проводили в соответствии с принципами Надлежащей клинической практики и Хельсинкской декларации Всемирной медицинской ассоциации, протокол исследования был одобрен локальным этическим комитетом Научно-исследовательского института комплексных проблем сердечно-сосудистых заболеваний (протокол № 19 от 06.11.2018 г.). Пациенты подписали письменное информированное согласие после разъяснения сути исследования. Критерием исключения был клинически диагностированный протезный эндокардит, подтвержденный методом посева или гистологически (окрашивание по Граму).
Результаты
При макроскопическом исследовании эксплантиро-ванных БП во всех образцах отмечены признаки СД в виде отрывов створок в комиссуральной зоне и перфораций в куполе. Отложения кальция локализовались главным образом в основании створок, располагаясь обособленно и не оказывая стенозирующий эффект на створчатый аппарат имплантатов. Случаев тотального кальциноза БП не выявлено. При этом со стороны выводного отдела присутствовал паннус, незначительно ограничивающий открытие БП из-за фиксации створок к каркасу.
Микроскопия срезов, окрашенных пентахромом по Расселу – Мовату, показала умеренную клеточную инфильтрацию, ограниченную предповерхностными слоями и поверхностью биоткани (рис. 1А). Крупные клеточные инфильтраты располагались преимущественно в основании створок, занимая участки с выраженным разрыхлением и фрагментацией волокнистой основы биоматериала (рис. 1Б).
А
Б
В
Г
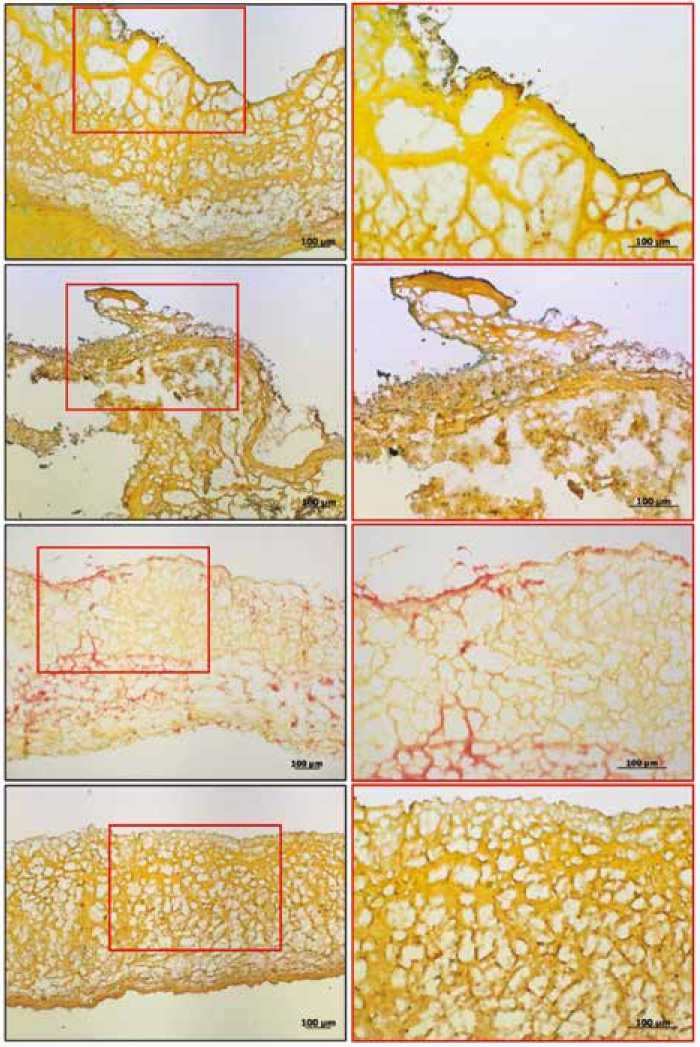
Рис . 1. Клеточная инфильтрация и компонентный состав створок изученных биопротезов клапанов сердца (окрашивание пентахромом по Расселу – Мовату): А – умеренная клеточная инфильтрация поверхности створки, обратите внимание на следовое присутствие мукополисахаридов (голубое окрашивание) вблизи клеток, Б – крупный клеточный инфильтрат, расположенный на участке с выраженной деструкцией коллагеновых волокон (желтое окрашивание), В – участок створки без клеточной инфильтрации и присутствием фибрина (красное окрашивание), Г – створка интактного биопротеза, обратите внимание, что потеря мукополисахаридов и эластина происходит на этапе химической фиксации биоматериала при производстве биопротезов
Fig. 1. Russell – Movat’s pentachrome staining of BHVs: А – moderate cellular infiltration beneath the surface, note the mucopolysaccharide residues (blue staining) around the cells, Б – colocalisation of cells with the degraded extracellular matrix (yellow staining), В – leaflet segment without the cellular infiltration and with fibrin (red staining), Г – intact BHV, note that loss of mucopolysaccharides and elastin occurs at the chemical fixation during the BHV manufacturing
Биоткань створок БП состояла исключительно из коллагеновых волокон, тогда как эластин и мукополисахариды в её структуре не отмечены (рис. 1В). Похожая картина была характерна для створок интактного БП, волокнистая матрица которых состояла исключительно из коллагена и не содержала эластических волокон и мукополисахаридов (рис. 1Г). Клеточные инфильтраты в створках контрольного БП отсутствовали.
Результаты иммунотипирования продемонстрировали, что почти все инфильтрирующие БП клетки положительны на пан-лейкоцитарный маркер CD45 и маркер макрофагов CD68 (рис. 2). Также в створках БП единично присутствовали сегментоядерные нейтрофилы (положительны на CD45 и MPO, но не CD68). Т- и В-лимфоциты (CD3 и CD19 соответственно) не обнаружены (данные не показаны).
CD45
CD68
MPO
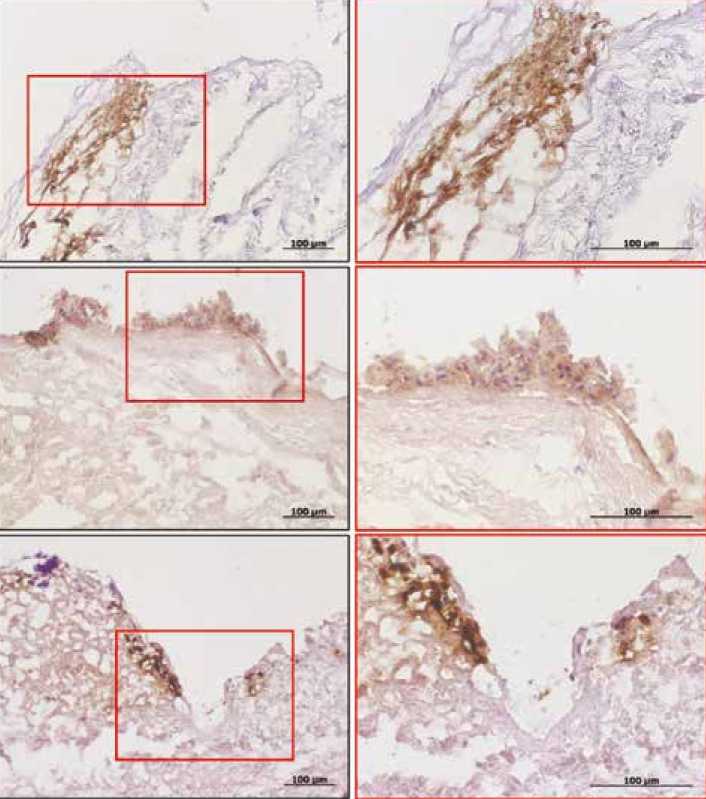
Рис. 2. Результаты иммунотипирования клеток в створках иссеченных биопротезов клапанов сердца: CD45 – пан-лейкоцитарный маркер, CD68 – маркер макрофагов, MPO (миелопероксидаза нейтрофилов) – маркер нейтрофилов
Fig. 2. Immunophenotyping of invading host cells within the BHV leaflets: pan-leukocyte marker CD45, macrophage marker CD68, and neutrophil marker MPO (myeloperoxidase)
Иммуногистохимическое окрашивание срезов антителами к катепсинам B/K/L/S/V/Z подтвердило присутствие всех исследуемых протеаз в створках иссеченных БП. При этом положительное окрашивание на катепсин B отмечено только в цитоплазме макрофагов (рис. 3А), тогда как остальные катепсины были детектированы и в соло-кализации с иммунными клетками, и в бесклеточной ткани, особенно на участках с повреждениями коллагеновой матрицы (рис. 3Б). Образцы интактного биоматериала не показали положительного окрашивания при обработке антителами к перечисленным протеазам (рис. 3В).
Обсуждение
В ходе настоящего исследования были изучены паттерны локализации катепсинов B/K/L/S/V/Z в створках эксплантированных БП. Особый интерес к перечисленным протеазам обусловлен их способностью расщеплять коллаген I типа и эластин [13], из которых состоит биоматериал БП [14]. Полученные данные показали, что проникающие в имплантаты макрофаги содержат все исследованные катепсины, что согласуется с литературными данными [13].
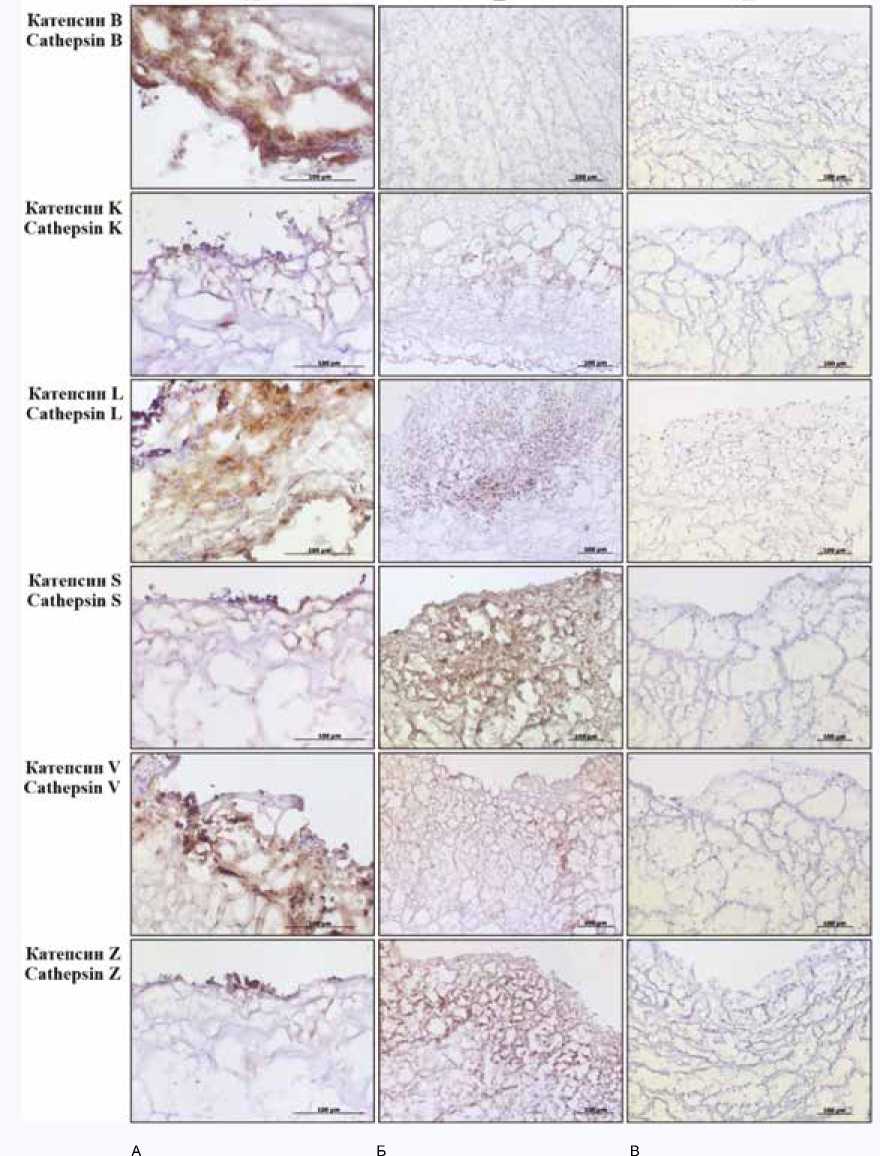
Рис. 3. Результаты иммуногистохимического окрашивания иссеченных биопротезов клапанов сердца антителами к катепсинам B/K/L/S/V/Z: А – инфильтраты иммунных клеток, Б – участки биоматериала без клеточной инфильтрации, В – створки интактного биопротеза (отрицательный контроль) Fig. 3. Immunohistochemical staining of the BHVs for cathepsin B, cathepsin K, cathepsin L, cathepsin S, cathepsin V, and cathepsin Z. А – immune cell infiltration, Б – BHV segments devoid of cells, В – intact BHV leaflets (negative control)
Кроме того, катепсины K/L/S/V/Z были детектированы на участках ткани без клеточной инфильтрации, что предполагает их проникновение в биоматериал из плазмы крови при функционировании БП.
Следует отметить, что в настоящее время нет информации о способности цистеиновых катепсинов расще- плять химически сшитую биологическую ткань, на основе которой изготавливают все коммерческие БП [15]. Тем не менее, данные in vitro исследований предполагают, что последняя не является инертной к протеолизу [16, 17]. Таким образом, логично предположить, что длительное воздействие на биоматериал смеси протеаз, состоящей из цистеиновых катепсинов и других ферментов, со временем способно приводить к деградации БП. Косвенно это предположение подтверждает солокализация внеклеточных катепсинов и участков с выраженной дезорганизацией и фрагментацией волокон коллагена в створках БП, отмеченная в настоящем исследовании.
Полученные результаты указывают на предпочтительное направление будущих исследований, нацеленных на разработку методов снижения темпов СД из-за протеолитической деградации. Для эффективной защиты от протеолиза новые модификации БП должны как уменьшать иммуногенность имплантатов (в целях сокращения секреции протеаз иммунными клетками), так и предотвращать пассивное пропитывание биоматериала белками из плазмы крови. Потенциально обе задачи могут быть реализованы в обозримом будущем, первая – благодаря де-целлюляризации и использованию при производстве БП низкоиммуногенных тканей генетически модифицированных животных [18, 19], вторая – посредством внедрения метода гелеобразования, когда внутреннюю структуру биоматериала заполняют биосовместимым полимерным гелем, создающим физическую преграду для циркулирующих в плазме крови веществ [20].
Заключение
Функционирующие БП подвержены хроническому отторжению, которое сопровождается макрофагальной инфильтрацией протезного биоматериала. Макрофаги продуцируют широкий спектр протеолитических ферментов, в том числе агрессивные коллагеназы и эластазы семейства цистеиновых катепсинов, в частности катепсины B/K/L/S/V/Z. Также большинство перечисленных протеаз поступают в биоматериал БП путем имбибиции из плазмы крови реципиента. Накопление цистеиновых катепсинов в биоматериале может способствовать протеолизу фибриллярных белков и деградации волокнистой матрицы створок БП. Полученные данные необходимо учитывать при разработке способов повышения устойчивости БП к протеолитической деградации. Последние должны как обеспечивать снижение иммуногенности протезного биоматериала, так и препятствовать его пропитыванию белками плазмы.
Список литературы Особенности экспрессии цистеиновых катепсинов B/K/L/S/V/Z в биопротезах клапанов сердца, эксплантированных по причине дисфункции
- Funkat A.K., Beckmann A., Lewandowski J., Frie M., Schiller W., Ernst M. et al. Cardiac surgery in Germany during 2011: a report on behalf of the German Society for Thoracic and Cardiovascular Surgery. Thorac. Cardiovasc. Surg. 2012;60(6):371-382. https://doi.org/10.1055/s-0032-1326724.
- Isaacs A.J., Shuhaiber J., Salemi A., Isom O.W., Sedrakyan A. National trends in utilization and in-hospital outcomes of mechanical versus bioprosthetic aortic valve replacements. J. Thorac. Cardiovasc. Surg. 2015;149(5):1262-1269.e3. https://doi.org/10.1016/j.jtcvs.2015.01.052.
- Siregar S., de Heer F., Groenwold R.H., Versteegh M.I., Bekkers J.A., Brinkman E.S. et al. Trends and outcomes of valve surgery: 16-year results of Netherlands Cardiac Surgery National Database. Eur. J. Cardiothorac Surg. 2014;46(3):386-397. https://doi.org/10.1093/ejcts/ezu017.
- Head S.J., Çelik M., Kappetein A.P. Mechanical versus bioprosthetic aortic valve replacement. Eur. Heart J. 2017;38(28):2183-2191. https://doi.org/10.1093/eurheartj/ehx141.
- Pibarot P., Dumesnil J.G. Prosthetic heart valves: selection of the optimal prosthesis and long-term management. Circulation. 2009; 119(7):1034-1048. https://doi.org/10.1161/CIRCULATIONAHA.108.778886.
- Capodanno D., Petronio A.S., Prendergast B., Eltchaninoff H., Vahanian A., Modine T. et al. Standardized definitions of structural deterioration and valve failure in assessing long-term durability of transcatheter and surgical aortic bioprosthetic valves: a consensus statement from the European Association of Percutaneous Cardiovascular Interventions (EAPCI) endorsed by the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur. Heart J. 2017;38(45):3382-3390. https://doi.org/10.1093/eurheartj/ehx303.
- Dvir D., Bourguignon T., Otto C.M., Hahn R.T., Rosenhek R., Webb J.G. et al. Standardized definition of structural valve degeneration for surgical and transcatheter bioprosthetic aortic valves. Circulation. 2018;137(4):388-399. https://doi.org/10.1161/CIRCULATIONAHA.117.030729.
- Cote N., Pibarot P., Clavel M.A. Incidence, risk factors, clinical impact, and management of bioprosthesis structural valve degeneration. Curr. Opin. Cardiol. 2017;32(2):123-129. https://doi.org/10.1097/HCO.0000000000000372.
- Marro M., Kossar A.P., Xue Y., Frasca A., Levy R.J., Ferrari G. Noncalcific mechanisms of bioprosthetic structural valve degeneration. J. Am. Heart Assoc. 2021;10(3):e018921. https://doi.org/10.1161/JAHA.120.018921.
- Shetty R., Pibarot P., Audet A., Janvier R., Dagenais F., Perron J. et al. Lipid-mediated inflammation and degeneration of bioprosthetic heart valves. Eur. J. Clin. Invest. 2009;39(6):471-480. https://doi.org/10.1111/j.1365-2362.2009.02132.x.
- Simionescu A., Simionescu D.T., Deac R.F. Matrix metalloproteinases in the pathology of natural and bioprosthetic cardiac valves. Cardiovasc Pathol. 1996;5(6):323-332. https://doi.org/10.1016/s1054-8807(96)00043-9.
- Костюнин А.Е., Глушкова Т.В., Шишкова Д.К., Маркова В.Е., Овчаренко Е.А. Скрининговый анализ протеолитических ферментов и их ингибиторов в створках эпоксиобработанных биопротезных клапанов сердца, эксплантированных по причине дисфункций. Биомедицинская химия. 2022;68(1):68-75. https://doi.org/10.18097/PBMC20226801068.
- Fonovic M., Turk B. Cysteine cathepsins and extracellular matrix degradation. Biochim. Biophys. Acta. 2014;1840(8):2560-2570. https://doi.org/10.1016/j.bbagen.2014.03.017.
- Soares J.S., Feaver K.R., Zhang W., Kamensky D., Aggarwal A., Sacks M.S. Biomechanical behavior of bioprosthetic heart valve heterograft tissues: characterization, simulation, and performance. Cardiovasc. Eng. Technol. 2016;7(4):309-351. https://doi.org/10.1007/s13239-016-0276-8.
- Кудрявцева Ю.А. Биологические протезы клапана сердца. От идеи до клинического применения. Комплексные проблемы сердечнососудистых заболеваний. 2015;4:6-16. https://doi.org/10.17802/2306-1278-2015-4-6-16.
- Margueratt S.D., Lee J.M. Stress state during fixation determines susceptibility to fatigue-linked biodegradation in bioprosthetic heart valve materials. Biomed. Sci. Instrum. 2002;38:145-150.
- Zhuravleva I.Y., Karpova E.V., Oparina L.A., Poveschenko O.V., Surovtseva M.A., Titov A.T. et al. Cross-linking method using pentaepoxide for improving bovine and porcine bioprosthetic pericardia: a multiparametric assessment study. Materials Science and Engineering C: Materials for Biological Applications. 2021;118:111473. https://doi.org/10.1016/j.msec.2020.111473.
- Manji R.A., Lee W., Cooper D.K.C. Xenograft bioprosthetic heart valves: past, present and future. Int. J. Surg. 2015;23(Pt B):280-284. https://doi.org/10.1016/j.ijsu.2015.07.009.
- Костюнин А.Е., Резвова М.А. Роль остаточных ксеноантигенов в дегенерации ксеногенных биопротезов клапанов сердца. Иммунология. 2019;40(4):56-63. https://doi.org/10.24411/0206-4952-2019-14005.
- Ding K., Zheng C., Huang X., Zhang S., Li M., Lei Y. et al. A PEGylation method of fabricating bioprosthetic heart valves based on glutaraldehyde and 2-amino-4-pentenoic acid co-crosslinking with improved antithrombogenicity and cytocompatibility. Acta Biomater. 2022;144:279-291. https://doi.org/10.1016/j.actbio.2022.03.026.


