Особенности экспрессии генов микробного сообщества рубца коров в период сухостоя и лактации
Автор: Лаптев Г.Ю., Филиппова В.А., Корочкина Е.А., Ильина Л.А., Йылдырым Е.А., Дубровин А.В., Дуняшев Т.П., Пономарева Е.С., Сметанникова Т.С., Скляров С.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Структура генома, геномные технологии
Статья в выпуске: 2 т.57, 2022 года.
Бесплатный доступ
Качество и количество корма, потребляемого лактирующими и сухостойными коровами, сильно различаются. Сухостойные коровы обычно получают рацион с высоким содержанием грубых кормов и низким содержанием комбикорма, что приводит к замедлению скорости ферментации в рубце. Сразу после отела коров кормят рационами с низким содержанием грубой клетчатки и высоким - комбикорма, для которых обычно характерна высокая скорость брожения вследствие большого содержания таких легкоусвояемых полисахаридов, как крахмал. В настоящей работе впервые установили, что повышение доли крахмала в рационе дойных коров приводит к изменениям в экспрессии ряда генов микроорганизмами рубца, в особенности гена L-лактатдегидрогеназы. Нашей целью был анализ экспрессии генов, участвующих в ключевых реакциях метаболизма рубца, в зависимости от физиологического периода и содержания грубой клетчатки в рационе животного. Образцы отбирали в 2020 году в АО «Агрофирма Дмитрова Гора» (Тверская обл.) от 15 коров ( Bos taurus ) молочного направления черно-пестрой голштинизированной породы 2-3-й лактации. Животные находились в одинаковых условиях на привязном содержании. Для эксперимента отобрали шесть коров, из которых сформировали две группы ( n = 3): I группа - сухостойные животных (в среднем за 30 сут до отела), II группа - животных в период лактации (208-е сут лактации). Пробы химуса (30-50 г от каждой коровы) отбирали из верхней части вентрального мешка рубца вручную стерильным зондом. Тотальную ДНК из исследуемых образцов выделяли с использованием набора Genomic DNA Purification Kit («Fermentas, Inc.», Литва). Бактериальное сообщество рубца изучали методом NGS-секвенирования на платформе MiSeq («Illiumina, Inc.», США) с применением праймеров для V3-V4 региона 16S рРНК. Биоинформатический анализ данных выполняли с использованием программного обеспечения Qiime2 ver. 2020.8 (https://docs.qiime2.org/2020.8/). Для анализа таксономии использовали справочную базу данных Silva 138 (https://www.arbsilva.de/docu-mentation/release-138/). Тотальную РНК из образцов рубцового содержимого выделяли с помощью набора Aurum Total RNA («Bio-Rad», США). На матрице РНК получали кДНК (набор iScript RT Supermix, «Bio-Rad», США). Относительную экспрессию генов бактерий анализировали при помощи количественной ПЦР, которую проводили на детектирующем амплификаторе ДТ Lite-4 624 (ООО «НПО ДНК-Технология», Россия). Показано, что изменение рациона коров, связанное с повышением доли крахмала, способствовало снижению доли целлюлозолитических бактерий семейств Ruminococcaceae и Lachnospiraceae и повышению численности бактерий сем. Prevotellaceae , связанных с разложением крахмала. Также были показаны изменения в экспрессии бактериальных генов в зависимости от рациона. Так, экспрессия гена L-лактатдегидрогеназы увеличивалась в группе лактирующих коров (р £ 0,05), получающих рацион с большим содержанием крахмала. Это, вероятно, связано с большим содержанием лактата в рубце коров, потребляющих высокие концентрации легкоусвояемых углеводов и с формированием адаптивных механизмов в микробном сообществе рубца. Также у лактирующих коров отмечали увеличение экспрессии гена фосфофруктокиназы (р £ 0,05) - одного из регулирующих ферментов гликолиза. Улучшение доступности моносахаридов из комбикормов способствует интенсификации процесса гликолиза рубцовыми микроорганизмами. В связи с этим ген Ldh-L можно рассматривать как кандидат в биомаркеры, которые способны дать представление об активности процессов синтеза молочной кислоты и, как следствие, о снижении pH в рубце коров.
Рубец, экспрессия генов, l-лактатдегидрогеназа, фосфофруктокиназа, микроорганизмы, физиологический период, крупный рогатый скот
Короткий адрес: https://sciup.org/142235673
IDR: 142235673 | УДК: 636.2:591.1:579.2:577.2 | DOI: 10.15389/agrobiology.2022.2.304rus
Текст научной статьи Особенности экспрессии генов микробного сообщества рубца коров в период сухостоя и лактации
Качество и количество корма, потребляемого лактирующими и сухостойными коровами, сильно различаются. Сухостойные коровы обычно получают рацион с высоким содержанием грубых кормов и низким содержанием комбикорма, что приводит к замедлению скорости ферментации в рубце. Сразу после отела коров кормят рационами с низким содержанием грубой клетчатки и высоким — комбикорма, для которых обычно характерна высокая скорость брожения вследствие большого содержания таких легкоусвояемых полисахаридов, как крахмал. В настоящей работе впервые установили, что повышение доли крахмала в рационе дойных коров приводит к изменениям в экспрессии ряда генов микроорганизмами рубца, в особенности гена L-лактатдегидрогеназы. Нашей целью был анализ экспрессии генов, участвующих в ключевых реакциях метаболизма рубца, в зависимости от физиологического периода и содержания грубой клетчатки в рационе животного. Образцы отбирали в 2020 году в АО «Агрофирма Дмитрова Гора» (Тверская обл.) от 15 коров (Bos taurus) молочного направления черно-пестрой голштинизированной породы 2-3-й лактации. Животные находились в одинаковых условиях на привязном содержании. Для эксперимента отобрали шесть коров, из которых сформировали две группы (n = 3): I группа — сухостойные животных (в среднем за 30 сут до отела), II группа — животных в период лактации (208-е сут лактации). Пробы химуса (30-50 г от каждой коровы) отбирали из верхней части вентрального мешка рубца вручную стерильным зондом. Тотальную ДНК из исследуемых образцов выделяли с использованием набора Genomic DNA Purification Kit («Fermentas, Inc.», Литва). Бактериальное сообщество рубца изучали методом NGS-секвенирования на платформе MiSeq («Illiumina, Inc.», США) с применением праймеров для V3-V4 региона 16S рРНК. Биоинформатический анализ данных выполняли с использованием программного обеспечения Qiime2 ver. 2020.8 . Для анализа таксономии использовали справочную базу данных Silva 138 . Тотальную РНК из образцов рубцового содержимого выделяли с помощью набора Aurum Total RNA («Bio-Rad», США). На матрице РНК получали кДНК (набор iScript RT Supermix, «Bio-Rad», США). Относительную экспрессию генов бактерий анализировали при помощи количественной ПЦР, которую проводили на детектирующем амплификаторе ДТ Lite-4 624 (ООО «НПО ДНК-Технология», Россия). Показано, что изменение рациона коров, связанное с повышением доли крахмала, способствовало снижению доли целлюлозолитических бактерий семейств Ruminococcaceae и Lachnospiraceae и повышению численности бактерий сем. Prevotellaceae, связанных с разложением крахмала. Также были показаны изменения в экспрессии бактериальных генов в зависимости от рациона. Так, экспрессия гена L-лактатдегидрогеназы увеличивалась в группе лактирующих коров (р ≤ 0,05), получающих рацион с большим содержанием крахмала. Это, вероятно, связано с большим содержанием лактата в рубце коров, потребляющих высокие концентрации легкоусвояемых углеводов и с формированием адаптивных механизмов в микробном сообществе рубца. Также у лактирующих коров отмечали увеличение экспрессии гена фосфофруктокиназы (р ≤ 0,05) — одного из регулирующих ферментов гликолиза. Улучшение доступности моносахаридов из комбикормов способствует интенсификации процесса гликолиза рубцовыми микроорганизмами. В связи с этим ген Ldh-L можно рассматривать как кандидат в биомаркеры, которые способны дать представление об активности процессов синтеза молочной кислоты и, как следствие, о снижении pH в рубце коров.
Продуктивность молочного животноводческого хозяйства слагается из успешной организации и контроля процесса производства. Многочисленные исследования и практические наблюдения подтверждают, что получение максимального удоя возможно при постоянном отслеживании показателей лактации, начиная с сухостойного периода. Кроме того, успешная организация лактационного цикла коров способствует раскрытию генетического потенциала по молочной продуктивности с сохранением репродуктивного здоровья животного, что отражается на экономической составляющей животноводческого хозяйства. Во время лактационного цикла особое внимание необходимо уделять переходному периоду длительностью 21 сут до и после отела. Согласно некоторым данным, переходный период можно рассматривать как благоприятную возможность для установления лактации и обеспечения хорошего самочувствия и размножения (1).
Качество и количество корма, потребляемого лактирующими и сухостойными коровами, сильно различаются. Сухостойные коровы обычно получают рацион с высоким содержанием грубых кормов и низким — комбикормов, что приводит к замедлению скорости ферментации в рубце (2). Сразу после отела коров кормят рационами с низким количеством грубой клетчатки и высоким содержанием комбикорма, для которых характерна высокая скорость брожения (3). Очевидно, что вид и количество грубых кормов и концентратов в рационах, потребляемых коровами, определяют микробный состав и активность рубца (4), а также влияют на физиологические характеристики, главным образом pH и ферментацию (5-7), что, в свою очередь, может воздействовать на эпителий желудочно-кишечного тракта. В ряде исследований сообщалось, что эпителий рубца у телят (8), сухостойных коров (9) и даже у коров в переходный период (10) зависел от типа предложенной диеты.
По мнению J.W. Schroeder (11), в переходный период особое внимание следует уделять потреблению животными кормов и концентратов в целях подготовки стенки рубца и его микрофлоры к предстоящему потреблению корма с высоким содержанием зерновых. M.S. Jolicoeur с соавт. (12) показали, что чем меньшее число раз меняется рацион перед отелом, тем легче адаптируется рубец к диете и улучшается послеродовой энергетический баланс. D.W. Pitta с соавт. (13) указывают на то, что микробиом рубца изменяется по мере перехода дойных коров из периода без лактации в период лактации из-за изменений режима питания. Согласно результатам анализа содержимого рубца животных в переходный период, наиболее многочисленными наблюдаемыми типами во всех сообществах были Bacteroidetes и Firmicutes . Когда коровы переходили в период лактации, соотношение Bacteroidetes к Firmicutes увеличивалось с 6:1 до 12:1 (р < 0,05) и было больше у первородящих, чем у повторнородящих коров (р < 0,05). Данные, полученные A. Bach с соавт. (14), свидетельствуют о том, что перед отелом относительная доля бактерий, разлагающих клетчатку, выше, чем бактерий, которые питаются быстро ферментируемыми углеводами. После отела наблюдается быстрый сдвиг в сторону увеличения доли бактерий, разлагающих быстро ферментируемые углеводы. У животных после отела отмечали более высокое потребление сухого вещества, что привело к увеличению потребления неволокнистых углеводов на 1,21 кг/сут, что отрицательно повлияло бы на pH рубца и микробный баланс.
Несмотря на ряд работ, сфокусированных на изучении микробиоты рубца в разные периоды лактационного цикла, остается актуальной оценка микробной составляющей рубца молочных коров разной продуктивности в переходный период лактационного цикла в зависимости от продуктивности животных и организации кормления в животноводческих хозяйствах.
Большинство исследований экспрессии генов рубца сосредоточено на изменениях в экспрессии генов его эпителия у коров (15). Вместе с этим получено мало информации о возможной взаимосвязи между типом диеты и изменениями экспрессии генов в эпителии и микробиоме рубца (10). Учитывая различия в компонентах рационов на разных физиологических этапах подобные изменения должны происходить и в экспрессии генов, участвующих в метаболизме летучих жирных кислот, углеводов и т.д. Они могут быть связаны с изменениями как качественного состава микробных сообществ, так и индивидуальных транскрипционных профилей микроорганизмов.
В настоящей работе впервые установили, что повышение доли крахмала в рационе дойных коров приводит к изменениям в экспрессии ряда генов микроорганизмами рубца, в особенности гена L-лактатдегидрогеназы.
Нашей целью был анализ экспрессии генов, участвующих в ключевых реакциях метаболизма рубца, в зависимости от физиологического периода животного и содержания грубой клетчатки в рационе.
Методика. Образцы отбирали в 2020 году в АО «Агрофирма Дмитрова Гора» (Тверская обл.) от 15 коров ( Bos taurus ) молочного направления черно-пестрой голштинизированной породы 2-3-й лактации. Животные находились в одинаковых условиях на привязном содержании. В эксперимент отобрали шесть коров, из которых сформировали две группы ( n = 3): I группа — сухостойные животные (в среднем за 30 сут до отела), II группа — животные в период лактации (208-е сут лактации).
Сухостойных коров отбирали по ожидаемой дате отела. Число животных в группах соответствовало методикам, представленным в ранее опубликованных исследованиях (16, 17). Средняя живая масса животных в I группе составляла 703 кг, во II группе — 667 кг. Пробы химуса (30-50 г от каждой коровы) отбирали из верхней части вентрального мешка рубца вручную стерильным зондом с максимально возможным соблюдением условий асептики.
Тотальную ДНК из образцов выделяли с использованием набора Genomic DNA Purification Kit («Fermentas, Inc.», Литва) согласно прилагаемой инструкции. Анализ основан на селективном осаждении ДНК из субстрата детергентным методом с применением растворов для лизиса клеточных стенок, осаждения ДНК, раствора 1,2 М хлорида натрия, хлороформа.
Бактериальное сообщество рубца исследовали методом NGS-секвенирования на платформе MiSeq («Illiumina, Inc.», США) с праймерами для V3-V4 региона 16S рРНК (прямой праймер: 5´-TCGTCGGCAGCGTCAG-ATGTGTATAAGAGACAGCCTACGGGNGGCWGCG-3´, обратный праймер: 5´-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACH-VGGGTATCTAATCC-3´. Использовали реагенты для приготовления библиотек Nextera® XT IndexKit («Illiumina, Inc.», США), для очистки ПЦР-продуктов Agencourt AMPure XP («Illiumina, Inc.», США) и для проведения секвенирования MiSeq® ReagentKit v2 (500 cycle) («Illiumina, Inc.», США). Максимальная длина полученных последовательностей составила 2½250 п.н. Биоинформатический анализ данных выполняли с использованием программного обеспечения Qiime2 ver. 2020.8 . После первоначального импорта последовательностей в формат Qiime2 парные строки прочтений выравнивали. Далее проводили фильтрацию последовательностей по качеству (параметры настроек по умолчанию). Фильтрацию шумовых последовательностей осуществляли с методом Deblur (максимальная длина последовательности обрезки — 250 п.н.) . Для построения филогении de novo применяли программный пакет MAFFT , далее проводили маскированное выравнивание последовательностей. Для анализа таксономии использовали справочную базу данных Silva 138 .
Тотальную РНК из образцов рубцового содержимого выделяли с помощью набора Aurum Total RNA («Bio-Rad», США) согласно инструкции производителя. На матрице РНК получали кДНК (набор iScript RT Supermix, «Bio-Rad», США).
Относительную экспрессию генов бактерий анализировали при помощи количественной ПЦР, которую проводили на детектирующем ампли-фикаторе ДТ Lite-4 624 (ООО «НПО ДНК-Технология», Россия). Условия амплификации: 1 мин при 95 ° С (1 цикл); 15 с при 95 ° С, 1 мин при 50 ° С (45 циклов). Использовали реакционную смесь для амплификации, которая входила в состав набора SsoAdvanced Universal SYBR Green Supermix («Bio-Rad», США), приготовленную согласно протоколу производителя. Относительную экспрессию рассчитывали методом 2 - AA Ct (18). Праймеры для генов, анализируемых в настоящей работе, были следующими:
|
Праймер |
| Последовательность (5 '^ 3 ' ) |
Ссылка |
|
Фосфофруктокиназа (PFK) |
F: ATCGGTGGTGACGGTTCTTAT R: GATATCWCCAGCRTKACGTCCCAT |
(18) |
|
Фосфоенолпируваткарбоксикиназа (PEPK) |
F: AAGGKATGTTCTCWATSATGAACTAC R: TAGATMGGRTAAGAAACACGAGT |
(18) |
|
Метилмелонил-КоА-мутаза (MCM) |
F: GGCSATYGGCAYSAACTTCTWCATGGA R: GTCGGTSGGCAGMGCGATSGCCTCGTC |
(18) |
|
КЛК-редуктаза (CLA-reductase) |
F: CATTCGCACTTGGTACATCTCAGC R: ACGTACACGTGGTACTTCCTCAAG |
(18) |
|
L-лактатдегидрогеназа (L-LDG) |
F: CATCAAAAAGTTGTGTTAGTCGGCG R: TCAGCTAAACCGTCGTTAAGCACTT |
(19) |
|
D-лактатдегидрогеназа (D-LDG) |
F: CTGGGATCCGTTGAGGGAGATGCTTAAG R: TCCGAAGCTTTTAGTTGACCCGGTTGAC |
(20) |
|
Гуанин-аминогидролаза GAH1 |
F: ATTGCYTTCTGYCCGACYTCCAACCT R: TTGTAKGCYTCGTTSAGCGTYTGCAG |
(18) |
|
16S рРНК (Вас) |
F: AGGCCTTCGGGTTGTAAAGT R: CGGGGATTTCACATCTCACT |
(21) |
Универсальный ген, кодирующий 16S-рибосомальную субъединицу прокариот (F: 5´-AGGCCTTCGGGTTGTAAAGT-3´, R: 5´-CGGGGATTT-CACATCTCACT-3´), служил референсным.
Математическую и статистическую обработку результатов осуществляли методом однофакторного дисперсионного анализа (ANOVA) в программах Microsoft Excel XP/2003, R-Studio (Version 1.1.453) . Для коррекции ошибки 1-го типа рассчитывали критерий достоверно значимой разности Тьюки (Tukey’s HSD test) . Результаты представлены как средние значения (M) и стандартные ошибки средних (±SEM). Уровень статистической значимости — р ≤ 0,05. Для оценки достоверности различий использовали t-критерий Стьюдента.
Результаты. Два рациона, которые потребляли контрольная и опытная группы коров, значительно различались по содержанию легкоусвояемых полисахаридов (крахмала) и клетчатки (табл. 1). В рационе сухостойных коров содержалось больше клетчатки — 68,3 % (кислотно-детергетной и нейтрально-детергентной), в рационе дойных ее доля была ниже — 46,0 %. Кислотно-детергентная клетчатка (КДК) включает целлюлозу, лигнин и нерастворимые соли. Чем ниже доля КДК, тем больше корма животное способно потребить и переварить. Нейтрально-детергентная клетчатка (НДК) служит материалом клеточных стенок растений, входящих в корм, и включает в себя гемицеллюлозу, целлюлозу, лигнин, нерастворимую золу. Чем ниже процент НДК, тем больше корма способно потребить и переварить животное. Доля крахмала в рационе сухостойных коров составляла всего 16,2 %, в то время как в рационе дойных коров она была существенно больше — 26,6 %.
1. Состав рационов коров ( Bos taurus ) черно-пестрой голштинизированной породы в сухостойный и дойный физиологические периоды (АО «Агрофирма Дмитрова Гора», Тверская обл., 2020 год)
|
Компонент рациона, кг |
Сухостойные (I группа) |
Дойные (II группа) |
|
Солома |
0,5 |
- |
|
Комбикорм |
1,8 |
4,55 |
|
Шрот подсолнечный |
0,3 |
- |
|
Шрот соевый |
0,53 |
2,6 |
|
Кукуруза |
0,53 |
4,0 |
|
Пшеница |
0,29 |
1,2 |
|
Жом свекловичный |
1,97 |
0,6 |
|
Силос кукурузный |
5,9 |
6,4 |
|
Патока |
– |
0,61 |
|
Барда спиртовая |
– |
1,0 |
|
Сенаж злаково-бобовый |
– |
3,5 |
|
НДК, % от СВ |
41,63 |
28,28 |
|
КДК, % от СВ |
26,64 |
17,75 |
|
Крахмал, % |
16,22 |
26,64 |
Примечание. НДК — нейтрально-детергентная клетчатка, КДК — кислотно-детергентная клетчатка, СВ — сухое вещество. Прочерк означает, что компонент отсутствовал в рационе.
Рис. 1. Таксономический состав микробного сообщества рубца у коров ( Bos taurus ) черно-пестрой голшти-низированной породы в сухостойный (I группа) и дойный (II группа) физиологические периоды по результатам NGS-секвенирования фрагмента гена 16S рРНК (АО «Агрофирма Дмитрова Гора», Тверская обл., 2020 год) .
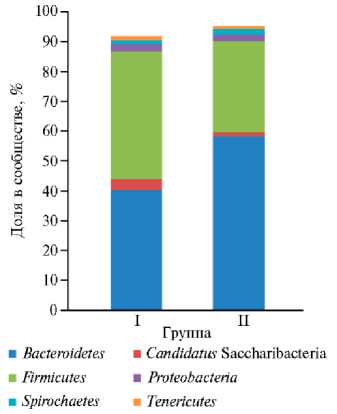
Мы определили таксономический состав (рис. 1) и особенности транскрипции ряда ключевых генов метаболизма рубцовых микроорганизмов, принимающих участие в процессах гликолиза и глюконеогенеза, метаболизме лактата, жирных кислот.
В рубце сухостойных коров наибольшей численности достигали представители филы Firmicutes (43,9 %), у дойных коров превалировали бактерии филы Bacteroidetes (58,3 %). Эти две филы были доминирующими в рубце коров обеих групп, что считается нормой для сообществ рубца и желудочно-кишечного тракта (23). Фила Firmicutes характеризовалась большим обилием анаэробных и амилолитических бактерий. Поэтому колебания соотношения представителей этих фил могут свидетельствовать об изменениях в сообществе микроорганизмов рубца, связанных с адаптацией к особенностям рациона (24).
Состав рациона — один из основных факторов, влияющих на изменение микробиоты рубца, наряду с воздействиями окружающей среды (25). Это подтверждается исследованиями D.W. Pitta с соавт. (13), которые показали, что микробиом рубца изменяется по мере перехода дойных коров из периода без лактации в период лактации из-за изменений режима питания. Согласно результатам нашего анализа содержимого рубца животных, в переходный период соотношение обилия Bacteroidetes к Firmicutes увеличивалось с 6:1 до 12:1 (р < 0,05). Данные A. Bach с соавт. (14) также свидетельствуют о том, что перед отелом относительная доля бактерий, разлагающих клетчатку, выше, чем бактерий, которые питаются быстро ферментируемыми углеводами. После отела наблюдается быстрый сдвиг в сторону увеличения доли бактерий, разлагающих быстро ферментируемые углеводы.
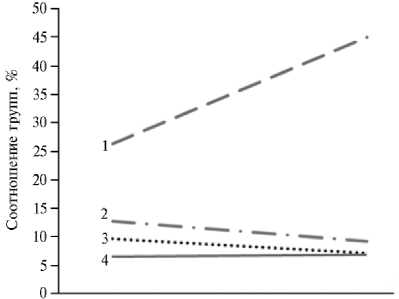
I II Группа
Рис. 2. Соотношение некоторых групп микроорганизмов сообщества рубца у коров ( Bos taurus ) черно-пестрой голштинизированной породы в зависимости от рациона, потребляемого в сухостойный (I группа) и дойный (II группа) физиологические периоды: 1 — Prevotellaceae , 2 — Rumino-coccsceae , 3 — Lachnospiraceae , 4 — Succiniclasticum ruminis (АО «Агрофирма Дмитрова Гора», Тверская обл., 2020 год).
Изменения в соотношении легко- и трудноусвояемых углеводов в рационе привело к изменению соотношения различных групп микроорганизмов в рубце (рис. 2). С увеличением доли крахмала и снижением — грубых кормов происходило увеличение численности представителей семейства Prevotel-laceae и снижение — семейств Ru-minococcsceae и Lachnospiraceae. То есть в рубце у дойных коров наблюдалось снижение количества целлюлозолитических бактерий и увеличение — бактерий, обладающих амилолитической активностью. Suc-ciniclasticum ruminis — обитатель рубца, способный превращать сукцинат в пропионат в качестве единственного механизма производства энергии. Succiniclasticum ruminis счи- тается основным микроорганизмом, вовлеченным в этом процессе, важ- ность которого определяется в первую очередь участием пропионата в процессе глюконеогенеза в печени животного. Поскольку пропионат — это единственная глюконеогенная летучая жирная кислота (ЛЖК) в рубце, которая обеспечивает хозяину больше энергии в виде АТФ, чем любые другие ЛЖК, продуцируемые в рубце, ее важность очевидна (25). Вместе с тем изменение рациона, касающееся легко- и трудноусвояемых углеводов, не оказало влияния на численность Succiniclasticum ruminis.
Для изучения функциональных особенностей, связанных с разным количеством крахмала и грубой клетчатки в рационах, мы выделили мРНК из рубцового содержимого и исследовали особенности транскрипции ряда ключевых генов метаболизма рубцовых микроорганизмов, принимающих участие в процессах гликолиза (фосфофруктокиназа, фосфоенолпируват-карбоксикиназа), метаболизме лактата (лактатдегидрогеназа), жирных кислот (метил мелонил-КоА-мутаза, КЛК-редуктаза).
Результаты оценки экспрессии бактериальных генов в рубце коров, связанной с синтезом фосфофруктокиназы (phosphofructokinase, PFK), фос-фоенолпируваткарбоксикиназы (phosphoenolpyruvate carboxykinase, PEPK), редуктазы коньюгированной линолевой кислоты (conjugated linoleic acid reductase, cla-r), L-лактатдегидрогеназы (L-lactate dehydrogenase, Ldh-L), D-лактатдегидрогеназы (D-lactate dehydrogenase, Ldh-0813), метилмалонил-КоА-мутазы (methylmalonyl-CoA mutase, МСМ), гуанин-аминогидролазы (guanine aminohydrolase, GAH) представлены на рисунке 3.
Фосфофруктокиназа и фосфоенолпируваткарбоксикиназа — важные участники углеводного метаболизма, а редуктаза линолевой кислоты связана с метаболизмом жирных кислот. Фосфофруктокиназа (EC 2.7.1.11) служит одним из регулирующих ферментов гликолиза, который отвечает за перенос фосфатной группы от молекулы АТФ на фруктозо-6-фосфат, что приводит к образованию фруктозо-1,6-бисфосфата и АДФ. Гликолиз — универсальный путь катаболизма глюкозы и самый распространенный из трех
(существуют также пентозофосфатный путь и путь Энтнера-Дудорова) путей окисления глюкозы, обнаруженных в живых клетках. Увеличение экспрессии гена PFK в период лактации в 2,83 раза (p ≤ 0,05) могло быть связано с напряжением углеводного обмена в рубце во время лактации и адаптацией микроорганизмов к модификациям имеющихся в рубце питательных веществ. В этот период в рационе увеличивается количество доступных источников глюкозы — крахмала и моносахаридов. Увеличение экспрессии генов бактериальных фосфофруктокиназ может иметь негативные последствия для метаболизма макроорганизма. Результатом утилизации глюкозы в рубце и, как следствие, ее низкого содержания в плазме крови, становится активация физиологических механизмов преодоления дефицита энергии: организм животных активно мобилизует триглицериды из жировой ткани в попытке удовлетворяют потребности в большом количестве энергии (27). Подобный эффект представляется закономерным, поскольку преобладание в рационе легкоусвояемого крахмала должно интенсифицировать процесс гликолиза в рубце, что приводит к конкурентному вытеснению целлюлозолитических бактерий представителями Prevotellaceae , потребляющими крахмал. Кроме того, нежелательные для рубца облигатно-гомоферментативные и факультативно-гетероферментные молочнокислые бактерии, как правило, ферментируют глюкозу до пирувата посредством гликолиза. Дальнейшие реакции молочнокислого брожения приводят к образованию значительного количества лактата (28) и, следовательно, снижению pH в рубце.
Интересно, что увеличение экспрессии гена фосфоенолпируваткар-боксикиназы (PEPK) в рубце в период лактации в 1,73 раза также может быть связано с активацией патогенетических процессов. Фосфоенолпи-руваткарбоксикиназа — фермент пути синтеза глюкозы из неуглеводных соединений (глюконеогенеза) (21). Этот анаболический путь связан с проявлением вирулентности у ряда внутриклеточных бактериальных патогенов, например у Mycobacterium tuberculosis (29, 30).
Лактат образуется в результате молочнокислого брожения из предшественников под действием двух различных форм НАД-связанных лактатдегидрогеназ: одна из них (ЕС 1.1.1.27) производит изомер L(+)-лактат L-LDG, другая (ЕС 1.1.1.28) — изомер D( - )-лактат D-LDG.
По мнению исследователей (31), изомер D( - )-лактат существенно отличается от L-лактата по действию. Важное различие между изомерами — возможность их почечной экскреции, которая ниже для D-лактата, что определяет его главную роль в провоцировании метаболического ацидоза (32). В связи с этим сведения об экспрессии генов Ldh-L и Ldb 0813 могут дать представление об активности процессов синтеза молочной кислоты и, как следствие, о снижении pH в рубце коров. Полученные данные согласуются с общепринятым мнением (33), что переход на высококонцентрированную диету провоцирует формированию метаболических нарушений в рубце. На фоне стрессовых ситуаций (отел, лактация) и отрицательного энергетического баланса коровы подвергаются высокому риску метаболических нарушений, связанных со снижением pH.
Мы не выявили статистически значимых различий между группами по уровню экспрессии гена D-лактатдегидрогеназы. В то же время экспрессия гена L-лактатдегидрогеназы увеличивалась в группе лактирующих коров в 4,8 раза (p ≤ 0,05). Это свидетельствует о том, что организм животных в период молочной продуктивности обеспечивал более эффективную устойчивость к стрессовым факторам, чем организм сухостойных коров. Вероятно, это связано с формированием адаптивных механизмов в микробном сообществе рубца.
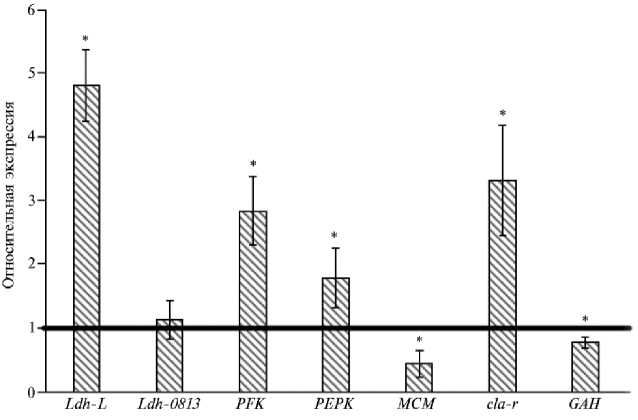
Рис. 3. Относительная экспрессия генов микробного сообщества рубца у коров ( Bos taurus ) чернопестрой голштинизированной породы в зависимости от рациона, потребляемого в сухостойный (горизонтальная черта) и дойный (диаграмма) физиологические периоды (АО «Агрофирма Дмитрова Гора», Тверская обл., 2020 год) .
* Различия с показателями в сухостойный период статистически значимы при p ≤ 0,05.
В связи с этим гены Ldh-L и Ldh 0813 , на наш взгляд, — важные кандидаты в биомаркеры, которые могут дать представление об активности процессов синтеза молочной кислоты и, как следствие, о снижении pH в рубце коров. Полученные данные согласуются с общепринятым мнением (34), что резкий переход на высококонцентрированную диету способен провоцировать развитие метаболических нарушений в рубце.
В то же время у коров из II группы по сравнению с животными из I группы наблюдалось статистически значимое (p ≤ 0,05) снижение экспрессии гена MCM , связанного с синтезом метилмалонил-КоА-мутазы, активирующей превращение метилмалонил-КоА в сукцинил-КоА. Известно (35), что сукцинил-КоА служит важнейшим звеном цикла Кребса. Цикл трикарбоновых кислот (цикл Кребса, цикл лимонной кислоты), несомненно, играет в организме центральную регуляторную роль. Он представляет собой сложную, многоступенчатую последовательность реакций, поставляющих энергетические и пластические эквиваленты, восстановленные и фосфорилированные кофакторы основных биосинтетических путей. Интенсивность практически всех процессов в организме регулируется соотношением восстановленных и окисленных адениловых и флавиновых нуклеотидов, АТФ/АДФ, АТФ/АМФ и АТФ/неорганический фосфат.
Фермент MCM широко распространен во всех живых организмах, кроме растений. Он был изучен, выделен и кристаллизован из грамположи-тельных бактерий Propionibacterium freudenreichii var. shermanii , у которых он участвует в превращении пирувата в пропионат. Фермент был описан как гетеродимер, состоящий из большой ( α ) и малой ( β ) субъединиц, образующих белок массой 150 кДа, один домен которого связывается с ацил-КоА, а другой — с коферментом B 12 (36).
Кроме того, роль цикла трикарбоновых кислот, занимающего центральное место в энергетическом обмене, не ограничивается производством и накоплением энергии (37). Промежуточные соединения четырех- и пятиуглеродного цикла служат предшественниками для синтеза многих соединений в рубце, включая цитрат для синтеза липидов, оксалоацетат для про- изводства аспартата.
Экспрессия гена GAH1 , связанная с синтезом фермента гуанинаминогидролазы, снижалась в рубце коров во время лактации (p ≤ 0,05) по сравнению с сухостойными животными. Это могло отрицательно сказаться на синтезе ценного микробного протеина, поскольку гуанинаминогидролаза катализирует реакции катаболизма пуринов (38). В то же время важным процессом белкового обмена у жвачных животных служит деградация азотсодержащих кормовых соединений, в частности пуринов, и синтез микробного белка (39). Снижение экспрессии гена GAH1 в рубце коров в период доения и стабилизации лактации могло быть связано с асинхронным потреблением углеводов и белков на фоне высококонцентрированного кормления, а также стрессом, связанным с процессом лактации, и, как следствие, отрицательным энергетическим балансом.
Ген cla-r отвечает за синтез редуктазы конъюгированной линолевой кислоты и приводит к образованию конъюгированной линолевой кислоты (CLA), которая образуется как один из промежуточных продуктов метаболизма в рубце жвачных животных (40). Butyrivibrio fibrisolvens имеет самый высокий потенциал продукции CLA (41). Увеличение экспрессии гена cla-r у коров II группы в 3,3 раза (p ≤ 0,05) могло быть связано с ростом численности типичного обитателя рубца — бактерии Butyrivibrio fibrisolvens филума Firmicutes . Это соединение привлекло значительное внимание исследователей как вещество, благоприятно влияющее на здоровье человека и животных. Основным источником CLA для человека служат молочные продукты (42).
Таким образом, изменение рациона сухостойных и дойных коров, связанное с повышением доли крахмала, способствовало снижению содержания в рубце целлюлозолитических бактерий семейств Ruminococcaceae и Lachnospiraceae и возрастанию обилия бактерий семейства Prevotellaceae , связанных с разложением крахмала. Наблюдались изменения в экспрессии генов микроорганизмами рубца при рационах, содержащих разные количества клетчатки и легкоусвояемых полисахаридов. Показано, что экспрессия гена L-лактатдегидрогеназы увеличивалась в группе лактирующих коров. Это, вероятно, связано с более высоким содержанием лактата в рубце животных, потребляющих высокие концентрации легкоусвояемых углеводов, содержащихся в комбикормах, а также с формированием адаптивных механизмов в микробном сообществе рубца. Это косвенно подтверждается и увеличением экспрессии гена фосфофруктокиназы — одного из регулирующих ферментов гликолиза у лактирующих коров. Увеличение доступности углеводов в комбикорме способствует интенсификации процесса гликолиза рубцовыми микроорганизмами. В связи с этим ген L-лактатдегидрогеназы, на наш взгляд, можно рассматривать как кандидат в биомаркеры, которые способны дать представление об активности процессов синтеза молочной кислоты и о снижении pH в рубце коров.
Список литературы Особенности экспрессии генов микробного сообщества рубца коров в период сухостоя и лактации
- Sammad A., Khan M.Z., Abbas Z., Hu L., Ullah Q., Wang Y., Zhu H., Wang Y. Major nutritional metabolic alterations influencing the reproductive system of postpartum dairy cows. Metabolites, 2022, 12(1): 60 (doi: 10.3390/metabo12010060).
- Dieho K., Dijkstra J., Schonewille J.T., Bannink A. Changes in ruminal volatile fatty acid production and absorption rate during the dry period and early lactation as affected by rate of increase of concentrate allowance. Journal of Dairy Science, 2016, 99(7): 5370-5384 (doi: 10.3168/jds.2015-10819).
- Offner А., Bach А., Sauvant D. Quantitative review of in situ starch degradation in the rumen. Animal Feed Science and Technology, 2003, 106(1-4): 81-93 (doi: 10.1016/S0377-8401(03)00038-5).
- Fernando S.C., Purvis H.T. II, Najar F.Z., Sukharnikov L.O., Krehbiel C.R., Nagaraja T.G., Roe B.A., DeSilva U. Rumen microbial population dynamics during adaptation to a high grain diet. Applied and Environmental Microbiology, 2010, 76(22): 7482-7490 (doi: 10.1128/AEM.00388-10).
- Penner G.B., Beauchemin K.A., Mutsvangwa T. Severity of ruminal acidosis in primiparous Holstein cows during the periparturient period. Journal of Dairy Science, 2007, 90(1): 365-375 (doi: 10.3168/jds.S0022-0302(07)72638-3).
- Brown M.S., Krehbiel C.R., Galyean M.L., Remmenga M.D., Peters J.P., Hibbard B., Robinson J., Moseley W.M. Evaluation of models of acute and subacute acidosis on dry matter intake, ruminal fermentation, blood chemistry, and endocrine profiles of beef steers. Journal of Animal Science, 2000, 78(12): 3155-3168 (doi: 10.2527/2000.78123155x).
- Bevans D.W., Beauchemin K.A., Schwartzkopf-Genswein K.S., McKinnon J.J., McAllister T.A. Effect of rapid or gradual grain adaptation on subacute acidosis and feed intake by feedlot cattle. Journal of Animal Science, 2005, 83(5): 1116-1132 (doi: 10.2527/2005.8351116x).
- Górka P., Kowalski Z.M., Pietrzak P., Kotunia A., Jagusiak W., Holst J.J., Guilloteau P., Zabielski R. Effect of method of delivery of sodium butyrate on rumen development in newborn calves. Journal of Dairy Science, 2011, 94(11): 5578-5588 (doi: 10.3168/jds.2011-4166).
- Reynolds C.K., Dürst B., Lupoli B., Humphries D.J., Beever D.E. Visceral tissue mass and rumen volume in dairy cows during the transition from late gestation to early lactation. Journal of Dairy Science, 2004, 87(4): 961-971 (doi: 10.3168/jds.S0022-0302(04)73240-3).
- Bannink A., Gerrits W.J.J., France J., Dijkstra J. Variation in rumen fermentation and the rumen wall during the transition period in dairy cows. Animal Feed Science and Technology, 2012, 172(1-2): 80-94 (doi: 10.1016/j.anifeedsci.2011.12.010).
- Schroeder J.W. Feeding and managing the transition dairy cow. NDSU Extension Service. North Dakota State University, Fargo, North Dakota, 2001.
- Jolicoeur M.S., Brito A.F., Santschi D.E., Pellerin D., Lefebre D., Berthiaume R., Girard C.L. Short dry period management improves peripartum ruminal adaptation in dairy cows. Journal of Dairy Science, 2014, 97(12): 7655-7667 (doi: 10.3168/jds.2014-8590).
- Pitta D.W., Kumar S., Vecchiarelli B., Shirley D.J., Bittinger K., Baker L.D., Ferguson J.D., Thomsen N. Temporal dynamics in the ruminal microbiome of dairy cows during the transition period. Journal of Animal Science, 2014, 92(9): 4014-4022 (doi: 10.2527/jas.2014-7621).
- Bach A., López-García A., Gonzaliez-Recio O., Elcoso G., Fàbregas F., Chaucheyras-Durand F., Castex M. Changes in the rumen and colon microbiota and effects of live yeast dietary supplementation during the transition from the dry period to lactation of dairy cows. Journal of Dairy Science, 2019, 102(7): 6180-6198 (doi: 10.3168/jds.2018-16105).
- Steele M.A., Croom J., Kahler M., Al Zahal O., Hook S.E., Plaizier K., McBride B.W. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1515-R1523 (doi: 10.1152/ajpregu.00120.2010).
- Kalckar H.M. Differential spectrophotometry of purine compounds by means of specific enzymes; studies of the enzymes of purine metabolism. Journal of Biological Chemistry, 1947, 167(2): 461-475.
- Fujihara T., Shem M.N. Metabolism ofmicrobial nitrogen in ruminants with special reference to nucleic acids. Journal of Animal Science, 2011, 82(2): 198-208 (doi: 10.1111/j.1740-0929.2010.00871.x).
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods, 2001, 25(4): 402-408 (doi: 10.1006/meth.2001.1262).
- Fernando S.C. Meta-functional genomics of the bovine rumen. Oklahoma State University, 2008.
- Zhang X., Zhang S., Shi Y., Shen F., Wang H. A new high phenyl lactic acid-yielding Lactobacillus plantarum IMAU10124 and a comparative analysis of lactate dehydrogenase gene. FEMS Microbiology Letters, 2014, 356(1): 89-96 (doi: 10.1111/1574-6968.12483).
- Huang Y., You C., Liu Z. Cloning of D-lactate dehydrogenase genes of Lactobacillus delbrueckii subsp. bulgaricus and their roles in d-lactic acid production. 3 Biotech, 2017, 7(3): 194 (doi: 10.1007/s13205-017-0822-6).
- Wen S., Chen X., Xu F., Sun H. Validation of reference genes for real-time quantitative PCR (qPCR) analysis of Avibacterium paragallinarum. PLoS ONE, 2016, 11(12): e0167736 (doi: 10.1371/journal.pone.0167736).
- Henderson G., Cox F., Ganesh S., Jonker A., Young W., Global Rumen Census Collaborators, Janssen P.H. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range. Scientific Reports, 2015, 5: 14567 (doi: 10.1038/srep14567).
- Sheida E.V., Lebedev S.V., Ryazanov V.A., Miroshnikov S.A., Rakhmatullin Sh.G., Duskaev G.K. Changes in the taxonomic composition of the rumen microbiome during the dietary supplements administration. IOP Conference Series: Earth and Environmental Science, 2021, 848(1): 012058 (doi: 10.1088/1755-1315/848/1/012058).
- Xie X., Yang C., Guan Le L., Wang J., Xue M., Liu J.X. Persistence of cellulolytic bacteria Fibrobacter and Treponema after short-term corn stover-based dietary intervention reveals the potential to improve rumen fibrolytic function. Frontiers in Microbiology, 2018, 9: 1363 (doi: 10.3389/fmicb.2018.01363).
- Abbas W., Howard J.T., Paz H.A., Hales K.E., Wells J.E., Kuehn L.A., Erickson G.E., Spangler M.L., Fernando S.C. Influence of host genetics in shaping the rumen bacterial community in beef cattle. Scientific Reports, 2020, 10(1): 15101 (doi: 10.1038/s41598-020-72011-9).
- Rukkwamsuk T., Kruip T.A., Meijer G.A., Wensing T. Hepatic fatty acid composition in periparturient dairy cows with fatty liver induced by intake of a high energy diet in the dry period. American Dairy Science Association, 1999, 82(2): 280-287 (doi: 10.3168/jds.S0022-0302(99)75234-3).
- Le Bras G., Deville-Bonne D., Garel J.R. Purification and properties of the phosphofructokinase from Lactobacillus bulgaricus. A non-allosteric analog of the enzyme from Escherichia coli. European journal of biochemistry, 1991, 198(3): 683-687 (doi: 10.1111/j.1432-1033.1991.tb16067.x).
- Ronimus R.S., Morgan H.W. Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism. Archaea, 2003, 1: 199-221 (doi: 10.1155/2003/162593).
- Puckett S., Trujillo C., Eoh H., Marrero J., Spencer J., Jackson M., Schnappinger D., Rhee K., Ehrt S. Inactivation of fructose-1,6-bisphosphate aldolase prevents optimal cocatabolism of glycolytic and gluconeogenic carbon substrates in Mycobacterium tuberculosis. PLoS Pathogens, 2014, 10(5): e1004144 (doi: 10.1371/journal.ppat.1004144).
- Brissac T., Ziveri J., Ramond E., Tros F., Kock S., Dupuis M., Brillet M., Barel M., Peyriga L., Cahoreau E., Charbit A. Gluconeogenesis, an essential metabolic pathway for pathogenic Francisella. Molecular Microbiology, 2015, 98(3): 518-534 (doi: 10.1111/mmi.13139).
- Huang Y., You C., Liu Z. Cloning of D-lactate dehydrogenase genes of Lactobacillus delbrueckii subsp. bulgaricus and their roles in D-lactic acid production. Biotechnology, 2017, 7(3): 194 (doi: 10.1007/s13205-017-0822-6).
- Hernández J., Benedito J.L., Abuelo A., Castillo C. Ruminal acidosis in feedlot: from aetiology to prevention. The Scientific World Journal, 2014, 2014: 702572 (doi: 10.1155/2014/702572).
- Bell A. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation. Journal of Animal Science, 1995, 73(9): 2804-2819 (doi: 10.2527/1995.7392804x).
- Galushko A.S., Schink B. Oxidation of acetate through reactions of the citric acid cycle by Geobacter sulfurreducens in pure culture and in syntrophic coculture. Archives of Microbiology, 2000, 174(5): 314-332 (doi: 10.1007/s002030000208).
- Takahashi-Iñiguez T., García-Hernandez E., Arreguín-Espinosa R., Flores M.E. Role of vitamin B12 on methylmalonyl-CoA mutase activity. Journal of Zhejiang University Science B, 2012, 13(6): 423-437 (doi: 10.1631/jzus.B1100329).
- Stine Z.E., Altman B.J., Hsieh A.L., Gouw A.M., Dang C.V. Deregulation of the cellular energetics of cancer cells. In: Pathobiology of human disease. /L.M. McManus, R.N. Mitchell (eds.). Academic Press, San Diego, CA, USA, 2014: 444-455 (doi: 10.1016/B978-0-12-386456-7.01912-2).
- Fujihara T., Shem M.N. Metabolism of microbial nitrogen in ruminants with special reference to nucleic acids. Journal of Animal Science, 2011, 82(2): 198-208 (doi: 10.1111/j.1740-0929.2010.00871.x).
- Fukuda S., Furuya H., Suzuki Y., Asanuma N., Hino T. A new strain of Butyrivibrio fibrisolvens that has high ability to isomerize linoleic acid to conjugated linoleic acid. Journal of Applied Microbiology, 2005, 51(2): 105-113 (doi: 10.2323/jgam.51.105).
- Harfoot C.G., Hazlewood G.P. Lipid metabolism in the rumen. In: The rumen microbial ecosystem. 2nd ed. /P.N Hobson, C.S. Stewart (eds.). Springer, Dordrecht, 1997: 382-426 (doi: 10.1007/978-94-009-1453-7_9).
- Houseknecht K.L., Heuvel J.P.V., Moya-Camarena S.Y., Portocarrero C.P., Peck L.W., Nickel K.P., Belury M.A. Dietary conjugated linoleic acid normalizes impaired glucose tolerance in the Zucker diabetic fattyfa/farat. Biochemical and Biophysical Research Communications, 1998, 244(3): 678-682 (doi: 10.1006/bbrc.1998.8303).
- Rainio A., Vahvaselka M., Suomalainen T., Laakso S. Reduction of linoleic acid inhibition in production of conjugated linoleic acid by Propionibacterium fredenreichii ssp. shermanii. Canadian Journal of Microbiology, 2001, 47(8): 735-740 (doi: 10.1139/W01-073).


