Особенности эндокринного аппарата поджелудочной железы после введения N-ацетилцистеина в модели острого постлучевого панкреатита
Автор: Демяшкин Г.А., Угурчиева Д.И., Якименко В.А., Вадюхин М.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Исследования постлучевых поражений поджелудочной железы (ПЖЖ) после облучения заряженными частицами (электроны, протоны) немногочисленны. Установлена эффективность применения некоторых антиоксидантов для снижения диапазона и глубины постлучевых повреждений ПЖЖ. Однако механизмы радиационно-индуцированного повреждения ПЖЖ окончательно не раскрыты, а исследования ее эндокринного аппарата после облучения электронами единичны. Цель - оценка экспрессии инсулина и глюкагона в панкреатических островках после введения N-ацетилцистеина в модели острого постлучевого панкреатита.
Поджелудочная железа, инсулоциты, глюкагоноциты, облучение электронами, n-ацетилцистеин
Короткий адрес: https://sciup.org/14130553
IDR: 14130553 | УДК: 615.849.12 | DOI: 10.34014/2227-1848-2024-2-166-174
Текст научной статьи Особенности эндокринного аппарата поджелудочной железы после введения N-ацетилцистеина в модели острого постлучевого панкреатита
Введение. В настоящее время высокая вероятность развития постлучевых состояний обусловлена применением ионизирующего излучения в медицине, а также риском техногенных катастроф. Были разработаны многочисленные нормы (Радиационная защита и безопасность источников излучения: международные основные нормы безопасности МАГАТЭ, 2015) и правила (СанПиН 2.6.1.2523-09 «Нормы радиационной безопасности НРБ-99/2009» от 7.07.2009), регламентирующие надзор за радиоактивностью, однако актуальной остается разработка методов профилактики и лечения постлучевых поражений органов [1].
Исследования постлучевых поражений поджелудочной железы после облучения заряженными частицами (электроны, протоны) немногочисленны, однако электронотерапия является одним из перспективных методов в радиобиологии и может быть использована для моделирования острого постлучевого панкреатита [2].
Исследователи обнаружили эффективность применения некоторых антиоксидантов для снижения диапазона и глубины постлучевых повреждений поджелудочной железы [3, 4]. Одним из препаратов, обладающих антиоксидантной активностью, является N-аце- тилцистеин, который препятствует развитию оксидативного стресса путем связывания свободных радикалов после воздействия заряженных частиц [5].
В подавляющем большинстве морфологических исследований функциональную оценку эндокринной активности поджелудочной железы осуществляли по уровням двух ключевых гормонов, ответственных за регуляцию углеводного обмена, – инсулина и глюкагона. Некоторые авторы описывали резкое снижение содержания этих гормонов и, как следствие, подтверждали недостаточность эндокринного аппарата поджелудочной железы в модели сахарного диабета после введения, например, стрептозоцина или D-галактозы [6, 7]. Их токсический эффект во многом схож с действием ионизирующего излучения и в большей степени заключается в генерации высоких концентраций свободных радикалов, запускающих гибель клеток поджелудочной железы путем апоптоза.
Однако механизмы радиационно-индуцированного повреждения поджелудочной железы окончательно не раскрыты, а исследования ее эндокринного аппарата после облучения электронами единичны. Кроме того, интересным представляется изучение функционального статуса эндокринных клеток поджелудочной железы, защищенных от воздействия ионизирующего излучения введением N-ацетилцистеина. Полученные результаты в будущем могут послужить основой для разработки эффективных мер профилактики острого постлучевого панкреатита.
Цель исследования. Оценка экспрессии инсулина и глюкагона в панкреатических островках после введения N-ацетилцистеина в модели острого постлучевого панкреатита.
Материалы и методы. Крысы линии Wistar (n=60) были поделены на четыре экспериментальные группы:
I (n=10) – контрольная, в которой вводили раствор NaCl 0,9 %;
-
II (n=20) – фракционное локальное облучение электронами в суммарной облучающей дозе (СОД) 25 Гр;
-
III (n=20) – интраперитонеальное введение N-ацетилцистеина в дозе 120 мг/кг за 1 ч
до локального облучения электронами в СОД 25 Гр;
-
IV (n=10) – интраперитонеальное введение N-ацетилцистеина в дозе 120 мг/кг.
Локальное облучение животных электронами проводили на линейном акселераторе NOVAC-11. Животных всех групп выводили из эксперимента путем введения высоких доз анестетика через неделю после последней фракции. Все манипуляции выполняли согласно Международным рекомендациям по проведению медико-биологических исследований с использованием животных (ЕЭС, Страсбург, 1985) и Хельсинкской декларации Всемирной медицинской ассоциации.
При проведении гистологического исследования фрагменты поджелудочной железы фиксировали в растворе забуференного формалина, после проводки в автоматическом режиме заливали в парафиновые блоки, готовили серийные срезы (толщиной 2 мкм), депарафинировали, дегидратировали и окрашивали гематоксилином и эозином. Гистологические микропрепараты изучали под микроскопом Leica DM2000 с микрофотосъемкой. Оценивали степень повреждения поджелудочной железы по стандартным критериям с применением балльной шкалы от 0 до 3 баллов [8].
При иммуногистохимическом исследовании в качестве первичных использовали поликлональные антитела к цитоплазматическому антигену β-клеток – Insulin (Cell Marque, EP125; 1:300) и цитоплазматическому антигену α-клеток – Glucagon (Cell Marque, 259A-15; 1:100). Для определения вторичных антител применяли универсальную двухкомпонентную систему детекции HiDef Detection™ HRP Polymer system (Cell Marque, США), анти-IgG мыши/кролика, пероксидазу хрена (HRP) и субстрат DAB. Ядра клеток докрашивали гематоксилином Майера. Подсчет количества иммунопозитивных клеток проводили в 10 случайно отобранных полях зрения при увеличении ×400 (в %). Полученные количественные данные переводили в баллы в соответствии со шкалой: 0 баллов – менее 5 % позитивных клеток в островке поджелудочной железы, 1 балл – 6–25 % позитивных клеток в островке поджелудочной железы, 2 бал- ла – 26–50 % позитивных клеток, 3 балла – более 50 % позитивных клеток в островке поджелудочной железы [9].
Полученные в результате подсчёта данные обрабатывали с использованием компьютерной программы SPSS 12 for Windows statistical software package (IBM Analytics, США). Данные выражали как среднее значение и стандартное отклонение. Сравнения проводили с использованием дисперсионного анализа. Статистический анализ полученных данных выполняли с помощью теста Крускала – Уоллиса и U-теста Манна – Уитни с поправкой Бонферрони. Различия при p<0,05 считали статистически значимыми.
Результаты. При гистологическом анализе образцов поджелудочной железы через неделю после фракционного локального облучения электронами в СОД 25 Гр были обнаружены признаки острого постлучевого панкреатита: кистозное расширение и вакуолизация ацинусов – 2 балла, фокальный некроз паренхимы – 1 балл, отек – 3 балла, лимфоцитарная инфильтрация – 2 балла, а также геморрагии – 2 балла (рис. 1).
Введение N-ацетилцистеина в III группе привело к снижению диапазона и глубины постлучевого повреждения поджелудочной железы: расширение и вакуолизация ацинусов – 1 балл, фокальный некроз паренхимы – 0 баллов, отек – 2 балла, лимфоцитарная инфильтрация – 1 балл, а также геморрагии – 0 баллов (рис. 1).
При иммуногистохимическом исследовании в панкреатических островках контрольной группы выявили окрашивание эндокринных клеток с антителами к инсулину (3 балла) и глюкагону (2 балла). Через неделю после воздействия фракционного облучения электронами в СОД 25 Гр наблюдали снижение уровней экспрессии инсулина (в 2,2 раза; 2 балла) и глюкагона (в 1,5 раза; 1 балл) по сравнению с контрольной группой. В группе предлучевого введения N-ацетилцистеина через неделю после облучения электронами в СОД 25 Гр количество иммунопозитивных эндокринных клеток было приближено к контрольным значениям: инсулин – в 1,5 раза меньше (2–3 балла), глюкагон – в 1,2 раза меньше (2 балла) (рис. 1). В IV группе не обнаружили достоверных различий по сравнению с контрольной группой как при морфологическом, так и при иммуногистохимическом исследовании (табл. 1).
Таблица 1
Table 1
Иммуногистохимическая характеристика распределения инсулина и глюкагона в панкреатических островках контрольной и опытных групп
Immunohistochemical characteristics of insulin and glucagon distribution in pancreatic islets (control and experiment)
|
Группа Group |
Инсулин, % Insulin, % |
Глюкагон, % Glucagon, % |
|
Контроль Control |
73,1±3,2 |
38,4±1,6 |
|
Облучение Irradiation |
32,7±1,3* |
24,5±0,9* |
|
Облучение + N-АЦ Irradiation + N-АC |
49,3±2,1* |
33,1±1,2* |
|
N-АЦ N-АC |
70,6±2,5 |
36,8±1,5 |
Примечание. * – статистически значимые различия по сравнению с контролем (р<0,05), N-АЦ – N-ацетилцистеин.
Note. * – the differences are statistically significant compared with the control (р<0.05), N-AC – N-acetyl-cysteine.
Гл.
Glu.
Контроль
Облучение
Облучение + N-АЦ
Control Irradiation Irradiation + N-AC
ГЭ
Инс.
Ins.
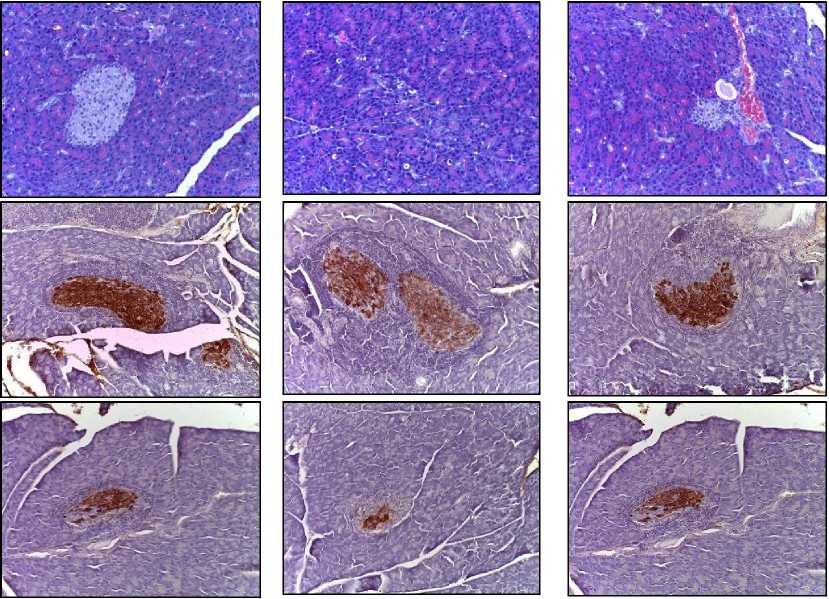
Рис. 1. Поджелудочная железа контрольной и опытных групп.
Верхний ряд – морфологическая картина, окрашивание гематоксилином и эозином (ГЭ), ×400.
Средний ряд – иммуногистохимическая картина с антителами к инсулину (Инс.), ×400.
Нижний ряд – иммуногистохимическая картина с антителами к глюкагону (Гл.), ×400.
N-АЦ – N-ацетилцистеин
Fig. 1. Pancreas of control and experimental groups.
Middle row – immunohistochemical picture with insulin (Ins.) antibodies, ×400 magnification.
Bottom row – immunohistochemical picture with glucagon (Glu.) antibodies, ×400 magnification.
N-AC – N-acetylcysteine
Обсуждение. Известно, что ионизирующее излучение запускает прямые (генерация сшивок/разрывов ДНК, хромосомных аберраций) и косвенные (оксидативный стресс в результате генерации активных форм кислорода и азота, других продуктов радиолиза воды, продуктов перекисного окисления липидов и др.) механизмы гибели клеток поджелудочной железы на фоне недостаточности факторов антиоксидантной защиты [10]. Ключевым каскадом в этом процессе считается апоптоз, однако не следует исключать возможности активации и других путей, например ферроптоза, митохондриально-опосредованного некроза и др. [11, 12]. Это сопровождается уменьшением пула функционально активных клеток островков поджелудочной железы с развитием локальных признаков воспаления, что подтверждает обнаруженный нами через неделю после облучения электронами морфологический паттерн, соответствующий острому постлучевому панкреатиту.
Воздействие фракционного облучения электронами приводит к резкому снижению количества функционально активных клеток островков поджелудочной железы, ответственных за синтез двух основных гормонов-антагонистов, обеспечивающих метаболизм глюкозы, – инсулина и глюкагона. Обнаруженные нами иммуногистохимические изменения подтверждают снижение экспрессии этих гормонов в островках поджелудочной железы облученных животных (II группа). Так, можно говорить о значительном уменьшении синтетической активности инсулоци-тов (β-клеток) и глюкагоноцитов (α-клеток) в результате их лучевого повреждения.
Некоторые авторы пришли к выводу, что лучевое повреждение островков поджелудочной железы на поздних сроках может приводить к развитию сахарного диабета на фоне снижения уровня инсулина плазмы крови [13, 14]. Кроме того, Х-облучение всего тела в дозе 6 Гр в эксперименте на мышах увеличивало риск отдаленного развития инсулинорези-стентности, изменения эпигенома и нарушения деления прогениторных клеток, особенно у животных, находящихся на высокожировой диете [15]. Несмотря на то что облучение электронами в нашем исследовании было локальным, что снижает риск развития инсулинорезистент-ности в жировой ткани и скелетных мышцах (в отличие от Х-облучения всего тела), не исключено увеличение риска развития сахарного диабета в отдаленные сроки, связанного со снижением активности эндокринного аппарата поджелудочной железы. Однако необходимо проведение дальнейших, более детальных исследований с применением современных методов молекулярно-генетического анализа.
На основании перечисленных выше механизмов радиационной гибели эндокринных клеток поджелудочной железы можно говорить о ведущей роли оксидативного стресса в этом процессе. Ввиду несостоятельности за- щитно-приспособительных механизмов антиоксидантной системы целесообразным представляется применение субстратов, обладающих антиоксидантной активностью, одним из которых, вероятно, является N-ацетилцистеин, что подтверждается результатами, полученными в нашем исследовании, и работами других авторов.
Механизм антиоксидантного действия N-ацетилцистеина в поджелудочной железе окончательно не изучен, однако можно предполагать, что он заключается в индукции физиологической защиты организма и связывании продуктов радиолиза воды, что оказывает тормозное влияние на генерацию новых цитотоксичных свободных радикалов [16, 17]. Хотя точное раскрытие механизмов антиоксидантного действия N-ацителцистеина и нуждается в проведении новых исследований, посвященных молекулярно-биологической оценке его свойств, наше исследование в сочетании с единичными результатами, полученными другими авторами [18], демонстрирует вероятный протективный эффект предлуче-вого введения этого препарата с незначительной степенью радиационно-индуцированных морфологических и иммуногистохимических изменений по сравнению с группой контроля.
Заключение. При иммуногистохимическом исследовании функционального статуса α- и β-клеток поджелудочной железы было выявлено, что локальное облучение электронами в СОД 25 Гр через неделю приводит к снижению их эндокринной активности, которая частично сохраняется после предлучевого введения N-ацетилцистеина, что указывает на его протективный эффект.
Список литературы Особенности эндокринного аппарата поджелудочной железы после введения N-ацетилцистеина в модели острого постлучевого панкреатита
- Singh V.K., Seed T.M. Pharmacological management of ionizing radiation injuries: current and prospective agents and targeted organ systems. Expert Opin Pharmacother. 2020; 21 (3): 317-337. DOI: 10.1080/14656566.2019.1702968.
- Donya M., RadfordM., ElGuindy A., Firmin D., Yacoub M.H. Radiation in medicine: Origins, risks and aspirations. Glob Cardiol Sci Pract. 2014; 2014 (4): 437-448. DOI: 10.5339/gcsp.2014.57.
- Cervelli T., Panetta D., Navarra T., Gadhiri S., Salvadori P., Galli A., Caramella D., Basta G., Picano E., Del Turco S. A New Natural Antioxidant Mixture Protects against Oxidative and DNA Damage in Endothelial Cell Exposed to Low-Dose Irradiation. Oxid Med Cell Longev. 2017; 2017: 9085947. DOI: 10.1155/2017/9085947.
- Campesi I., Brunetti A., Capobianco G., Galistu A., Montella A., Ieri F., Franconi F. Sex Differences in X-ray-Induced Endothelial Damage: Effect of Taurine and N-Acetylcysteine. Antioxidants. 2023; 12: 77. DOI: 10.33 90/antiox12010077.
- Topcu A., Mercantepe F., Rakici S., Tumkaya L., Uydu H.A., Mercantepe T. An investigation of the effects of N-acetylcysteine on radiotherapy-induced testicular injury in rats. Naunyn Schmiedebergs Arch Pharmacol. 2019; 392 (2): 147-157. DOI: 10.1007/s00210-018-1581-6.
- Amin A., Lotfy M., Mahmoud-Ghoneim D., Adeghate E., Al-Akhras M., Al-Saadi M., Al-Rahmoun S., HameedR. Pancreas-protective effects of chlorella in STZ-induced diabetic animal model: insights into the mechanism. Journal of Diabetes Mellitus. 2011; 1: 36-45. DOI: 10.4236/jdm.2011.13006.
- El-Far A.H., Lebda M.A., Noreldin A.E., Atta M.S., Elewa Y.H.A., Elfeky M., Mousa S.A. Quercetin Attenuates Pancreatic and Renal D-Galactose-Induced Aging-Related Oxidative Alterations in Rats. Int J Mol Sci. 2020; 21 (12): 4348. DOI: 10.3390/ijms21124348.
- El Agaty S., Asmaa I.A. Pathophysiological and immunohistochemical analysis of pancreas after renal ischemia/reperfusion injury: protective role of melatonin. Archives of Physiology and Biochemistry. 2020; 126 (3): 264-275. DOI: 10.1080/13813455.2018.1517182.
- Mercantepe F., Tümkaya L., Mercantepe T., Yilmaz Rakici S. The effects of coenzyme Q10 (CoQ10) on ionizing radiation-induced pancreatic ß-cell injury. Endocrinol Res Pract. 2023; 27 (3): 127-134. DOI: 10.5152/erp.2023.23245.
- Reisz J.A., Bansal N., Qian J., Zhao W., Furdui C.M. Effects of ionizing radiation on biological molecules-mechanisms of damage and emerging methods of detection. Antioxid Redox Signal. 2014; 21 (2): 260-292. DOI: 10.1089/ars.2013.5489.
- Lei G., Mao C., Yan Y., Zhuang L., Gan B. Ferroptosis, radiotherapy, and combination therapeutic strategies. Protein Cell. 2021; 12 (11): 836-857. DOI: 10.1007/s13238-021-00841-y.
- Jiao Y., Cao F., Liu H. Radiation-induced Cell Death and Its Mechanisms. Health Phys. 2022; 123 (5): 376-386. DOI: 10.1097/HP.0000000000001601.
- Baek J.Y., Lim D.H., Oh D., Nam H., Kim J.J., Lee J.H., Min B.H., Lee H. Increased Risk of Diabetes after Definitive Radiotherapy in Patients with Indolent Gastroduodenal Lymphoma. Cancer Res Treat. 2022; 54 (1): 294-300. DOI: 10.4143/crt.2021.073.
- Bacarella N., Ruggiero A., Davis A.T. Whole Body Irradiation Induces Diabetes and Adipose Insulin Resistance in Nonhuman Primates. Int J Radiat Oncol Biol Phys. 2020; 106 (4): 878-886. DOI: 10.1016/ j.ijrobp.2019.11.034.
- Nylander V., Ingerslev L.R., Andersen E., Fabre O., Garde C., Rasmussen M., Citirikkaya K., Bäk J., Christensen G.L., AznarM., SpechtL., Simar D., BarresR. Ionizing Radiation Potentiates High-Fat Diet-Induced Insulin Resistance and Reprograms Skeletal Muscle and Adipose Progenitor Cells. Diabetes. 2016; 65 (12): 3573-3584. DOI: 10.2337/db16-0364.
- Ezerina D., Takano Y., Hanaoka K., Urano Y., Dick T.P. N-Acetyl Cysteine Functions as a Fast-Acting Antioxidant by Triggering Intracellular H2S and Sulfane Sulfur Production. Cell Chem Biol. 2018; 25 (4): 447-459.e4. DOI: 10.1016/j.chembiol.2018.01.011.
- MinatiM.A., LibertM., Dahou H., Jacquemin P., AssiM. N-Acetylcysteine Reduces the Pro-Oxidant and Inflammatory Responses during Pancreatitis and Pancreas Tumorigenesis. Antioxidants. 2021; 10 (7): 1107. DOI: 10.3390/antiox10071107.
- Yilmaz H., Mercantepe F., Tumkaya L., Mercantepe T., Yilmaz A., Yilmaz R.S. The potential antioxidant effect of N-acetylcysteine on X-ray ionizing radiation-induced pancreas islet cell toxicity. Biochem Bio-phys Res Commun. 2023; 685: 149154. DOI: 10.1016/j.bbrc.2023.149154.


