Особенности кишечной микробиоты у пациентов с воспалительными заболеваниями кишечника
Автор: Лагутина С.Н., Чижков П.А., Зуйкова А.А., Есина Е.Ю., Добрынина И.С., Скуратова О.С., Сыромятников М.Ю.
Журнал: Juvenis scientia @jscientia
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.9, 2023 года.
Бесплатный доступ
Введение. Воспалительные заболевания кишечника (ВЗК) занимают лидирующие позиции в структуре заболеваний желудочно-кишечного тракта (ЖКТ), так как являются прогрессирующей хронической патологией с аутоиммунным типом воспаления. Изменение показателей микробиоты кишечника может определять морфологические изменения на латентном этапе заболевания. Цель исследования. Оценка родо-видового биоразнообразия микробиоты у пациентов с ВЗК. Пациенты и методы. Выполнено секвенирование 16S рРНК микробиоты кишечника у 15 пациентов с подтвержденным язвенным колитом (ЯК) и 20 здоровых лиц, которые являлись контрольной группой. Проведен анализ показателей общего анализа крови и уровня С-реактивного белка (СРБ). Для статистического анализа использовали программы Microsoft Excel и Statistica. Результаты. Среди исследуемых лабораторных показателей у пациентов с ВЗК было отмечено значительное увеличение уровня СРБ, лейкоцитов и нейтрофилов по сравнению с группой контроля. В результате секвенирования кишечной микробиоты у пациентов с ВЗК выявлено снижение нормобиоты, а также увеличение содержания представителей патогенного кластера. Заключение. Выявлено снижение биоразнообразия микробиоты у пациентов с ВЗК по сравнению с группой контроля. Также наблюдалось значимое изменение патогенного кластера и дисбаланс представителей Bacteroidetesи Firmicutes.
Воспалительные заболевания кишечника, язвенный колит, секвенирование, микробиота кишечника, родо-видовое биоразнообразие, нормобиота, патогенный кластер
Короткий адрес: https://sciup.org/14127825
IDR: 14127825 | DOI: 10.32415/jscientia_2023_9_3_5-11
Текст научной статьи Особенности кишечной микробиоты у пациентов с воспалительными заболеваниями кишечника
В настоящее время воспалительные заболевания кишечника (ВЗК) занимают лидирующие позиции в структуре заболеваний желудочно-кишечного тракта (ЖКТ). ВЗК являются прогрессирующими хроническими заболеваниями с аутоиммунным типом воспаления, основными из них являются язвенный колит (ЯК), болезнь Крона. Длительность и степень тяжести воспалительного процесса приводят к высокому риску развития осложнений, в том числе колоректального рака. Именно бактериальный состав толстой кишки способен изменяться под воздействием различных факторов, что является эффективным средством для поддержания противовоспалительного состояния. В настоящее время известно, что при ВЗК наблюдается повышение уровня провоспалительных цитокинов: фактора некроза опухоли α (ФНО- α ) и различных интерлейкинов (ИЛ) [1]. При ЯК в развитии хронического воспаления участвуют клетки Th2 и Th17, продуцирующие различные цитокины. Основную роль во взаимодействии с микробиотой кишечника может играть ИЛ-33. Сигнальная ось ИЛ-33/ ST2 вовлекается в патогенез ВЗК через индукцию ИЛ-4. Данный механизм способен определять тяжесть аутоиммунного воспаления в активной фазе заболевания, когда уже происходит образование язвенных дефектов в слизистой оболочке кишечника. Количественное и качественное изменение родового и видового составов кишечной микробиоты может определять признаки патологического воспаления на латентной стадии [2, 3]. Изучение представителей кишечной микробиоты может привести к обнаружению новых диагностических признаков, влияющих на эффективность лекарственной терапии, а также исход заболевания.
ЦЕЛЬ РАБОТЫ
Изучение родо-видового состава микробиоты кишечника у пациентов с ВЗК.
ПАЦИЕНТЫ И МЕТОДЫ
Было выполнено секвенирование 16S рРНК микробиоты кишечника у 15 пациентов с подтвержденным (по результатам колоноскопии с прицельной биопсией) язвенным колитом и 20 здоровых лиц, которые являлись контрольной группой. Критерием включения в основную группу являлся первично установленный на амбулаторном этапе диагноз ЯК. Критерием исключения являлось проведение в течение последних трех месяцев терапии антибактериальными и гормональными препаратами. Пациенты получали симптоматическую терапию, которая включала в себя прием спазмолитических (мебеверин/дротаверин) и про-тиводиарейных (смектит диоктаэдрический/лопер-амид) препаратов. Все пациенты осуществляли сбор биоматериала (кал) в стерильный контейнер объемом 5 мл, после чего он был подвержен заморозке до проведения секвенирования 16S рРНК. Замораживание кала при подготовке к секвенированию проводилось при температуре –80 °C в лабораторных условиях. Тяжесть атаки определялась согласно индексу Мейо. Сформированные группы были сопоставимы по полу и возрасту. У всех исследуемых был проведен анализ показателей общего анализа крови (ОАК: показатели лейкоцитарной формулы, скорость оседания эритроцитов (СОЭ)), С-реактивного белка (СРБ). Анализ полученных данных проводился с использованием программ Microsoft Excel, Statistica. Количественные данные были описаны с помощью медианы (Me), значений нижнего и верхнего квартилей (Q1-Q3). Сравнение двух групп по количественному признаку, распределение которого отличалось от нормального, проводилось с помощью U-критерия Манна-Уитни. Различия в значении показателя между признаками считали значимыми при p<0,05.
РЕЗУЛЬТАТЫ
Среди пациентов с ВЗК индекс Мейо был равен 2 баллам (легкая степень тяжести) у 45% (пациенты с ЯК), 4 баллам (средняя степень тяжести) у 33%, 6 баллам (тяжелая степень) у 22%. Среди исследуемых лабораторных показателей у пациентов с ВЗК было отмечено значительное увеличение СОЭ, лейкоцитов, нейтрофилов по сравнению с группой контроля (табл. 1).
В результате секвенирования кишечной микробиоты было выявлено отсутствие или крайне низкое значение показателей нормобиоты у пациентов с ВЗК (табл. 2).
Таблица 1
|
Показатели |
Статистические показатели |
Значения |
|
Контрольная группа |
||
|
Лейкоциты, (×109/л) |
Ме |
3,8 |
|
Q1 - Q3 |
3,1-4,9 |
|
|
Нейтрофилы палочкоядерные, (%) |
Ме |
5 |
|
Q1 - Q3 |
1-8 |
|
|
Нейтрофилы сегментоядерные, (%) |
Ме |
56 |
|
Q1 - Q3 |
48-70 |
|
|
СОЭ, мм/ч |
Ме |
7 |
|
Q1 - Q3 |
1-12 |
|
|
Пациенты с ВЗК (ЯК) |
||
|
Лейкоциты, (×109/л) |
Ме |
6,1 |
|
Q1 - Q3 |
2,3-26,5 |
|
|
Нейтрофилы палочкоядерные, (%) |
Ме |
20 |
|
Q1 - Q3 |
12-36 |
|
|
Нейтрофилы сегментоядерные, (%) |
Ме |
68 |
|
Q1 - Q3 |
56-90 |
|
|
СОЭ, мм/ч |
Ме |
10 |
|
Q1 - Q3 |
1-54 |
|
Результаты лабораторной диагностики
Отмечалось увеличение показателей патогенного кластера, что также может настораживать в отношении воспалительных процессов и риска развития колоректального рака (табл. 3).
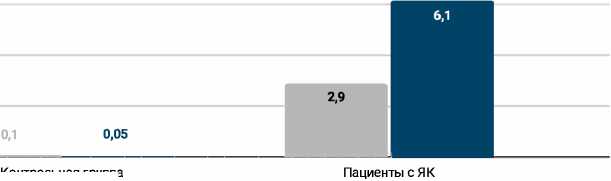
При оценке кластера сульфатредуцирую-щих бактерий отмечалось значительное увеличение доли бактерий родов Desulfovibrio и Methanobrevibacter — 2,9% и 6,1%, соответственно (рис. 1).
Были выявлены прямые, статистически значимые корреляционные связи между показателями Desulfovibrio , Methanobrevibacter и уровнем СРБ (p=0,012, p=0,044, соответственно), а также между Fusobacterium и уровнем СОЭ (p=0,017).
Таблица 2
Показатели нормальной микробиоты кишечника у пациентов с ВЗК
|
Состав бактерий, % |
Статистические показатели |
Значения |
|
Контрольная группа |
||
|
Lactobacterium (0,02%-0,1%) |
Ме |
0,02 |
|
Q1 - Q3 |
0-0,3 |
|
|
Bifidobacterium (0,1%-1%) |
Ме |
0,5 |
|
Q1 - Q3 |
0,2-3,1 |
|
|
Faecalibacterium (5%-9%) |
Ме |
6,3 |
|
Q1 - Q3 |
4,8-9,1 |
|
|
Bacteroides (9%-19%) |
Ме |
9,5 |
|
Q1 - Q3 |
7-15,7 |
|
|
Пациенты с ВЗК (ЯК) |
||
|
Lactobacterium (0,02%-0,1%) |
Ме |
0,01 |
|
Q1 - Q3 |
0-0,02 |
|
|
Bifidobacterium (0,1%-1%) |
Ме |
0,01 |
|
Q1 - Q3 |
0-0,02 |
|
|
Faecalibacterium (5%-9%) |
Ме |
0,1 |
|
Q1 - Q3 |
0-6,1 |
|
|
Bacteroides (9%-19%) |
Ме |
0,6 |
|
Q1 - Q3 |
0-5,8 |
|
ОБСУЖДЕНИЕ
Увеличение количества представителей типа Firmicutes может настораживать в отношении воспалительных процессов и новообразований, за счет выделения активных метаболитов, которые способствуют значительному снижению барьера слизистой, что напрямую может способствовать развитию новообразований [3].
Увеличение представителей сульфатредуци-рующей группы бактерий может говорить о степени тяжести основного заболевания. Благодаря своей уникальной способности превращать водород и углекислый газ в метан Desulfovibrio и Methanobrevibacter помогают эффективно расщеплять пищевые волокна, а также влияют на иммунные клетки организма и выработку антибак-
б
О
Контрольная группа
■ Desulfovibrio, % ■ Methanobrevibacter, %
Рисунок 1. Оценка состава сульфатредуцирующих бактерий у пациентов с ВЗК.
Таблица 3
Показатели патогенной микрофлоры кишечника у пациентов с ВЗК
Бутират-продуцирующие бактерии синтезируют важный метаболит, необходимый для защиты целостности эпителиального барьера кишечника и сохранения иммунного гомеостаза хозяина за счет дифференцировки регуляторных Т-клеток [6]. Снижение уровня бутирата вызывает дисфункцию кишечного эпителиального барьера и приводит к экспрессии нескольких воспалительных маркеров [7, 8].
ЗАКЛЮЧЕНИЕ
По результатам проведенного исследования выявлено уменьшение родо-видового биоразнообразия нормальной микробиоты кишечника у пациентов с ВЗК по сравнению с группой контроля. Исследование кишечной микробиоты может позволить обнаружить новые диагностические признаки и способствовать раннему выявлению заболеваний кишечника и выработке дифференцированных подходов к лечению.
Финансирование: Исследование было выполнено при финансовой поддержке УМНИК (№ 88696-У).
Список литературы Особенности кишечной микробиоты у пациентов с воспалительными заболеваниями кишечника
- Burakova I, Smirnova Y, Gryaznova M, et al. The Effect of Short-Term Consumption of Lactic Acid Bacteria on the Gut Microbiota in Obese People. Nutrients. 2022;14(16):3384. DOI: 10.3390/nu14163384.
- Loke YL, Chew MT, Ngeow YF, et al. Colon Carcinogenesis: The Interplay Between Diet and Gut Microbiota. Front Cell Infect Microbiol. 2020;10:603086. DOI: 10.3389/fcimb.2020.603086.
- Caparrós E, Wiest R, Scharl M, et al. Dysbiotic microbiota interactions in Crohn’s disease. Gut Microbes. 2021;13(1):1949096. DOI: 10.1080/19490976.2021.1949096.
- Glassner KL, Abraham BP, Quigley EMM. The microbiome and inflammatory bowel disease. J Allergy Clin Immunol. 2020;145(1):16-27. DOI: 10.1016/j.jaci.2019.11.003.
- Torres J, Mehandru S, Colombel JF, Peyrin-Biroulet L. Crohn’s disease. Lancet. 2017;389(10080):1741-1755. DOI: 10.1016/S0140-6736(16)31711-1.
- Gajendran M, Loganathan P, Catinella AP, Hashash JG. A comprehensive review and update on Crohn’s disease. Dis Mon. 2018;64(2):20-57. DOI: 10.1016/j.disamonth.2017.07.001.
- He Y, Hu Y, Yuan M, et al. Prognostic and therapeutic implication of m6A methylation in Crohn disease. Medicine (Baltimore). 2022;101(51):e32399. DOI: 10.1097/MD.0000000000032399.
- Sokol H, Landman C, Seksik P, et al. Fecal microbiota transplantation to maintain remission in Crohn’s disease: a pilot randomized controlled study. Microbiome. 2020;8(1):12. DOI: 10.1186/s40168-020-0792-5.


