Особенности клинического течения злокачественной листовидной опухоли молочной железы
Автор: Щеголькова Татьяна А., Германович Наталья Ю., Печетов Алексей А., Жаворонкова Ольга И., Глотов Андрей В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 4 т.12, 2022 года.
Бесплатный доступ
Листовидные (филлоидные) опухоли молочной железы являются редкой патологией в онкологии, не превышающие 1% [1]. Заболевание встречается у женщин любого возраста, чаще в 40-50 лет [2,3]. На ранних стадиях развития заболевание не имеет специфических клинических симптомов и диагностических признаков. Так, по данным Wang (2017), в некоторых случаях клинический диагноз можно установить только при гистологическом исследовании удаленного материала. Представляем собственное клиническое наблюдение листовидной злокачественной опухоли (ЗЛО) молочной железы [4]. У пациентки И., 50 лет, с 2014 года установлен диагноз фиброзно-кистозная мастопатия (ФКМ). Длительное время находилась на диспансерном наблюдении, без отрицательной динамики. При очередном плановом обследовании выявлено очаговое образование в правой молочной железе неправильной формы, цитологическая картина фиброаденомы. За два года наблюдения опухолевый узел увеличился в 4 раза. Выполнена трепан-биопсия, заключение - листовидная опухоль молочной железы без признаков злокачественного роста. Представлена дальнейшая тактика ведения пациентки. Выводы: Женщинам, имеющим подобные образования в молочной железе, необходим мультидисциплинарный подход. При больших размерах опухолевого узла и быстром росте методом выбора морфологической верификации является core-биопсия с последующим гистологическим и иммуногистохимическим исследованием. Своевременная правильная диагностика позволяет поставить диагноз на ранних этапах.
Листовидная опухоль, злокачественная листовидная опухоль, фиброаденома, дифференциальная диагностика опухолей молочной железы
Короткий адрес: https://sciup.org/140296535
IDR: 140296535 | DOI: 10.18027/2224-5057-2022-12-4-50-57
Текст научной статьи Особенности клинического течения злокачественной листовидной опухоли молочной железы
Листовидные (филлоидные) опухоли молочных желез являются редкой патологией в онкологии, частота их не превышает 1% от всех опухолей молочной железы [1]. Заболевание встречается у женщин любого возраста от 10 до 70 лет, преимущественно — 40–50 лет, и лишь несколько случаев были зарегистрированы у мужчин на фоне гинекомастии [2,3]. Листовидная опухоль характеризуется быстрым ростом, склонностью к малигнизации, рецидивированию до 31,5%. При озлокачествлении листовидной опухоли возможно системное метастазирование в 20% случаев, при этом в легкие — 66% и менее 1 % — в аксиллярные лимфатические узлы [2,5–9].
Этиология и патогенез листовидной опухоли на данный момент точно не известна, однако ряд авторов считают, что индукция ее может происходить из-за факторов роста, продуцируемых эпителием молочной железы, а также из-за гормонального дисбаланса, в первую очередь, эстрогенов. С молекулярно-генетических позиций показано, что у носителей герминальной миссенс-мутации R1699W гена BRCA1 высока вероятность развития злокачественной листовидной опухоли, а аллельные потери в локусе D22S264 гена
TP5 определяют прогрессирование болезни [1,6]. Патогенез развития ЛО связывают с гиперэкспрессией эпителиального лиганда WNT, что коррелирует с активацией стромального сигнального пути WNT. Гиперэкспрессия и мутации генов NF1, RB1, PIK3CA, EGFR, TP53 и ERBB4 ассоциированы с ма-лигнизацией листовидных опухолей. В процессе малигни-зации строма становится независимой от эпителиального компонента, и появляется автономный стромальный рост. Листовидная опухоль отличается от других опухолевых заболеваний МЖ потенциальной возможностью трансформации в саркому при больших размерах [1,3,6,10].
История впервые описанного случая гетерогенной фиброэпителиальной опухоли уходит в 1838 г., когда впервые J. Muller. описал данное образование, дав ей название cystosarcoma phyllodes (с греч. sarcoma — появление плоти, и phyllon — листовидный), так как на разрезе, макропрепарат напоминает вид капустного листа [3,5]. Всемирная организация здравоохранения в 1995 году в разделе фиброэпителиальных новообразований выделила группу листовидных опухолей, разделив их на доброкачественные, пограничные и злокачественные с распределением 60%,
20% и 20% соответственно [6,11–13]. Особенно сложна диагностика листовидных опухолей небольших размеров (до 5 см) [3,5,9,14]. По данным C.L. Chua, из 106 больных с филлодной опухолью в 71 % случаев цитологически в предоперационный период был установлен диагноз фиброаденома молочной железы [3]. Анализируя данные различных авторов, информативность цитологического исследования на амбулаторном этапе при ЛО составляет до 30%, и даже с учетом применения дополнительных методов исследования частота правильного предоперационного диагноза не превышает 10%, при злокачественности— 25%. Поэтому окончательный диагноз возможно поставить только при гистологическом исследовании всего удаленного препарата [3,4,11,14].
Представляем собственное клиническое наблюдение ЛЗО молочной железы у пациентки с длительным анамнезом.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ ПАЦИЕНТКИ И., 50 ЛЕТ
Больная наблюдается у маммолога-онколога с 2014 года, диагноз — ФКМ. В 2018 г. на маммографии отмечена отрицательная динамика (по сравнению с 2017 г.) в виде появления образования в правой молочной железе размером до 1,7 см, BI-RADS III (по стандартизированной шкале оценки результатов маммографии). УЗИ МЖ: справа в нижне-наружном квадранте солидное образование неоднородной эхоструктуры, размером до 1,8 см, с достаточно четкими, но неровными контурами. BI-RADS III (рис. 1). Снимки из медицинского архива пациентки.
В январе 2019 г. выполнена ТАБ указанного образования: фиброаденома правой молочной железы с гиперплазией кубического эпителия. Пациентка консультирована маммологом-онкологом рекомендована core-биопсия образования, однако по причине ухудшения эпидемической ситуации в связи с новой коронавирусной инфекцией (COVID-19) манипуляция не была выполнена.
На протяжении двух лет пациентка динамически наблюдалась у онколога-маммолога, выполняли плановые инструментальные обследования молочных желез, без попытки верификации образования. На протяжении 4 лет отмечалось постепенное увеличение опухолевого узла до 2,2 см (данные маммографии от апреля 2021 г. в правой молочной железе определяется округлое образование с неровными контурами общим размером до 2,2 × 2,1 см, BI-RADS III .
В ноябре 2021 г. после перенесенного заболевания COVID-19 пациентка при пальпации отметила увеличение образования в правой молочной железе. По УЗИ молочных желез — справа объемное неоднородно солидное образование размером до 2,5 см, BI-RADS III. Пациентка осмотрена маммологом по месту жительства, назначено медикаментозное лечение с последующим динамическим наблюдением.
Через месяц, в декабре 2021 г., больная отметила болезненность в области уплотнения, а также увеличение
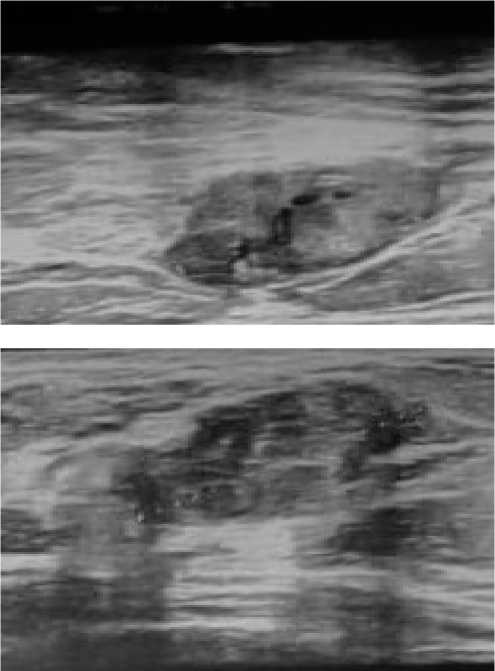
Рисунок 1. УЗ картина образования в молочной железе.
правой молочной железы в объеме. По результатам УЗИ молочных желез — справа преимущественно в наружных квадрантах и субареолярно лоцируется образование размером до 53 мм, внутренняя эхоструктура образования представлена чередованием тканевого компонента с щелевидными жидкостными участками (рис. 2). Заключение: эхографическая картина не позволяет исключить процесс абсцедирования на фоне мастита и/или деструкции в опухолевом образовании (учитывая данные предыдущих исследований). Снимки и заключение из медицинского архива пациентки (рис. 2).
Пациентка была экстренно направлена маммологом на госпитализацию с диагнозом: нелактационный мастит справа. При госпитализации по лабораторным, инструментальным исследованиям, повторной биопсии правой молочной железы данных за воспалительный процесс не обнаружено, больная была выписана из отделения с рекомендациями о повторной консультации онколога-маммолога.
Повторно выполнена ТАБ образования правой молочной железы по назначению врача онколога. Результат цитологического исследования: признаки воспалительного процесса без атипии. В декабре 2021 г. проведена маммография: в правой молочной железе на границе наружных квадрантов определяется тень образования дольчатой формы с нечетким контуром размером до 7,3 × 7,9 см. Аксил-
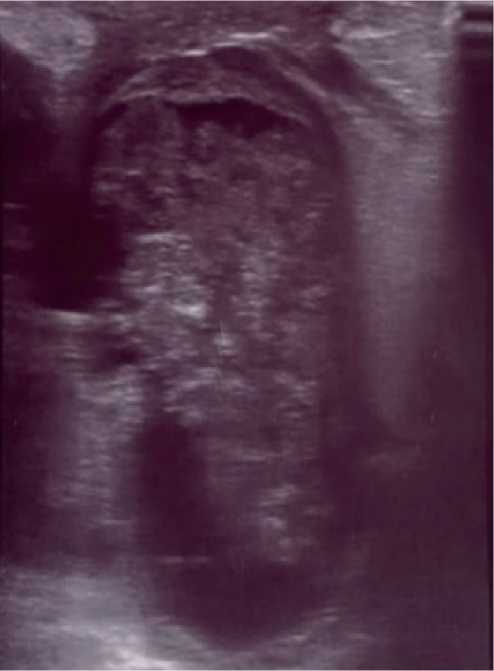
Рисунок 2. УЗИ образования в молочной железе (динамика через 3 года после выявления).
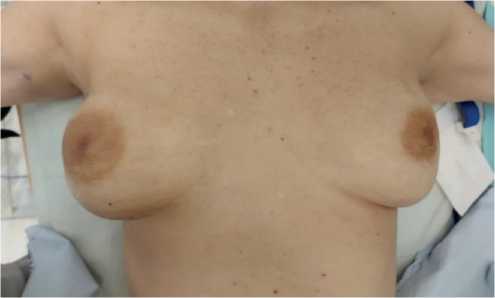
Рисунок 3. Внешний вид пациентки до операции
лярные лимфатические узлы — без особенностей. Учитывая малую информативность цитологического заключения, пациентке выполнена трепанобиопсия. Морфологическое заключение (от 28.12.21 г.): листовидная опухоль молочной железы с неопределенным потенциалом злокачественности.
В январе 2022 г. пациентка обратилась за консультацией к маммологу-онкологу в НМИЦ хирургии им. А. В. Вишневского, в связи с деформацией правой молочной железы, прогрессирующим ростом опухоли.
Локальный статус: молочные железы асимметричные за счет увеличения правой молочной железы. Область соска и ареолы без особенностей. Выделений из сосков нет. При пальпации правой молочной железы отмечается уплотнение с нечеткими границами, размерами до 8 см, локализовано преимущественно в наружных квадрантах, с переходом на внутренние, плохосмещаемое. Регионарные лимфатические узлы не увеличены (рис. 3).
УЗИ молочных желез (использован конвексный датчик) в правой молочной железе в наружных квадрантах и субареолярно, с переходом на внутренние квадранты, визуализируется образование (размером более 7,6 × 6 см), неправильной формы, с бугристым контуром и гетерогенной эхоструктурой, которая представлена чередованием слоев «компактного» солидного компонента повышен-
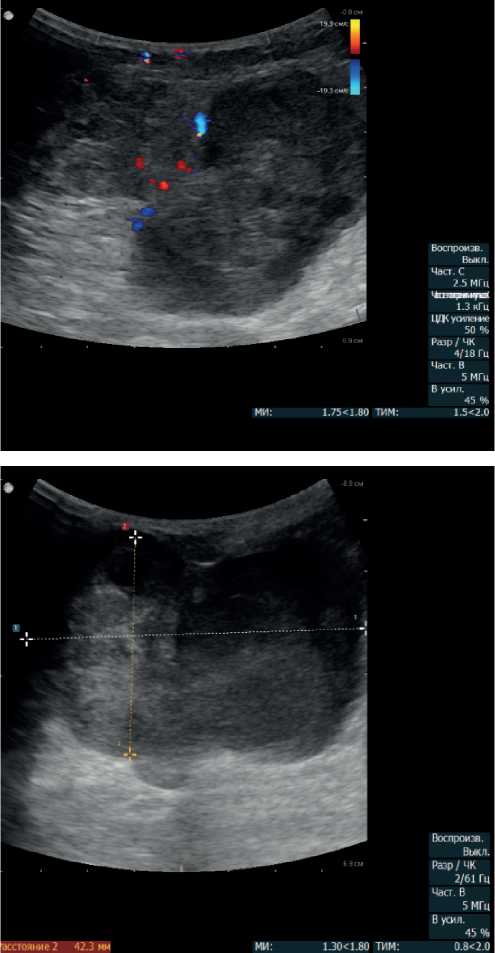
Рисунок 4. УЗИ образования в молочной железе (динамика через 4 года от момента выявления).
ной эхогенности и разрозненных гипоэхогенных участков по типу щелевидных «дефектов» с густым жидкостным компонентом. В режиме цветового допплеровского картирования определяются разноплановые сосудистые локусы как в структуре образования, так и по периферии. Регионарные лимфатические узлы: справа отмечается лимфатический узел размером до 9 × 4 мм сохранением дифференциацией на слои (рис. 4.).
Пересмотр гистологических препаратов в патологоанатомическом отделении НМИЦ хирургии им. А.В. Вишневского показал, что образование имеет строение листовидной опухоли с очагами остеоидной и хондроидной дифференцировки, признаками атипии стромальных клеток и высокой клеточностью. Заключение: листовидная опухоль правой молочной железы с признаками клеточной атипии.
Принимая во внимания результаты гистологического исследования, быстрый рост опухолевого узла (7,6 × 6,0 × 7,0 см), пожелание пациентки, предложено хирургическое лечение в объеме — простая мастэктомия справа с отсроченной реконструкцией.
Послеоперационный период без особенностей, пациентка в удовлетворительном состоянии выписалась на 8 сутки после операции.
Заключительное патологоанатомическое исследование препарата: при макроскопическом исследовании в толще ткани молочной железы выявлен белесоватосерый опухолевый узел дольчатого вида, с относительно четкой границей с окружающей тканью железы. Опухоль расположена на 0,2 см от кожи и 1,5 см от фасциального края (рис. 5.)
Гистологическое заключение: опухолевый узел представлен листовидной опухолью (рис. 6а) с преобладанием участков выраженной плотноклеточной пролиферации стромального компонента с полиморфизмом ядер клеток. Встречаются фигуры патологических митозов. Помимо гомологичного злокачественного стромального компонента в опухоли присутствуют крупные зоны остеоидной дифференцировки с атипией остеобластов, а также хондроидной дифферецировки с атипией (рис. 6б, в). Имеются небольшие участки сохранившихся листовидных структур с гиперплазией эпителия и участками малоклеточной гиалинизированной стромы, частично некротизированных.
Заключение: злокачественная листовидная опухоль правой молочной железы размерами 8,8 × 7,0 × 5,0 см. Злокачественный стромальный компонент с преобладанием фибробластического компонента и наличием остео-бластического (рис. 6б) и хондробластического (рис. 6в) вариантов строения. В краях ткани железы без элементов опухоли. Grade 3.
pT2 pN0 (0/2) cM0; Grade 3; M9020/3, Pn0, L0, V0, R0.
Пациентка консультирована химиотерапевтом, назначена системная терапия, тактика выбрана согласно лечению стромальных опухолей, сарком. Находится под амбулаторным наблюдением в НМИЦ хирургии им. А.В. Вишневского с февраля 2022 г. По результатам УЗИ
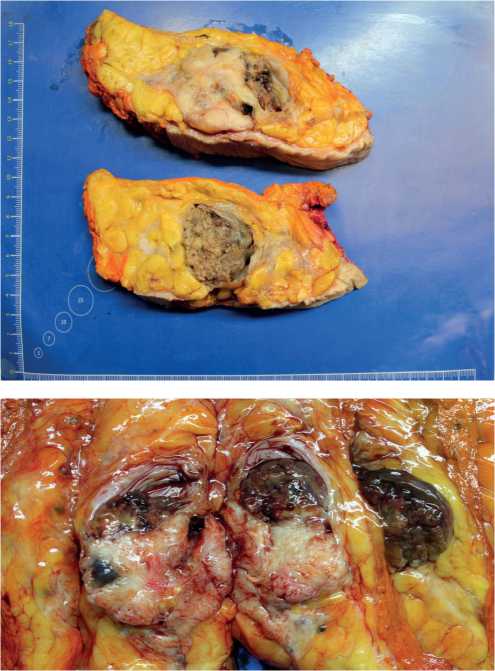
Рисунок 5. Макрофотография опухоли в разрезе.
послеоперационного рубца (август 2022 г.) — без признаков рецидива опухоли.
Листовидная опухоль представляет собой диагностическую дилемму как для маммологов, так и для лучевых диагностов, и для патоморфологов [12].
Мультимодальная инструментальная оценка на ранних этапах развитиях не всегда имеет однозначные дифференциально диагностические критерии, характерные исключительно для ЛО, однако многофакторный анализ клинического течения в совокупности с данными инструментальных методов исследования и морфологического заключения позволяют поставить верный диагноз [9,15].
Среди инвазивных методов диагностики ТАБ признана малоинформативным методом, так как достоверна лишь в 30% случаях [2,4,14]. Возможно, материал взят из обширных полостей (щелей), особенно сложна диагностика листовидных опухолей небольших размеров (до 5 см) [7,13]. Данная особенность определяет технический нюанс и при планировании и выполнении core-биопсии. Забор материала должен быть выполнен из разных отделов опухоли, количество полученных полноценных фрагментов ткани (биоптатов) из опухоли — не менее 4, в условиях отсутствия признаков значимой васкуляризации образования — до 6 [4,15]. Известно, что для листовидной опухоли характерно явление стромальной метаплазии с появлением участков хрящевой или костной ткани. В них также
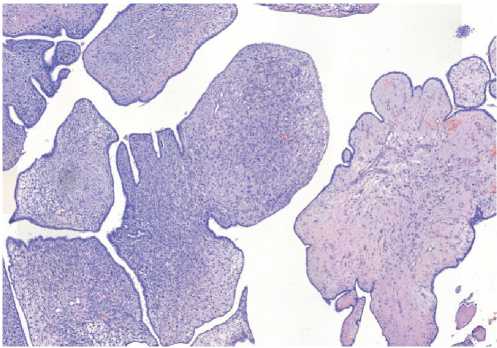
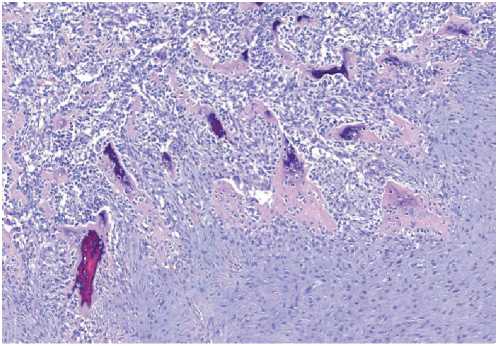
Рисунок 6а. Микрофотография. Участки листовидных структур с участками относительно малоклеточной гиалинизированной стромы и плотноклеточной пролиферации. Увеличение × 50.
могут быть явления атипии вплоть до появления признаков, характерных для хондросаркомы или остеосаркомы [17]. При выполнении трепан-биопсии может возникнуть диагностическая трудность в дифференциальной диагностике с первичной саркомой молочной железы, а также метапластической карциномой. Для ЗЛО характерно следующие морфологические характеристики: выраженный ядерный полиморфизм, высокая клеточность и митотическая активность, выраженное преобладание стромального компонента, вплоть до полного исчезновения эпителиальных структур в полях зрения. Отличительной особенностью метапластической карциномы в сравнении с листовидной опухолью является диффузная экспрессия маркеров эпителиальной дифференцировки (p63, высокомолекулярные цитокератины) [16].
Согласно клиническим рекомендациям от 2016 года, при больших доброкачественных ЛО, деформирующих молочную железу, показана мастэктомия, без лимфаденэктомии, при ЗЛО мастэктомия сочетается с системной терапией. Энуклеация даже при небольших размерах недопустима (частота местных рецидивов после секторальной резекции — 20%, а после энуклеации — 100%) [1,2,5,6,18–20].
Анализ практических рекомендаций по лечению сарком мягких тканей (СМТ) показывает, что морфологическая диагностика представляет большую сложность вследствие значительной гетерогенности опухолей даже внутри одного гистологического подтипа. Трансформация и дедифференцировка доброкачественной опухоли мягких тканей в злокачественную встречается, но редко. В настоящее время выделяется более 100 гистологических подтипов, требующих различных подходов к лечению. Оперативное вмешательство при местно-распространённых формах СМТ проводят с учетом принципов футлярности и зональности, с отступом > 1 см. При отсутствии опухолевых клеток в краях резекции (R0) послеоперационная
Рисунок 6б. Микрофотография. Зона остеоидной дифферен цировки с атипией остеобластов. Увеличение × 100.
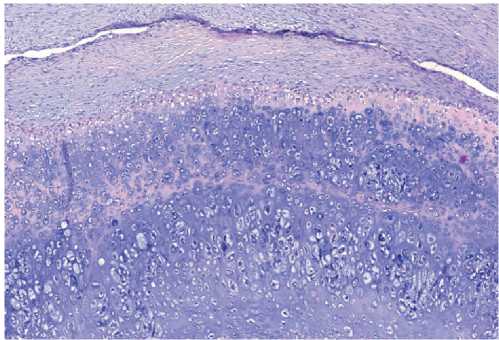
Рисунок 6в. Микрофотография. Зона хондроидной дифферецировки с атипией хондроцитов. Увеличение × 100.
ЛТ не требуется. При II–III стадии опухолевого процесса наиболее часто используют химиотерапию (ХТ) доксорубицин, ифосфамид, дакарбазин. Стандартом ХТ диссеминированных СМТ I линии является комбинированный режим «доксорубицин + ифосфамид» [21].
В заключение хотелось бы отметить, что точная доопе-рационная диагностика листовидных опухолей, благодаря команде специалистов разных областей, позволяет успешно планировать хирургическое лечение [8].
Выводы. Анализ клинического примера позволяет заключить, что при своевременном современном комплексном подходе в диагностике можно избежать выполнения калечащих операций и минимизировать рецидив опухоли.
Список литературы Особенности клинического течения злокачественной листовидной опухоли молочной железы
- Корженкова Г. П., Касымова А. А. Злокачественная листовидная опухоль на примере клинического случая /// Вестник рентгенологии и радиологии .- 2021 .- Т. 102 .- № 3 .- С. 178-182 .- https://doi.org/10.20862/0042-4676-2021-102-3-178-182 .
- Волченко А. А., Пак Д. Д., Усов Ф. Н., Фетисова Е. Ю. Клинические наблюдения. Гигантская листовидная опухоль молочной железы : клинические наблюдения. Журнал «Онкохирургия», 2012, том 4, № 2.
- Zhang Y, Kleer CG. Phyllodes Tumor of the Breast : Histopathologic Features, Differential Diagnosis, and Molecular / Genetic Updates. Arch Pathol Lab Med. 2016 Jul ; 140 (7) : 665-71. https://doi.org/10.5858/arpa.2016-0042-RA. PMID:27362571..
- Ван Шу. Диссертация на соискание ученой степени кандидата медицинских наук. Выявление и лечение неэпителиальных злокачественных опухолей молочной железы. Санкт-Петербург 2017. Стр 134. 5.
- Roberts N, Runk DM. Aggressive malignant phyllodes tumor. Int J Surg Case Rep. 2015 ; 8C : 161-5. https://doi.org/10.1016/j.ijscr.2014.12.041. Epub 2015 Jan 15. PMID:25697402 ; PMCID : PMC4353966.).
- Денчик Д. А,. Воротников И. К,. Любченко Л. Н [и др.] // Особенности листовидных опухолей / Опухоли женской репродуктивной системы .- 2010 .- № 3 .- С. 21-23 .
- Rageth CJ, O'Flynn EAM, Pinker K, Kubik-Huch RA, Mundinger A, Decker T, Tausch C, Dammann F, Baltzer PA, Fallenberg EM, Foschini MP, Dellas S, Knauer M, Malhaire C, Sonnenschein M, Boos A, Morris E, Varga Z. Second International Consensus Conference on lesions of uncertain malignant potential in the breast (B3 lesions). Breast Cancer Res Treat. 2019 Apr ; 174 (2) : 279-296. https://doi.org/10.1007/s10549-018-05071-1. Epub 2018 Nov 30. Erratum in : Breast Cancer Res Treat. 2019 Jul ; 176 (2) : 481-482. PMID:30506111 ; PMCID : PMC6538569.
- Lissidini G, Mulè A, Santoro A, Papa G, Nicosia L, Cassano E, Ashoor AA, Veronesi P, Pantanowitz L, Hornick JL, Rossi ED. Malignant phyllodes tumor of the breast : a systematic review. Pathologica. 2022 Apr ; 114 (2) : 111-120. https://doi.org/10.32074/1591-951X-754. Epub 2022 Apr 13. PMID:35414723.
- Зикиряходжаев А. Д., Широких И. М. Харченко Н. В [и др.] Филлоидные опухоли молочных желез. Современное состояние проблемы // Исследования и практика в медицине .- 2017 .- Т. 4 .- № 2 .- С. 13-22 .- https://doi.org/10.17709/2409-2231-2017-4-2-2.
- Баранова И. Б., Размахаев Г. С. Листовидная (филлоидная) злокачественная опухоль молочной железы в материале тонкоигольной аспирационной пункции. Клинический случай / Новости клинической цитологии России .- 2021 .- Т. 25 .- № 4 .- С. 14-18 .- https://doi.org/10.24412/1562-4943-2021-4-0003 .
- Zhang Y, Kleer CG. Phyllodes Tumor of the Breast : Histopathologic Features, Differential Diagnosis, and Molecular / Genetic Updates. Arch Pathol Lab Med. 2016 Jul ; 140 (7) : 665-71. https://doi.org/10.5858/arpa.2016-0042-RA. PMID:27362571.).
- Lissidini G, Mulè A, Veronesi P, et al. Malignant phyllodes tumor of the breast : a systematic review. Pathologica 2022 ; 114 : 111-120.
- Григорук О. Г.,. Богатырев В. Н,. Лазарев А. Ф [и др.] Цитологическая диагностика листовидных опухолей и сарком молочной железы // Маммология .- 2005 .- № 1 .- С. 23-28.
- Chua CL, Thomas A, Ng BK. Cystosarcoma phyllodes : a review of surgical options // Surgery .- 1989 .- Vol. 105 .- P. 141-147).
- Высоцкая И. В,. Летягин В. П, Черенков В. Г. [и др.] Клинические рекомендации РООМ по профилактике РМЖ, дифференциальной диагностике, лечению, предопухолевых и доброкачественных заболеваний молочных желез. Клинические рекомендации общероссийской общественной организации Роом по диагностике и лечению РМЖ .- Москва : Издательский дом «АБВ-пресс», 2017 .- С. 91-124 .
- Lim, S. Z., Selvarajan, S., Thike, A. A. et al. Breast sarcomas and malignant phyllodes tumours : comparison of clinicopathological features, treatment strategies, prognostic factors and outcomes. Breast Cancer Res Treat 159, 229-244 (2016). https://doi.org/10.1007/s10549-016-3946-1.
- Chia Y, Thike AA, Cheok PY, Yong-Zheng Chong L, Man-Kit Tse G, Tan PH. Stromal keratin expression in phyllodes tumours of the breast : a comparison with other spindle cell breast lesions. J Clin Pathol. 2012 ; 65 (4) : 339-347. https://doi.org/10.1136/jclinpath-2011-200377.
- Ходорович О. С., Солодкий В. А., Калинина -Масри А. А. [и др.] Филлоидные опухоли молочной железы. От диагностики до патоморфологического исследования /// Опухоли женской репродуктивной системы .- 2021 .- Т. 17 .- № 3 .- С. 69-78 .- https://doi.org/10.17650/1994-4098-2021-17-3-69-78 .
- Ben Hassouna J, Damak T, Gamoudi A, Chargui R, Khomsi F, Mahjoub S, Slimene M, Ben Dhiab T, Hechiche M, Boussen H, Rahal K. Phyllodes tumors of the breast : a case series of 106 patients. Am J Surg. 2006 Aug ; 192 (2) : 141-7. https://doi.org/10.1016/j.amjsurg.2006.04.007. PMID:16860620.
- Высоцкая И. В., Летягин В. П., Черенков В. Г. [и др.] Клинические рекомендации Российского общества онкомаммологов по профилактике рака молочной железы, дифференциальной диагностике, лечению предопухолевых и доброкачественных заболеваний молочных желез. Опухоли женской репродуктивной системы .- 2016 .- Т. 12 .- № 3 .- С. 43-52 .
- Клинические рекомендации «Саркомы мягких тканей» (утв. Минздравом России). 2020. https://bazanpa.ru/minzdrav-rossii-klinicheskie-rekomendatsii-ot01012020-h4758471.


