Особенности лечебной тактики при несостоятельности желудочно-кишечного анастомоза у пациентов с морбидным ожирением после гастрошунтирования по Ру
Автор: Станкевич В.Р., Смирнов А.В., Злобин А.И., Панченков Д.Н., Данилина Е.С., Иванов Ю.В.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.14, 2023 года.
Бесплатный доступ
Обоснование. Гастрошунтирование по методу Ру является основным видом бариатрической операции. Наиболее грозным и тяжело протекающим осложнением у пациентов с морбидным ожирением после гастрошунтирования остаётся несостоятельность гастроэнтероанастомоза. Цель исследования - изучить возможности улучшения результатов лечения пациентов с ожирением при возникновении несостоятельности гастроэнтероанастомоза после операции гастрошунтирования с помощью применения новых минимально инвазивных методов. Методы. Представлено ретроспективное когортное описательное исследование, включившее всех пациентов с картиной несостоятельности гастроэнтероанастомоза после гастрошунтирования, получавших лечение в отделении хирургии ФГБУ ФНКЦ ФМБА России в 2019-2022 годах. Всего за этот период выполнено 445 операций гастрошунтирования, у 7 (1,6%) пациентов в послеоперационном периоде развилась несостоятельность гастроэнтероанастомоза. Результаты. Представлены результаты лечения несостоятельности гастроэнтероанастомоза при операциях гастрошунтирования у пациентов с морбидным ожирением. Отмечена сложность ранней диагностики несостоятельности гастроэнтероанастомоза у данной категории пациентов. Все сомнения в диагностике несостоятельности анастомоза должны завершаться ревизионной лапароскопией с интраоперационной эзофагогастроскопией. Применение минимально инвазивных методик (хирургических, эндоскопических), лекарственной терапии, адекватной нутритивной поддержки является неотъемлемым принципом современной тактики ведения пациентов с несостоятельностью анастомозов. Заключение. Использование эндоскопической внутрипросветной вакуумной аспирационной системы в лечении несостоятельности гастроэнтероанастомоза позволяет избежать распространения воспаления в брюшной полости, ускорить репаративный процесс в зоне несостоятельности и в большинстве случаев избежать программируемых санаций, значительно улучшив тем самым результаты лечения.
Морбидное ожирение, несостоятельность гастроэнтероанастомоза, гастрошунтирование по ру, эндоскопическая внутрипросветная вакуумная аспирационная система, минимально инвазивные методы
Короткий адрес: https://sciup.org/143180537
IDR: 143180537 | DOI: 10.17816/clinpract117516
Текст научной статьи Особенности лечебной тактики при несостоятельности желудочно-кишечного анастомоза у пациентов с морбидным ожирением после гастрошунтирования по Ру
The article can be used under the CC BY-NC-ND 4 license
Submitted 14.12.2022
Revised 27.03.2023
Published 30.06.2023
Как и при любой операции, после гастрошунтирования могут наблюдаться различные послеоперационные осложнения. Одним из наиболее грозных и тяжело протекающих осложнений у пациентов с морбидным ожирением после гастрошунтирования является несостоятельность гастроэнтероанастомоза (ГЭА), возникающая, по данным разных авторов, в 1–3% случаев [1]. Несостоятельность ГЭА является второй по частоте причиной послеоперационной летальности у бариатрических пациентов, уступая лишь тромбоэмболическим осложнениям [2].
Высокая послеоперационная летальность (6– 17%) при несостоятельности ГЭА, длительный и дорогостоящий период лечения и реабилитации придаёт данной проблеме большую актуальность и социально-экономическую значимость [4, 5]. Активный поиск современных и эффективных способов лечения несостоятельности ГЭА у пациентов с ожирением после операции гастрошунтирования является одним из дискутабельных вопросов в бариатрической хирургии.
Цель исследования — изучить возможности улучшения результатов лечения пациентов с ожирением при возникновении несостоятельности ГЭА после операции гастрошунтирования с помощью применения новых минимально инвазивных методов.
МЕТОДЫ
Дизайн исследования
Проведено ретроспективное когортное исследование.
Критерии соответствия
Критерии включения: в исследование включены все пациенты ( n =7), у которых за 2019–2022 годы в послеоперационном периоде после гастрошунтирования развилась несостоятельность ГЭА.
Условия проведения
Исследование проводилось на базе хирургического отделения ФНКЦ ФМБА России в 2019– 2022 годах.
Описание медицинского вмешательства
Всего за обозначенный период (2019–2022 гг.) в отделении хирургии ФГБУ ФНКЦ ФМБА России выполнено 445 операций гастрошунтирования по Ру больным морбидным ожирением. Все операции выполнены лапароскопическим доступом с использованием пяти портов. В 7 (1,6%) наблюдениях в послеоперационном периоде возникла несостоятельность ГЭА.
Исходы исследования
Основным исходом, благодаря оценке которого достигается цель исследования, были избраны случаи развития жизнеугрожающих состояний и смерти (степени хирургических осложнений IV и V по классификации Clavien–Dindo, 2004).
Этическая экспертиза
Настоящее исследование одобрено локальным этическим комитетом ФГБУ ФНКЦ ФМБА России (Протокол № 9 от 25.10.2022).
Статистический анализ
В описательной части исследования результаты представлены в виде непараметрических данных с указанием медианного значения. В связи с малым объёмом выборки статистический анализ не применялся.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Медиана возраста больных с несостоятельностью ГЭА составил 51,3 (от 42 до 58) года; мужчин было 5 (71%), женщин — 2 (29%). Индекс массы тела пациентов колебался от 44 до 57 кг/м2 (медиана 51,6). Сахарным диабетом 2-го типа страдали 6 (86%) больных. Курильщиками со стажем в данной группе были 4 (57%) пациента (с их слов, при подготовке к операции количество выкуриваемых сигарет в день снизилось вдвое). Медианный койко-день у пациентов с несостоятельностью ГЭА составил 28 (16–52) койко-дней. Медианная продолжительность операции гастрошунтирования в группе пациентов с несостоятельностью ГЭА составила 217 (160–282) минут.
Всем пациентам с несостоятельностью ГЭА бариатрическая операция выполнялась впервые. Перед операцией гастрошунтирования всем больным было рекомендовано снизить вес на 15% от избытка массы тела, придерживаясь белковой диеты, которая была подробно разъяснена за 2 недели до операции. Однако пациенты, у которых развилась несостоятельность ГЭА, смогли снизить вес перед операцией в среднем лишь на 5,6%.



Основные результаты исследования
Сроки выявления несостоятельности ГЭА составили 2–4 суток после гастрошунтирования по Ру. Основными симптомами несостоятельности ГЭА были следующие: в 100% случаев тахикардия свыше 100 уд./мин, одышка, чувство нехватки воздуха и десатурация (SpO2 <92%); в 43% (n=3) — субфебрильная температура тела; в 57% (n=4) — температура тела >38°С; в 71% (n=5) — боль в эпигастрии, левой половине грудной клетки; у всех больных (100%) отмечались лейкоцитоз выше 16х109/л и повышение уровня C-реактивного белка более чем в 6 раз относительно нормы. У 1 пациен- та на этапе диагностики не выявлено перитонеальных симптомов. Поступление нехарактерного (пенистого) отделяемого по страховочному дренажу из брюшной полости отмечено в 43% (n=3) случаев.
Для диагностики несостоятельности ГЭА использованы следующие инструментальные методы: ультразвуковое исследование (УЗИ) брюшной полости на предмет выявления свободной жидкости; рентгеноскопия с водорастворимым контрастом; компьютерная томография (КТ) с внутривенным и пероральным контрастированием; эзофагогаст-роскопия; ревизионная релапароскопия. При УЗИ свободная жидкость в брюшной полости выявлена лишь у 1 (14%) пациента. Несостоятельность ГЭА диагностирована в 71% ( n =5) случаев методом рентгеноскопии с водорастворимым контрастом, в 86% ( n =6) — методом КТ с внутривенным и пероральным контрастированием, в 86% ( n =6) — с помощью эзо-фагогастроскопии. Ревизионная релапароскопия при неподтверждённых инструментальными исследованиями признаках несостоятельности ГЭА выполнена в 1 (14%) случае. Размер выявленного дефекта в 43% ( n =3) случаев составил до 1 см, ещё в 43% ( n =3) — 1–2 см и в 14% ( n =1) — более 2 см.
При лечении всех пациентов с диагностированной несостоятельностью ГЭА использовался комплексный подход, состоящий из хирургического и эндоскопического этапов.
Основными задачами хирургического этапа являлись попытка ушивания дефекта области ГЭА, санация и дренирование данной зоны; наложение гастростомы на «большой» («отключённый») желудок в связи с необходимостью обеспечения длительного энтерального питания; ревизия брюшной полости на предмет отсутствия иной острой интра-абдоминальной патологии; взятие посева для проведения адекватной антибактериальной терапии в послеоперационном периоде.
Основные задачи эндоскопического этапа: ревизия области несостоятельности ГЭА со стороны слизистой оболочки органа; подведение к зоне дефекта на тонком назоинтестинальном зонде губки для лечения несостоятельности с помощью вакуумной аспирационной системы путём создания отрицательного внутрипросветного давления.
В 100% случаев ревизионные вмешательства выполнены лапароскопическим доступом и не потребовали конверсии.
При ревизионной операции выявленный дефект ушивали на зонде 36 Fr двухрядным швом поли-филаментной рассасывающейся нитью 3/0. После ушивания зоны несостоятельности выполнялась ревизия области ГЭА гибким эндоскопом с проведением воздушной пробы, которая в 100% случаев была отрицательной. Ретроспективный анализ показал, что ни одна попытка ушивания дефекта анастомоза не увенчалась успехом. Спустя 1–3 суток отмечалась повторная несостоятельность того же дефекта, что подтверждалось КТ-исследованием с пероральным контрастированием либо эзофа-гогастроскопией. Этот факт указывает на необходимость предполагать и предвидеть именно такой исход ревизионной операции, а именно формирование свища области ГЭА, и в обязательном порядке выполнять последующие этапы хирургического вмешательства.
Зона ГЭА дренируется двумя двухпросветными дренажами не менее 24 Fr, которые располагаются под и над анастомозом. Промывные каналы дренажей могут быть использованы для налаживания аспирационно-промывной системы. Дополнительные дренажи могут быть установлены в брюшной полости при уже развившемся перитоните. Дренажи удаляются лишь при отсутствии отделяемого по ним, отсутствии «затёков» контрастного препарата при КТ брюшной полости с пероральным контрастированием после начала перорального приёма чистых жидкостей. В наших наблюдениях это происходило на 16–50-е сутки после операции, непосредственно перед выпиской.
С целью обеспечения энтерального питания пациента во всех случаях накладывали гастростому на «большой» («отключённый») желудок. Наложение гастростомы, в отличие от еюностомы, не требует повторного хирургического реконструктивного вмешательства с наложением дополнительного анастомоза. Преимущество гастростомы перед назоинтестинальным капилляром для кормления также бесспорно. Частые дислокации капилляра при смене губки вакуумной аспирационной системы, малый диаметр просвета, не позволяющий в достаточном объёме кормить пациента, длительная привязка пациента к кровати в процессе питания безоговорочно свидетельствуют в пользу гастростомы в качестве оптимального способа доставки энергетических ресурсов в желудочно-кишечный тракт.
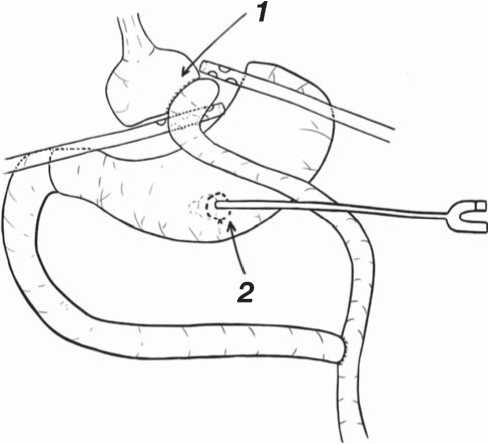
Рис. 1. Окончательный вид ревизионной релапароскопии при несостоятельности гастроэнтероанастомоза после гастрошунтирования по Ру: 1 — дренажи, подведённые к зоне несостоятельности; 2 — гастростома для питания.
Fig. 1. Final stage of the revisional relaparoscopy at gastrojejunostomy leakage after Roux-en-Y gastric bypass: 1 — drains at the leakage zone; 2 — feeding gastrostomy.
Ревизионная операция заканчивается эндоскопическим этапом — внутрипросветной установкой губки вакуумной аспирационной системы. Площадь смоделированной губки должна быть чуть больше размера дефекта ГЭА. Губка фиксируется вокруг тонкого назогастрального зонда несколькими капроновыми нитями. С помощью гастроскопа к зоне ушитой несостоятельности ГЭА под визуальным контролем подводится зонд с губкой (рис. 2, 3). После извлечения гастроскопа зонд фиксируется к носу.
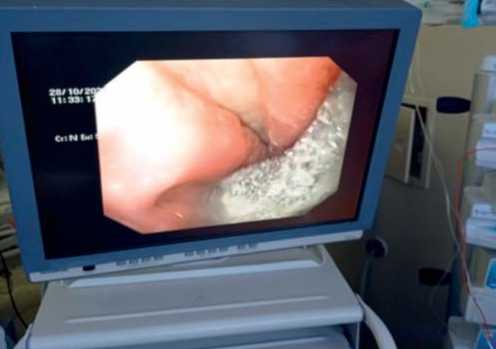
Рис. 2. Эндофото: губка на зонде установлена в области несостоятельности гастроэнтероанастомоза.
Fig. 2. Photo: A sponge on a nasogastric tube is installed in the area of gastrojejunostomy leak.
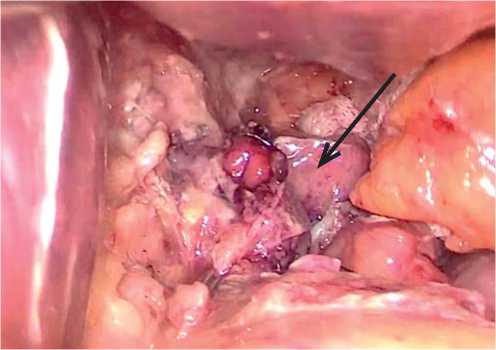
Рис. 3. Зона несостоятельности области гастроэнтероанастомоза при ревизионной релапароскопии (стрелка). Fig. 3. Zone of gastrojejunostomy leak during revision relaparoscopy (arrow).


же отсутствии «затёков» при пероральном приёме водорастворимого контрастного вещества при КТ брюшной полости.
Все пациенты после ревизионной операции находились в реанимационном отделении в течение 2–28 суток, где проводилась комплексная интенсивная терапия, направленная на стабилизацию витальных функций пациента.
Использованная тактика лечения при возникновении несостоятельности ГЭА оказалась эффективной и позволила избежать летальных исходов. Все 7 пациентов выписаны из стационара в удовлетворительном состоянии на амбулаторный этап под наблюдение хирурга.
Нежелательные явления
Следует отметить, что 1 пациенту потребовалось чрескожное дренирование поддиафрагмального абсцесса, который сформировался на 18-е сутки после ревизионной операции. Ещё у 1 пациента сформировался желудочно-плевральный свищ слева, осложнённый эмпиемой плевры на 10-е сутки после операции, что дополнительно потребовало санационной видеоторакоскопии, дренирования левой плевральной полости.
ОБСУЖДЕНИЕ
Согласно данным литературы, риск возникновения несостоятельности в области ГЭА выше у пациентов с суперожирением (индекс массы тела >50 кг/м2), в возрасте старше 60 лет, с сахарным диабетом 2-го типа, у лиц мужского пола, курильщиков, а также у повторно прооперированных [1, 2].
Диагностика несостоятельности ГЭА у пациентов с морбидным ожирением непроста. Клинические проявления перитонита можно увидеть лишь в запущенных случаях, что связано с эпидуральной анальгезией в послеоперационном периоде, а также высоким болевым порогом у пациентов с морбидным ожирением и сахарным диабетом 2-го типа. По данным ряда авторов, первыми клиническими признаками несостоятельности являются тахикардия более 100 уд./мин, одышка и десатурация в покое и при малейшем напряжении (попытка встать), гипертермия, икота, боль в эпигастрии и за грудиной. Среди наиболее часто встречаемых лабораторных признаков несостоятельности анастомоза — сохраняющиеся в течение суток высокие показатели маркеров воспаления: С-реактивный белок, лейкоцитоз, нейтрофильный сдвиг [1, 2].
Лечение несостоятельности ГЭА в большинстве случаев включает релапароскопию или релапаротомию, санацию, дренирование брюшной полости с ушиванием зоны дефекта ГЭА [3]. В некоторых случаях авторы рекомендуют выполнять ререзекцию ГЭА с формированием нового соустья, а иногда гастрэктомию [3]. Крайне редко — при микронесостоятельности ГЭА и формировании внутрибрюш-ного абсцесса — прибегают лишь к чрескожному дренированию гнойника под ультразвуковым контролем либо КТ. При лечении несостоятельности в области ГЭА используются также эндо- скопические методики, такие как установка внутрипросветных стентов, клипирование дефектов [4, 5]. Однако миграция стентов, не всегда полное обеспечение герметизма области несостоятельности и возможные осложнения при длительном их нахождении в просвете желудочно-кишечного тракта вплоть до перфорации пищевода не находят повсеместного применения при данном осложнении гастрошунтирования [6]. Зачастую при лечении несостоятельности в области ГЭА и перитонита прибегают к повторным санационным вмешательствам. При санационных вмешательствах открытым доступом риск неблагополучного исхода значительно возрастает в связи с высоким риском нагноения обширного массива мягких тканей в области лапаротомного доступа, невозможностью адекватной активизации пациента и обеспечения необходимой оксигенации из-за выраженности ожирения и развивающейся дыхательной недостаточности. Летальность в группе пациентов, прооперированных открытым (лапаротомным) доступом, увеличивается с 0,1–0,3 до 10–15% [2, 3]. Средняя продолжительность пребывания в стационаре пациентов с несостоятельностью ГЭА колеблется в пределах 12–28 койко-дней.
Ещё одна проблема при лечении пациентов с несостоятельностью ГЭА при гастрошунтировании по Ру — осуществление энтерального питания из-за необходимости исключения зоны дефекта из пассажи пищи. Решением может стать как полный отказ от энтерального питания с переходом на парентеральный тип кормления, так и выведение еюностомы, гастростомы или эндоскопическое заведение за зону анастомоза назоинтестинального капилляра [3].
Важным компонентом лечения несостоятельности ГЭА является местное лечение дефекта в зоне анастомоза. В последние годы в абдоминальной хирургии широкое распространение получило лечение перитонита с помощью вакуумной аспирационной системы путём создания отрицательного давления при сформированной лапаростоме [7, 8]. Однако, как показали практические результаты, возможно и топическое применение данной методики при подведении губки к области несостоятельности анастомоза эндоскопическим способом [8, 9]. Использование вакуумной аспирационной системы позволяет добиться следующих результатов:
-
• удаление избыточного раневого отделяемого, в том числе веществ, замедляющих заживление раны (слюна, желудочное отделяемое) [10, 11];
-
• сохранение влажной раневой среды, стимулирующей ангиогенез, усиливающей фибринолиз и способствующей функционированию факторов роста [10, 11];
-
• ускоренное снижение бактериальной обсеме-нённости тканей раны;
-
• снижение локального интерстициального отёка тканей, снижение межклеточного давления, усиление местного лимфообращения и транскапиллярного транспорта, что увеличивает скорость формирования грануляционной ткани [12];
-
• усиление местного кровообращения;
-
• деформация тканевого ложа за счёт локального отрицательного давления (это вызывает деформацию клеток вакуумируемых тканей и стимулирует миграцию и пролиферацию клеток) [12];
-
• уменьшение площади раны;
-
• формирование новых сосудов и дальнейшее улучшение качества грануляционной ткани за счёт раневой гипоксии вследствие снижения парциального давления кислорода в ране [12];
-
• сокращение затрат (губка вакуумной аспирационной системы устанавливается на срок от 3 до 5 суток, обеспечивая адекватное дренирование области несостоятельности анастомоза) [11];
-
• профилактика внутрибольничных инфекций за счёт отсутствия необходимости в санационных релапароскопиях снижает риск контаминации раневой поверхности госпитальными штаммами микроорганизмов;
-
• усиление эффекта медикаментозного лечения: за счёт усиления местного крово- и лимфообращения и транскапиллярного транспорта, улучшения перфузии раневого ложа происходит повышение концентрации в тканях раны вводимых парентерально лекарственных средств, что также повышает общую эффективность лечения [12].
Преимущество использованной лечебной тактики заключается в комплексном лечении несостоятельности ГЭА, локализации и отграничении воспалительного процесса, предупреждении развития перитонита и полиорганной недостаточности, а также местном лечении раневого дефекта с использованием эндоскопических минимально инвазивных методик. Этот подход позволяет избежать открытых санаций брюшной полости, что, несомненно, влияет на исход несостоятельности ГЭА. Данная методика не препятствует ранней активизации пациента из-за отсутствия лапаро-томной раны и позволяет минимизировать риски
кт ГА
тромбоэмболических и лёгочных осложнений, как это случается у малоподвижных пациентов в ходе санационных релапаротомий. Методика позволяет уже в первые сутки после ревизионной операции использовать энтеральное питание через установленную гастростому.
Используя данный комплекс лечебных мероприятий с применением минимально инвазивных методик, удалось избежать летальных исходов в группе бариатрических пациентов с несостоятельностью ГЭА после лапароскопических операций гастрошунтирования.
Ограничения исследования
Объём выборки нашего исследования недостаточен для формирования убедительных выводов. Выявление достаточного количества случаев несостоятельности ГЭА требует крайне длительного периода наблюдений с учётом низкого риска развития этого осложнения. Для настоящего исследования характерны все ошибки, присущие малым когортным ретроспективным исследованиям (ошибка отбора, ошибка последующего наблюдения и информационная ошибка).
ЗАКЛЮЧЕНИЕ
Исходя из представленных материалов исследования, следует обратить внимание на сложность ранней диагностики несостоятельности ГЭА у пациентов с морбидным ожирением. К сожалению, в настоящее время отсутствует 100% метод инструментальной и лабораторной диагностики этого осложнения. При подозрении на несостоятельность ГЭА следует прибегать ко всем имеющимся в клинике возможностям и методам инструментальной диагностики. Любое сомнение в сторону несостоятельности ГЭА должно завершаться диагностической лапароскопией с интраоперационной эзофагогастроскопией. Раннее выявление несостоятельности анастомоза и активная хирур- гическая тактика позволят успешно лечить данное грозное осложнение с применением минимально инвазивных методик, что немаловажно для паци- ентов с суперожирением.
Комплексное лечение несостоятельности ГЭА после лапароскопической операции гастрошунтирования по Ру, а именно использование минимально инвазивных методик (хирургических, эндоскопических), лекарственной терапии, адекватной нутритивной поддержки, является неотъемлемым принципом современной тактики ведения паци- ентов с несостоятельностью анастомозов. Использование эндоскопической внутрипросветной вакуумной аспирационной системы в лечении несостоятельности ГЭА позволит избежать распространения воспалительного процесса в брюшной полости, ускорить репаративный процесс в зоне несостоятельности и в большинстве случаев избежать программируемых санаций, значительно улучшив тем самым результаты лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. В.Р. Станкевич — выполнение хирургических операций у пациентов, написание текста статьи; А.В. Смирнов — обработка и обсуждение результатов исследования, написание текста статьи; А.И. Злобин , Д.Н. Панченков, Е.С. Данилина — поисково-аналитическая работа, обсуждение результатов исследования, написание текста статьи; Ю.В. Иванов — руководство лечением пациентов и обсуждение результатов исследования. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Список литературы Особенности лечебной тактики при несостоятельности желудочно-кишечного анастомоза у пациентов с морбидным ожирением после гастрошунтирования по Ру
- Borraez-Segura B, Orozco-Hernández JP, Anduquia-Garay F, et al. Increase in C-reactive protein as early predictor of anastomotic leakage in abdominal surgery. Cir Cir. 2022;90(6): 759–764. doi: 10.24875/CIRU.21000597
- Mocanu V, Dang J, Ladak F, et al. Predictors and outcomes of leak after Roux-en-Y gastric bypass: An analysis of the MBSAQIP data registry. Surg Obes Relat Dis. 2019;15(3): 396–403. doi: 10.1016/j.soard.2019.01.012
- Spyropoulos C, Argentou MI, Petsas T, et al. Management of gastrointestinal leaks after surgery for clinically severe obesity. Surg Obes Relat Dis. 2012;8(5):609–615. doi: 10.1016/j.soard.2011.04.222
- Blackmon SH, Santora R, Schwarz P, et al. Utility of removable esophageal covered self-expanding metal stents for leak and fistula management. Ann Thorac Surg. 2010;89(3):931–936. doi: 10.1016/j.athoracsur.2009.10.061
- Scavone G, Caltabiano G, Inì C, et al. Radiological stent placement of post sleeve gastrectomy leak: Efficacy, imaging features and post-procedure complications. Heliyon. 2022;8(1): e08857. doi: 10.1016/j.heliyon.2022.e08857
- Hirdes MM, Vleggaar FP, van der Linde K, et al. Esophageal perforation due to removal of partially covered self-expanding metal stents placed for a benign perforation or leak. Endoscopy. 2011;43(2):156–159. doi: 10.1055/s-0030-1255849
- Norman G, Shi C, Goh EL, et al. Negative pressure wound therapy for surgical wounds healing by primary closure. Cochrane Database Sys Rev. 2020;6(6):CD009261. doi: 10.1002/14651858.CD009261.pub6
- Markus A, Henrik BJ, Benedikt R, et al. Endoscopic vacuum therapy in salvage and standalone treatment of gastric leaks after bariatric surgery. Langenbecks Arch Surg. 2022;407(3): 1039–1046. doi: 10.1007/s00423-021-02365-9
- Cipolla J, Baillie DR, Steinberg SM, et al. Negative pressure wound therapy: Unusual and innovative applications. OPUS 12 Scientist. 2008;2(3):15–29.
- Cheng Y, Wang K, Gong J, et al. Negative pressure wound therapy for managing the open abdomen in non-trauma patients. Cochrane Database Syst Rev. 2022;5(5):CD013710. doi: 10.1002/14651858.CD013710.pub2
- Morell B, Murray F, Vetter D, et al. Endoscopic vacuum therapy (EVT) for early infradiaphragmal leakage after bariatric surgery-outcomes of six consecutive cases in a single institution. Langenbecks Arch Surg. 2019;404(1):115–121. doi: 10.1007/s00423-019-01750-9
- Scott RB, Ritter LA, Shada AL, et al. Endoluminal vacuum therapy for gastrojejunal anastomotic leaks after Roux-en-Y gastric bypass: A pilot study in a swine model. Surg Endosc.2016;30(11):5147–5152. doi: 10.1007/s00464-016-4823-z


