Особенности лечения больных с повреждением глотки и пищевода при переднем шейном спондилодезе
Автор: Погодина Алла Николаевна, Гринь Андрей Анатольевич, Касаткин Денис Сергеевич, Кайков Александр Константинович, Львов Александр Сергеевич, Кордонский Антон Юрьевич, Шибаев Евгений Юрьевич
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 (30), 2017 года.
Бесплатный доступ
Цель. Уточнить причины возникновения, выявить особенности повреждения и усовершенствовать тактику лечения больных с проникающим повреждениями пищевода после переднего шейного спондилодеза или в комбинации с ним. Материал и методы: За период с 01.01.2003 по 31.12.2016 годы в НИИ СП им. Н.В. Склифосовского прооперированно 24 пациента с повреждением пищевода после операции на шейном отделе позвоночника передним доступом. Инструментальная диагностика повреждения пищевода включала в себя рентгенологический (обзорная рентгенография шеи и груди, рентгеноконтрастное исследование пищевода с жидкой бариевой взвесью, фистулография, компьютерная томография шеи и средостения) и эндоскопический методы (эзофагоскопия), а также магнитно-резонансную томографию шеи. Все больные были оперированы мультидисциплинарной бригадой в составе нейрохирурга, хирурга и пластического хирурга. Результаты: Всем больным удалось восстановить или сохранить опороспособность позвоночного столба, при этом удалить инфицированные трансплантаты, при необходимости выполнить адекватную декомпрессию сосудисто-нервных образований позвоночного столба и фиксацию позвоночно-двигательного сегмента. Органосохраняющая операция на шейном отделе пищевода путем ушивания дефекта пищевода двухрядным швом в сочетании с миопластикой выполнена 21 больному. Органодеструктивные операции выполнены 2 пациентам. Умер 1 больной.Заключение: Повреждения пищевода после переднего шейного спондилодеза или в комбинации с ним остаются редким осложнением, поэтому получать большой опыт в лечении таких больных в условиях одной клиники не представляется возможным. В связи с этим любые публикации на эту тему представляют большой интерес. Учитывая неудовлетворительные результаты консервативной терапии, золотым стандартом можно считать хирургическое лечение в условиях многопрофильного стационара с участием мультидисциплинарной бригады.
Передний шейный спондилодез, повреждение, перфорация пищевода, метал- лоимпланты, тактика, лечение
Короткий адрес: https://sciup.org/143164641
IDR: 143164641
Текст научной статьи Особенности лечения больных с повреждением глотки и пищевода при переднем шейном спондилодезе
Введение. Одной из распространенных причин проникающих повреждений пищевода является его травма ятрогенного характера. По данным разных авторов, у 27,9%-44,6% больных с проникающими повреждениями пищевода осложнение возникло при диагностических и лечебных вну-трипищеводных манипуляциях, интубации трахеи, операциях на органах шеи и средостения [1, 3]. Летальность в данной группе больных достигает 13,2%. При этом, если осложнение выявлено в первые 24 часа после вмешательства и проведено своевременное хирургическое лечение, смертность составляет 7.4 %, позднее – 20.3 % [14].
Особую группу составляют пациенты с повреждением пищевода при операции на шейном отделе позвоночника. Выбор тактики и объема оперативной помощи больным с данным осложнением сложен. Повреждение пищевода сопровождается гнойно-воспалительным процессом в параэзофагеальной клетчатке и средостении, может сочетаться с дислокацией фрагментов фиксирующей системы, несостоятельным спондилодезом, недостаточным объемом декомпрессии сосудисто-невральных структур позвоночного канала. Такие повреждения при операциях на шейном отделе позвоночника являются опасными и угрожающими жизни, летальность достигает 18,2%. При этом, в структуре ятрогенных ранений пищевода частота его травмы при переднем шейном спондилодезе занимает не последнее место и случается у 0,02%-1,52% оперированных больных [2, 12, 13, 21]. К примеру, при операциях на органах шеи такое осложнение развивается у 0,50%-5,9% больных, при исследованиях с применением эзофагоскопа – у 0,03%-3,00% человек, при интубации трахеи – у 0,03%-1,70% пациентов. [1, 3, 14, 27].
Таким образом, проблема своевременной диагностики, лечения и профилактики повреждения пищевода при переднем шейном спондилодезе является актуальной и требует изучения.
Цель исследования. Уточнить причины повреждения пищевода, выявить их особенности и усовершенствовать тактику хирургического лечения данной группы больных.
Материал и методы. За период с 01.01.2003 по 10.10.2016 гг. нами проведено лечение 24 пациентов с повреждением пищевода при переднем шейном спондилодезе (ПШС). Было 16 мужчин и 8 женщин, средний возраст составил 36,0 + 2,7 лет (17 - 70 лет). В НИИ СП им. Н.В. Склифосовского повреждение пищевода произошло у 4 пострадавших, 16 пациентов были переведены из других стационаров страны. В лечебных учреждениях по месту выявления данного осложнения нами оперированы 4 больных.
С травмой шейного отдела позвоночника (ШОП) было 20 пострадавших, с цервикальной миелопатией на фоне дегенеративного поражения ШОП – 4 пациента.
Неврологический статус у пациентов с травмой шейного отдела позвоночника мы оценивали по шкале ASIA: у 10 больных имелась клиническая картина полного перерыва спинного мозга (степень А), у 2 пострадавших двигательная функция ниже уровня травмы была сохранена, но более половины ключевых мышц имели силу менее 3 баллов (степень С), у 4 больных элементы чувствительности ниже уровня поражения были сохранены (степень B), у 3 – двигательные и чувствительные расстройства отсут- ствовали (степень Е). Неврологическое состояние больных с дегенеративными заболеваниями позвоночника (ДЗП) по шкале JOA было 13, 10, 9, 9 баллов соответственно.
Экстренное хирургическое вмешательство на шейном отделе позвоночника выполнено 20 пострадавшим с осложненной и/или нестабильной травмой ШОП, 4 больным операция произведена в плановом порядке по поводу компрессионной миело- и/или радикулопатии на фоне ДЗП.
Передний шейный спондилодез с использованием вариаций межтеловых ауто- и аллотрансплантатов и фиксирующих пластин произведен 22 пациентам, удаление межпозвонкового диска без дополнительной фиксации – 1 больному. Ещё 1 пациенту с ранением пищевода на этапе доступа фиксацию из переднего доступа не проводили из-за риска развития инфекционных осложнений.
Выявлены следующие механизмы травмы пищевода: остро возникшие ранения (7 человек) и медленно прогрессирующие повреждения (17 человек). У 7 человек осложнение произошло в ходе выполнения декомпрессивно-стабилизирующей операции (защемление пищевода между пластиной и телом позвонка в момент фиксации пластины, ранение острым инструментом, повреждение пищевода ранорас-ширителем). У 12 пациентов дефект в стенке пищевода сформировался вследствие компрессии полого органа фрагментами дислоцировавшихся имплантов. И у 5 больных развился пролежень пищевода от прилежания металлоконструкции.
У больных с остро возникшим повреждением пищевода осложнение выявлялось на 1-15 сутки от момента операции (в среднем на 5,42 +1,95 сутки, n=7). Наличие перфорации пищевода у пациентов с медленно прогрессирующим повреждением его стенки диагносцированно в сроки от 16 до 1500 суток от момента операции на шейном отделе позвоночника (в среднем на 210+ 100,24 сутки, n=17).
Диагностика осложнений включала в себя клинический, лучевой (обзорная рентгенография шеи и груди, рентгеноконтрастное исследование пищевода с жидкой взвесью сульфата бария, фистулография, компьютерная томография шеи и средостения, магнитно-резонансная томография шеи) и эндоскопический (эзофагоскопия) методы.
Только у 1 больного повреждение пищевода наступило и было выявлено во время операции, признаком стало поступление в операционную рану слюны.
Из 24 больных у 21 повреждение пищевода проявилось местным воспалительным процессом в области операционной раны на шее. Из них у 12 человек возникло воспаления в пара-эзофагеальной клетчатке с распространением на верхнее средостение. Наружный пищеводношейный свищ сформировался у 10 больных.
У 2 больных клинических проявлений дефекта в стенке пищевода не было. Повреждения обнаружены случайно. У 1 пациента при обзорной рентгенографии органов грудной клетки на 210 сутки после первичной операции выявлено инородное тело (винт) в средостении на уровне Th4 позвонка. У другого больного на 230 сутки в связи с желудочно-кишечным кровотечением выполнена эзофагогастродуоденоскопия. Находкой оказался обширный дефект пищевода с замещением его стенки титановой пластиной на большом протяжении.
Выбор хирургической тактики зависел от размера дефекта стенки пищевода и распространенности патологических изменений в ней; вида инфекционного процесса (абсцесс, флегмона шеи, медиастинит, остеомиелит); наличия механической нестабильности или вероятности ее возникновения после удаления инфицированных имплантатов; необходимости декомпрессии сосудисто-невральных структур позвоночного канала, а также способа энтерального питания.
Целью хирургического лечения было: устранить дефект стенки пищевода, купировать воспалительный процесса (удалить инфицированные металло-импланты, выполнить секвестрэк-томию, дренировать клетчаточные пространства шеи и средостения) и восстановить опороспо-собность позвоночного столба.
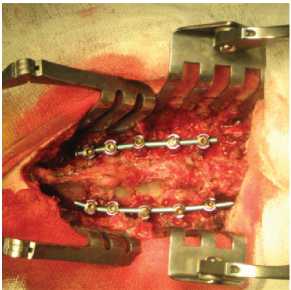
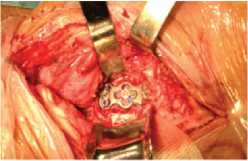
Задний шейный спондилодез, как первый этап операции, выполнен 10 пациентам, у которых ожидалось развитие механической нестабильности в позвоночно-двигательном сегменте после удаления вентральной пластины и межтелового трансплантата (рис. 1).
В связи с удовлетворительной консолидацией межтелового трансплантата у 11 больных после удаления металлоимплантов из передних отделов позвоночного столба дополнительный спондилодез не выполняли. После удаления инфицированной пластины выполняли кюретаж окружающей костной ткани.
У 2 пациентов с сохраняющейся компрес-
А Б В
Рис. 1. Компьютерная томография (КТ) и интраоперационная фотография шейного отдела позвоночника пациентки с дефектом пищевода после переднего шейного спондилодеза на уровне С5-7 аутокостью и титановой пластиной. а, б) – КТ в аксиальной плоскости и в) реформация в сагиттальной плоскости шейного отдела позвоночника после
Г
удаления межтелового трансплантата и фиксирующей пластины. Виден костный дефект в зоне удаленного межтелового трансплантата, места стояния фиксирующих пластину винтов (белые стрелки); г – интраоперационная фотография. Состояние после комбинированного заднего спондилодеза 10-ти винтовой системой на уровне C5-Th2 позвонков.
А
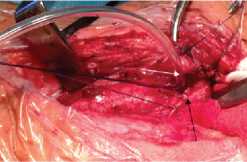
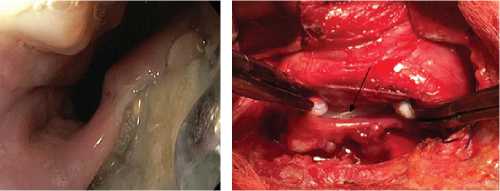
Рис. 2. Интраоперационные фотографии разных этапов операции у пациента с пролежнем стенки пищевода от титановой пластины и хроническим наружным пищеводно-шейным свищем: а – выполнена широкая коллотомия со стороны
Б
В первичной операции (слева), в наружный пищеводно-шейный свищ (черная стрелка) заведен резиновый зонд (белая стрелка); б – этап иссечения свища, вскрытия абсцесса шеи, мобилизации пищевода; в – вид раны после частичной мобилизации пищевода, пищевод отведен медиально (голубая стрелка), фиксирующая пластина выделена из окружающих тканей.
сией спинного мозга и дислокацией фрагментов фиксирующей системы на момент поступления в НИИ СП им. Н.В. Склифосовского мы отказались от проведения задней фиксации. Им выполнено удаление нагноившихся трансплантов, секвестрэктомия, декомпрессия спинного мозга, передний комбинированный спондило-
А Б
В Г
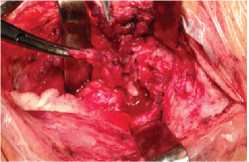
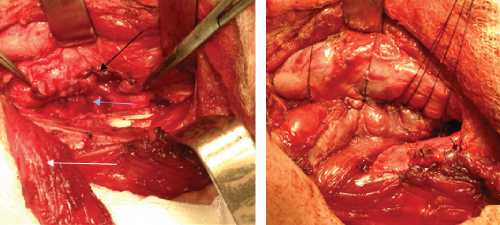
Рис. 3. Интраоперационные фотографии различных этапов операции у пациента с пролежнем стенки пищевода: а) – интраоперационная эзофагоскопия. В просвете пищевода определяются фрагменты фиксирующей системы; б) – общий вид раны после мобилизации пищевода. В просвете пищевода через дефект стенки виден назогастральный зонд (черная стрелка); в) – вид раны после удаления металлоконструкции, секвестрэктомии (голубая стрелка), линия шва пищевода (черная стрелка). Выделена медиальная порция m.sternocleidomastoideus на питающей ножке (белая стрелка); г) – произведено укрепление линии шва и тампонада сформировавшихся после секвестрэктомии полостей в телах позвонков медиальной порцией m.sternocleidomastoideus.
дез аллокостью и титановой пластиной. Церви-котомия выполнялась с противоположной первичному доступу стороны.
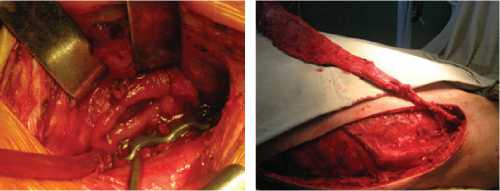
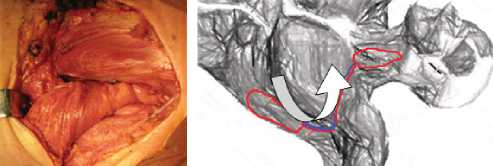
Вмешательство на пищеводе заключалось в иссечении измененных краев дефекта, ушивании его двухрядным швом (викрил). С помощью интраоперационной эзофагоскопии оценивали локализацию и величину дефекта и проводили мобилизацию пищевода (рис. 2, 3). Для укрепления линии шва пищевода у 15 больных применяли медиальную порцию грудиноключично-сосцевидной мышцы на сосудистой ножке [11]. При большом размере дефекта стенки пищевода, а также при необходимости обширной тампонады полостей в телах позвонков и разобщения линии шва пищевода от тел позвонков, у 6 больных выполнено перемещение фрагмента широчайшей мышцы спины на сосудистой ножке (рис. 4).
Ушивание дефекта пищевода не выполняли у 2 пациентов в связи с обширным некрозом его стенки. Поэтому после удаления металлоконструкции произведено пересечение пищевода на шее, ушивание дистальной культи
А Б
В Г
Рис. 4. Интраоперационные фотографии и схематичное изображение различных этапов операции у пациента с обширным дефектом задне-левой стенки в верхне-грудном и шейном отделах пищевода, с образованием полости в средостении и двух параэзофагеальных каналов; 3 месяца после первичной операции: а) – дефект пищевода, глотки моби-лизирован; б) – этап формирования аутотрансплантата из широчайшей мышцы спины на сосудистой ножке; в) – выполнена транспозиция лоскута широчайшей мышцы спины на сосудистой ножке и пластика задней стенки пищевода; г) – схематичное изображение транспозиции фрагмента широчайшей мышцы спины.
4 больным, с клинико-инструментальными признаками гастроэзофагального рефлюкса, выполнена фундопликация по Nissen. Питание через зонд обеспечено 11 больным [8, 30].
Всем больным назначали антибактериальную терапию препаратами с широким спектром действия. После получения результатов бактериологического посева из раны, с металлоконструкции или из абсцесса проводили ее коррекцию (рис. 7).
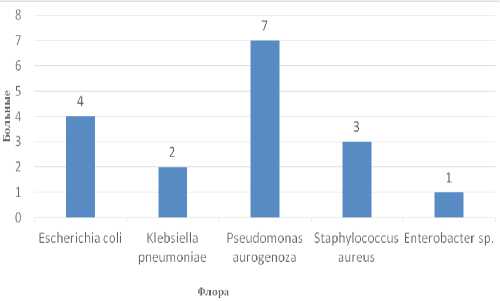
Рис. 7. Частота выявления различной микрофлоры при бактериологических исследованиях отделяемого из раны, с металлоконструкции и/или абсцесса.
пищевода и формирование концевой эзофаго-фарингостомы. В последующем одному больному были выполнены пластические операции на шейном отделе пищевода, после чего начато питание через рот (рис. 5, 6).
Всем пациентам с пищеводно-шейным свищом и медиастинитом выполняли дренирование параэзофагеальной клетчатки.
Для выключения пищевода из пищеварения и проведения энтерального питания гастростомия по Кадеру выполнена 12 пациентам, из них
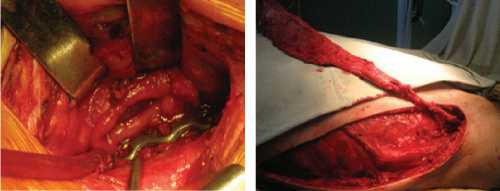
Рис. 6. Схематичное изображение сегментарной пластики шейного отдела пищевода свободным трансплантатом из тонкой кишки на сосудистой ножке. (Рисунок с пояснением взят из оригинальной статьи А.Н. Погодиной, Е.Ю. Шибаева,2010) [10].
Рис. 5. Интраоперационная фотография сегментарной пластики шейного отдела пищевода свободным трансплантатом из тонкой кишки на сосудистой ножке пациенту после пересечения пищевода на шее. Фарингоэн-тероанастамоз, зона шва (белая стрелка).
Результат. Таким образом, органосохраняющая операция на шейном отделе пищевода путем ушивания его дефекта двухрядным швом в сочетании с миопластикой выполнена 21 больному. Органодеструктивные операции выполнены 2 пациентам – им произведено пересечение пищевода на шее с формированием эзофаго-фарингостомы. Впоследствии одному из них произведена реконструктивная операция, и в настоящий момент пациент питается через рот. Лечение второго больного не завершено, и он готовится к пластической операции на шейном отделе пищевода.
Восстановить или сохранить опороспо-собность позвоночного столба, удалить инфицированные трансплантаты, при необходимости выполнить адекватную декомпрессию сосудисто-нервных образований позвоночного столба и фиксацию позвоночно-двигательного сегмента удалось 23 больным. Хирургическое лечение не было произведено 1 пострадавшему с тяжелой позвоночно-спинальной травмой, который умер на 2 сутки после выявления осложнения.
Результаты лечения пациентов и характеристика осложнений, связанных с перфорацией пищевода, представлены в таблице.
Таблица
Результаты лечения пациентов и характеристика осложнений, связанных с перфорацией пищевода
|
Всего больных/ оперированных по поводу перфорации пищевода |
Осложнения перфорации пищевода |
Причина повреждения пищевода (кол-во больных/%) |
Вид операции на пищеводе (кол-во больных) |
Умерло боль-ных/% |
Питание через рот (данные на конец 2016 года) |
|||||
|
Остеомиелит позвонков (кол-во боль-ных/%) |
Медиастинит (кол-во боль-ных/%) |
Пролежень металло-конструкцией |
Повреждение дислоцировав-шимся имплантатом |
Интраоперационное ранение |
Ушивание дефекта, пластика киватель-ной мышцей |
Ушивание дефекта, пластика широчайшей мышцей спины на сосудистой ножке |
Пересечение пищевода на шее с выведением фарингостомы |
|||
|
24/23 |
6 (25%) |
12 (50%) |
5 (20,83) |
12 (50%) |
7 (29,16%) |
15 |
6 |
2 |
3/12,5% |
20 |
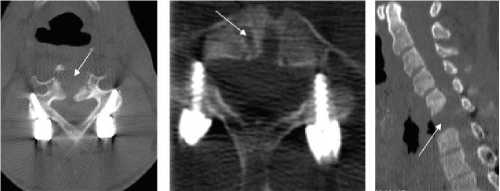
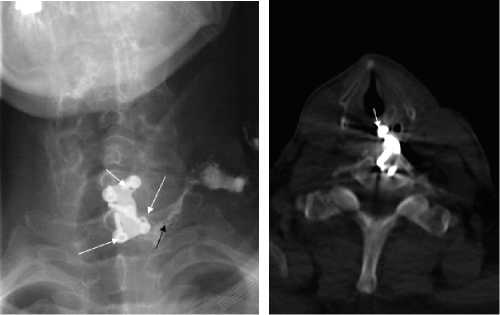
Обсуждение . У 12 пациентов повреждение пищевода наступило вследствие дислокации фрагментов фиксирующей системы из-за нарушения технологии ее установки или применения имплантов, не предназначенных для фиксации шейного отдела позвоночника (рис. 8). При несоблюдении угла установки винта в пластине его головка может выступать над поверхностью пластины и травмировать пищевод (рис. 9, 10). При использовании блокирующих винтов необходимо, чтобы они занимали своё место без перекоса (рис. 11). Попадание винта в межпозвонковый диск или в область поперечных отростков может способствовать миграции винтов или всей пластины. Одной из причин миграции одного края пластины (как правило, нижнего) является несоблюдение конгруэнтности поверхностей пластин и передних отделов позвоночного столба (пластина работает как «клавиша») (рис. 12).
А Б
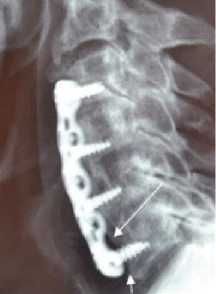
Рис. 9. Дефект установки фиксирующей пластины у пациента с перфорацией пищевода дислоцировавшимся винтом: а) рентгенограмма шейного отдела позвоночника в прямой проекции с рентгеноконтрастным исследованием пищевода жидкой бариевой взвесью. Контрастное вещество находится за переделами просвета пищевода, в области свищевого хода (черная стрелка). Отсутствует ориентация винтов в пластине под заданным углом (белая стрелка); б) компьютерная томография шейного отдела позвоночника в аксиальной проекции. Определяется дислоцировавшийся винт, послуживший причиной повреждения стенки пищевода (белая стрелка).

Рис 8. Удаленный межтеловой имплант и титановая пластина, которые конструктивно не предназначены для шейного спон- дилодеза. Их применение привело к несостоятельной фикса-
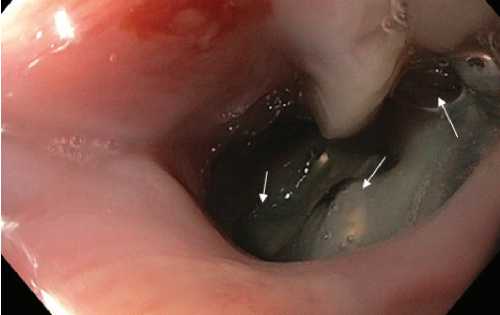
Рис. 10. Интраоперационная эзофагоскопия у пациента с перфорацией пищевода дислоцировавшимся винтом. В просвете пищевода определяются фрагменты фиксирующей системы. Белой стрелкой указаны фиксирующие винты с нарушенной ориентацией в пластине.
ции позвонков,миграции элементов конструкции и перфора- ции пищевода.

А

Рис. 11. Удаленные имплантаты из шейного отдела позвоночника и схема правильной установки основных и блокирующих винтов в пластине: а) вид удаленных винтов из нижней части пластины и б) вид пластины с «заклиненными» в ней неправильно установленными винтами, выступающими за пределы пластины головками винтов; в) схема правильной установки основных и блокирующих винтов в пластине.
Б
А
Б

В Г
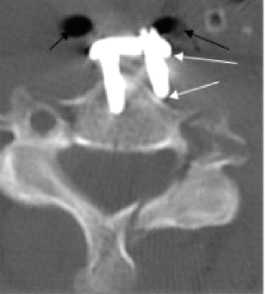
Рис. 12. а) – рентгенография шейного отдела позвоночника в боковой проекции. Консолидация межтеловых трансплантатов удовлетворительная, обращает на себя внимание отсутствие конгруэнтности титановой пластины к позвонкам (белая стрелка); б) – компьютерная томография шейного отдела позвоночника, аксиальная проекция. Отмечается миграция фиксирующего винта и пластины (белые стрелки), косвенные признаки околопищеводного абсцедирования (пузырьки газа)(черные стрелки); в)– интраоперационная эзофагоскопия. В просвете пищевода на уровне С6 позвонка определяется фиксирующий винт (белая стрелка); г)– фотография титановой пластины после ее удаления.
У 5 пациентов дефект сформировался вследствие тесного прилежания пищевода к титановой пластине, о чём свидетельствовал обширный дефекта пищевода с некрозом краев, грубым рубцовым процессом в его стенке и выраженным организованным спаечным процессом с окружающими тканями и пластиной (рис. 13).
Случаи повреждения пищевода описанного выше происхождения, а также ранение высоко- оборотной дрелью, скальпелем, зажимом типа «москит» описаны и другими авторами [4-7, 23, 34, 37].
Перфорация пищевода преимущественно происходила при операциях на позвонках С5-С7. Только у 3 пролеченных нами больных осложнение возникло после вмешательства на уровне С3-С4 позвонков. Данное обстоятельство может быть связано с тем, что в так называемом треугольнике Киллиана (промежуток между проходящей в косом направлении щитовидно-глоточной мышцей (m.thyropharyngeus) и перстневидно-глоточной мышцей (m.cricopharyngeus)), пищевод наиболее уязвим, в данной области он сзади предлежит непосредственно к предпозвоночной фасции (lamina prevertebralis fasciae cervicalis). Поэтому ушивание предпозвоночной фасции после установки титановой пластины можно рассматривать как метод профилактики таких поздних осложнений как пролежень пищевода. А при использовании ранорасширителей необходимо заводить их лопасти под длинные мышцы шеи (Musculus longus colli), что обеспечивает защиту пищевода от прямой компрессии лапками ранорасширителя, ранения острым предметом, высокооборотной фрезой, защемления между пластиной и телом позвонка в момент фиксации (рис. 15) [17, 29, 39]. Целесообразно также использовать пластины с низким профилем (тонкие).
А
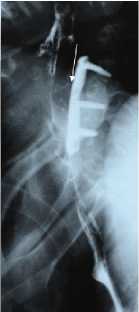
Б
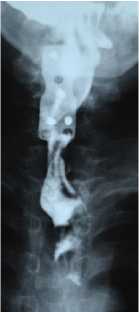
Рис. 13. Рентгеноконтрастное исследование пищевода с сульфатом бария в а) прямой и б) боковой проекциях у пациента с пролежнем пищевода титановой пластиной через 11 месяцев после операции. На уровне С5-С7 позвонков пищевод интимно прилежит к плоскости пластины (белая стрелка). Обращает внимание, что поступления контрастного вещества за контуры пищевода во время исследования нет. В последствии на операции выявлено, что задняя стенка пищевода замещена титановой пластиной на значимом протяжении и вовлечена в грубый рубцово-спаечный процесс.
Передний шейный спондилодез
•заведение в пищевод назогастрального зонда на этапе доступа
•постоянный визуальный контроль за манипуляциями в ране
•охранение пищевода от повреждения инструментом и длительной компрессии лопастями рано- расширителя (использования пластинчатых крючков)
•надежная фиксация винта в пластине, соблюдение конгруэнтности пластины и позвоночного столба, применение сертифицированных имплантов
•ушивание предпозвоночной фасции
Интраоперационное ранение пищевода
•местные воспалительные изменения на шее, поступление слюны из раны
•дислокация металлоимплантов при контрольных рентгенологических исследованиях
•дисфагия

•
•
•
ушить дефект стенки пищевода двухрядным швом (викрил)
выполнить декомпрессию спинного мозга без фиксации укрепить линию шва и изолировать пищевод от тел позвон
-
ков аутомышечным трансплантатом, установить двухпросветный дренаж
•при выраженной нестабильности установить Halo – аппа рат
•повернув больного на живот выполнить задний спондило дез, демонтировать Halo-аппарат
•местное лечение операционной раны (в том числе с исполь-
зованием аспирационно-ирригационной системы) и кормле ние через назогастральный зонд не менее 10 дней
•антибактериальная терапия препаратами с широким спект ром действия
-
•обзорная рентгенография шеи и груди
•рентгеноконтрастное исследование пищевода с жидкой взвесью сульфата бария
•фистулография
•КТ, МРТ шеи и средостения
•эзофагоскопия

•пищеводно-шейный свищ
•несостоятельность швов пищевода

•ревизия операционной раны, удаление металлоимплантов (если ожидается развитие нестабильности в ПДС, первым этапом следует выполнить задний спондилодез), секвестрэктомия •ушивание дефекта стенки пищевода и миопластика
•дренирование параэзофагеальной клетчатки, при медиастините – средостения
•гастростомия по Кадеру,
•больным с клинико-инструментальными признаками гастроэзофагального рефлюкса показана фундопликация по Nissen
•антибактериальная терапия с учетом результатов бактериологического исследования
•кормление через гастростому не менее 10 дней
•контрольное рентгеноконтрастное исследование пищевода с жидкой взвесью сульфата бария через 7-10 дней, или чаще, в зависимости от клинического течения заболевания
При обширном некрозе стенки пищевода показано пересечение пищевода с формированием эзофаго-фарингостомы. В последующем возможна сегментарная пластика шейного отдела пищевода свободным трансплантатом из тонкой кишки на сосудистой ножке
Рис. 14. Алгоритм профилактики,диагностики и лечения повреждения пищевода при ПШС.
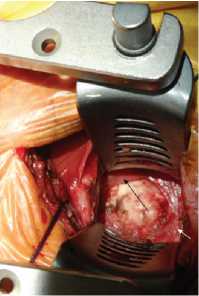
Рис. 15. Интраоперационная фото-гра фия. Операционная рана (левосторонняя коллотомия).
Белой стрелкой обозначен край рассеченной предпозвоночной фасции, длинные мыши шеи отсе-парованы от шейных позвонков, латеральная лопасть ранорас-ширителя заведена под длинную мышцу шеи, медиальная лопасть ранорасширителя установлена некорректно, в ране зияет пищевод (черная стрелка).
В ходе исследования нами сформулирован алгоритм диагностики, лечения и профилактики повреждения пищевода при ПШС [Рис. 14].
Выводы.
-
1. Тщательное соблюдение хирургической техники (заведение в пищевод назогастрального зонда на этапе доступа с целью его лучшей идентификации, постоянный визуальный контроль в ходе манипуляций в ране, охранение пищевода от повреждения инструментом и длительной компрессии лопастями ранорасширителя посредством корректной установки ранорасши-рителя или использования пластинчатых крючков), методики установки фиксирующих систем (надежная фиксация винта в пластине, соблюдение конгруэнтности пластины и позвоночного столба, тщательная подготовка места для меж-
- телового трансплантата) позволяют уменьшить риск повреждения пищевода.
-
2. С целью изоляции металлоимплантов от пищевода необходимо ушивать предпозвоноч-ную фасцию.
-
3. После ПШС необходим периодический контроль за стоянием фиксирующей системы рентгенологическим методом через 3, 6 и 12 месяцев.
-
4. При появлении местных воспалительных изменений на шее требуется проведение рентгеноконтрастного исследования пищевода с жидкой взвесью сульфата бария.
-
5. При перфорации пищевода во время или после переднего спондилодеза операцию по устранению последствий данного осложнения необходимо выполнять мультидисциплинарной бригадой в составе нейрохирурга, хирурга и пластического хирурга.
-
6. Применение аутомышечных трансплантатов позволяет не только устранить дефект в стенке пищевода, но и изолировать пищевод от металлоимплантов или позвонков, а также улучшить регенеративную способность костной ткани. Следует отметить, что при обширных дефектах стенки пищевода (линейный размер дефекта более 3 см) предпочтение следует отдать аутотрансплантату из широчайшей мышцы спины на сосудистой ножке.
Список литературы Особенности лечения больных с повреждением глотки и пищевода при переднем шейном спондилодезе
- Абакумов М.М., Погодина А.Н. Повреждения пищевода при кадиодилятации. Хирургия. 1978. №8. С. 110-111.
- Басков А.В., Гринь А.А., Яриков Д.Е. Хирургическое лечение при травме шейного отдела позвоночника. Нейрохирургия. 2003. № 1. С. 6.
- Белоконев В.И., Замятин В.В., Измайлов Е.П. Диагностика и лечение повреждений пищевода. М.: 1999. 160 С. 24-29.
- Белоконев В.И., Пушкин С.Ю., Бенян А.С., Камеев И.Р., Айрапетова М.П. Особенности диагностики и лечения пациентов с повреждениями пищевода при фиксации шейного отдела позвоночника металлоконструкциями. Новости хирургии. 2014. Том 22. №1. С. 51 -57.
- Бобров В.М. Повреждения пищевода, вызванные инородными телами или инструментами/В. М. Бобров, В. А. Лысенко, П.В. Шушков, В. А. Быданов. Вестник оториноларингологии. 2005. № 2. С. 55-60
- Гринь А.А., Кайков А.К., Крылов В.В. Профилактика и лечение осложнений у больных с позвоночно-спинномозговой травмой (часть 1). Нейрохирургия. 2014. № 4. С. 75-86.
- Кайков А.К. Ошибки и их профилактика в диагностике и лечении больных с травмой позвоночника и спинного мозга: дис.. канд. мед. наук. М, 2013. 84 с.
- Комаров Б.Д., Каншин Н.Н., Абакумов М.М. Повреждения пищевода. М.: Медицина.1981.176с.
- Крылов В.В., Гринь А.А. Травма позвоночника и спинного мозга. М.: 2014. 420 с.
- Погодина, А.Н. Пластика шейного отдела пищевода и трахеи методами микрохирургической аутотрансплантации тканей: клиническое наблюдение/А.Н. Погодина, Е.Ю. Шибаев, К.М. Рабаданов, Д.А. Кисель. Трансплантология. 2010. №2. С. 35-38.
- Попов Е.Н. Пластика мышечным лоскутом на ножке при повреждениях шейной части пищевода. Хирургия. 1966. № 1. С. 113-117.
- Яриков Д.Е., Басков А.В. Передний доступ для стабилизации шейного отдела позвоночника. Нейрохирургия. 2000. №1. С. 32-38.
- Ahn S.H., Lee S.H., Kim E.S., Eoh W. Successful repair of esophageal perforation after anterior cervical fusion for cervical spine fracture. J Clin Neurosci. 2011. Vol. 18, N. 10. P 1374-1380.
- Biancari F., D’Andrea V., Paone R., Di Marco C. Current treatment and outcome of esophageal perforations in adults: systematic review and meta-analysis of 75 studies. World J Surg., 2013, Vol. 37, № 5. P 1051-1059.
- Bohlmann H.H., Eismont F.J. Surgical techniques of anterior decompression and fusion for spinal cord injuries. Clin Orthop. 1981. Vol. 154. P. 57-67.
- Brewer, L.A. Options in the management of perforations of the esophagus/L.A. Brewer, R. Carter, G.A. Mulder, Q.R Stiles. American Journal of Surgery. 1986.Vol.152. №1.P 62-69.
- Brinster C.J., Singhal S., Lee L., Marshall M.B., Kaiser L.R., Kucharczuk J.C. Evolving options in the management of esophageal perforation. Ann. Thorac Surg. 2004. Vol.77.№.4. P. 1475-1483.
- Dakar E., Uribe J.S., Padhya T.A., Vale F.L. Management of delayed esophageal perforations after anterior cervical spinal surgery. J Neurosurg Spine. 2009. Vol. 11, N. 3. P 320-325.
- Edward C.B., Todd B.F. Spine surgery: techniques, complication avoidance, and management. Philadelphia, PA: Elsevier/Saunders, 2011, pp 129-144.
- Fuji T., Kuratsu S., Shirasaki N., Harada T., Tatsumi Y., Satani M., Kubo M., Hamada H. Esophagocutaneous fistula after anterior cervical spine surgery and successful treatment using a sternocleidomastoid muscle flap. Clin. Orthop. Relat Res. 1991. №.267. P 8-13.
- Gaudinez R.F., English G.M., Gebhard J.S., Brugman J.L., Donaldson D.H., Brown C.W. Esophageal perforations after anterior cervical surgery. J. Spinal Disord. 2000. Vol. 13, N. 1. P 77-84.
- Gupta N.M. Personal management of 57 consecutive patients with esophageal perforation/N.M. Gupta, L. Kaman. American Journal of Surgery. 2004.Vol.187. №1.P 58-63.
- Jin S.W., Kim S.H., Choi J.I., Ha S.K., Lim D.J. Late infection from anterior cervical discectomy and fusion after twenty years. Korean J Spine. 2014. Vol.11, №.1. P 22-24.
- Kelly M.F. Delayed pharyngoesophageal perforation: a complication of anterior spine surgery/M.F. Kelly, J. Spiegel, K.A. Rizzo, D. Zwillenberg. Ann Otol Rhinol Laryngol. 1991. Vol. 100. P 201-205.
- Kim, Y.J. Delayed esophageal perforation and abscess formation after cervical vertebrectomy and fusion/Y.J. Kim, P.A. Glazer. Orthopedics. 2002. Vol.25. №10. P 1091-1093.
- Lu X., Guo. Q., Ni B. Esophagus perforation co mplicating anterior cervical spine surgery. Eur Spine J. 2012. Vol. 21, N.1. P 172-177.
- Markar S.R., Mackenzie H., Wiggins T. Management and Outcomes of Esophageal Perforation: A National Study of 2,564 Patients in England. Am J. Gastroenterol 2015, Vol. 110, № 11. P 1559-1156.
- Navarro R., Javahery R., Eismont F., Arnold D.J., Bhatia N.N., Vanni S., Levi A.D. The role of the sternocleidomastoid muscle flap for esophageal fistula repair in anterior cervical spine surgery. Spine (Phila Pa 1976). 2005. Vol.30. №.20. P 617-622.
- Newhouse K.E, Lindsey R.W., Clark C.R., Lieponis J., Murphy M.J. Esophageal perforation following anterior cervical spine surgery. Spine (Phila Pa 1976) 1989. Vol.14. №10. p1051-1053.
- Nissen R. Gastropexy and fundoplication in surgical treatment of hiatal hernia. Am. J. Dig. Dis. 1961. Vol. 6. P. 954 -961.
- M. Hanci, M. Toprak, A.C. Sarioglu et al. Oesophageal perforation subsequent to anterior cervical spine screw/plate fixation. Paraplegia. 1995. Vol. 33. P 606-609.
- Orlando, E.R. Management of the cervical esophagus and hypofarinx perforations complicating anterior cervical spine surgery/E.R. Orlando, E. Caroli E., L. Ferrante//Spine (Phila Pa 1976). 2003. Vol. 28. №15. P 290-295.
- Paradells V.R., Pérez J.B., Vicente F.J., Florez L.B., de la Viuda M.C, Villagrasa F.J. Esophageal, ph aryngeal and hemorrhagic complications occurring in anterior cervical surgery: Three illustrative cases. Surg Neurol Int. 2014. Vol.16, №5. P 126-130.
- Reeder L.B., DeFilippi V.J., Ferguson M.K. Current results of therapy for esophageal perforation. Am. J. Surg. 1995. №.169. P 615-617.
- Reid R.R, Dutra J., Conley D.B, Ondra S.L, Dumanian G.A. Improved repair of cervical esophageal fistula complicating anterior spinal fusion: free omental flap compared with pectoralis major flap. Report of four cases. J Neurosurg. 2004. №.100. P 66-70.
- Rubin J.S. Repair of post-laryngectomy pharyngeal fistulae. J. Laryngol Otol. 1989. Vol.103. №.3. P 302-305.
- Shinomiya K., Okamoto A., Kamikozuru M., Furuya K., Yamura J. An analysis of failures in primary cervical anterior spinal cord decompression and fusion. J Spinal Disord. 1993. №.6. P 277-288
- Smith M.D., Bolesta M.J. Esophageal perforation after anterior cervical plate fixation: a report of two cases. J Spinal Disord. 1992. №5. P 357-362.
- Tew J.M. Jr., Mayfield F.H. Complications of surgery of the anterior cervical spine. Clin Neurosurg. 1976. №.23. P. 424-434.
- Whitehill, R. Late esophageal perforation from an autogenous bone graft/R. Whitehill, E.C. Sirna, D.C. Young, R.W. Cantrell. J. Bone Joint Surg Am. 1985. Vol.67. P 644-645.


