Особенности макрофагальной инфильтрации почек у пациентов с инфарктом миокарда
Автор: Керчева М.А., Рябов В.В., Ребенкова М.С., Ким Б., Рябцева А.Н., Колмаков А.А., Гомбожапова А.Э., Кжышковска Ю.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.36, 2021 года.
Бесплатный доступ
Цель: определить особенности фенотипического состава макрофагальной инфильтрации почек и его взаимосвязи с клинико-анамнестическими данными у пациентов, умерших в разные сроки после инфаркта миокарда (ИМ).Материал и методы. Анализировался материал (срезы почек), забранный у пациентов (n = 30), умерших от ИМ I типа. Макрофагальную инфильтрацию почек оценивали с помощью иммуногистохимического исследования с применением антител (CD68, CD80, CD163, CD206, стабилин-1).Результаты. Возраст включенных в исследование пациентов составил 74,8 ± 9,8 лет, в 87% случаев встречался ИМ с подъемом сегмента ST (ИМспST), уровень креатинина на момент госпитализации составлял 115,1 ± 79 мкмоль/л. Выявлена выраженная гетерогенность фенотипов клеток в ткани почек: количество CD163+ клеток составило 55 (32; 97), CD68+ 30 (23; 51), CD206+ 4 (2; 6), CD80+ 3 (2; 5), стабилин-1+ 2 (1; 3). У пациентов с наступлением летального исхода до 3-х сут ИМ преобладали клетки CD163+ и CD68+ (p
Инфаркт миокарда, макрофаги, сердечная недостаточность, почечная недостаточность, ремоделирование сердца
Короткий адрес: https://sciup.org/149136654
IDR: 149136654 | УДК: 616.127-005.8:616.61-003.2 | DOI: 10.29001/2073-8552-2021-36-2-61-69
Текст научной статьи Особенности макрофагальной инфильтрации почек у пациентов с инфарктом миокарда
Наличие кардиоренального синдрома (КРС) осложняет течение постинфарктного периода в 40% случаев [1, 2] и служит барьером для улучшения прогноза и снижения смертности у пациентов с инфарктом миокарда (ИМ) [3].
Известно, что развитие постинфарктного ремоделирования сердца связано с активацией системы врожденного иммунитета в ответ на острую ишемию миокарда и гибель кардиомиоцитов [4]. В ответ на повреждение миокарда запускается воспалительная реакция с привлечением клеток иммунной системы – моноцитов/макрофагов (мф) [5]. Поступившие в миокард с током крови моноциты поляризуются в мф с провоспалительным фенотипом (М1 типа), начинается фаза воспаления, которая с 3-х сут ИМ сменяется фазой регенерации, основными участниками которой являются мф с противовоспалительным фенотипом (М2 типа) [6, 7]. Существуют экспериментальные данные, указывающие на наличие кардиоренальных и ренокардиальных взаимоотношений, что проявляется изменением макрофагального состава почки в провоспа-лительном направлении в ответ на ишемию миокарда и поляризацию воспалительных мф сердца. При этом имеются данные об обратной связи, отражающие тот факт, что провоспалительная поляризация мф почки в ответ на ишемию миокарда и/или повреждение почки индуцирует или усугубляет провоспалительную реакцию мф сердца, нарушает контролируемое привлечение и скоординированный переход воспаления в заживление, что в конечном итоге приводит к затяжной воспалительной реакции, характеризующейся неблагоприятным прогнозом [7–9]. Однако данное утверждение не подкреплено результатами in vivo у человека и требует дальнейшего изучения.
Цель исследования: определение фенотипического состава макрофагальной инфильтрации почек и его взаимосвязи с клинико-анамнестическими данными у пациентов, умерших в разные сроки после ИМ.
Материал и методы
В нашей работе в качестве объекта исследования выступали фрагменты почек, полученные во время аутопсии у пациентов ( n = 30), умерших от ИМ I типа в период с 2013 по 2014 гг. Критерии исключения: ИМ II–V типов, онкологические заболевания, инфекционные осложнения (сепсис, пневмония), клапанные пороки, требующие хирургического вмешательства. Исследование проводилось в соответствии с принципами Хельсинкской декларации и было одобрено локальным этическим комитетом (выписка из протокола № 128 от 23.12.2014 г.). Патологоанатомическое вскрытие осуществлялось согласно приказу Министерства здравоохранения Российской Федерации от 6 июня 2013 г. № 354н. Подписание информированного согласия пациентов не проводилось, что не противоречило правилам исследования согласно Хельсинкской декларации («Информированное согласие», пункт 32).
Аутопсия выполнялась в течение 24 ч после смерти пациента на базе патологоанатомического отделения. Забранный материал фиксировался в 10% забуферен-ном формалине в течение суток, после чего проводилась стандартная гистологическая проводка и заливка в парафин в аппарате Thermo Scientific Excelsior ES. Парафиновые блоки хранились в архиве в течение 6 лет. Затем из них с помощью ротационного микротома Thermo Scientific HM355S были выполнены микротомные срезы почки с последующим нанесением материала на стекла с L-по-лилизиновым покрытием.
Макрофагальная инфильтрация почек была оценена с помощью иммуногистохимического исследования. С целью иммунофенотипирования мф использовали антитела к общему маркеру мф CD68, антитела к маркеру мф М1 типа CD80 и антитела к маркерам мф М2 типа – CD163, CD206, стабилин-1. Применялась система визуализации HRP-DAB (horseradishperoxidase-3,3’-diaminobenzidine, пероксидаза-3, 3’диаминобензидин). Подсчет мф в почке проводился в светлом поле двумя независимыми специалистами на микроскопе Axio Imager M2, Zeiss. Согласно срокам наступления летального исхода после ИМ пациенты были разделены на две группы: 1-я группа — умершие в течение первых 3 сут от начала заболевания, 2-я группа — умершие в срок с 4-х по 21-е сут.
Обработка данных осуществлялась с использованием статистического пакета STATISTICA 12.0. Нормальность количественных данных проверялась по критерию Шапиро – Уилка. Возраст пациентов и уровень креатинина при поступлении в стационар описывались средним значением (М) и стандартным отклонением ( SD ), остальные количественные показатели, не имевшие нормального распределения, – медианой (Ме) и интерквартильным интервалом ( Q 1; Q 3). Категориальные показатели описывались частотами и процентами. Для сравнения количественных показателей в независимых группах использовался критерий Манна – Уитни, для сравнения категориальных признаков – χ2 (критерий Пирсона) и точный критерий Фишера. Корреляционные связи между количеством клеток и клинико-анамнестическими данными выявлялись с помощью коэффициента корреляции Спирмена. Проверка статистических гипотез проводилась по уровню значимости р = 0,05.
Результаты
Основные клинико-анамнестические данные пациентов представлены в таблице 1.
Результаты иммуногистохимического анализа макрофагальной инфильтрации почек у пациентов, умерших от ИМ, представлены на рисунке 1. Данные об изменении количества клеток в зависимости от сроков ИМ указаны в таблице 2.
Согласно полученным данным, в почках пациентов, умерших от ИМ, присутствовали как мф М2, так и мф М1 типа. При этом количество CD163+ и CD68+ клеток в раннюю фазу ИМ было значимо выше, чем клеток с иными фенотипами ( p = 0,0001), наименьшим было количество стаби-лин-1+ клеток ( p = 0,001). В позднюю фазу ИМ количество CD68+ клеток стало значимо меньше, чем CD163+ клеток ( p = 0,001), однако оставалось выше, чем количество клеток с иными фенотипами, которые, в свою очередь, количественно друг от друга не отличались (см. табл. 2, рис. 1).
Количество CD206+ клеток ( p = 0,0001) в почках, как и количество CD80+ клеток, снижалось относительно раннего периода ИМ к позднему периоду ( p = 0,001) (см. табл. 2).
Основные корреляционные связи между количеством клеток макрофагального ряда в почках и клинико-анамнестическими данными представлены на рисунке 2.
Наиболее часто с развитием неблагоприятных сердечно-сосудистых осложнений у пациентов с ИМ ассоциировалось количество СD80+ и СD206+ клеток: низкий уровень СD206+ клеток в раннюю фазу ИМ был ассоциирован с высоким риском разрыва стенки ЛЖ.
Таблица 1. Клинико-анамнестические характеристики пациентов, включенных в исследование
Table 1. Clinical and medical history characteristics of patients enrolled in the study
|
Параметры Characteristics |
Все пациенты All patients |
1-я группа Group 1 |
2-я группа Group 2 |
|
Количество пациентов, n (%) Number of patients, n (%) |
30 (100) |
17 (57) |
13 (43) |
|
Возраст, лет Age, years |
74,8 ± 9,8 |
73 ± 9,3 |
77 ± 10,1 |
|
Мужской пол, n (%) Male gender, n (%) |
12 (39) |
7 (42) |
5 (38) |
|
ИМспST, n (%) STEMI, n (%) |
26 (87) |
16 (94) |
10 (77) |
Локализация инфаркта MI localization
|
Передний ИМ, n (%) Anterior MI, n (%) |
10 (33) |
8 (47) |
2 (15) |
|
Задний ИМ, n (%) Posterior MI, n (%) |
8 (27) |
3 (18) |
5 (38) |
|
Циркулярный, n (%) Anterior-inferior MI, n (%) |
12 (40) |
6 (35) |
6 (46) |
Факторы риска ИБС Risk factors for CAD
|
СД, n (%) Diabetes mellitus, n (%) |
9 (30) |
4 (23) |
5 (38) |
|
ГБ, n (%) History of hypertension, n (%) |
30 (100) |
17 (100) |
13 (100) |
|
Ожирение, n (%) Obesity, n (%) |
10 (33) |
6 (35) |
4 (31) |
|
Дислипидемия, n (%) Dyslipidemia, n (%) |
8 (27%) |
2 (12) |
6 (46)* |
|
Курение, n (%) Smoking history, n (%) |
5 (17) |
2 (12) |
3 (23) |
Наличие в анамнезе Medical history
|
НРС, n (%) Arrhythmias, n (%) |
5 (17) |
0 |
5 (38) |
|
Повторный ИМ, n (%) Recurrent MI, n (%) |
16 (53) |
7 (42) |
9 (69) |
|
ХСН, n (%) CHF, n (%) |
15 (50) |
6 (35) |
9 (69) |
|
ХОБЛ, n (%) COPD, n (%) |
11 (37) |
7 (42) |
4 (31) |
|
МКБ, n (%) Kidney stone disease, n (%) |
4 (13) |
1 (6) |
3 (23) |
|
ХБП на момент госпитализации, n (%) CKD at the time of hospitalization, n (%) |
10 (33) |
3 (18) |
7 (54)* |
|
Уровень креатинина на момент госпитализации, мкмоль/л Creatinine level at the time of hospitalization, μmol/L |
115,1 ± 79 |
150 ± 80,5 |
155,4 ± 7 9 |
|
СКФ на момент госпитализации, мл/мин/1,73м2 Glomerular filtration rate at the time of hospitalization, mL/min/1.73 m2 |
44 ± 26 |
48 ± 18 |
42 ± 30 |
Поражение коронарного русла, стенозы более 70% Angiography data, lesions > 70%
|
Ствол ЛКА, n (%) Left main disease, n (%) |
3 (10) |
0 |
3 (23) |
|
ПНА, n (%) LAD, n (%) |
16 (53) |
7 (42) |
9 (69) |
|
ОА, n (%) LCX, n (%) |
14 (47) |
6 (35) |
8 (61) |
|
ПКА, n (%) RCA, n (%) |
13 (43) |
8 (47) |
5 (38) |
Осложнения ИМ Complications following MI
|
ОСН при поступлении (> I ФК), n (%) AHF at admission (> I FC), n (%) |
22 (73) |
15 (88) |
7 (54)* |
|
Аневризма ЛЖ, n (%) LV aneurysm, n (%) |
7 (23) |
4 (23) |
3 (23) |
|
Рецидив ИМ, n (%) Recurrent MI, n (%) |
8 (27) |
1 (6) |
7 (54)* |
|
Постинфарктная стенокардия, n (%) Postinfarction angina, n (%) |
9 (30) |
1 (6) |
7 (54)* |
Окончание табл. 1
End of table 1
Причина смерти Cause of death
|
Кардиогенный шок, n (%) Cardiogenic shock, n (%) |
25 (86) |
12 (70) |
13 (100)* |
|
Разрыв миокарда, n (%) Cardiac rupture, n (%) |
2 (7) |
2 (28) |
0 |
|
Аритмогенный шок (ФЖ), n (%) Arrhythmogenic shock (VF), n (%) |
2 (7) |
1 (6) |
1 (8) |
Примечание: * – статистически значимые различия между группами.
Аббревиатуры: ИМспST – инфаркт миокарда с подъемом сегмента ST, ИМ – инфаркт миокарда, ИБС – ишемическая болезнь сердца, СД – сахарный диабет, ГБ – гипертоническая болезнь, НРС – нарушение ритма сердца, ХСН – хроническая сердечная недостаточность, ХОБЛ – хроническая обструктивная болезнь легких, МКБ – мочекаменная болезнь, ХБП – хроническая болезнь почек, СКФ – скорость клубочковой фильтрации, ЛКА – левая коронарная артерия, ПНА – передняя нисходящая артерия, ОА – огибающая артерия, ПКА – правая коронарная артерия, ОСН – острая сердечная недостаточность, ФК – функциональный класс, ЛЖ – левый желудочек, ФЖ – фибрилляция желудочков.
Note: * – statistically significant differences between groups.
Abbreviations: STEMI – ST-segment elevation myocardial infarction, MI – myocardial infarction, CAD – coronary artery disease, CHF –chronic heart failure, COPD – chronical obstructive pulmonary disease, CKD – chronical kidney disease, LAD – left anterior descending artery, LCX – left circumflex artery, RCA – right coronary artery, AHF – acute heart failure, FC – functional class, LV – left ventricular, VF – ventricular fibrillation.
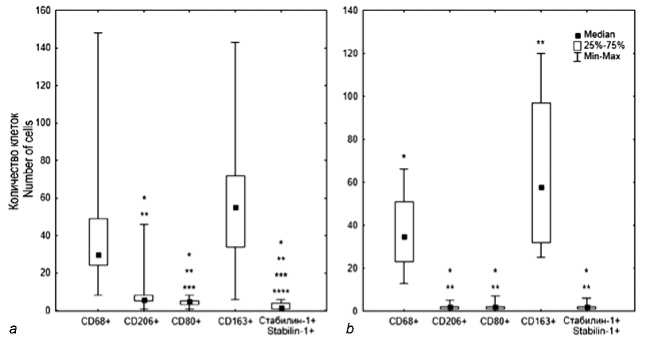
Рис. 1. Структура фенотипического разнообразия макрофагальной инфильтрации почек у пациентов, умерших от инфаркта миокарда, в зависимости от сроков наступления фатального инфаркта миокарда: а – ранний период, b – отдаленный период)
Примечание: * – статистически значимое отличие относительно количества клеток CD163+, ** – относительно количества клеток CD68+, *** – относительно количества клеток CD206+, **** – относительно количества клеток CD80+.
Fig. 1. Phenotypic diversity of macrophage infiltration of the kidneys in patients with myocardial infarction and fatal outcome, depending on the timing of the infarction: a – early period, b – long-term period
Note: * – statistically significant difference relative to the number of CD163+ cells, ** – relative to the number of CD68+ cells, *** – relative to the number of CD206+ cells, **** – relative to the number of CD80+ cells.
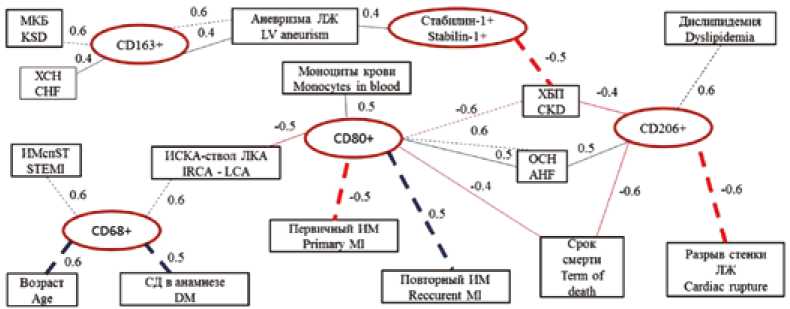
Рис. 2. Корреляции между количеством клеток макрофагального ряда и клинико-анамнестическими данными у пациентов, умерших от инфаркта миокарда
Примечание: –– связи между количеством клеток и параметром в общей выборке, – – – для 1-й группы, ------для 2-й группы, ИМ – инфаркт миокарда, ИСКА – инфаркт-связанная коронарная артерия, ЛЖ – левый желудочек, ЛКА – левая коронарная артерия, МКБ – мочекаменная болезнь, ОСН – острая сердечная недостаточность, СД – сахарный диабет, ХБП – хроническая болезнь почек, ХСН – хроническая сердечная недостаточность.
Fig. 2. Correlations between macrophage counts and clinical data in patients with MI and fatal outcome
Note: Relationships between cell counts and parameters over the entire patient sample (–––), group 1 (- - -), and group 2 (-----). Abbreviations: AHF – acute heart failure, CHF – chronic heart failure, CKD – chronic kidney disease, DM – diabetes mellitus, IRKA – infarction-related coronary artery, KSD – kidney stone disease, LV – left ventricle, LCA – left coronary artery, MI – myocardial infarction, STEMI – ST-segment elevation myocardial infarction.
Таблица 2. Сравнение фенотипов почечных макрофагов у пациентов, умерших в разные сроки после инфаркта миокарда
Table 2. Comparison of renal macrophage phenotypes in patients died at different times after MI
|
Параметры клетки Сells |
Все пациенты All patients |
1-я группа Group 1 |
2-я группа Group 2 |
|
CD 163+ |
55,5 (28; 47) |
55 (27; 55) |
58 (25; 57) |
|
CD 206+ |
4,0 (6,5; 11) |
6 (7,5; 15) |
2 (0,9; 2)* |
|
CD 68+ |
30,0 (23; 40) |
30 (27; 56) |
35 (13; 30) |
|
CD 80+ |
3 (1,6; 2,7) |
5 (1,3; 2,8) |
2 (1,2; 2,7)* |
|
Стабилин-1 Stabilin-1+ |
2 (1,2; 2,1) |
1,5 (1,2; 2,6) |
2 (1; 2,5) |
Примечание: * – статистически значимые различия между группами.
Note: * – statistically significant differences between groups.
Значительное количество СD80+ и СD206+ клеток было связано с большей частотой развития острой сердечной недостаточности (СН) и более ранним сроком наступления летального исхода ( p < 0,05). Также стоит обратить внимание на наличие прямой взаимосвязи между количеством стабилин-1+ и CD163+ клеток и частотой развития аневризмы ЛЖ (см. рис. 2).
Количество CD163+ и CD80+ клеток связано с наличием в анамнезе сердечно-сосудистой патологии: так, высокий уровень СD163+ клеток был ассоциирован с большей частотой встречаемости в анамнезе хронической СН, а большее количество СD80+ клеток было связано с наличием у пациентов в анамнезе повторного ИМ. Количество CD163+, CD80+, CD206+ и стабилин-1+ клеток было связано с наличием в анамнезе патологии почек: так, высокий уровень СD163+ клеток был ассоциирован с наличием в анамнезе МКБ, а меньшее количество СD80+, CD206+ и стабилин-1+ клеток – с наличием в анамнезе ХБП. Количество CD68+ и CD80+ клеток было связано с тяжестью поражения коронарного русла: так, меньшее количество СD80+ и большее количество СD68+ клеток было связано с преимущественным поражением ствола ЛКА. Большее количество СD68+ клеток помимо этого было связано и с большей частотой развития ИМспST (см. рис. 2).
Обсуждение
Основная парадигма взаимоотношений «сердце – почка», базирующаяся на активации ренин-ангиотензи-новой системы (РААС) с последующим повреждением паренхимы почек, повышением артериального давления и развитием гипертрофии миокарда, продемонстрировала свою состоятельность уже несколько десятилетий назад [7, 10, 11]. Отличные результаты показало и применение нейрогормональной терапии, направленной на подавление активации РААС, у пациентов с СН [12]. Однако пределы ее возможностей, вероятно, были достигнуты, ведь несмотря на применение современной терапии ИМ в полном объеме, включающей в том числе и ингибиторы ангиотензинпревращающего фермента, антагонисты рецепторов ангиотензина II, у 40% пациентов, перенесших ИМ, функция почек к моменту выписки из стационара так и не нормализуется [1, 2].
Не так давно в условиях эксперимента на животных было выявлено участие системы врожденного иммунитета в развитии как СН, так и почечной недостаточности
(ПН) [7, 13–15]. Изменения макрофагальной инфильтрации почек влияли как на изменение макрофагальной инфильтрации сердца, так и на исход заболевания. Стоит отметить, что ранее уже предпринимались попытки изучения особенностей макрофагальной инфильтрации почек и ее динамики, связи с клинико-анамнестическими данными у отдельных групп пациентов – с ХБП, гломерулосклерозом, нефропатией, СД 2-го типа [15]. Однако результаты этих исследований немногочисленны и неоднозначны. Ясно одно, что при различных повреждениях почек одни и те же фенотипы мф могут вести себя по-разному, проявляя как профибротический, так и проти-вофибротический эффект [16]. В случае с ишемическим повреждением почки при ИМ также остается неясным, какой из этих эффектов связан с благоприятным исходом.
В нашу выборку были включены пациенты преимущественно с ИМспST, наиболее частой причиной смерти служил кардиогенный шок. Анализируемые нами группы пациентов были сопоставимы по основным клинико-анамнестическим данным, однако по количеству рецидивов ИМ и постинфарктной стенокардии они отличались, что, вероятно, обусловлено разными сроками наступления летального исхода. Согласно полученным нами результатам, ХБП реже встречалась у пациентов с более ранним сроком наступления летального исхода. Возможно, это обусловлено тем, что в острый период ИМ наличие острой СН, являющейся триггером для развития КРС, чаще регистрировалось у этой группы пациентов. В нашем исследовании при анализе мф инфильтрации почек мы опирались на классическую схему деления мф на два основных фенотипа: М1 и М2 типа – про- и противовоспалительные [4]. Понимая, что мф M1 и M2 типа представляют две крайности спектра с континуумом промежуточных фенотипов между ними, нами была предпринята попытка оценить целый спектр маркеров почечных мф у пациентов с ИМ.
Нами было выявлено присутствие в тканях почек у больных ИМ мф как 1-го, так и 2-го фенотипов в ранние и отдаленные сроки ИМ. Известно, что макрофагальный состав почки в норме представлен в основном тканевыми мф, обладающими противовоспалительным фенотипом (М2) и осуществляющими функцию фагоцитоза и поддержания гомеостаза [17]. При истощении пула тканевых мф в результате ИМ происходит их пополнение пришлыми мф. В условиях эксперимента на животных выявлено, что в ходе острой почечной травмы в ответ на повреждение тканевые мф почек под влиянием молекулярных паттернов, связанных с повреждением и патоген-ассоциированных молекулярных паттернов, реализуют функцию фагоцитоза и активно секретируют провоспалительные цитокины [18], после чего в поврежденную ткань почек рекрутируются естественные клетки-киллеры, нейтрофилы и воспалительные моноциты [15]. Воспалительные моноциты поляризуются в мф M1 типа при участии провоспалитель-ных медиаторов (интерферон-g), запускается процесс воспаления [4], после чего активизируются Th2-клетки и регуляторные Т-клетки, происходит секреция цитокинов интерлейкинов-4 и -10, мф М1 типа поляризуются до M2 фенотипа – происходит разрешение воспаления и восстановление тканей – наступает фаза регенерации [15]. Как было сказано ранее, мф почек могут пополняться как из моноцитов кровотока, так и из эмбриональных предшественников [19]. В нашем случае наличие прямой связи между количеством CD80+ клеток и уровнем циркулирующих в крови моноцитов может отражать эти данные. Преимущественная инфильтрация почек СD68+ и СD163+ клетками в течение всего раннего периода наблюдения и последующее преобладание СD163+ клеток в позднюю фазу ИМ может указывать на тот факт, что CD163+ клетки представляют собой пул тканевых мф, а CD68+ клетки – пул пришлых мф, рекрутированных в почечную ткань в связи с ее острым повреждением.
Известно, что при двухфазной реакции в тканях в ответ на ишемию фаза воспаления сменяется фазой регенерации с преобладанием мф М2 типа и снижением мф М1 типа [4, 7]. Однако в нашей выборке происходит снижение как CD80+ (М1 тип), так и CD206+ (М2 тип) клеток уже к 4-м сут ИМ, что, вероятно, ассоциировано с замедлением пролиферации канальцевых клеток и регенерации почек [15]. Этот факт может указывать и на недостаточную регенерацию/заживление миокарда и ассоциирован с неблагоприятным прогнозом у пациентов с ИМ [20]. Наряду с этим стоит отметить, что значимое снижение CD80+ клеток в регенераторную фазу отражает естественное течение воспалительной реакции после ИМ [4, 19]. Количество СD80+ и СD206+ клеток наиболее часто связано с развитием неблагоприятных сердечно-сосудистых осложнений, таких как высокий риск разрыва стенки ЛЖ, острая СН и скорое наступление летального исхода, что отражает участие клеток данных фенотипов в процессах развития ремоделирования миокарда и прогрессирования СН у пациентов с ИМ. Наличие обратной связи между количеством СD80+, CD206+ клеток и частотой развития ХБП, скорее всего, отражает участие данных клеток в процессах ее развития у пациентов с ИМ. Интересным представляется и тот факт, что наряду с большим количеством CD68+ клеток, количество CD80+ клеток было связано с тяжестью поражения коронарного русла, что также отражает участие активации системы врожденного иммунитета в процессах развития СН [4]. Однако, несмотря на активную вовлеченность CD80+ клеток в процессы развития СН и ПН, в условиях эксперимента отмечено повышение мф М1 типа в воспалительную фазу за счет поляризации тканевых мф почки и пополнения пула мф пришлыми моноцитами [15]. В нашей же выборке подобные данные не выявлены, что также может быть ассоциировано с неблагоприятным прогнозом. У мышей в условиях эксперимента подавление активности экспрессии генов, ответственных за секрецию белков S100A8 и S100A9, участвующих в процессе поляризации мф М2 типа в мф М1 типа в раннюю фазу ИМ путем экс- прессии фактора некроза опухоли почечными мф и индуцирования секреции колониестимулирующего фактора эндотелием подоцитов, ведет к снижению адаптивного ответа миокарда и развитию его гипертрофии и фиброза в ответ на гемодинамическую перегрузку [7, 21]. Повышение концентрации колониестимулирующего фактора в плазме индуцирует пролиферацию мф Ly6Clo в сердце мыши, аналога мф человека типа М2, которая посредством секреции амфирегулина запускает гипертрофический паракринный путь в сердце и поляризацию мф М1 типа в М2 тип в тканях сердца и почек. У этих мышей отмечается дилатация полостей сердца и увеличение смертности в течение 28 сут после ИМ по сравнению с мышами с активной экспрессией генов [7].
Кроме того, нами был проанализирован новый перспективный маркер мф М2 типа – стабилин-1+. Количество стабилин-1+ клеток при ИМ в нашей выборке не снижалось в течение всего периода наблюдения и было минимальным относительно прочих маркеров мф. Ранее было показано, что рецепторы стабилина-1 регулируют миграцию Т- и В-лимфоцитов и гранулоцитов в очаг повреждения и обладают противовоспалительной активностью, препятствуя развитию фиброза при хроническом воспалении [22]. Однако литературные данные относительно роли этого маркера весьма неоднозначны; исследования, посвященные роли рецептора стабилин-1 при поражениях почек, единичны [22]. В нашей выборке зарегистрировано наличие ассоциаций между большим количеством стабилин-1+ клеток и высокой частотой развития аневризмы ЛЖ, наряду с количеством CD163+ клеток. Также выявлено наличие обратной связи между количеством этих клеток в ранний период ИМ и наличием ХБП в анамнезе, что может указывать на участие клеток с данным фенотипом в процессах регенерации как почек, так и миокарда.
Заключение
Макрофагальная инфильтрации почек характеризуется выраженной гетерогенностью в зависимости от сроков смерти после ИМ. В ранние сроки инфаркта преобладают CD163+ и CD68+ клетки, в поздние сроки – CD163+ клетки. Меняется число CD80+ и CD206+ клеток, снижаясь с 4-х сут ИМ. Наличие множественных корреляционных связей между количеством клеток макрофагального ряда в почках и развитием неблагоприятных сердечно-сосудистых осложнений у пациентов с ИМ актуализирует дальнейшее изучение данного направления.
Список литературы Особенности макрофагальной инфильтрации почек у пациентов с инфарктом миокарда
- Reinstadler S.J., Kronbichler A., Reindl M., Feistritzer H.J., Innerhofer V., Mayr A. et al. Acute kidney injury is associated with microvascular myocardial damage following myocardial infarction. Kidney Int. 2017;92(3):743–750. DOI: 10.1016/j.kint.2017.02.016.
- Kofman N., Margolis G., Gal-Oz A., Letourneau-Shesaf S., Keren G., Rozenbaum Z. et al. Long-term renal outcomes and mortality following renal injury among myocardial infarction patients treated by primary percutaneous intervention. Coron. Artery Dis. 2019;30(2):87–92. DOI: 10.1097/MCA.0000000000000678.
- Collet J.P., Thiele H., Barbato E., Barthélémy O., Bauersachs J., Bhatt D.L. et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur. Heart J. 2021;42(14):1289–1367. DOI: 10.1093/eurheartj/ehaa575.
- Gombozhapova A., Rogovskaya Y., Shurupov V., Rebenkova M., Kzhyshkowska J., Popov S.V. et al. Macrophage activation and polarization in post-infarction cardiac remodeling. J. Biomed. Sci. 2017;24(1):13. DOI: 10.1186/s12929-017-0322-3.
- Mosser D.M., Edwards J.P. Exploring the full spectrum of macrophage activation. Nat. Rev. Immunol. 2008;8(12):958–969. DOI: 10.1038/nri2448.
- Mann D.L., McMurray J.J., Packer M., Swedberg K., Borer J.S., Colucci W.S. et al. Targeted anticytokine therapy in patients with chronic heart failure: Results of the Randomized Etanercept Worldwide Evaluation (RENEWAL). Circulation. 2004;109(13):1594–1602. DOI: 10.1161/01.CIR.0000124490.27666.B2.
- Fujiu K., Shibata M., Nakayama Y., Ogata F., Matsumoto S., Noshita K. et al. A heart-brain-kidney network controls adaptation to cardiac stress through tissue macrophage activation. Nat. Med. 2017;23(5):611–622. DOI: 10.1038/nm.4326.
- Nahrendorf M., Swirski F.K. Monocyte and macrophage heterogeneity in the heart. Circ. Res. 2013;112(12):1624–1633. DOI: 10.1161/CIRCRESAHA.113.300890.
- Wang C., Pei Y.Y., Ma Y.H., Ma X.L., Liu Z.W., Zhu J.H. et al. Risk factors for acute kidney injury in patients with acute myocardial infarction. Chin. Med. J. (Engl.). 2019;132(14):1660–1665. DOI: 10.1097/CM9.0000000000000293.
- Chalikias G., Serif L., Kikas P., Thomaidis A., Stakos D., Makrygiannis D. et al. Long-term impact of acute kidney injury on prognosis in patients with acute myocardial infarction. Int. J. Cardiol. 2019;283:48–54. DOI: 10.1016/j.ijcard.2019.01.070.
- Kaesler N., Babler A., Floege J., Kramann R. Cardiac remodeling in chronic kidney disease. Toxins (Basel). 2020;12(3):161. DOI: 10.3390/toxins12030161.
- Yusuf S., Pfeffer M.A., Swedberg K., Granger C.B., Held P., McMurray J.J. et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet. 2003;362(9386):777–781. DOI: 10.1016/S0140-6736(03)14285-7.
- Salman I.M. Cardiovascular autonomic dysfunction in chronic kidney disease: A comprehensive review. Curr. Hypertens. Rep. 2015;17(8):59. DOI: 10.1007/s11906-015-0571-z.
- Silljé H.H.W., de Boer R.A. Heart failure: Macrophages take centre stage in the heart-brain431 kidney axis. Nat. Rev. Nephrol. 2017;13(7):388–390. DOI: 10.1038/nrneph.2017.73.
- Chen T., Cao Q., Wang Y., Harris D.C.H. M2 macrophages in kidney disease: Biology, therapies, and perspectives. Kidney Int. 2019;95(4):760–773. DOI: 10.1016/j.kint.2018.10.041.
- Huen S.C., Cantley L.G. Macrophages in renal injury and repair. Annu. Rev. Physiol. 2017;79:449–469. DOI: 10.1146/annurev-physiol-022516-034219.
- Kercheva M., Gusakova A.M., Ryabova T.R., Suslova T.E., Kzhyshkowska J., Ryabov V.V. Serum levels of bone morphogenetic proteins 2 and 4 in patients with acute myocardial infarction. Cells. 2020;9(10):2179. DOI: 10.3390/cells9102179.
- Wen Y., Crowley S.D. The varying roles of macrophages in kidney injury and repair. Curr. Opin. Nephrol. Hypertens. 2020;29(3):286–292. DOI: 10.1097/MNH.0000000000000595.
- Ginhoux F., Guilliams M. Tissue-resident macrophage ontogeny and homeostasis. Immunity. 2016;44(3):439–449. DOI: 10.1016/j.immuni. 2016.02.024.
- Kercheva M., Ryabova T., Gusakova A., Suslova T.E., Ryabov V., Karpov R.S. Serum soluble ST2 and adverse left ventricular remodeling in patients with ST-segment elevation myocardial infarction. Clin. Med. Insights. Cardiol. 2019;13:1179546819842804. DOI: 10.1177/1179546819842804.
- Shirani J., Meera S., Dilsizian V. The cardiorenal axis: Myocardial perfusion, metabolism, and innervation. Curr. Cardiol. Rep. 2019;21(7):60. DOI: 10.1007/s11886-019-1147-3.
- Ikezumi Y., Kondoh T., Matsumoto Y., Kumagai N., Kaneko M., Hasegawa H. et al. Steroid treatment promotes an M2 anti-inflammatory macrophage phenotype in childhood lupus nephritis. Pediatr. Nephrol. 2021;36(2):349–359. DOI: 10.1007/s00467-020-04734-w.


