Особенности межструктурной экспрессии "хранителя генома" - гена ТР53 в мозге при формировании долговременной пространственной памяти у взрослых крыс Вистар
Автор: Грудень Марина Алексеевна, Ратмиров Александр Максимович
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Эксперимент
Статья в выпуске: 4 (81) т.15, 2019 года.
Бесплатный доступ
Изучали экспрессию гена Тр53, продукт которого белок p53 обеспечивает генетическую стабильность клеток, в различных структурах мозга-гиппокампе, префронтальной коре и мозжечке при формировании долговременной пространственной памяти в водном лабиринте Морриса у половозрелых крыс Wistar. В качестве контроля выступали интактные животные, а также крысы, которых подвергали активному принудительному плаванию. Использовали метод ПЦР в реальном времени для определения уровня экспрессии гена Тр53. Показано, что на стадии активного плавания наблюдается ингибирование активности гена Тр53 во всех изученных церебральных структурах. В условиях выработки долговременной пространственной памяти в гиппокампе активность гена Тр53 восстанавливается до уровня нативных животных, а в префронтальной коре и мозжечке наблюдается активация экспрессии гена Тр53 в 18 и 50 раз превышающая таковую у нативных крыс. Выявлена структурная специфичность эффектов модуляции активности гена Тр53 на стадии формирования пространственной памяти, что можно объяснить необходимостью наработки белка p53 для взаимодействия с компонентами транскрипционной машины и ее активации при выполнении животными нового для них навигационного навыка.
Пространственная память, водный лабиринт морриса, тр53 ген, белок p53, гиппокамп, префронтальная кора, мозжечок, крысы
Короткий адрес: https://sciup.org/140248167
IDR: 140248167
Текст научной статьи Особенности межструктурной экспрессии "хранителя генома" - гена ТР53 в мозге при формировании долговременной пространственной памяти у взрослых крыс Вистар
В спектре интегративной деятельности мозга память является одним их фундаментальных процессов. В связи с этим, исследование механизмов памяти в норме и патологии является одним из главных направлений современной нейронауки. Когда идет речь о нейробиологических механизмах памяти, то они наиболее часто изучаются в особой зоне мозга – гиппокампe. Эта структура действительно является одним из основных центров формирования памяти, в частности, одной из ее форм – Гиппокамп зависимой пространственной памяти [14]. В гиппокампе памятная информация задерживается не очень надолго – это ее кратковременное хранилище, далее происходит так называемый этап «консолидации» памяти, превращение её из кратковременной в долговременную; при этом информация переходит из гиппокампа в нейронные сети других зон мозга, в частности в префронтальную кору и мозжечок [1, 13]. Системное описание процесса консолидации, включает две группы неразрывно связанных процессов. Первая – процессы системной специализации: морфологическая и функциональная модификация нейронов, связанная с их вовлечением в обеспечение вновь формируемой системы. Для второй группы - необходимо учесть, что сформированная память не является неизменной, она модифицируется, «реконсолидирует-ся» [1, 11]. Реконсолидация рассматривается как общий механизм реорганизации ранее сформированной памяти при формировании новой памяти [1, 7]. При этом подчеркивается, что реконсолидация не отменяет сформированной долговременной памяти и постоянства системной организации памяти [1, 12]. На современном этапе значительное внимание при изучении данного вопроса уделяется процессам клеточной программируемой гибели (апоптоза) в обеспечении различных видов поведения и памяти c фокусированием на особенностях их генетической регуляции [6]. Около 30 лет тому назад был открыт ряд генов, участвующих в регуля- ции апоптоза, причем продукты некоторых из этих генов являются активаторами, в то время как другие - ингибиторами апоптоза. Например, повышение экспрессии гена Тp53 и уровня белка р53 в ответ на повреждения ДНК вызывает апоптотическую гибель клеток различных тканей. Однако, по-видимому, белок р53 индуцирует только специфические виды апоптоза, вызванные сильными повреждениями ДНК или нарушением регуляцией клеточного цикла. По-видимому, р53-зависимый апоптоз происходит в ответ на получение клеткой двух противоречивых сигналов: сигнала к вхождению в S - фазу и противоположного тормозящего сигнала. Результаты исследований, что основной задачей белка р53 становится избавление от генетически опасных дефектных клеток, что достигается путем активации клеточного апоптоза. Таким образом, при действии генотоксических агентов белок р53 не только увеличивает время репарации ДНК, но также защищает организм от распространения клеток с опасными мутациями. Структура белка р53 и значение различных доменов для регуляции транскрипции и других свойств белка хорошо изучены, однако механизм проапоптотической активности белка р53 неизвестен. Большая часть работ в данном контексте была проведена в области канцерогенеза. Вовлеченность гена Тp53 в процессы обучения и памяти практически не изучены. Однако было показано, что в модели водного лабиринта Морриса у мышей с индуцированным нарушением пространственной памяти D-галактозой с последующим ее восстановлением Schisantherin A происходит регулирование экспрессии p19/p53/p21/cyclinD1/CDK4 генов, что свидетельствует в участии их в механизмах памяти [10]. Немногочисленность данных в данном вопросе диктует теоретический и практический интерес изучения активности генов, кодирующие белки, которые вовлечены в механизмы апоптоза нервных клеток при обучении и формировании различных видов памяти.
Целью настоящей работы явилось сравнительное изучение особенностей экспрессии Тp53 гена в релевантных структурах мозга: гиппокампе, мозжечке и префронтальной коре мозга у половозрелых крыс Wistar, обученных пространственному навыку в водном лабиринте, а также у подвергнувшихся принудительному плаванию и интактных животных.
Методы исследования.
Эксперименты были выполнены на крысах -самцах Wistar (n=30, трехмесячного возраста и массой 250,0±15,0 г.), которые содержались в стандартных условиях при свободном доступе к пище и воде, а также 12-ти часовом световом режиме при соблюдении этических норм работы с экспериментальными животными, сформулированных Советом Европейского сообщества об использовании жи- вотных для экспериментальных исследований (Директива 86/609/EEC в пересмотре от 14.11.2005). Формирование пространственной памяти у крыс было изучено с использованием водного лабиринта Морриса (Columbus Instruments, USA) по протоколу, описанному ранее [8]. Крысы были разделены на 3 группы: 1 гр. – интактные животные (n=10), 2 гр. – группа «активного контроля – принудительное плавание без платформы » (n=10), 3 гр. – «обученные в водном лабиринте Морриса» животные (n=10). Экспериментальный протокол составлен таким образом, что время принудительного плавания крысы в группе активного контроля соответствовало времени, проведенному в воде обучавшимся животным, т.е. каждому обучавшемуся животному по времени и паттерну плавания соответствовала одна “контрольная” особь. Через 24 ч по окончании поведенческих экспериментов всех крыс декапити-ровали, извлекали на холоду (+4ºС) структуры мозга: Гиппокамп, префронтальную кору и мозжечок, которые использовали для изучения экспрессии гена Тp53 методом ПЦР в режиме реального времени по описанному ранее протоколу [2,3], применяя в качестве референсного гена – ген β-актина для последующего расчёта относительно уровня экс--ΔΔCt прессии изучаемых генов по методу 2 [9]. Уро вень экспрессии гена Тp53 в 2-ой и 3–ей группах был подсчитан относительно данных их экспрессии у интактных животных. На Рис.2 экспрессия изучаемого гена Тp53 группе «активный контроль» и у обученных животных представлена в относительных единицах.
Статистическую обработку полученных результатов проводили по алгоритмам программы “Statistica 7,0”. При сравнении нескольких независимых выборок применяли однофакторный непараметрический дисперсионный анализ по методу Крускалла-Уолиса (Н-критерий) с последующим post-hoc анализом по U-критерию Манна-Уитни. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным величине 0,05.
Результаты и обсуждение.
С целью изучения вовлеченности гена Тp53 в процессы обучения и формирование пространственной памяти в работе были проведены поведенческие эксперименты по выработке долговременной пространственной памяти у взрослых крыс в водном лабиринте Морриса. В результате было показано, что среднее значение времени достижения платформы у животных во втором и всех последующих сеансах было достоверно ниже, чем в первом ( р <0,01–0,05), а к концу 4-го сеанса обучения (4 день эксперимента) значения времени достижения платформы животными были меньше 10 сек ( р <0,01), что свидетельствует о формировании стабильной долговременной пространственной памяти (Рис. 1).
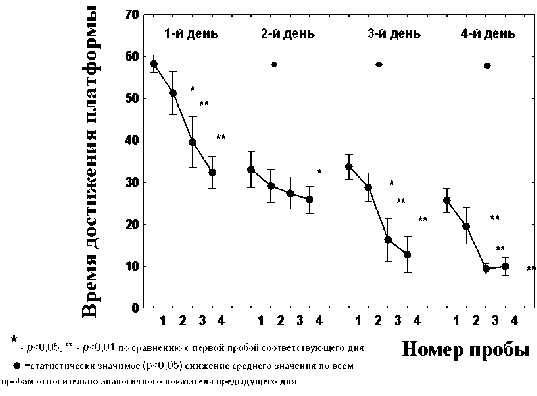
Рис. 1. Формирование долговременной пространственной памяти у половозрелых крыс Wistar в водном лабиринте Морриса.
В генетических экспериментах изучали экспрессию гена Тp53 , продукт которого белок p53 обеспечивает генетическую стабильность клеток, в различных структурах мозга-гиппокампе, префронтальной коре и мозжечке при формировании долговременной пространственной памяти в водном лабиринте Морриса у половозрелых крыс wistar. В качестве контроля выступали интактые животные, а также крысы, которых подвергали активному принудительному плаванию. Методом ПЦР в реальном времени определяли уровень экспрессии гена Тp53 . В исследованиях транскрипционной активности изучаемого гена Тp53 в различных церебральных структурах у крыс всех групп были обнаружены значимые различия в уровне его экспрессии в гиппокампе, префронтальной коре и мозжечке животных в группах «активного контроля» и «обучения» по сравнению с нативными животными. Анализ межструктурной экспрессии гена Тp53 у животных, подвергнувшихся принудительному плаванию в водном лабиринте без платформы документировал практически полное подавление активности гена Тp53 при принудительной физической нагрузке в воде во всех изученных структурах мозга по сравнению с его эндогенной активностью у нативных животных ( p <0,001) (Рис. 2 А).
Вероятно, что такое ингибирование активности гена Тp53, возможно связано с активацией нейрогенеза и рецепроктным подавлением апоптоза вновьобразованных нервных клеток при испытываемом стрессе животных от помещения в воду и резкой активацией физической нагрузки при принудительном плавании [2]. Можно предположить, что помещение экспериментальных животных в незнакомую ранее им среду (непрозрачную воду) и многодневное нахождение в ней без платформы, олицетворяющую твердую поверхность привело крыс к эмоциональному напряжению и стрессу, вызвало элементы страха и тревожности, а также физическое перенапряжение.
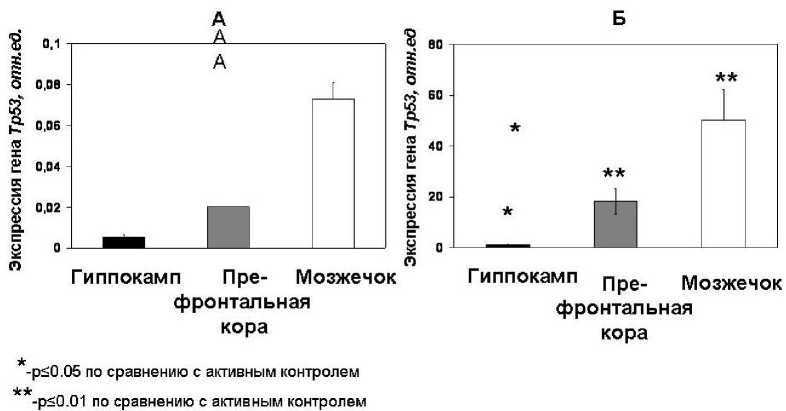
Рис. 2. Уровень экспрессии гена Тр53 в церебральных структурах крыс Wistar в группах «активного контроля» (А) и при обучении пространственному навыку (Б)
Эмоциональная и физическая нагрузка явились негативными сигналами геному, в частности, выразившимися в ингибировании активности гена Тp53 и, вероятно, последующему снижению содержания белка p53. В группе крыс с формированной долговременной пространственной памятью структурный паттерн экспрессии изучаемого гена Тp53 отличается от такового у животных, которых принуждали к плаванию в водном лабиринте без платформы. Отмечается противоположный вектор экспрессии гена Тp53 в исследуемых структурах мозга. При обучении документирована усиленная активация экспрессии гена Тp53 в префронтальной коре и мозжечке в 50 и 18 раз, соответственно по сравнению с интактными животными, а на фоне подавления активности гена Тp53 на инициативной стадии помещения животных в воду, обучение новому навигационному навыку резко стимулирует экспрессию данного гена (Рис. 2.Б). Данный факт, вероятно, связан с необходимостью срочной наработки продукта экспрессии гена Тp53 – белка p53, имеющего характерное для транскрипционного фактора строение и состоящего из доменов, определяющих способность к узнаванию и связыванию со специфическими последовательностями ДНК, а также к взаимодействию с компонентами транскрипционной машины и ее активации. Связываясь с регуляторными участками определенных генов, белок р53 обычно вызывает их активацию, хотя некоторые гены он, напротив, репрессирует, используя для репрессии несколько альтернативных механизмов. При обучении навигационному навыку необходим синтез новых белков, без которых не происходит консолидация памятного следа при формировании памяти. Вероятно, белок p53 берет на себя функцию сигнальной молекулы, обеспечивающей запуск экспрессии других генов, продукты которых вовлечены в данные процессы, например гена NRG, дефицит продукта которого приводит к нарушению памяти [4] или генов – регуляторов нейрогенеза и апоптоза, участвующих в регуляции данных процессов [7]. Кроме того, наши результаты согласуются с выводами других исследователей о генных путях, важных одновременно как для обучения и для памяти, так и апоптоза [8].
Таким образом, 4-х-дневное обучение животных нахождению платформы в водном лабиринте привело к формированию долговременной пространственной памяти, что было ассоциировано с тенденцией возвращения уровня экспрессии гена Тp53 к таковому у интактных крыс в гиппокампе и активацией экспрессии данного гена в префронтальной коре и мозжечке мозга. Полученные данные демонстрируют ранее написанное, что консолидация пространственной памяти, вероятно, произошла в префронтальной кое и мозжечке, которые задействованы наряду с гиппокампом в акцептировании информации, хранении и консолидации и воспроизведении на день тестирования сформированной пространственной памяти. В генетическом обеспечении данных процессов, как было документировано, принимает участие ген Тp53, экспрессия которого служит своего рода чувствительным механизмом поддержания устойчивости и мобильности генома нервных клеток при формировании долговременной памяти.
Список литературы Особенности межструктурной экспрессии "хранителя генома" - гена ТР53 в мозге при формировании долговременной пространственной памяти у взрослых крыс Вистар
- Александров Ю.И., Горкин А.Г., Созинов А.А. и др. Консолидация и реконсолидация памяти: психофизиологический аспект // Вопросы психологии. 2015. № 3. С. 133-142.
- Грудень М.А., Сторожева З.И., Ратмиров А.М., Шерстнев В.В. Паттерн экспрессии генов Notch2, Numb и Cas8 в релевантных структурах мозга крыс при формировании пространственной памяти // Бюллетень экспериментальной медицины и биологии. 2017. № 6. С. 751-755.
- Грудень М.А, Ратмиров А.М., Соловьева О.А., Шерстнев В.В. Г енетическая регуляция активности калиевых каналов типа kir в различных отделах мозга при фрмировании пространственной памяти у половозрелых крыс // Академический журнал Западной Сибири. 2017. Т. 13, № 1 (68). С. 72-73.
- Грудень М.А., Ратмиров А.М., Сторожева З.И. Дифференциальная экспрессия гена NrG1 в церебральных структурах у крыс Wistar при формировании пространственной памяти // Академический журнал Западной Сибири. 2018. Т. 14, № 1 (72). С. 36-42.
- Шерстнёв В.В., Голубева О.Н., Грудень М.А., Сторожева З.И., Гусева Е.В. Нейрогенез и нейроапоптоз в различных отделах зрелого мозга крыс Wistar // Нейрохимия. 2012. № 3. С. 206-212.
- Achanta P., Thompson K.J., Fuss M., Martinez J.L. Jr. Gene expression changes in the rodent hippocampus following whole brain irradiation // Neurosci Lett. 2007. V. 418, № 2. Р. 143-114.
- Hupbach A., Hardt O., Gomez R., Nadel L. The dynamics of memory: context-dependent updating // Learn Mem. 2008. V. 15, № 8. Р. 574-579.
- Gruden M.A., Storozheva Z.I., Sewell R.D. et al. Distinct functional brain regional integration of Casp3, Ascl1 and S100a6 gene expression in spatial memory // Behav Brain Res. 2013. V. 252. Р. 230-238.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) // Method. Methods. 2001. V. 25, № 4. Р. 402-408.
- Liu C., Sun W., Li N. et al. A improves learning and memory of mice with d-galactose-induced learning and memory impairment through its antioxidation and regulation of p19/p53/p21/Cyclin D1/CDK4/RB Gene Expressions // J Med Food. 2018. V. 21, № 7. Р. 678-688.
- Nader K., Schafe G.E., Le Doux J.E. The labile nature of consolidation theory // Nat Rev Neurosci. 2000. V. 1, № 3. Р. 216-219.
- Nader K., Schafe G.E., Le Doux J.E. Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval // Nature. 2000. V. 406, № 6797. Р. 722-726.
- Rolls E.T., Wirth S. Spatial representations in the primate hippocampus, and their functions in memory and navigation // Prog Neurobiol. 2018. № 171. Р. 90-113.
- Tan H.M., Wills T.J., Cacucci F. The development of spatial and memory circuits in the rat // Wiley Interdiscip Rev Cogn Sci. 2017. V. 8, №3, e 1424.


