Особенности микроциркуляторных реакций в области экспериментального раневого дефекта у белых крыс
Автор: Лойко Д.Д., Савкина А.А., Степанова Т.В., Кириязи Т.С., Основин О.В., Андронова Т.А., Абдрахманова И.И., Федоров А.Н., Иванов А.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 2 т.18, 2022 года.
Бесплатный доступ
Цель: выявить изменения параметров микроциркуляторного русла методом лазерной допплеровской флоуметрии в процессе заживления раневого дефекта и возможности их применения для модернизации технологий оценки эффективности средств для лечения ран. Материал и методы. Исследования выполнены на 25 белых крысах, разделенных на две группы: 10 контрольных интактных крыс, 15 животных с полнослойным экспериментальным дефектом кожи. У крыс оценивали параметры микроциркуляции кожи краев экспериментальной раны с помощью лазерной допплеровской флоуметрии, а также проводили анализ гистологических препаратов тканей области раневого дефекта. Результаты. Изменения микроциркуляции кожи краев раневого дефекта характеризуются воспалительной гиперемией, проявляющейся увеличением перфузионного показателя на 27% и нормированных амплитуд миогенных, дыхательных и сердечных колебаний. Изменения микроциркуляции верифицируются морфологической картиной воспаления, которая отражает увеличение количества полнокровных сосудов артериального и венозного русла, а также лейкоцитарную инфильтрацию дна и краев раны. Заключение. Мониторинг микроциркуляторных нарушений, возникающих в области кожных ран, позволяет оценить динамику репаративного процесса, что может быть использовано для разработки и оценки эффективности существующих медикаментозных и немедикаментозных методов стимуляции регенерации.
Микроциркуляция, полнослойный раневой дефект, регенерация
Короткий адрес: https://sciup.org/149141153
IDR: 149141153 | УДК: 616-003.9:616-018
Текст научной статьи Особенности микроциркуляторных реакций в области экспериментального раневого дефекта у белых крыс
1 Введение. В настоящее время во всем мире распространенность острых и хронических ран остается на высоком уровне. Различные осложнения, которыми может сопровождаться процесс заживления ран, включая раневую инфекцию, формирование гипертрофированных рубцов и келоидов, оказывают негативное влияние как на качество жизни пациентов, так и на экономику системы здравоохранения в связи с увеличением продолжительности и стоимости лечения [1]. Одним из важных этапов создания новых средств для ухода и лечения ран является их апробация in vivo , что обусловливает актуальность совершенствования моделей и средств оценки эффектов инновационных продуктов.
По современным представлениям процесс заживления ран представляет собой сложную сеть физиологических изменений, включая реакции со стороны микрососудов зоны повреждения [2, 3]. Микроцирку-ляторные реакции в области раны оказывают непосредственное влияние на динамику и интенсивность репарации кожных ран, корригируя метаболические фазы течения раневого процесса [4]. Наблюдение за динамикой раневого процесса позволяет принять своевременное эффективное терапевтическое решение, что оказывает значительное влияние на конечный результат лечения.
Сегодня лазерная допплеровская флоуметрия — одна из самых современных неинвазивных методик, позволяющих оценить состояние микроциркулятор-ного русла [5]. Новизной методологического подхода, реализующегося в ходе настоящего исследования, является разработка возможности применения параметров лазерной допплеровской флоуметрии в оценке динамики репаративной регенерации кожных ран .
В связи с этим цель настоящего исследования — выявить изменения параметров микроциркулятор-ного русла методом лазерной допплеровской фло-уметрии в процессе заживления раневого дефекта и возможности их применения для модернизации технологий оценки эффективности средств для лечения ран.
Материалы и методы. Эксперимент выполнен на 25 белых крысах массой 250–320 г, разделенных на две группы: в контрольную группу были включены 10 интактных крыс, в опытную группу вошли 15 животных с полнослойным экспериментальным дефектом кожи.
На протяжении всего эксперимента животные находились в стандартных условиях вивария в индивидуальных клетках. Для общей анестезии животным вводились «Телазол» («ZoetisInc», Испания) в дозе
0,1 мл/кг и «Ксиланит» (ООО «Нита-Фарм», Россия) в дозе 1 мг/кг внутримышечно. Все исследования были выполнены в соответствии с Европейской конвенцией по защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986), национальных руководств и правил учреждения по содержанию и использованию лабораторных животных и одобрены этическим комитетом Саратовского ГМУ имени В. И. Разумовского (протокол № 1 от 05.02.2019).
Контрольная группа, включавшая 10 интактных крыс, была сформирована для регистрации исходных параметров микроциркуляции кожи у крыс, которым не проводилась обработка антисептиками.
Моделирование полнослойного дефекта кожи осуществлялось хирургическим методом [6]. Для этого у животных опытной группы после депиляции и антисептической обработки кожи в межлопаточной области с помощью квадратного трафарета 5%-м йодом наносились контуры будущего раневого дефекта. По разметке с помощью скальпеля проводилось формирование полнослойного раневого дефекта размером 10×10 мм.
Для исследования состояния микрокровотока в зоне раневого дефекта использовали метод лазерной допплеровской флоуметрии, реализация которой выполнялась с помощью прибора «ЛАКК-ОП» (Россия). Измерение параметров микроциркуляции у животных опытной группы проводили на 14-е сутки эксперимента, располагая датчик анализатора на расстоянии 1 мм от верхнего края экспериментального дефекта. Оценивали перфузионный показатель и нормированные амплитуды эндотелиальных, нейрогенных, миогенных, дыхательных и сердечных колебаний [7].
Вывод животных из эксперимента осуществлялся передозировкой препаратов для наркоза. Для оценки морфологических изменений, происходящих в зоне экспериментальной полнослойной раны, мягкие ткани раневого дефекта забирались на 14-е сутки эксперимента и фиксировались в 10%-ном растворе формалина для дальнейшего гистологического исследования. Гистологические срезы толщиной 5 мкм окрашивались гематоксилином и эозином (ООО «Биовитрум», Россия). Микроскопию препаратов зоны раневого дефекта выполняли с помощью микровизора проходящего света серии μVizo-103 (ООО «ЛОМО ФОТОНИКА», Россия). Оценивали состояние и кровенаполнение сосудов микроциркуля-торного русла, а также инфильтрацию дна раны и ее перифокальной зоны клеточными элементами, участвующими в реализации раневого процесса, такими как фибробласты, лимфоциты, макрофаги.
Статистическую обработку полученных данных проводили с использованием программы Statistica 10.
Изменение показателей микроциркуляции в зоне раневого дефекта, Ме (Q25; Q75)
|
Показатели |
Группа |
|
|
контроля ( n =10) |
опытная ( n =15) |
|
|
Показатель перфузии, перф. ед. |
10,4 (9,6; 12,3) |
13,2 (11,3; 14,1) р =0,015 |
|
Амплитуда колебаний, усл. ед. |
||
|
эндотелиальных |
15,2 (11,5; 17,7) |
5,3 (4,04; 6,1) р <0,001 |
|
нейрогенных |
6,8 (6,7; 8,2) |
6,7 (5,4; 7,5) р =0,157 |
|
миогенных |
6,7 (5,9; 7,9) |
10,6 (7,3; 11,6) р <0,001 |
|
дыхательных |
9,1 (7,9; 11,6) |
14,7 (12,5; 18,8) р <0,001 |
|
сердечных |
3,8 (3,3; 4,7) |
18,6 (16,4; 20,1) р <0,001 |
П р и м еч а н и е : в каждом случае приведены медиана и интерквартильный размах; p — по сравнению с контролем.
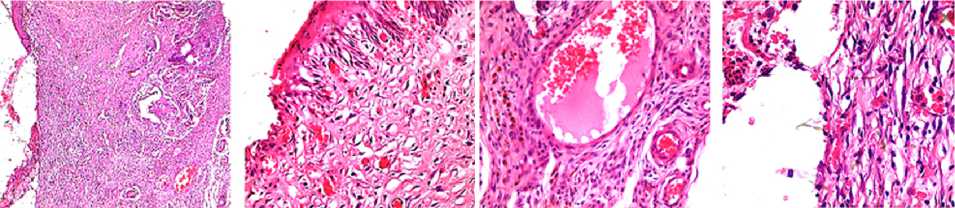
А Б В Г
Морфологические изменения в зоне раневого дефекта (окраска гематоксилином и эозином): А — зона раневого дефекта кожи (объектив ×5); Б — полнокровие сосудов перифокальной зоны, лимфоцитарная инфильтрация (объектив ×20); В — сладж и сепарация крови, лимфоцитарная инфильтрация, сидерофаги в перифокальной зоне (объектив ×40); Г — нейтрофильная инфильтрация края раневого дефекта (объектив ×40).
Полученные данные не соответствовали законам нормального распределения, поэтому представлены в таблице в виде медианы ( Ме ) и интерквартильного размаха (Q25; Q75). Сравнение между группами проведено с помощью критерия Манна — Уитни. Критический уровень значений показателя достоверности принимали равным 0,05.
Результаты. На 14-е сутки эксперимента у крыс опытной группы отмечалось уменьшение площади раневого дефекта до 6,3 (5;30) мм2 (уменьшение на 95% от исходной величины).
При оценке микроциркуляторных нарушений в зоне полнослойной кожной раны установлено, что у крыс опытной группы на 14-е сутки эксперимента перфузионный показатель кожи на границе раневого дефекта был статистически значимо выше контрольных значений на 27%. Повышение перфузии в данной группе животных сопровождалось перераспределением вклада активных и пассивных механизмов модуляции микрокровотока. При оценке активных механизмов модуляции выявлено статистически значимое снижение нормированных амплитуд эндотелиальных колебаний на 65% относительно контроля и, напротив, увеличение нормированных амплитуд миогенных колебаний на 58%. Значимых изменений нормированных амплитуд нейрогенных колебаний перфузии кожи на границе раневого дефекта у крыс опытной группы через 2 недели не вы- явлено. Установлено, что большой вклад в изменение микроциркуляторных реакций кожи на границе раневого дефекта вносят пассивные механизмы модуляции кровотока. Это проявлялось статистически значимым увеличением относительно контрольных значений нормированных амплитуд дыхательных колебаний на 6l %, а сердечных — в 4,9 раза (таблица).
При морфологическом исследовании препаратов зоны раневого дефекта установлено, что соединительная ткань перифокальной зоны богата кровеносными сосудами артериального и венозного русла (рис. А, Б). Отмечается их полнокровие (рис. Б), в отдельных сосудах присутствует сладж и сепарация крови (рис. В). При анализе клеточных популяций области кожной раны обнаружено, что преобладающей клеточной популяцией являются фибробласты. Наблюдается выраженная лимфоцитарная инфильтрация, присутствуют единичные сидерофаги. Края и дно раны инфильтрированы нейтрофилами (рис. Г).
Обсуждение. Полученные в ходе эксперимента данные о темпах регенерации полнослойной кожной раны согласуются с данными литературы, свидетельствующими о том, что раневой дефект кожи у крыс к 14-му дню эксперимента эпителизирует-ся более чем на 90% [8]. Вместе с тем результаты проведенного исследования подтверждают, что заживление кожной раны у крыс опытной группы сопровождается выраженными изменениями микро- кровотока, проявляющимися повышением перфузии краев раневого дефекта, а также изменением вклада активных и пассивных механизмов в регуляции кровотока. Полученный результат соответствует данным других авторов, которые продемонстрировали активацию коллатерального кровотока на модели полнослойного дефекта кожи [3].
Выявленные особенности микроциркуляторных реакций соответствуют морфологическим изменениям, происходящим в области раневого дефекта. Так, повышение перфузии краев кожной раны согласуется с наличием большого количества сосудов по периферии раны. Кроме того, отмечается их выраженное кровенаполнение, что непосредственно приводит к увеличению перфузионного показателя.
Увеличение вклада пассивных механизмов модуляции микрокровотока краев раневого дефекта у крыс опытной группы на 14-е сутки эксперимента, проявляющееся повышением сердечных и дыхательных колебаний в спектре ЛДФ-грамм, характеризует усиление притока и затруднения оттока крови в микроциркуляторном русле соответственно [9]. Это подтверждает визуализированное полнокровие сосудов как артериального, так и венозного русла. Наличие сладжа и сепарации крови в отдельных венулах свидетельствует о резком снижении оттока крови, что, вероятно, является одной из причин выраженного увеличения вклада дыхательных колебаний в модуляцию кровотока в микроциркуляторном русле кожи краев раневого дефекта.
Следует отметить, что эффективное заживление ран и образование грануляционной ткани невозможно без ангиогенеза. Процесс образования новых сосудов в физиологических и патологических условиях регулируется различными биологически активными веществами, среди которых особая роль отводится цитокинам и ростовым факторам. Согласно данным литературы, нейтрофилы, которые первыми мигрирует в область раневого дефекта, способны синтезировать и высвобождать широкий спектр цитокинов и проангиогенных факторов, таких как VEGF, TNFα, IL-1β, IL-8, которые прямо или косвенно способствуют росту и миграции эндотелиальных клеток, что вызывает образование новых кровеносных сосудов [10]. В то же время источниками цитокинов и ростовых факторов, влияющих на ангиогенные реакции, могут быть и другие клетки лейкоцитарного ряда, в частности лимфоциты, а также тканевые макрофаги и пролиферирующие фибробласты [11]. Присутствие в зоне экспериментального раневого дефекта клеток указанных ранее популяций, включая нейтрофилы, макрофаги, лимфоциты и фибробласты, и продукция ими регуляторных молекул может объяснять выявленные изменения микроциркуляции. В частности, обнаруженное в ходе исследования снижение миогенного тонуса сосудов, сопровождающееся увеличением нормированных амплитуд миогенных колебаний, может быть связано с продукцией различных провоспалительных цитокинов лейкоцитами, присутствующими в тканях зоны раневого дефекта в большом количестве. Помимо этого, в очаге воспаления развивается локальный ацидоз и гипоксия тканей, которые, в свою очередь, приводят к снижению миогенного тонуса и дилатации прекапиллярных сфинктеров, что выражается в увеличении амплитуд миогенных колебаний [9].
Заключение. Особенности микрокровотока в области раневого дефекта, выявленные с помощью лазерной допплеровской флоуметрии, соответствуют морфологическим характеристикам динамики раневого процесса. Мониторинг микроциркуляторных нарушений, возникающих в области кожных ран, позволяет неинвазивно оценить динамику репаративного процесса, что может быть использовано для патогенетической разработки и оценки эффективности существующих и медикаментозных и немедикаментозных методов стимуляции регенерации.
Список литературы Особенности микроциркуляторных реакций в области экспериментального раневого дефекта у белых крыс
- Sen CK. Human wound and its burden: updated 2020 compendium of estimates. Adv Wound Care (New Rochelle) 2021; 10 (5): 281–92.
- Haller HL, Sander F, Popp D, et al. Oxygen, pH, lactate, and metabolism-how old knowledge and new insights might be combined for new wound treatment. Medicina (Kaunas) 2021; 57 (11): 1190.
- Yousefi S, Qin J, Dziennis S, et al. Assessment of microcirculation dynamics during cutaneous wound healing phases in vivo using optical microangiography. J Biomed Opt 2014; 19 (7): 76015.
- Sоrensen MA, Petersen LJ, Bundgaard L, et al. Regional disturbances in blood flow and metabolism in equine limb wound healing with formation of exuberant granulation tissue. Wound Repair Regen 2014; 22 (5): 647–53.
- Kulikov DA, Glazkov AA, Kovaleva YuA. et al. Prospects of laser Doppler flowmetry application in assessment of skin microcirculation in diabetes. Diabetes Mellitus 2017; 20 (4): 279–85. Russian (Куликов Д. А., Глазков А. А., Ковалева Ю. А. и др. Перспективы использования лазерной допплеровской флоуметрии в оценке кожной микроциркуляции крови при сахарном диабете. Сахарный диабет 2017; 20 (4): 279–85).
- Smotrin SM, Dovnar RI, Vasil`kov AYU, et al. Effect of a dressing containing gold or silver nanoparticles on experimental wound healing. Journal of the Grodno State Medical University 2012; 1 (37): 75–80. Russian (Смотрин С. М., Довнар Р. И., Васильков А. Ю. и др. Влияние перевязочного материала, содержащего наночастицы золота или серебра, на заживление экспериментальной раны. Журнал Гродненского государственного медицинского университета 2012; 1 (37): 75–80).
- Humeau A, Koïtka A, Abraham P, et al. Time-frequency analysis of laser Doppler flowmetry signals recorded in response to a progressive pressure applied locally on anaesthetized healthy rats. Phys Med Biol 2004; 49 (5): 843–57.
- Bi H, Feng T, Li B, et al. In vitro and in vivo comparison study of electrospun pla and pla / pva / sa fiber membranes for wound healing. Polymers (Basel) 2020; 12 (4): 839.
- Krupatkin AI. Blood flow oscillations — new diagnostic language in microvascular research. Regional Blood Circulation and Microcirculation 2014; 13 (1): 83–99. Russian (Крупаткин А. И. Колебания кровотока — новый диагностический язык в исследовании микроциркуляции. Регионарное кровообращение и микроциркуляция 2014; 1 (49): 83–99).
- Tecchio C, Cassatella MA. Neutrophil-derived cytokines involved in physiological and pathological angiogenesis. Chem Immunol Allergy 2014; (99): 123–37.
- Wang Z, Qi F, Luo H, Xu G, et al. Inflammatory microenvironment of skin wounds. Front Immunol 2022; (13): 789274.


