Особенности морфогенеза яровой мягкой пшеницы в культуре in vitro в зависимости от условий произрастания
Автор: Никитина Е.Д., Хлебова Л.П.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Экология
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Изучено влияние условий произрастания 12 сортов яровой мягкой пшеницы на реализацию их морфогенетического потенциала в культуре незрелых зародышей. Установлена достоверная зависимость каллусо-, морфогенеза и регенерации растений от генотипического разнообразия сортов, условий выращивания донорных растений и генотип-средо- вого взаимодействия. Генотипическая специфичность исходного материала является доминирующим фактором, определяющим эффективность всех образовательных процессов in vitro (каллусогенеза - на 38 %, морфогенеза - на 33 %, регенерации растений - на 80 %). Реакция отдельных генотипов на условия выращивания доноров эксплантов специфична. Полевые условия наиболее благоприятны для генотипов с высоким уровнем регенерации, условия зимнее-весенней вегетации в теплице - для сортов с низким регенерационным потенциалом, так как повышают частоту выхода растений в 3,4-13,9 раза.
Мягкая пшеница, генотип, условия произрастания, незрелые зародыши, каллусогенез, морфогенез, регенерация
Короткий адрес: https://sciup.org/14113068
IDR: 14113068 | УДК: 581:633.11
Текст научной статьи Особенности морфогенеза яровой мягкой пшеницы в культуре in vitro в зависимости от условий произрастания
Введение. Феномен тотипотентности соматических растительных клеток позволяет индуцировать морфогенетические процессы в культуре in vitro , в результате которых de novo образуются ткани и органы, способные формировать целый организм [5]. Известно, что морфогенез является одним из наиболее сложных и трудно регулируемых событий в культуре ткани, особенно для семейства Gramineae. Результаты многих исследований [2, 21], а также данные наших экспериментов [3, 11, 13, 14] продемонстрировали несомненную генотипическую обусловленность данного процесса. Установлена зависимость способности к реализации генетических потенций от дифференцировки клеток экспланта. У пшеницы наилучшие результаты получены при использовании 14–17-дневных незрелых зародышей [1, 6, 7, 16]. Кроме того, реализацию морфогенетических возможностей клеточных культур определяют условия выращивания in vitro [8–10, 12, 15, 17, 22].
Из вышеизложенного следует, что одним из направлений исследовательской активности остается поиск факторов, обеспечивающих формирование морфогенного каллуса и последующую успешную регенерацию из него растений.
Если для культуры пыльников злаков однозначно установлено, что условия роста донорных растений существенно влияют на способность к андрогенезу, причем максимальный выход эмбриогенных структур наблюдается при выращивании исходного материала в полевую вегетацию [4, 20], то в отношении культуры незрелых зародышей нет однозначного мнения. Так, например, С. Меддок и соавт. не обнаружили различий между каллусогенной способностью незрелых зародышей пшеницы, сформировавшихся в разных условиях [21]. Другие исследователи показали незначительное различие эм-бриогенного потенциала каллусных культур в зависимости от физиологического состоя- ния исходных растений [18]. Экспланты одних генотипов демонстрировали сходную реакцию на культивирование in vitro, несмотря на различающиеся условия выращивания родительских форм, в то время как другие сорта продуцировали больше эмбриогенного каллуса при пассировании материала, выращенного в теплице. Таким образом, приведенные сведения не дают четкого представления о влиянии условий произрастания исходных сортов злаков на изменчивость морфогенетических процессов в культуре незрелых зародышей.
Цель исследования. Изучить возможности морфогенетического потенциала каллус-ных культур сортов T. aestivum в зависимости от условий роста и развития растений – доноров эксплантов.
Материалы и методы. Материалом для исследования служили 12 сортов яровой мягкой пшеницы различного эколого-географического происхождения: Алтайская 81 , Алтайская 50 , Алтайская 88 , Целинная 20 , Скала , Зарница , Жница , Тулунская 10 , Ботаническая 2 , Спектр , Россиянка (Россия), Leones (Аргентина). Растения-доноры выращивали в селекционных теплицах арочного типа и в полевых условиях.
Тепличная вегетация продолжалась с января по май. Среднемесячная температура варьировала в пределах 21,0–24,9 °С. На протяжении февраля, марта, апреля и мая освещенность постепенно возрастала, равняясь 14,5; 17,8; 19,1 и 22,0 клк соответственно. Досвечивание в теплице производилось лампами ДМЗ-3000, что повышало уровень естественной освещенности на 10 клк.
Освещенность в полевых условиях в ясные солнечные дни превышала 50 клк, в пасмурную погоду составляла 10–14 клк. Среднемесячная температура в мае, июне, июле и августе была равна 12,7; 19,0; 21,5 и 16,5 °С соответственно.
Для индукции каллуса использовали незрелые зародыши размером 1,3–1,5 мм, которые пассировали на среду Линсмайера–Скуга (RM-64) [19], содержащую 0,8 % агара, 3,0 % сахарозы, 2 мг/л 2,4-Д. Клеточные культуры выращивали в темноте при температуре 26±1 °С, пересаживая каждые 30–35 дней на дифференцирующую среду с гормональным составом: 0,5 мг/л 2,4-Д и 0,5 мг/л кинетина. Выявленные зоны морфогенеза переносили на среду для регенерации, содержащую 0,2 мг/л индолилуксусной кислоты. Проростки, достигшие 5–7 см, высаживали в сосуды с почвой и доращивали до созревания в климатической камере при температуре 12 °С ночью и 17 °С днем с 16-часовым фотопериодом. Эксперимент выполнен в 4 повторениях по 60 зародышей на генотип. В ходе исследования определяли следующие показатели: число каллусов на эксплант (каллусогенез), число морфогенных клеточных линий на каллус (морфогенез), число регенерантов на морфогенный каллус (частота регенерации).
Статистический анализ данных проводили с использованием пакета прикладных программ ВИУА.
Результаты и обсуждение. Результаты тестирования сортов T. aestivum показали, что в полевую вегетацию средняя частота индукции клеточных линий (каллусогенез) составила 91,7 %, варьируя от 76,6 ( Жница ) до 100,0 % ( Целинная 20 , Алтайская 88 , Россиянка ) (табл. 1).
При выращивании донорных растений в условиях зимне-весенней вегетации в теплице средний результат оказался несколько ниже – 87,6 %. Пределы изменчивости составили от 72,9 ( Ботаническая 2 ) до 97,6 % ( Скала ). Однако реакция сортов на условия выращивания неоднозначна. Для одних ( Скала , Спектр , Жница , Зарница ) лучшими являются условия закрытого грунта, в то время как другие индуцируют клеточные линии значительно эффективнее от донорных сортов полевой вегетации.
Дисперсионный анализ полученных данных показал, что изменчивость каллусогенеза статистически значимо определяется разнообразием генотипов, условий произрастания растений-доноров и их взаимодействием (табл. 2).
Морфогенез в среднем по всем сортам эффективнее реализовался у эксплантов мягкой пшеницы летнего периода развития, достигнув 65,7 %. Размах изменчивости по признаку составил от 28,4 (Тулунская 10) до 91,2 % (Leones). Средняя частота формирова- ния морфогенных каллусов в тепличную вегетацию оказалась несколько ниже – 55,7 %, варьируя от 43,8 (Ботаническая 2) до 76,7 % (Скала). Условия выращивания исходных растений в теплице снижали морфогенетические возможности каллусных тканей большинства генотипов, за исключением сортов Тулунская 10, Зарница и Алтайская 88.
Таблица 1
Реакция сортов яровой мягкой пшеницы, выращенных в различных условиях, на культивирование in vitro
|
Сорт |
Каллусогенез, % |
Морфогенез, % |
Частота регенерации растений, % |
|||
|
1 |
2 |
1 |
2 |
1 |
2 |
|
|
Скала |
81,8 |
97,6 |
88,9 |
76,7 |
356,3 |
275,8 |
|
Спектр |
84,8 |
96,8 |
78,6 |
53,3 |
402,3 |
140,0 |
|
Ботаническая 2 |
97,6 |
72,9 |
73,7 |
43,8 |
94,3 |
115,4 |
|
Leones |
95,3 |
81,8 |
91,2 |
52,2 |
146,2 |
49,4 |
|
Тулунская 10 |
92,7 |
76,3 |
28,4 |
53,6 |
157,1 |
155,6 |
|
Целинная 20 |
100,0 |
88,0 |
75,2 |
46,6 |
23,5 |
17,1 |
|
Жница |
76,6 |
81,6 |
63,9 |
45,0 |
117,4 |
83,3 |
|
Зарница |
86,0 |
95,3 |
43,2 |
68,3 |
29,7 |
46,4 |
|
Алтайская 81 |
98,4 |
88,8 |
52,6 |
50,6 |
6,6 |
22,7 |
|
Алтайская 50 |
86,6 |
86,4 |
69,0 |
53,7 |
3,6 |
30,8 |
|
Алтайская 88 |
100,0 |
94,5 |
56,1 |
60,5 |
3,3 |
23,1 |
|
Россиянка |
100,0 |
91,0 |
67,9 |
64,0 |
1,8 |
25,0 |
|
Среднее значение |
91,7 |
87,6 |
65,7 |
55,7 |
111,8 |
81,3 |
Примечание. 1 – полевая вегетация; 2 – зимне-весенняя вегетация в теплице.
Данные дисперсионного анализа подтверждают достоверность наблюдаемых различий по признаку «морфогенез» как по ге- нотипам, так и по условиям роста и развития исходных сортов, а также по их взаимодействию (табл. 2).
Таблица 2
Влияние генотипов и условий произрастания исходного материала на процессы культивирования незрелых зародышей яровой мягкой пшеницы
|
Источник вариации |
F ф |
||
|
Каллусогенез |
Морфогенез |
Регенерация растений |
|
|
Генотипы |
4,5** |
6,7* |
50,8* |
|
Условия |
5,3** |
20,6* |
6,6** |
|
Взаимодействие «генотип – условия» |
3,1* |
5,8* |
6,0* |
Примечание. F ф – фактическое значение F-критерия по фактору; *, ** – достоверно при 1 и 5 % уровне значимости соответственно.
Регенерационные процессы в среднем по генотипам активнее протекали в клеточных культурах, полученных из эксплантов летней вегетации. Частота регенерации оказалась равной 111,8 %, в условиях теплицы она составила 81,3 % (табл. 1). Однако реакция изученных образцов была неоднозначной и определялась физиологическим состоянием донорных растений. Условия открытого грунта оказали благоприятное воздействие на реализацию регенерационного потенциала одних сортов (Скала, Leones, Спектр, Целинная 20, Жница) и снижали выход растений-регенерантов у остальных генотипов. Следует отметить, что сорта с низкой регенерационной активностью значительно повышали ее при использовании условий теплицы для выращивания доноров эксплантов. В результате частота выхода регенерантов у сортов Алтайская 81, Алтайская 50, Алтайская 88 и Россиянка возросла в 3,4; 8,6; 7,0 и 13,9 раза соответственно. Указанные сорта обнаружили низкий выход регенерантов (от эксплантов, выращиваемых в поле), несмотря на относи- тельно высокую долю морфогенных каллусов (52,6–69,0 %). Это объясняется тем, что большинство морфогенных клеточных линий развивались по пути ризогенеза, что исключило формирование in vitro полноценных растений. Следовательно, условия развития зародышей (будущих эксплантов) ex vivo в зимне-весеннюю вегетацию в теплице способствовали в дальнейшем индукции эмбриоидогенеза и гем-моризогенеза после введения их в культуру. Это привело к столь существенному изменению направления морфогенеза и многократно повысило выход растений-регенерантов.
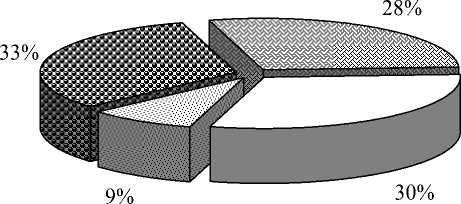
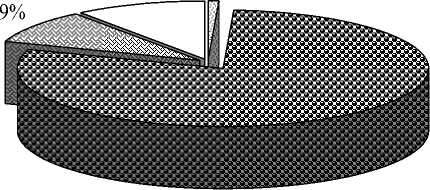
Результаты дисперсионного анализа подтвердили статистически значимое влияние на признак «регенерация растений» всех источников вариации (табл. 2). Сравнивая доли вклада генотипического разнообразия и условий в образовательные процессы при культивировании незрелых зародышей пшеницы, мы видим, что каллусо-, морфогенез и регенерация растений определяются в большей степени генотипом и взаимодействием «генотип – условия» (рис. 1).
4%
31%
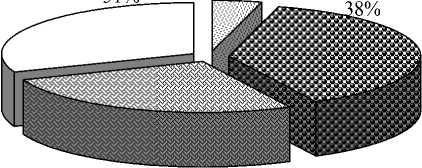
27%
Каллусогенез
Морфогенез
-
□ Условия
^ Генотип
0 Взаимодействие генотип х условия
-
□ Случайное
Регенерация растений
Рис. 1. Вклад источников вариации в общую изменчивость образовательных процессов в культуре незрелых зародышей яровой мягкой пшеницы
Анализ данных по влиянию условий выращивания растений – доноров эксплантов свидетельствует о постоянном, но низком вкладе этого фактора в изменчивость различных культуральных процессов. Количественная оценка влияния данного фактора в зависимости от стадии развития культуры варьировала от 1 до 9 %. Тем не менее полевые условия способствовали увеличению средних значений всех изучаемых процессов в культуре незрелых зародышей: каллусогенез повысился на 4,1 %, морфогенез – на 10,0 % и регенерация растений – на 30,5 %.
Следует также принять во внимание, что генотип-средовое взаимодействие существенно для всех изученных признаков. Его вклад в наблюдаемую изменчивость каллусо-, морфогенеза и регенерацию растений составила 27, 28 и 9 % соответственно. Различные генотипы, подвергнутые одинаковому изменению условий среды, реагировали на него по-разному.
Заключение. Таким образом, различные образовательные процессы в культуре незрелых зародышей пшеницы в большей мере зависят от наследственности сортов и лишь в некоторой степени – от комплекса факторов среды, в которых эти сорта произрастают. Реакция отдельных генотипов на условия выращивания доноров эксплантов специфична. Полевые условия наиболее благоприятны для генотипов с высоким уровнем регенерации, условия зимнее-весенней вегетации в теплице – для сортов с низким регенерационным потенциалом.
-
1. Батыгина Т. Б. Прикладные аспекты эмбриологии. Автономность зародыша и эмбриокультура цветковых растений / Т. Б. Батыгина, В. Е. Васильева // Ботанический журн. – 1987. – Т. 72, № 2. – С. 155–161.
-
2. Гапоненко А. К. Регенерация растений различных генотипов пшеницы Тriticum aestivum L . in vitro / А. К. Гапоненко, М. А. Мунтян // Доклады АН СССР. – 1984. – Т. 278, № 5. – С. 12–31.
-
3. Григорьева Л. П. Скрининг сортов пшеницы по способности к морфогенезу в культуре незрелых зародышей in vitro / Л. П. Григорьева, И. А. Шлецер // Известия Алтайского гос. ун-та. – 2006. – № 3 (51). – С. 64–66.
-
4. Дьячук Т. В. Культура пыльников пшеницы и ее использование в селекции / Т. В. Дьячук, П. А. Дьячук // Биология культивируемых клеток и биотехнология : Международная конференция. – Новосибирск, 1988. – С. 207–208.
-
5. Ежова Т. А. Генетический контроль тотипотентности растительных клеток в культуре in vitro / Т. А. Ежова // Онтогенез. – 2003. – Т. 34, № 4. – С. 245–252.
-
6. Круглова Н. Н. Незрелый зародыш пшеницы как морфогенетический компетентный эксплант / Н. Н. Круглова, А. А. Катасонова // Физиология и биохимия растений. – 2009. – Т. 41, № 2. – Р. 124–131.
-
7. Круглова Н. Н. Периодизация эмбриогенеза пшеницы как методологический аспект биотехнологических разработок / Н. Н. Круглова // Известия Уфимского научного центра РАН. – 2012. – № 2. – С. 21–24.
-
8. Никитина Е. Д. Влияние температуры и освещения на прямое прорастание незрелых зародышей Triticum aestivum L. в культуре in vitro / Е. Д. Никитина, Л. П. Хлебова // Известия Алтайского гос. ун-та. – 2014. – № 3–1 (83). – С. 46–50.
-
9. Никитина Е. Д. Влияние фитогормонов на морфогенез и регенерацию растений каллусных тканей Triticum aestivum / Е. Д. Никитина // Генетика. – 1994. – № 30 (прил.). – С. 109–110.
-
10. Никитина Е. Д. Разработка отдельных элементов технологии клеточной селекции яровой пшеницы на устойчивость к абиотическим стрессам / Е. Д. Никитина, Л. П. Хлебова, О. В. Ере-щенко // Известия Алтайского гос. ун-та. – 2014. – Т. 2, № 3 (79). – С. 50–54.
-
11. Никитина Е. Д. Роль генотипа в реализации морфогенетических процессов в культуре незрелых зародышей у Triticum aestivum L. / Е. Д. Никитина // Сибирский вестн. сельскохозяйственной науки. – 2004. – № 2 (152). – С. 32–34.
-
12. Никитина Е. Д. Роль физических факторов в реализации морфогенетического потенциала клеточных культур T. aestivum / Е. Д. Никитина // Новые методы биотехнологии растений : материалы II Российского симпозиума. – Пущино : Пущинский НЦ, 1993. – С. 159.
-
13. Никитина Е. Д. Создание источников устойчивости яровой пшеницы к воздействию никеля методами клеточной селекции in vitro / Е. Д. Никитина, Л. П. Хлебова, Г. Г. Соколова // Известия Алтайского гос. ун-та. – 2013. – № 3–1 (79). – С. 088–090.
-
14. Создание стрессоустойчивого материала яровой мягкой пшеницы с использованием клеточной селекции in vitro / Е. Д. Никитина [и др.] // Известия Алтайского гос. ун-та. – 2013. – № 3–2 (79). – С. 95–98.
-
15. Суханов Н. П. Условия получения каллуса и регенерантов в культуре незрелых зародышей пшеницы / Н. П. Суханов, Н. Д. Папазян // Апо-
миксис и цитоэмбриология растений. – 1983. – № 5. – С. 124–128.
-
16. Хамула П. В. Влияние генотипа и размера зародыша мягкой пшеницы на частоту каллусооб-разования / П. В. Хамула, В. Д. Солодовниченко, Л. В. Базько // Селекционно-генетические аспекты повышения продуктивности зерновых культур. – Мироновка, 1987. – С. 45– 48.
-
17. Effect of 2,4-dichlorophenoxyacetic acid and NaCl on the establishment of callus and plant regeneration in durum and bread wheat / A. Pellegrineschi [et al.] // Plant Cell, Tissue, Organ Culture. – 2004. – Vol. 77, № 3. – Р. 245–250.
-
18. Identification of callus types for long-term maintenance and regeneration from commercial cultivars of wheat ( Triticum aestivum L.) / F. E. Redway [et al.] // TAG. – 1990. – № 79. – P. 609–617.
-
19. Linsmaier E. Organic growth factor reqular-ments of tobacco tissue culture / E. Linsmaier, F. Sko-og // Physiol. Plant. – 1965. – Vol. 18, № 1. – P. 100–127.
-
20. Ouyang J. W. Induction of pollen plants in Triticum aestivum / J. W. Ouyang // Haploids of higher plants in vitro . – Springer-Verlag ; Berlin ; Heidelberg ; New York, 1986. – P. 26–41.
-
21. Plant regeneration from cultured immature embryos and inflorescences of 25 cultivars of wheat ( T. aestivum ) / S. E. Maddock [et al.] // J. Exp. Bot. – 1983. – Vol. 34, № 144. – P. 915–926.
-
22. Przetakiewicz A. The effect of auxin on plant regeneration of wheat, barley and Triticale / A. Prze-takiewicz, W. Orczyk, A. Nadolska-Orczyk // Plant Cell, Tissue and Organ Culture. – 2003. – Vol. 73, № 3. – Р. 245–256.
MORPHOGENESIS FEATURES OF SPRING WHEAT IN VITRO CULTURE DEPENDING ON GROWING CONDITIONS
E.D. Nikitina 1 , L.P Khlebova2
-
1Altai Research Institute of Agriculture, Barnaul, 2Altai State University, Barnaul
Список литературы Особенности морфогенеза яровой мягкой пшеницы в культуре in vitro в зависимости от условий произрастания
- Батыгина Т. Б. Прикладные аспекты эмбриологии. Автономность зародыша и эмбриокультура цветковых растений/Т. Б. Батыгина, В. Е. Васильева//Ботанический журн. -1987. -Т. 72, № 2. -С. 155-161.
- Гапоненко А. К. Регенерация растений различных генотипов пшеницы Тriticum aestivum L. in vitro/А. К. Гапоненко, М. А. Мунтян//Доклады АН СССР. -1984. -Т. 278, № 5. -С. 12-31.
- Григорьева Л. П. Скрининг сортов пшеницы по способности к морфогенезу в культуре незрелых зародышей in vitro/Л. П. Григорьева, И. А. Шлецер//Известия Алтайского гос. ун-та. -2006. -№ 3 (51). -С. 64-66.
- Дьячук Т. В. Культура пыльников пшеницы и ее использование в селекции/Т. В. Дьячук, П. А. Дьячук//Биология культивируемых клеток и биотехнология: Международная конференция. -Новосибирск, 1988. -С. 207-208.
- Ежова Т. А. Генетический контроль тотипотентности растительных клеток в культуре in vitro/Т. А. Ежова//Онтогенез. -2003. -Т. 34, № 4. -С. 245-252.
- Круглова Н. Н. Незрелый зародыш пшеницы как морфогенетический компетентный эксплант/Н. Н. Круглова, А. А. Катасонова//Физиология и биохимия растений. -2009. -Т. 41, № 2. -Р. 124-131.
- Круглова Н. Н. Периодизация эмбриогенеза пшеницы как методологический аспект биотехнологических разработок/Н. Н. Круглова//Известия Уфимского научного центра РАН. -2012. -№ 2. -С. 21-24.
- Никитина Е. Д. Влияние температуры и освещения на прямое прорастание незрелых зародышей Triticum aestivum L. в культуре in vitro/Е. Д. Никитина, Л. П. Хлебова//Известия Алтайского гос. ун-та. -2014. -№ 3-1 (83). -С. 46-50.
- Никитина Е. Д. Влияние фитогормонов на морфогенез и регенерацию растений каллусных тканей Triticum aestivum/Е. Д. Никитина//Генетика. -1994. -№ 30 (прил.). -С. 109-110.
- Никитина Е. Д. Разработка отдельных элементов технологии клеточной селекции яровой пшеницы на устойчивость к абиотическим стрессам/Е. Д. Никитина, Л. П. Хлебова, О. В. Ерещенко//Известия Алтайского гос. ун-та. -2014. -Т. 2, № 3 (79). -С. 50-54.
- Никитина Е. Д. Роль генотипа в реализации морфогенетических процессов в культуре незрелых зародышей у Triticum aestivum L./Е. Д. Никитина//Сибирский вестн. сельскохозяйственной науки. -2004. -№ 2 (152). -С. 32-34.
- Никитина Е. Д. Роль физических факторов в реализации морфогенетического потенциала клеточных культур T. aestivum/Е. Д. Никитина//Новые методы биотехнологии растений: материалы II Российского симпозиума. -Пущино: Пущинский НЦ, 1993. -С. 159.
- Никитина Е. Д. Создание источников устойчивости яровой пшеницы к воздействию никеля методами клеточной селекции in vitro/Е. Д. Никитина, Л. П. Хлебова, Г. Г. Соколова//Известия Алтайского гос. ун-та. -2013. -№ 3-1 (79). -С. 088-090.
- Создание стрессоустойчивого материала яровой мягкой пшеницы с использованием клеточной селекции in vitro/Е. Д. Никитина //Известия Алтайского гос. ун-та. -2013. -№ 3-2 (79). -С. 95-98.
- Суханов Н. П. Условия получения каллуса и регенерантов в культуре незрелых зародышей пшеницы/Н. П. Суханов, Н. Д. Папазян//Апомиксис и цитоэмбриология растений. -1983. -№ 5. -С. 124-128.
- Хамула П. В. Влияние генотипа и размера зародыша мягкой пшеницы на частоту каллусообразования/П. В. Хамула, В. Д. Солодовниченко, Л. В. Базько//Селекционно-генетические аспекты повышения продуктивности зерновых культур. -Мироновка, 1987. -С. 45-48.
- Effect of 2,4-dichlorophenoxyacetic acid and NaCl on the establishment of callus and plant regeneration in durum and bread wheat/A. Pellegrineschi //Plant Cell, Tissue, Organ Culture. -2004. -Vol. 77, № 3. -Р. 245-250.
- Identification of callus types for long-term maintenance and regeneration from commercial cultivars of wheat (Triticum aestivum L.)/F. E. Redway //TAG. -1990. -№ 79. -P. 609-617.
- Linsmaier E. Organic growth factor reqularments of tobacco tissue culture/E. Linsmaier, F. Skoog//Physiol. Plant. -1965. -Vol. 18, № 1. -P. 100-127.
- Ouyang J. W. Induction of pollen plants in Triticum aestivum/J. W. Ouyang//Haploids of higher plants in vitro. -Springer-Verlag; Berlin; Heidelberg; New York, 1986. -P. 26-41.
- Plant regeneration from cultured immature embryos and inflorescences of 25 cultivars of wheat (T. aestivum)/S. E. Maddock //J. Exp. Bot. -1983. -Vol. 34, № 144. -P. 915-926.
- Przetakiewicz A. The effect of auxin on plant regeneration of wheat, barley and Triticale/A. Przetakiewicz, W. Orczyk, A. Nadolska-Orczyk//Plant Cell, Tissue and Organ Culture. -2003. -Vol. 73, № 3. -Р. 245-256.


