Особенности морфологического исследования опухоли Вилмса у детей младшего возраста
Автор: Нгуба Муана М.А., Ал Хадж А. М., Агафонникова А.А., Чепелев А.С., Кондратьев Г.В., Тимофеев Е.В.
Журнал: Juvenis scientia @jscientia
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.9, 2023 года.
Бесплатный доступ
Введение. Опухоль Вилмса (ОВ, нефробластома) - наиболее частая злокачественная эмбриональная опухоль почки детей, встречается с частотой от 0,7-0,8 до 1 случая на 100 000 населения детского возраста. Патологоанатомические характеристики ОВ многообразны, выявляется широкий тканевой и клеточный спектр (некроз и кровоизлияния), часто определяются разрастание в почечную и полую вены и локальные метастазы в регионарные лимфатические узлы. Микроскопически нефробластома представлена тремя компонентами разной степени дифференцировки: бластемой, эпителиальным и стромальным компонентом. Цель исследования. Произвести детальное макроскопическое исследование операционного материала и оценить гистологическую вариабельность компонентов ОВ. Материалы и методы. В исследование включено 3 пациента в возрасте от 1 до 6 лет, которые находились на лечении в онкогематологическом отделении клиники СПбГПМУ в 2022 году с диагнозом опухоль Вилмса. Проанализированы макроскопические материалы и гистологические препараты. Использовались стандартные методики подготовки и окраски тканей опухоли и световая микроскопия с фотографированием. Результаты. Макроскопически наблюдался увеличенный за счет опухоли размер почки, цвет на поверхности - серо-розовый, с участками темно-красного и синюшного, крупнобугристая форма (субкапсулярные узлы с тенденцией к выпячиванию) с дефектами капсулы. На разрезе почки определялись множественные неоднородные по плотности узлы. В одном случае верифицирован бластемный тип ОВ, в остальных - нефробластома смешанного типа. Заключение. Макроскопическая и микроскопическая картина ОВ чрезвычайно разнообразна и демонстрирует широкую тканевую и клеточную вариабельность (некроз и кровоизлияния). Проведение макроскопического и гистологического исследования является диагностически значимым методом, оценивающим локализацию опухоли в отношении к сосудам. Все критерии влияют на определение стадии опухоли и дальнейшую тактику лечения.
Нефробластома, опухоль вилмса, гистологическое исследование, онкологические заболевания, детский возраст, морфология
Короткий адрес: https://sciup.org/14127824
IDR: 14127824 | DOI: 10.32415/jscientia_2023_9_3_12-21
Текст научной статьи Особенности морфологического исследования опухоли Вилмса у детей младшего возраста
Нефробластома или опухоль Вилмса (ОВ) — это злокачественная эмбриональная опухоль почки, развивающаяся из плюрипотентных клеток-предшественников нефрогенной ткани и составляющая 90% всех злокачественных опухолей почек детского возраста от 1 до 5 лет [1]. Другими опухолями почек у детей, которые встречаются гораздо реже, являются: врожденная мезобластная нефрома, рабдоидная опухоль почки, светлоклеточная саркома почки, мультилокулярная кистозная нефрома (или одиночная мультилокулярная киста), частично дифференцированная кистозная нефробластома, метанефрическая аденофиброма, почечно- клеточный рак (включая папиллярный и медуллярный рак почки) и почечно- клеточная ангиомиолипома (рис. 1).
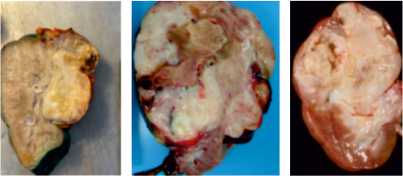
Рисунок 1. Типы злокачественных опухолей почки — нефробластома (слева), мезобластная нефрома (в центре), рабдоидная опухоль почки (справа).
ОВ встречается с частотой от 0,7–0,8 до 1 на 100 000 населения детского возраста до 14 лет, что составляет около 5% от общего числа злокачественных новообразований детского возраста. Около 80% случаев ОВ диагностируется в возрасте до 5 лет, из них 15% до 1 года, медиана возраста на момент постановки диагноза составляет 3,5 года. ОВ поражает, в основном, одну почку, в 6–10% случаев встречается билатеральное поражение почек. Вероятность обнаружения нефробластомы не связана с полом ребенка. Также не было выявлено никаких изменений в частоте поражения правой и левой почек [2].
Генетические факторы, в частности дефекты в нескольких генах — WT1, WT2 и WT3, которые связаны с нарушениями образования специфических белков, участвующих в регуляции развития первичного нефрона и действующих как регуляторы роста почек и супрессоры опухоли, играют ключевую роль в генезе этой опухоли [3]. Аномальная активация гена инсулиноподобного фактора роста 2, наблюдаемая у многих пациентов с ОВ, свидетельствует о нарушении регуляции развития почек, вызванном повышенными пренатальными концентрациями митогена. Определенные расстройства или воздействие ионизирующего излучения в течение первой половины беременности тоже являются факторами риска.
ОВ часто сочетается с врожденными пороками развития, такими как аниридия (отсутствие радужной оболочки глаза), гемигипертрофия (когда одна сторона тела развита сильнее или слабее второй). Также ОВ может быть ассоциирована с рядом генетических синдромов, таких как синдромы Бекви-та- Видемана, Дениса- Драша, Перлмана и WAGR-синдром. Генетические синдромы встречаются в 5–10% случаев и чаще представляют собой сочетание опухоли с пороками развития мочеполовой системы, нефропатию и макросомию [2, 4].
Классифицируют опухоли почек по степени риска:
-
I. Опухоли низкого риска:
Мезобластная нефрома
Кистозная частично дифференцированная неф-робластома
Нефробластома — полностью некротическая (после предоперационной химиотерапии) II. Опухоли среднeго риска:
Нефробластома эпителиального типа Нефробластома стромального типа Нефробластома смешанного типа Нефробластома регрессивного типа Нефробластома с очаговым типом анаплазии III. Опухоли высокого риска:
Нефробластома бластемного типа Нефробластома с диффузной анаплазией Светлоклеточная саркома почки Рабдоидная опухоль почки
Стадийность определяется по размеру и состоянию опухоли, наличию регионарных и отделенных метастазов (табл. 1) [5].
Классификация послеоперационного стадиро-вания основана на радикальности оперативного
Таблица 1
|
Стадии опухоли |
Критерии |
|
I |
Неразорвавшаяся опухоль, не выходит за пределы капсулы почки, ограниченная почкой и может быть полностью удалена. |
|
II |
Опухоль выходит за пределы капсулы почки, прорастает в околопочечную клетчатку и может быть полностью удалена. |
|
III |
Опухоль прорастает в брюшную полость, без гематогенных метастазов и удаляется не радикально. Разрыв опухоли |
|
IV |
Наличие гематогенных метастазов в легкие, печень, кость независимо от того, какая местная стадия определяется отдельно, или метастазы в лимфатические узлы за пределами брюшно-тазовой области. |
|
V |
Двусторонняя опухоль. Каждая из 2 опухолей, взятых изолированно, должна иметь местную стадию I, II или III стадии. |
Классификация нефробластомы в соответствии с протоколом SIOP 93
вмешательства, а также на распространенности процесса. При метастатической форме или билатеральной форме нефробластомы, локальная стадия может не совпадать с клинической (например, стадия IV, локальная стадия III).
Стадия I:
-
• Опухоль ограничена почкой или окружена кап-сулой/псевдокапсулой, если выходит за контуры почки. Капсула/псевдокапсула могут быть инфильтрированы опухолью, но неопластическая ткань не достигает наружной ее границы;
-
• Опухоль может пролабировать в лоханку (так называемое «выпячивание») или «провисать» в мочеточник, не инфильтрируя его стенки;
-
• Сосуды почечного синуса интактны;
-
• Возможны инвазия и опухолевые эмболы в сосудах паренхимы почки.
Наличие зрелых тубулярных структур в мягких тканях почечного синуса не свидетельствует о его инфильтрации, эти структуры представляют собой интралобарные остатки нефрогенной стромы. Перилобарные остатки нефрогенной стромы могут также быть иногда обнаружены в мягких тканях почечного синуса. Истинной инфильтрацией мягких тканей почечного синуса/ворот почки является обнаружение очагов бластемы в непосредственной близости к нервным стволикам.
Наличие некроза или признаков терапевтического патоморфоза (гемосидероз, инфильтрация пенистыми макрофагами) в мягких тканях почечного синуса, почечной вене и/или в периреналь-ной жировой ткани не повышает стадию. Инфильтрация надпочечника не повышает стадию, если наружная поверхность капсулы его не вовлечена в опухолевый процесс. Опухоль может прилежать к капсуле печени, что не является инфильтрацией прилежащих органов. Только наличие истинной инфильтрации паренхимы печени должно быть расценено как стадия III.
Стадия II:
-
• Витальная опухоль визуализируется в пери-ренальной жировой ткани и не покрыта капсу-лой/псевдокапсулой, но удалена радикально («чистые» края резекции);
-
• Витальная опухоль инфильтрирует мягкие ткани почечного синуса;
-
• Витальная опухоль инфильтрирует кровеносные и лимфатические сосуды почечного синуса или почечной вены или визуализируется в пе-риренальных мягких тканях, но удалена радикально;
-
• Витальная опухоль инфильтрирует стенку мочеточника;
-
• Витальная опухоль инфильтрирует прилежащие органы или нижнюю полую вену, но удалена радикально. Только наличие нервов в мягких тканях, наряду с сосудами, дает основание считать визуализируемые структуры почечным синусом.
Стадия III:
-
• Витальная опухоль визуализируется в маркированных краях резекции («опухоль в краске»). При наличии опухоли с патоморфозом в крае резекции стадия III выставляется при условии обнаружения витальной опухоли менее чем в 5 мм от маркированного краской края резекции. При наличии витальной опухоли более чем в 5 мм от маркированного краской края резекции стадия не повышается до III. Расстояние минимум 5 мм от витальной опухоли до края резекции с пато-морфозом должно быть подтверждено несколькими блоками фрагментов, выделенных из этой области;
-
• Любые абдоминальные лимфатические узлы поражены витальной опухолью или опухолью с терапевтическим патоморфозом;
-
• Пре- или интраоперационый разрыв опухоли, видимый при патоморфологическом исследовании, вне зависимости от остальных критериев стадирования;
-
• Наличие опухолевого тромба в крае резекции мочеточника, почечной вены или нижней полой вены (края резекции в этом случае всегда обсуждаются с хирургом);
-
• Опухолевый тромб, вплотную прилежащий к стенке нижней полой вены, удален хирургом частями;
-
• Открытая/клиновидная биопсия опухоли до предоперационной химиотерапии или хирургического этапа лечения;
-
• Витальная опухоль или опухоль с патоморфо-зом проникают за пределы забрюшинного пространства;
-
• Опухолевые импланты (витальные или с пато-морфозом) найдены в любом месте брюшной полости/забрюшинного пространства.
Сокращение почечной вены: зачастую опухолевый тромб пролабирует в почечную вену и выходит за макроскопические края резекции. Это в большей степени заметно после хирургической резекции с последующей фиксацией. Стадия III выставляется только при условии фрагментации тромба в процессе выделения или же если выделение вызвало значительные затруднения со стороны хирурга.
Наличие некротизированной опухоли или опу- холи с патоморфозом в лимфатических узлах расценивается как предсуществовавший витальный метастаз, и выставляется стадия III (возможно, витальная опухоль имеет место быть за пределами исследуемого лимфатического узла). Регрессивные (терапевтически индуцированные) изменения в лимфатическом узле должны иметь форму пред-существовавшего метастаза. Интрасинусоидальное распределение пенистых макрофагов не расценивается как опухоль с патоморфозом.
Иногда в ткани лимфатического узла могут быть обнаружены зрелые тубулярные структуры, что ассоциировано с депозитами белка Тамм--Хорсфалла, но также встречается и без него. Данное явление не расценивается как метастаз.
Наличие повреждения/разрыва опухоли расценивается как значимое для стадии III только если визуализируется при нефрэктомии.
Стадия IV:
-
• Гематогенные метастазы (лёгкие, печень, кости, головной мозг и др.) или метастазы в отдалённые лимфатические узлы (вне брюшной полости и полости таза).
Стадия V:
Двусторонняя нефробластома. Опухоль с каждой стороны стадируется согласно описанным критериям отдельно.
Кроме того, выделяют 2 морфологические конфигурации заболевания:
-
• Aнапластическая, характеризующаяся выраженным клеточным полиморфизмом и атипией фокального или диффузного характера;
-
• Саркоматозная, включающую светлоклеточную саркому почки и злокачественную рабдоидную опухоль почки.
В последние годы выделяют 3 группы ОВ: благоприятную, нормальную и неблагоприятную. К первой группе относят мультикистозные, тубулярные и фиброаденоматозные формы опухоли, а к двум последним — новообразования со значительными очагами клеточного атипизма (анаплазией), светлоклеточную саркому и рабдоидную форму опухоли [6].
Иногда саркоматозные опухоли выделяют не как варианты ОВ, а как самостоятельные формы новообразований. По совокупности гистологических признаков ОВ подразделяют в зависимости от про- гноза на благоприятные и неблагоприятные. Такое деление основано на чувствительности опухолевых клеток к проводимой терапии.
ОВ часто обнаруживают родители во время купания или одевания ребенка. Родители наблюдают у ребенка увеличение живота, бледность кожных покровов и общее недомогание на начальных стадиях. На начальных стадиях заболевания снижения массы тела и лихорадки практически не встречаются. Иногда ОВ обнаруживается во время простого визита к педиатру. По мере роста опухоли клинические проявления нарастают, но болевой синдром не характерен, что может отсрочить раннее обращение к врачу [1, 3, 7].
При значительных размерах опухоли вследствие сдавления магистральных сосудов возникают отек нижних конечностей и асцит. Возможны тошнота, рвота, снижение аппетита, гематурия, боль в животе, характер и локализация которой довольно разнообразны. Причиной боли служат либо давление на окружающие органы, либо прорастание опухоли в диафрагму, печень или забрюшинную клетчатку. К поздним симптомам относят асимметрию живота и макрогематурию, местные проявления связаны с увеличением размеров пораженной почки, сдавлением и прорастанием опухоли в окружающие органы и ткани, в частности, в магистральные сосуды.
Опухоль чаще локализуется в верхних отделах живота, подреберье и напоминает увеличению селезенку.
Выживаемость детей с ОВ длительное время оставалась низкой и к середине XX века составила 47% при своевременном хирургическом вмешательстве с последующей послеоперационной лучевой терапией. К концу XX века выживаемость удалось значительно повысить до 95% при минимизации долгосрочных последствий за счет программного лечения с использованием химиотерапии, совершенствования хирургической помощи и снижения частоты применения лучевой терапии [8].
Макроскопическая картина чрезвычайно разнообразна, демонстрирует широкий тканевой и клеточный спектр (некроз и кровоизлияния) [3]. Распространено разрастание в почечную и полую вены и локальные метастазы в регионарные лимфатические узлы. При разрезе опухоль часто имеет тен- денцию к выпячиванию. Это однородная бледносерая масса мягкой консистенции. Распространено наличие кист.
Микроскопически нефробластома представлена тремя компонентами разной степени дифференцировки: бластемой, эпителиальным и стромальным компонентами. Бластемный компонент состоит из мелких, круглых или вытянутых, лимфоцитоподобных, плотно расположенных клеток с малым количеством цитоплазмы и незначительными признаками дифференцировки. Ядра округлой или полигональной формы, одинакового размера, хроматин конденсирован, хорошо заметны ядрышки, обычно много фигур митоза. Варианты роста бластемы: диффузный, узелковый, змееобразный, базалоидный, — часто сочетаются в пределах одной опухоли. Почечная бластема может формировать примитивные клубочки и канальцы, что служит проявлением способности к реверсии опухоли и возможности к самостоятельному созреванию. При анапластическом варианте опухоли клетки с выраженным полиморфизмом, ядра крупные, светлые, присутствует большое количество патологических митозов. Эпителиальный компонент представлен тубулярными структурами, повторяющими метанефритическую стадию развития почки, реже гломерулярными, в которых иногда обнаруживается метаплазия эпителия (плоскоклеточная, кишечная). Нередко из этого компонента образуются кисты. Стромальный компонент чаще представлен тонкими вытянутыми клетками, напоминающими эмбриональную мезенхиму, нередко в строме имеются недифференцированные поперечнополосатые мышцы, созревающие хондробласты и липобласты.
Дифференциальный диагноз ОВ следует проводить с простой кистой почки, гидронефрозом, поликистозом почек и тромбозом почечных вен. Самая сложная задача на предоперационном этапе — отличить ОВ от других новообразований почек, таких как фетальная мезодермальная гамартома, ангиомиолипома и почечно- клеточный рак [3, 6].
Хирургическое вмешательство — основной метод лечения больных с ОВ — опухоль и метастазы необходимо удалять. При односторонней опухоли операцией выбора служит трансперитонеальная нефрэктомия, при двусторонней — двусторонняя резекция в пределах здоровых тканей под контролем данных гистологического исследования.
Полихимиотерапия — важнейшая терапевтическая опция. Она чаще всего проводится в неоадъювантном и адъювантном вариантах. Послеоперационную химиотерапию целесообразно начать в течение двух недель после оперативного лечения. Объем и состав послеоперационной терапии будет зависеть от послеоперационной стадии и гистологического варианта опухоли.
ОВ неблагоприятного гистологического строения относительно устойчивы к радио- и химиотерапии и поэтому подвергаются агрессивным методам мультимодальной терапии. Лучевая терапия используется у детей старше трех лет с высокой группой риска.
Больным с рецидивами ОВ проводят агрессивную химиотерапию и радиотерапию, по показаниям — хирургическое лечение. Рецидив является основанием к использованию больших доз химиопрепаратов, применению новых комбинаций лекарственных средств. Назначение крайне агрессивной химиотерапии обычно приводит к гематологическим осложнениям, в связи с чем нередко таким больным выполняют аутотрансплантацию костного мозга [1, 2, 5].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Произвести детальное макроскопическое исследование операционного материала и оценить гистологическую вариабельность компонентов ОВ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 3 пациента в возрасте от 1 до 6 лет (девочка 1 год 2 месяца, мальчик 4 лет, девочка 6 лет), которые находились на лечении в онкогематологическом отделении клиники СПбГПМУ в 2022 году с диагнозом опухоль Вилмса. Проанализированы макроскопические материалы и гистологические препараты.
Патологоанатомическое обследование включало выполнение нефрадреналэктомии, идентификацию структуры ворот почки и мочеточника, окраску тканевыми красителями после просушивания органа, исследование паранефральной клетчатки и вовле- чения лимфатических узлов, окраску циркулярного хирургического края, измерение и взвешивание образца, вскрытие для подготовки к фиксации продольным разрезом (раскрытие «бабочкой»), измерение опухолевых узлов и самой опухоли, оценку зоны некроза и кровоизлияния, фиксацию фрагментов в 10%-м растворе формалина в течение 24 часов (рис. 2–4).
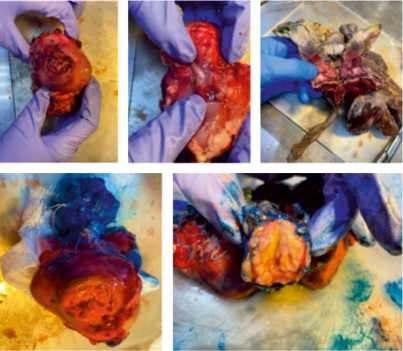
Рисунок 2. Этапы подготовки материала (сверху) и окраска тканевыми красителями (снизу)
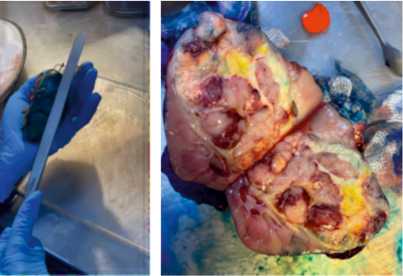
Рисунок 3. Срединный продольный разрез, раскрытие «бабочкой»
При микроскопическом исследовании оценивали долю индуцированных химиотерапией изменений, хирургический край резекции, стадию и прогностическую группу, все макроскопически различные участки опухоли, все имеющиеся лимфатические узлы, лоханку, клетчатку ворот, моче-
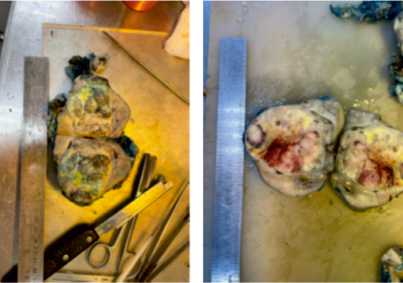
Рисунок 4. Измерение опухолевых узлов и оценка зон некроза и кровоизлияния точник и сосуды, каждый узел вне основного опухолевого узла, границу опухоль-ткань почки, капсулу опухоль-ткань почки, участки капсулы почки и пара-нефральной клетчатки, подозрительные на наличие опухолевой инфильтрации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По данным макроскопического исследования наблюдался увеличенный за счет опухоли размер почки (средний 7,5 х 6,5 х 6,0 см), цвет на поверхности — серо-розовый, с участками темно-красного и синюшного, крупнобугристая форма (субкапсулярные узлы с тенденцией к выпячиванию). На поверхности почки определялся дефект капсулы темно-красного цвета размером 2,5 х 2,0 см. Края резекции, дефекты капсулы, края опухоли прокрашивались различными гистологическими красителями.
На разрезе почки определялись множественные узлы, размерами от 6,5 х 5,5 см. Узел на разрезе имел очаги дрябловатой и плотноватой консистенции белесоватого цвета с четкими контурами. В присланном материале одного случая фрагменты ткани почки с подтвержденным диагнозом нефро-бластома, бластемный тип, ткань представлена на 80% бластемой, на 15% — стромальным компонентом, на 5% — эпителиальным компонентом, на фоне нефрогенных остатков и воспалительной лимфогистиоцитарной инфильтрации. В остальных случаях — нефробластома смешанного типа. В области ворот почки определялась опухолевая ткань, представленная бластемными клетками, окруженная псевдокапсулой, и прилежащий к ней крупный кровеносный сосуд, в просвете которого определялся опухолевой эмбол. Вена и артерия промаркирована шовным материалом.
ЗАКЛЮЧЕНИЕ
Макроскопическая и микроскопическая картина ОВ чрезвычайно разнообразна и демонстрирует широкую тканевую и клеточную вариабельность (некроз и кровоизлияния). Окрашивание краев резекции и капсулы опухоли, дефектов тканей позволяет оценить прорастание опухолевыми клетками. Проникновение опухолевых клеток в сосуды почечных ворот определяет метастазирование опухоли. Проведение макроскопического и гистологического исследования является диагностически значимым методом, оценивающим локализацию опухоли в отношении к сосудам. Все критерии влияют на
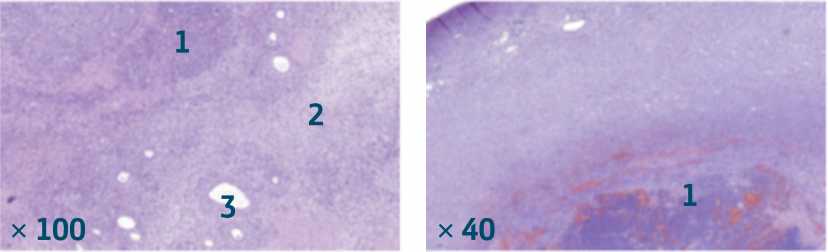
Рисунок 5. Нефробластома, бластемный тип (гематоксилин-эозин): 1 – бластема, 2 – стромальный компонент, 3 – эпителиальный компонент, на фоне нефрогенных остатков и воспалительной лимфогистиоцитарной инфильтрации.
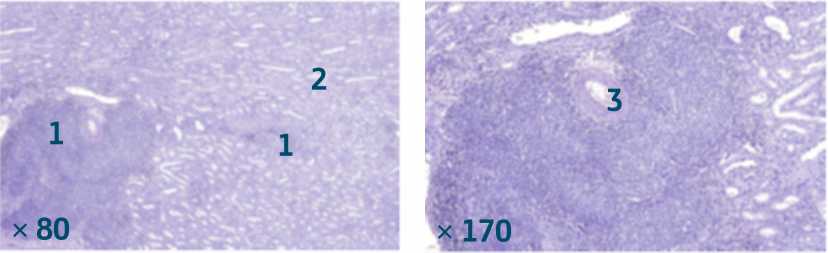
Рисунок 6. Нефробластома, бластемный тип (гематоксилин-эозин). Слева бластемные клетки (1) прорастают псевдокапсулу, распространяясь на интактную ткань почки (2). Справа интимноe расположение к стенке сосуда (3), что в дальнейшем может определять путь метастазирования.
определение стадии опухоли и дальнейшую тактику лечения.
Финансирование: Авторы заявляют об отсутствии финансирования.
Список литературы Особенности морфологического исследования опухоли Вилмса у детей младшего возраста
- Алиева М.Д., Полякова В.Г., Менткевич Г.Л., и др. Детская онкология: национальное руководство. Москва: Издательская группа РОНЦ; 2011.
- Белогурова М.Б. Опухоль Вилмса // Детская онкология. Руководство для врачей. Санкт-Петербург: 2002. С. 272-282.
- Андреева Ю.Ю., Франк Г.А. Опухоли почки. Морфологическая диагностика и генетика. Руководство. Москва: РМАПО; 2011.
- Treger TD, Brok J, Pritchard-Jones K. Biology and treatment of Wilms’ tumours in childhood. Revue d’Oncologie Hématologie Pédiatrique. 2016;4:170-181.
- Godzinski J. The current status of treatment of Wilms’ tumor as per the SIOP trials. J Indian Assoc Pediatr Surg. 2015;20(1):16-20. DOI: 10.4103/0971-9261.145439.
- Popov SD, Sebire NJ, Vujanic GM. Wilms’ Tumour - Histology and Differential Diagnosis. In: van den Heuvel-Eibrink MM, ed. Wilms Tumor. Brisbane (AU): Codon Publications; 2016.
- Chu A, Heck JE, Ribeiro KB, et al. Wilms’ tumour: a systematic review of risk factors and meta-analysis. Paediatr Perinat Epidemiol. 2010;24(5):449-469. DOI: 10.1111/j.1365-3016.2010.01133.x.
- Van den Heuvel-Eibrink MM, editor. Wilms Tumor. Brisbane (AU): Codon Publications; 2016 Mar.


