Особенности морфологии фолликулярной жидкости, уровней матриксной металлопротеиназы-1 и ее ингибитора-1 у пациенток с поликистозными яичниками в программах вспомогательных репродуктивных технологий
Автор: Маринова О.А., Трубникова Л.И.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Применение вспомогательных репродуктивных технологий у пациенток с синдромом поликистозных яичников (СПЯ) является эффективным способом реализации репродуктивной функции с мировыми показателями частоты наступления беременности 25-30 %. Цель исследования. Установить взаимосвязь уровней матриксной металлопротеиназы-1 (ММП-1) и ее ингибитора-1 (ТИМП-1) с особенностями морфологии фолликулярной жидкости у пациенток с СПЯ в программах вспомогательных репродуктивных технологий.
Бесплодие, синдром поликистозных яичников, вспомогательные репродуктивные технологии, матриксная металлопротеиназа-1 (ммп-1), тканевый ингибитор металлопротеиназы-1 (тимп-1), клиновидная дегидратация, фация
Короткий адрес: https://sciup.org/14130560
IDR: 14130560 | УДК: 618.11-008.64 | DOI: 10.34014/2227-1848-2024-2-78-89
Текст научной статьи Особенности морфологии фолликулярной жидкости, уровней матриксной металлопротеиназы-1 и ее ингибитора-1 у пациенток с поликистозными яичниками в программах вспомогательных репродуктивных технологий
Введение. Синдром поликистозных яичников (СПЯ) – наиболее частое заболевание репродуктивного возраста, обусловленное как наследственными факторами, так и воздействиями внешней среды. Ведущими признаками СПЯ являются гиперандрогения, менструальная и/или овуляторная дисфункция и поликистозное строение яичников [1]. В общей популяции распространенность СПЯ среди женщин варьирует от 8 % до 13 %. У пациенток с нарушением менструального цикла частота встречаемости синдрома составляет от 17,4 % до 46,6 %, при гирсутизме и других клинических проявлениях гиперандрогении – от 72,1 % до 82 %, при ановуляторном бесплодии - от 55 % до 91 % [1].
Несмотря на многочисленные исследования до настоящего времени не удалось сформировать единой концепции патогенеза и этиологии СПЯ. В патогенезе заболевания условно можно выделить нарушения в четырех различных отделах нейроэндокринной системы, каждое из которых может претендовать на стартовую роль: нарушения на уровне гипоталамо-гипофизарной системы, яичников, надпочечников и периферических инсулин-чувствительных тканей [2]. По клинической картине выделяют 4 фенотипа, по которым можно предположить степень агрессивности течения самого заболевания, а также развитие осложнений данного синдрома: фенотип А: ановуляция + гиперандрогения + поликистозные яичники на УЗИ; фенотип В: ановуляция + гиперандрогения; фенотип С: гиперандрогения + поликистозные яичники на УЗИ; фенотип D: ановуляция + поликистозные яичники на УЗИ [3].
В настоящее время не существует ни одного метода терапии, позволяющего полностью излечить больных с СПЯ. Патофизиологическое лечение, направленное на восстановление репродукции, имеет только временный эффект, после завершения беременности вновь проявляются симптомы СПЯ, т.е. наступает рецидив заболевания [4].
Для восстановления фертильности в настоящее время апробируются две технологии. Первая - стимуляция фолликулогенеза для образования одного или нескольких зрелых фолликулов и овуляции (частота наступления беременности - 50,0-60,0 %) [4]. Вторая - оперативные вмешательства на яичниках, выполненные эндоскопическим доступом, чаще лапароскопический дриллинг яичников (ЛДЯ) (эффективность - 56,0-62,0 %) [4]. Вместе с тем 20-30 % женщин с СПЯ не добиваются успеха при лечении бесплодия, что обусловлено высоким индексом массы тела, бесплодием более 3 лет и возрастом женщин старше 35 лет [3]. Согласно Международным клиническим рекомендациям (2018) хирургический метод лечения является методом второй линии для женщин с СПЯ при анову- ляторном бесплодии, у которых выявлена кло-мифенрезистентность и нет других факторов бесплодия. Согласно Российским клиническим рекомендациям (2021) проведение хирургического лечения может быть рекомендовано женщинам с СПЯ при наличии других показаний к хирургическому вмешательству (эндометриоз, трубно-перитонеальный фактор бесплодия) [2]. Характерно, что у женщин с ЛДЯ при проведении протоколов ВРТ риск тяжелого течения синдрома гиперстимуляции яичников (СГЯ) был невысокий, в то время как при проведении ВРТ после ЛДЯ отмечено уменьшение количества изъятых ооцитов и жизнеспособных эмбрионов. Следует отметить, что ни один из методов хирургического вмешательства не позволяет избежать образования в малом тазу спаечного процесса, который в дальнейшем осложняет проведение протоколов стимуляции овуляции при использовании ВРТ [3]. Согласно выводам последних исследований, назначение метформина у больных с СПЯ, избыточной массой тела и резистентностью к кломифену является более эффективным методом лечения, чем дрил-линг. Кроме того, частота живорождений после проведения ЛДЯ составляет 34,0 %, в других группах (кломифена цитрат, гонадотропины, ингибиторы ароматазы; кломифена цитрат + метформин) - 38,0 % [3]. При отсутствии резистентности первой линией терапии следует считать применение кломифена цитрата. Частота овуляции составляет 80 %, наступление беременности на монотерапии -от 7 % до 13 %, а при комбинации с препаратами ХГЧ увеличивается до 18-21 % [5]. В настоящее время продолжаются дискуссии о выборе оптимального протокола стимуляции суперовуляции у женщин с СПЯ, поскольку при применении протокола с антагонистами гонадотропин-релизинг-гормона (антГн-РГ) создаются более благоприятные условия для формирования пула растущих фолликулов и получения зрелых ооцитов и эмбрионов высокого качества. Однако использование данного протокола повышает риск развития осложнений в виде СГЯ в 1,5 раза. Поэтому в целях безопасного применения репродуктивных технологий широко используются протоколы стимуляции суперовуляции с использованием антГн-РГ [6].
Для СПЯ характерно вялотекущее хроническое воспаление, характеризующееся повышением активности маркеров воспаления в крови (цитокинов, лимфоцитов, нейтрофилов, эозинофилов, моноцитов), которые участвуют в аутоиммунных процессах. Женщины с СПЯ имеют повышенную васкуляризацию яичников и чрезмерно активный ангиогенез, как следствие, увеличение уровня фактора роста эндотелия сосудов (VEGF) [7]. Кроме того, в плазме крови отмечается увеличение ингибитора активатора плазминогена-1 и при стимуляции яичников происходит нарушение кровотока в микроциркуляторном русле, что свидетельствует о ранних дисфункциональных изменениях эндотелия сосудов [7]. Все эти процессы отражаются на качестве ооцитов у пациенток с СПЯ.
В этой связи представляет интерес исследование уровней матриксной металлопротеиназы-1 (ММП-1) и тканевого ингибитора металлопротеиназы-1 (ТИМП-1) в фолликулярной жидкости (ФЖ). Под контролем системы ММП-1/ТИМП-1 происходит формирование внеклеточного вещества и его разрушение, благодаря чему в яичниках создаются оптимальные условия для быстрорастущих фолликулов и желтых тел, а также для образования атретических тел. В результате ооциты и фол-ликулоциты созревающих фолликулов получают возможность расти и дифференцироваться. Перестройка коллагена также способствует клеточной миграции [8–16]. Необходимым условием нормального течения физиологических процессов в межклеточном матриксе является поддержание равновесия между активностью ММП и их ингибиторов. Нарушение этого равновесия может оказывать глубокое воздействие на состав межклеточного матрикса и влиять на различные функции клеток, включая адгезию, миграцию и дифференциацию [8–16], обусловливая развитие патологических процессов: воспалительных, аутоиммунных, нейродегенеративных, сердечно-сосудистых, инфекционных и онкологических [8-16]. Показано, что увеличение ММП-1 приводит к развитию процессов воспаления и деструкции, в то время как фиброз in vivo ассоциируется с увеличением уровня ТИМП-1, что подразумевает снижение активности ММП и, следовательно, увеличение накопления экстрацеллюлярного матрикса [13].
Проведенные ранее исследования при ряде гинекологических заболеваний и осложнениях беременности методом морфологической оценки биологических жидкостей показали, что при нарушениях перфузии органов, развитии эндотелиоза, склерозировании сосудов существенно нарушается структуропо-строение фаций (высушенная капля) и в них появляется большое количество специфических патологических маркеров, указывающих на наличие нарушений в органах и системах [17-22].
Цель исследования. Установить взаимосвязь уровней матриксной металлопротеиназы-1 и ее ингибитора-1 с особенностями морфологии фолликулярной жидкости у пациенток с поликистозными яичниками в программах вспомогательных репродуктивных технологий.
Материалы и методы. В исследование были включены 26 пациенток с СПЯ, страдающих бесплодием, наблюдавшихся в период 2013-2016 гг. в базовых женских консультациях кафедры акушерства и гинекологии УлГУ и в отделении вспомогательных репродуктивных технологий БУ «Президентский перинатальный центр» Минздрава Чувашии. Обследование пациенток проводилось согласно стандартам оказания медицинской помощи и включало сбор жалоб, анамнеза, данных о перенесенных заболеваниях, оперативных вмешательствах, особенностях менструальной и репродуктивной функций, физикальный осмотр, гинекологическое исследование. С целью оценки функциональной активности яичников проводилось определение гормонального профиля: уровней фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов, пролактина, стероидных, тиреоидных гормонов в крови на 3-5-й день менструального цикла; прогестерона - на 21-22-й день цикла. Состояние матки и маточных труб, органов малого таза исследовалось при УЗ-ди-гностике (с использованием трансвагинальн- ого датчика), лапароскопии, гистероскопии; для гистологической оценки эндометрия выполнялась биопсия. Наличие гиперплазии эндометрия подтверждалось результатом гистологического исследования.
Производился выбор протокола стимуляции овуляции, разрабатывался порядок контроля за исходом и конечным результатом ВРТ. Выбор режима лечения и схем стимуляции осуществлялся с учетом анамнеза пациентки, исхода предыдущих попыток ВРТ. У всех 26 пациенток применялся протокол с антГн-РГ, который вводился по 0,25 мг на 3-й день лечебного цикла и затем ежедневно до начала индукции овуляции. Стандартная доза гонадотропинов составила 75–225 МЕ в зависимости от возраста пациентки и анамнеза болезни. Овуляторная доза человеческого хорионического гонадотропина составляла 10 000 МЕ. Через 36 ч после введения овуляторной дозы человеческого хорионического гонадотропина под контролем ультразвукового исследования проводились трансвагинальная пункция фолликулов и аспира ция их содержимого. Тип оплодотворения ЭКО/ИКСИ применялся у 6 (23,1 %) пациенток, ЭКО-технология – у 20 (76,9 %) женщин. Для переноса использовались эмбрионы отличного и хорошего качества (А, АВ). В результате проведения программ ВРТ положительных исходов получено не было. В связи с этим проводился сравнительный анализ групп женщин в зависимости от наличия сопутствующей патологии – гиперпластического процесса эндометрия в анамнезе: 1-я группа (n=12, контрольная) – СПЯ без железистой гиперплазии эндометрия, 2-я группа (n=14, основная) – СПЯ с железистой гиперплазией эндометрия.
Критерии включения: ановуляторное бесплодие (МКБ-10: N97.0): СПЯ (фенотип А, В, С, D), бесплодие первичное и вторичное; возраст женщины от 24 до 40 лет.
Критерии исключения: бесплодие трубно-перитонеальное (МКБ-10: N97.1), маточное (МКБ-10: N97.2), цервикального происхождения (МКБ-10: N97.3), неуточненное (МКБ-10: N97.9), мужское (МКБ-10: N97.4); острые и подострые инфекционные, гинеко- логические и экстрагенитальные заболевания; доброкачественные опухоли репродуктивной системы; некоррегированные гормональные нарушения; злокачественные опухоли; пороки развития матки (двурогая матка, генитальный инфантилизм, гипоплазия матки); показатель антимюллеровского гормона (АМГ) ниже референсных значений (норма: 0,9–1,3 нг/мл).
Образованная в ходе исследования база данных размещалась в программе Microsoft Excel 2019 для Windows 10. Полученная информация подвергалась статистическому анализу с помощью прикладной программы Statistica 10.0. В начале анализа данных формировались вариационные ряды по абсолютным числам, вычислялись средние величины (M) и средняя арифметическая (m), достоверность различий проверялась с помощью критерия Стьюдента (t). Связь явлений, одно из которых входит в число причин, воздействующих на эти явления, выражалась с помощью корреляции (r). Влияние качественного признака на исход определялось с помощью отношения шансов (ОШ) и его 95 % доверительного интервала (ДИ).
Результаты и обсуждение. Группы пациенток в зависимости от возраста не различались: средний возраст пациенток с СПЯ составил 30,3±1,0 года, а пациенток с СПЯ в сочетании с гиперплазией эндометрия - 32,4±1,1 года (p>0,05). Большая часть пациенток проживали в городе - 18 (69,2 %) чел., имели высшее образование - 17 (65,4 %) чел., половина по социальному статусу относились к служащим - 13 (50,0 %) чел. В первом браке состояло 20 (76,9 %) женщин.
Достоверных различий между группами по количеству экстрагенитальных заболеваний выявлено не было (р>0,05), в целом на 1 пациентку приходилось 2,0 заболевания. В анамнезе имелись заболевания сердечно-сосудистой системы - у 8 (30,8 %) чел., органов пищеварения - у 13 (50,0 %), ожирение - у 7 (26,9 %). Различий между группами по количеству гинекологической патологии также не установлено (р>0,05), однако число заболеваний на одну пациентку с СПЯ в сочетании с гиперплазией эндометрия составило 6,1, а без гиперплазии - 3,2. При проведении сравнительного анализа выявлены различия, указывающие на более выраженные поражения репродуктивных органов у пациенток основной группы, у которых СПЯ сочетался с гиперплазией эндометрия (ОШ: 14,3; 95 % ДИ [7,9-25,6]), гидрос-альпинксом (ОШ: 8,2; 95 % ДИ [0,8-82,6]), аденомиозом (ОШ: 14,3; 95 % ДИ [7,9-25,6]). Различий между группами в количестве перенесенных ИППП не наблюдалось (p>0,05; 1,0 заболевания на 1 пациентку).
Число гинекологических операций в основной группе составило 2,2 на 1 пациентку, в контрольной группе - 1,3 (р>0,05). Пациентки с гиперплазией имели в анамнезе тубэктомии по поводу гидросальпинксов (х2=6,7, р=0,01; F=0,02, p<0,05; r=-0,5). При этом у 8 (30,8 %) женщин проведена декапсуляция яичников (в 24-30 лет), у 13 (50 %) пациенток выполнены операции на яичниках по типу резекции (в 24-32 года).
Средний возраст менархе составил 13±1 год без значимых различий между группами (p>0,05). У всех пациенток отмечались нарушения менструального цикла: в 18 (69,2 %) случаях - нерегулярные менструации, в 13 (50,0 %) -меноррагия, в 9 (34,6 %) - дисменорея. Возраст начала половой жизни составил 18±2 года (p>0,05).
Первичное бесплодие диагностировано у 11 (42,3 %) пациенток, вторичное - у 15 (57,7 %). У большинства пациенток первой группы (8 (66,7 %) чел.) длительность бесплодия составляла до 4 лет, у большинства пациенток второй группы (8 (57,1 %) чел.) - свыше 4 лет.
У 8 (53,3 %) пациенток 1-й группы в анамнезе было 11 беременностей (1,4 на 1 пациентку), причем у 3 (37,5 %) женщин - после проведения программы ЭКО. Из 5 (62,5 %) пациенток после проведенной стимуляции суперовуляции кломифена цитратом с последующей внутриматочной инсеминацией спермой мужа у 2 женщин наступили эктопические беременности, у 3 - произошли самопроизвольные выкидыши на ранних сроках. Три пациентки прервали беременность путем медицинского аборта.
У 7 (46,7 %) пациенток 2-й группы было 13 беременностей (1,9 на 1 пациентку), причем роды произошли в 1 (14,3 %) случае (после ЭКО). У остальных 6 (85,7 %) женщин после проведения нескольких курсов стимуляции кломифена цитратом с последующей внутриматочной инсеминацией спермой мужа в шести случаев произошли самопроизвольные выкидыши на ранних сроках, в четырех - эктопические беременности и в двух - прерывание беременности путем медицинского аборта.
При динамическом наблюдении на фоне коррекции гиперандрогении препаратами оральных контрацептивов (Логест, Жанин, Диане-35, Медиана) и синтетических прогестинов (дюфастон) контролировалось содержание гормонов. У пациенток 2-й группы по сравнению с пациентками 1-й группы был выше показатель ФСГ (8,3±0,2 и 6,3±0,7 мМ/мл соответственно, р<0,05). В 2 (7,7 %) случаях в крови выявлен повышенный гомоцистеин и Д-димер.
У пациенток с СПЯ в 100 % случаев с учетом анамнеза и предыдущих попыток ЭКО применились протоколы с антГн-РГ: в основном (76,9 %) - программа ЭКО, у 6 (23,1 %) женщин проводилось ЭКО/ИКСИ. В результате у пациенток 1-й группы количество ооцитов составило 11,0 (6,0; 12,0), эмбрионов -3,0 (2,0; 4,0), эмбрионов хорошего качества -2,0 (2,0; 3,0). У пациенток 2-й группы -7,0 (6,0; 12,0), 3,0 (1,0; 3,0) и 1,0 (0,0; 1,0) соответственно. Таким образом, отмечено снижение качественно-количественных характеристик эмбрионов у пациенток 2-й группы. В ходе проведения программы ЭКО у 3 пациенток (11,5 %) 1-й группы развился СГЯ легкой степени тяжести.
В результате проведения программ ВРТ удачных исходов не было.
Для определения возможной причины неудачных исходов проведено изучение струк-туропостроения ФЖ и содержания в ней ММП-1 и ТИМП-1, полученных одновременно с пункцией фолликулов и забором яйцеклеток.
ТИМП-1 играет в данной системе факторную роль, подавляя активность ММП-1 по механизму отрицательной обратной связи. Установлено, что увеличение ММП-1 на 1 ед. изм. приводит к уменьшению ТИМП-1 в среднем на 10,4 ед. изм. (для ТИМП-1 95 % ДИ [1558,9-3125,9]) [23].
Среднее значение ММП-1 в ФЖ составляет 4,9±1,0 нг/мл. Величина его зависит от возраста, формы и длительности бесплодия. С увеличением возраста уровень ММП-1 снижается, составляя 2,5±1,6 нг/мл у женщин после
30 лет (t=2,1; р<0,01) [23]. Однако при длительном бесплодии установлена четкая тенденция к повышению ММП-1 (r=0,3): менее 4 лет - 2,8±0,5 нг/мл, свыше 4 лет - 6,9± ±2,3 нг/мл (t=2,3; р<0,05) [23]. В нашем исследовании уровень ММП-1 у пациенток с СПЯ был низким и составил 1,5±0,1 нг/мл. Снижение показателя связано с наличием хронической ановуляции, патогенетически обусловленной гиперэстрогенемии, которая подавляет экспрессию металлопротеиназ [8-16].
Средний уровень ТИМП-1 в ФЖ составляет 2464,2±64,3 нг/мл. Показано, что значение показателя повышается с возрастом (25-30 лет - 2137,5±139,7 нг/мл; 31-36 лет -2435,0±125,7 нг/мл, p<0,05) и с длительностью бесплодия (менее 4 лет - 2276,8±70,7 нг/мл; свыше 4 лет - 2611,5±126,7 нг/мл, p<0,05) [23].
В нашем исследовании уровень ТИМП-1 у пациенток с СПЯ составил 2550±57,8 нг/мл, у пациенток СПЯ в сочетании с гиперплазией эндометрия в анамнезе - 2694,4±87,8 нг/мл (р<0,01). Чрезвычайное значение для функционирования яичников имеет морфоструктура гонад. При высоких уровнях ТИМП-1 в ФЖ (2694 нг/мл и выше) у пациенток с гиперплазией эндометрия происходит склерозирование стромы яичников, нарушение фолликулоге-неза, что, безусловно, влияет на исход лечения бесплодия.
Таким образом, у пациенток с СПЯ имеется дисбаланс в работе ферментной системы, поскольку хроническая ановуляция и существующая гиперэстрогенемия обусловливают низкие уровни ММП-1, в связи с чем уровни ТИМП-1 начинают повышаться раньше.
При исследовании ФЖ методом клиновидной дегидратации у пациенток с СПЯ был установлен реактивный (третий) тип структу-ропостроения фаций, у пациенток с СПЯ и гиперплазией эндометрия - хаотичный (четвертый) тип фаций (рис. 1), что подтверждает деструктивные процессы в репродуктивных органах. У пациенток с синдромом поликистозных яичников обнаружены выраженные ише-мическо-гипоксические нарушения в фолликулах (жгутовые и блоковидные трещины) и застойные процессы (24,5 %, трехлучевые трещины в промежуточной зоне). В половине фаций (50,0 %) выявлены маркеры, указывающие на напряжение компенсаторных механизмов гомеостаза (трещины «закрутка»). При прогрессировании патологического процесса и развитии гиперплазии эндометрия появляются маркеры, указывающие на эндотелиальную дисфункцию (дуговые трещины в фациях 4-го типа), ангиоспазм (гребешковые тре- щины) и склерозирование сосудов (53,9 %, листовидные структуры в фациях хаотичного типа). Установлено, что выраженность патологических изменений в репродуктивных органах, наличие в ФЖ патологических маркеров имеют корреляционную зависимость (r=0,7) от высоких показателей ТИМП-1 в фолликулярной жидкости.
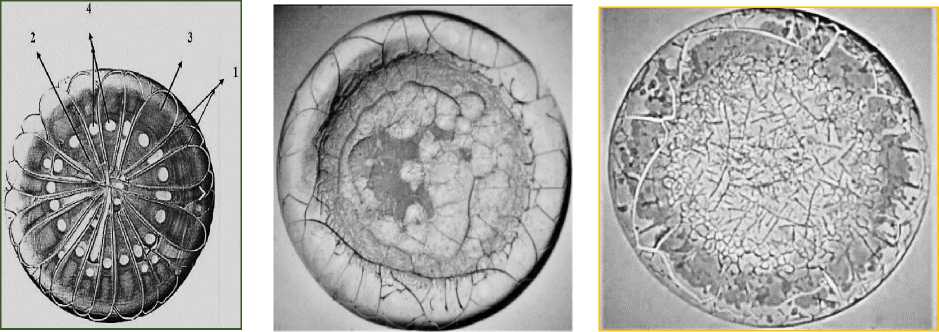
А Б В
Рис. 1. Типы фаций пациенток с синдромом поликистозных яичников, полученных в ходе исследования методом клиновидной дегидратации, ув. ×80: А – нормотип (1-й тип); Б – реактивный (3-й) тип; В – хаотичный (4-й) тип
Fig. 1. Facies of patients with polycystic ovary syndrome obtained during the study by wedge-shaped dehydration, ×80 magnification.
A – normotype (type 1); Б – reactive (type 3); B – chaotic (type 4)
Таким образом, ни в одном случае комплексная подготовка и использование современных методов ВРТ при бесплодии, связанном с СПЯ, не привели к позитивным результатам – наступлению маточной беременности и завершению ее рождением живого доношенного ребенка. Изучение содержания металлопротеиназ в ФЖ и ее структуропостроения подтвердило, что после хронической ановуля-ции, свойственной СПЯ, происходящие в яичнике сложные эндокринно-обменные нарушения, гиперпластические процессы в эндометрии, а также системные изменения в организме снижают фертильность [24, 25]. Применяемые в клинической гинекологии методы обследования бесплодных женщин не позволяют выявить глубокие деструктивные изменения в яичниках. Определение в ФЖ, взятой в процессе ВРТ одновременно с забором яйце- клеток, содержания ММП-1 и ТИМП-1 позволяет выявить остаточные явления перенесенных воспалительных заболеваний, развитие спаечных изменений. Высокий ТИМП-1 указывает на склерозирование ткани гонад, изменение эластичности сосудов, развитие эндоте-лиоза и, соответственно, снижение перфузии яичников. Изменение уровней металлопротеиназ находит отражение в структуропострое-нии ФЖ. Четвертый тип фации указывает на дезорганизацию обменных процессов, наличие в фации патологических маркеров (трехлучевые трещины в промежуточной зоне, гребешковые структуры) – на значительные нарушения микроциркуляции, а листовидные структуры в краевой зоне подтверждают предположение о склерозировании сосудистой стенки яичников (высокие уровни ТИМП-1 – 2694 нг/мл и выше), приводящем к уменьше- нию фолликулярного запаса и, следовательно, резкому снижению фертильности.
Заключение. У пациенток с СПЯ старше 32 лет с длительностью бесплодия свыше 4 лет, имеющих в анамнезе гиперплазию эндометрия и оперативные вмешательства (тубэктомии по поводу гидросальпинкса), до- стоверно увеличивается уровень ТИМП-1 (2694 нг/мл и выше) в фолликулярной жидкости и выявляются маркеры, указывающие на деструктивные изменения (склерозирование сосудов, ангиоспазм и эндотелиальная дисфункция), что снижает шансы на наступление беременности в программах ВРТ.
Список литературы Особенности морфологии фолликулярной жидкости, уровней матриксной металлопротеиназы-1 и ее ингибитора-1 у пациенток с поликистозными яичниками в программах вспомогательных репродуктивных технологий
- Радзинский В.Е. Синдром поликистозных яичников. В кн.: Очерки эндокринной гинекологии. 2-е изд. Москва: Редакция журнала StatusPraesens; 2023: 206-208.
- Синдром поликистозных яичников. Клинические рекомендации. 2021. URL: http://disuria.ru/_ld/ 11/112 9_kr21E2 8p2MZ .pdf (дата обращения: 24.06.2023).
- Андреева Е.Н., Шереметьева Е.В., Аракелян А.С. Хирургические аспекты лечения синдрома поликистозных яичников. Проблемы репродукции. 2020; 26 (5): 65-71. DOI: https//doi.org/10.17116/ repro20202605165.
- Кулаков В.И., Леонов Б.В., Кузьмичев Л.Н. Синдром поликистозных яичников: патогенез и лечение бесплодия. В кн.: Лечение женского и мужского бесплодия. Вспомогательные репродуктивные технологии. Москва: Медицинское информационное агентство; 2005: 413-426.
- Андреева Е.Н., Веснина А.Ф. Особенности использования вспомогательных репродуктивных технологий при синдроме поликистозных яичников. Трудный пациент. 2005; 3 (9): 5-11.
- Даниелян Р.М., Гзгзян А.М. Лечение бесплодия у женщин с синдромом поликистозных яичников методами вспомогательных репродуктивных технологий. Журнал акушерства и женских болезней. 2017; 66 (5): 37-45. DOI: 10.17816/JOWD66537-45.
- Перфилова В.Н., Музыко Е.А., Кустова М.В., Тихаева К.Ю. Роль пролиферативных, про- и противовоспалительных факторов эндотелия в регуляции созревания ооцитов при лечении бесплодия. Акушерство и гинекология. 2023; 8: 5-12. DOI: https://dx.doi.org/10.18565/aig.2023.154.
- Григоркевич О.С., Мокров Г.В., Косова Л.Ю. Матриксные металлопротеиназы и их ингибиторы. Фармакокинетика и фармакодинамика. 2019; 2: 3-16. DOI: 10.24411/2587-7836-2019-10040.
- Кушлинский Н.Е., Герштейн Е. С. Исследование матриксных металлопротеиназ и их тканевых ингибиторов в опухолях и периферической крови онкологических больных. Лабораторная служба. 2013; 1: 25-38.
- Герштейн Е.С., Кушлинский Д.Н., Адамян Л.В., Терешкина И.В., Лактионов К.П. Матриксные ме-таллопротеиназы и их тканевые ингибиторы в клиническом течении рака яичников (обзор). Молекулярная медицина. 2013; 6: 11-20.
- Рогова Л.Н., Шестернина Н.В., Замечник Т.В., Фастова И.А. Матриксные металлопротеиназы, их роль в физиологических и патологических процессах (обзор). Вестник новых медицинских технологий. 2011; XVIII (2): 86-89.
- Ярмолинская М.И., Молотков А. С., Денисова В.М. Матриксные металлопротеиназы и ингибиторы: классификация, механизм действия (обзор литературы). Журнал акушерства и женских болезней. 2012; LXI (1): 113-125.
- Тепляков A.Т., Aндрuянова A.B., Пушникова Е.Ю., Суслова Т.Е., Никонова Е.С., Конаков С.Н., Родионова O.A., Кузнецова A.B., Протопопова Н.В. Тканевой ингибитор матриксных металлопроте-иназ (ТИМП-1) как независимый маркер ишемического ремоделирования миокарда при хронической сердечной недостаточности. Сибирский журнал клинической и экспериментальной медицины. 2014; 29 (2): 2S-34.
- He T., Wang J., Wang X.L., Deng W.S., Sun P. Association between the Matrix Metalloproteina-se-9 rs3918242 Polymorphism and Ischemic Stroke Susceptibility: A Meta-Analysis. J Stroke Cerebro-vasc Dis. 2017; 26 (5): 1136-43. DOI: 10.1016/j.jstrokecerebrovasdis.2016.12.036.
- Lewinski A., Brona A., Lewandowski K.C., JedrzejukD., Bohdanowicz-PawlakA., Skowronska-JozwiakE., BienkiewiczM., Milewicz A. Effects of radioiodine administration on serum concentrations of matrix met-alloproteinases, adiponectin and thrombospondin-1. Thyroid Res. 2013; 6 (1): 9.
- Bienias B., Sikora P. Selected Metal Matrix Metalloproteinases and Tissue Inhibitors of Metalloprotein-ases as Potential Biomarkers for Tubulointerstitial Fibrosis in Children with Unilateral Hydronephrosis. Dis Markers. 2020; 2020: 9520309. DOI: 10.1155/2020/9520309.
- Краевой СЛ., Колтовой H.A. Диагностика по капле крови. Кристаллизация биожидкостей. Книга 1. Метод открытой капли (угловая дегидратация). Москва: МИС-РТ; 2013. 161.
- Шабалин В.Н., Шатохина С.Н. Функциональная морфология неклеточных тканей человека. Москва: РАН; 2019. 360.
- Шатохина С.Н. Функциональная морфология биологических жидкостей - новое направление в клинической лабораторной диагностике. Альманах клинической медицины. 200S; 1S: 50-56.
- Шатохина С.Н., Шабалин В.Н. Атлас структур неклеточных тканей человека в норме и патологии: в 3 томах. Т. 1: Морфологические структуры мочи. Тверь: OOO «Издательство «Триада»; 2011. 240.
- Шатохина С.Н., Шабалин В.Н. Атлас структур неклеточных тканей человека в норме и патологии: в 3 томах. Т. 2: Морфологические структуры сыворотки крови. Тверь: OOO «Издательство «Триада»; 2013. 240.
- Захарова Г.Л., Шабалин В.В., Янов Ю.К., Тыркова Е.В., Клячко Л.Л., Шабалина О.Н. Патент № 2005110264/15/03.30.2005; 2005.
- Маринова O.A., ТрубниковаЛ.И., AлбyтоваМ.Л. Прогностическое значение определения матрикс-ной металлопротеиназы-1 и ее тканевого ингибитора в фолликулярной жидкости у пациенток в программах экстракорпорального оплодотворения. Гинекология. 2021; 23 (6): 542-547.
- Клинические рекомендации «Гиперплазия эндометрия». 2021. URL: https://cr.minzdrav.gov.ru/ schema/646_1 (дата обращения: 24.06.2023).
- Чистякова Г.Н., Гришкина A.A., Ремизова И.И. Гиперплазия эндометрия: классификация, особенности патогенеза, диагностика (обзор). Проблемы репродукции. 201S; 24 (5): 53-57.


