Особенности неадаптивного остеогенеза субхондральной кости при артериальной гипертонии и дислипидемии
Автор: Кабалык М.А., Невзорова В.А., Коваленко Т.С.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 2 (32), 2018 года.
Бесплатный доступ
В последние годы все больше данных свидетельствуют о способности кардиоваскулярных факторов оказывать непосредственное влияние на ткани суставов, приводя к их ишемии, микротромбозам и реактивным изменениям костной ткани.цель: Изучить влияние артериальной гипертонии и гиперлипидемии на процессы клеточного стресса, ремоделирование субхондральной кости (СХК).Методы: Экспериментальное воспроизведение артериальной гипертонии, гиперлипидемии и их сочетания проводили на 24 половозрелых беспо- родных морских свинках. животных разделили на 4 группы по 6 в каждой. В первой группе моделировали эндокринную артериальную гипертонию (АГ). Во второй группе воспроизводили гиперлипидемию (ГЛ). В третьей - сочетание АГ и ГЛ. Четвертая группа - интактный контроль. На 60 сутки животные выведены из эксперимента, после чего произведён забор тканей коленных суставов задних лап.результаты: Кардиоваскулярные факторы инициировали ремоделирование СХК. Данный процесс характеризовался изменением структуры ком- пактной и трабекулярной её частей, формируя картину неадаптивного остеогенеза...
Субхондральная кость, артериальная гипертония, гиперлипидемия, остеоартрит, остеорегенерация
Короткий адрес: https://sciup.org/142215934
IDR: 142215934 | УДК: 612.143:612.123:616-091.816 | DOI: 10.17238/issn2226-2016.2018.2.25-30
Текст научной статьи Особенности неадаптивного остеогенеза субхондральной кости при артериальной гипертонии и дислипидемии
Артериальная гипертония (АГ) и гиперлипидемия – ключевые кардиометаболические факторы развития сердечно-сосудистых заболеваний. В настоящее время достигнуто достаточно глубокое понимание молекулярно-клеточных механизмов формирования ремоделирования сердечно-сосудистой системы в результате воздействия АГ и гиперлипидемии [1]. Уточнены сосудистые паттерны почечной дисфункции, поражения головного мозга [2]. Известно, что АГ, реализуясь повсеместно оказывает негативное влияние на все органы и ткани путём формирования типовых патогенетических каскадов, результатом которых является ремоделирование тканей с преимущественным замещением их соединительной тканью [1]. Дислипидемия, реализующаяся в рамках воспалительной реакции за счёт активации системы врождённого иммунитета, так же способствует полиорганному поражению. Этот феномен реализуется через импрегнацию липидов в тканях, развитие локальной и системной воспалительной реакции [3].
В последние годы все больше данных свидетельствуют о способности кардиоваскулярных факторов оказывать непосредственное влияние на ткани суставов, приводя к их ишемии, микротромбозам и реактивным изменениям костной ткани [4]. Так, Tsezou A.С. соавт. (2010) показали, что липиды способны депонироваться в суставном хряще [5]. Другие данные свидетельствуют о прямом влиянии гипрлипидемии на ремоделирование субхондральной кости (СХК), приводя к развитию дегенеративно-воспалительного заболевания – остеоартрита [6]. Примечательно, что широко распространённое заболевание – остеоартрит высоко ассоциировано с артериальной гипертонией и гиперлипидемией [5]. Вместе с тем, молекулярно-клеточные механизмы влияния артериальной гипертонии и дислипидемии на ткани суставов и их роль в развитии остеоартрита изучена недостаточно.
Субхондральная кость, как известно, обеспечивает амортизационную, локомоторную и трофическую функции сустава, что подчёркивает важность её в развитии заболеваний суставов. Ремоделирование СХК представляет собой процесс неадаптивной остеорегенерации, приводящий к существенным биохимическим, биомеханическим, морфологических сдвигам, нарушающих нормальную функцию суставов [7]. Наибольшее значение неадаптивный остеогенез имеет в развитии остеоартрита [8]. Можно предположить, что кардиометаболические факторы, реализующиеся через сосудистые паттерны, способны приводить к ремоделированию СХК, снижать её трофический потенциал по отношению к бессосудистому суставному хрящу. Очевидно, что изучение влияния факторов кардиоваскулярной коморбид-ности будет способствовать лучшему пониманию патогенеза остеоартрита, раскрытию интегративной теории патогенеза, совершенствованию способов профилактики и лечения.
Цель исследования
Изучить влияние артериальной гипертонии и гиперлипидемии на процессы клеточного стресса, ремоделирование СХК.
Материалы и методы
Экспериментальное воспроизведение артериальной гипертонии, гиперлипидемии и их сочетания проводили на 24 половоз- релых беспородных морских свинках мужского пола в возрасте 28-30 недель, весом 650-800 г в соответствии с положениями Хельсинкской декларации и рекомендациями Директивы Европейского сообщества (86/609 Г.С), дизайн исследования одобрен междисциплинарным этическим комитетом ФГБОУ ВО ТГМУ Минздрава России (протокол № 6 от 18.10.2014).
Животных разделили на 4 группы по 6 в каждой. В первой группе моделировали АГ с помощью внутримышечных инъекций раствора гидрокартизона в дозе 0,5 мг на 500 г массы животного кратностью 4 раза в неделю в сочетании с заменой питьевой воды на 0,9% раствор хлорида натрия. Во второй группе моделировали гиперлипидемию путём внутрибрюшинных инъекций 1,2 мл Твин-80 1 раз в 3 недели и модификацией рациона, который содержал 50% животных жиров, 40% сахаров и 10% клетчатки. В третьей группе животных комбинировали условия эксперимента 1 и 2 групп, добиваясь тем самым сочетания АГ и гиперлипидемии. Четвёртая группа (контроль) получала сбалансированный рацион. На протяжении эксперимента всем животным проводили еженедельные измерения систолического артериального давления, пульса в области плеча с использованием ML125/R (ADInstruments, Австрия). На 60 сутки животные были выведены из эксперимента передозировкой ксилозила и прометара, после чего производили забор образов крови для определения уровня общего холестерина на биохимическом анализаторе IDEXX (VetTest, США). Общая характеристика экспериментальных животных представлена в таблице 1.
Таблица 1
Характеристика животных в конце эксперимента (Ме [Q25; Q75])
|
Параметр, единицы измерения |
Экспериментальные группы животных |
Контроль (n=6) |
||
|
Артериальная гипертония (n=6) |
Гиперлипидемия (n=6) |
Артериальная гипертония и гиперлипидемия (n=6) |
||
|
Возраст, недели |
39 [37; 40] |
39 [38; 41] |
38 [37; 40] |
38 [37; 39] |
|
Вес, г |
660 [640; 840] |
850 [750; 960] |
880 [750; 910] |
750 [630; 840] |
|
Систолической артериальное давление, мм рт. ст. |
190 [165; 220] |
135 [132; 140] |
205 [172; 225] |
130 [125; 135] |
|
Пульс, ударов в минуту |
380 [325; 390] |
320 [304; 325] |
374 [331; 380] |
309 [285; 315] |
|
Общий холестерин, ммоль/л. |
2,55 [1,91; 2,80] |
12,17 [10,34; 14,71] |
11,66 [10,40; 15,55] |
2,09 [1,76; 2,20] |
Ткани коленных суставов задних лап фиксировали в 10% нейтральном забуференном формалине (24 ч), декальцинировали в электролитном растворе (Biovitrum, Россия). По стандартному методу проводили заключение в парафин и получали срезы толщиной 5-7 мкм, которые окрашивали гематоксилин эозином. Препараты оценивали с помощью микроскопа CX41
(Olympus, Япония), оснащенного цифровой камерой. Морфометрическую обработку полученных изображений осуществляли с помощью программы ImageJ 4.1. В качестве показателей при морфометрии субхондральной кости исследовали толщину собственной пластинки, толщину трабекулы, ширину межтрабекулярных пространств, костный индекс (отношение толщины трабекулы к ширине межтрабекулярного пространства - ТР/МП в процентах), количество остеоцитов в мм2 и остеобластов в мм2.
Статистический анализ результатов проводили с помощью Statistica 6.0 (StatSoft, США). Нормальность распределения показателей оценивали по значению медианы (Ме) и квартилей [Q25; Q75]. Поскольку в изучаемых выборках распределение значений не соответствовало по Колмогорову нормальному, для оценки достоверности различий при сравнении двух групп переменных использовали U-критерий Манна–Уитни и трёх – непараметрический H-критерий Краскела-Уоллиса. Достоверными считали различия показателей при p<0.05.
Результаты
У животных из контрольной группы собственная пластинка СХК (рис. 1, фрагмент А) была выполнена компактным веществом с направлением волокон по фронту костного образования и однородной минерализацией. Остеоциты имели продолговатые ядра и располагались вдоль волокон и пластин остеонов. Обнаруживали остеоны с гаверсовыми каналами и узкими вставочными сосудами, окруженные тремя-четырьмя слоями пластин. Губчатая кость (рис. 2, фрагмент А) у контрольных животных была представлена стереотипным чередованием костных трабекул и лакун. Трабекулы губчатой кости были выполнены костным веществом с направлением волокон по ходу цементных линий и остеоцитами разной степени дифференцировки. Эндост содержал обилие остеобластов и единичные остеокласты.
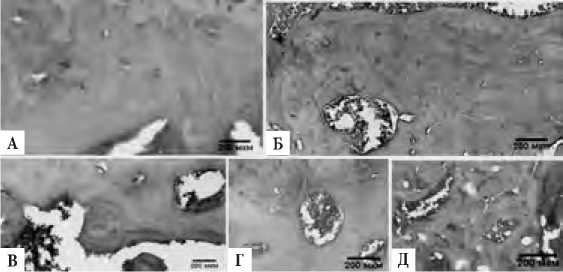
Рисунок 1. Морфология компактной пластинки субхондральной кости у экспериментальных животных. А – контрольная группа, Б – артериальная гипертония, В – гиперлипидемия, Г, Д – сочетание артериальной гипертонии и гиперлипидемии. Пояснения в тексте. (окраска гематоксилин и эозин, ув. х 200, масштаб 200 мкм).
При АГ собственная пластинка СХК (рис. 1, фрагмент Б) была представлена компактным веществом с разнонаправленным расположением соединительнотканных волокон с разной степенью обызвествления. Остеоциты имели крупные ядра. Встречались в большом количестве пустые костные лакуны, скопления остеокластов. Обнаруживали крупные каналы резорбции с депонированными остеобластами, но без признаков формиро- вания вторичных остеонов. Множество кровеносных сосудов лежали как в составе гаверсовых систем, так и обособленно в межклеточном веществе. Встречались единичные остеоны. При АГ в губчатой кости (рис. 2, фрагмент Б) обнаруживали разнонаправленные явления в виде сочетания новообразованных пакетов трабекулярной кости с чёткими очерченными реверсными (цементными) линиями и признаками резорбции со стороны эндоста с остеокластами и типичными лакунами Хоушипа.

Рисунок 2. Морфология губчатой части субхондральной кости у экспериментальных животных. А – контрольная группа, Б – артериальная гипертония, В – гиперлипидемия, Г, Д – сочетание артериальной гипертонии и гиперлипидемии. Пояснения в тексте. (окраска гематоксилин и эозин, ув. х 200, масштаб 200 мкм).
Как показали результаты морфометрии (табл. 2), в условиях экспериментальной АГ толщина собственной пластинки СХК была статистически значимо меньше по сравнению с группой контроля (z=-2,1, p=0,04), но не отличалась от группы экспериментального сочетания АГ и гиперлипидемии (z=1,4, p=0,1). Толщина костных трабекул при АГ достоверно не отличалась от контроля (z=1,9, p=0,05), но была значимо больше по сравнению с группой сочетания АГ и гиперлипидемии (z=2,1, p=0,04). Ширина межтрабкулярных пространств была статистически значимо меньше при АГ по сравнению с контролем (z=-2,1, p=0,04) и не отличалась от группы сочетания кардиометаболических факторов (z=-1,9, p=0,05). При этом костный индекс был достоверно выше у животных с АГ относительно контроля и животных с сочетанием АГ и гиперлипидемии (соответственно: z=2,7, p=0,006; z=2,7, p=0,006). Количество остеоцитов было значимо меньше при АГ по сравнению с группами контроля и сочетанного моделирования АГ и гиперлипидемии (соответственно: z=-2,9, p=0,004; z=-2,9, p=0,004). Численность остеобластов также была статистически значимо ниже по сравнению с контролем (z=-2,9, p=0,004), но не различалось по сравнению с группой АГ и дислипидемии (z=1,9, p=0,05).
При гиперлипидемии в собственной пластике СХК (рис. 1, фрагмент В) наблюдалась картина эндохондрального остеогенеза с инвазией в базальную зону суставного хряща. Сформированные фронты оссификации образовывали остеоны с широкими гаверсовыми каналами и вставочными кровеносными сосудами. Обнаруживались каналы резорбции различного калибра с остеокластами и остеобластами, окруженные концентрическими пластинками. Встречались единичные остеоны. В трабекулах губчатой кости при гиперлипидемии (рис. 2, фраг- мент В) обнаруживали тонкие новообразованные пакеты кости с нечётко очерченными реверсными (цементными) линиями. Структура трабекул была представлена остеонами, чередующимися с участками слабо кальцинированного матрикса.
Таблица 2
Результаты морфометрии субхондральной кости в исследуемых группах (Ме [Q25; Q75])
|
Параметр, единицы измерения |
Артериальная гипертония |
Гипер-ли-пидемия |
Артериальная гипертония и гипер-ли-пидемия |
Контроль |
H- критерий |
|
Толщина собственной пластинки, мкм |
530,3 [480,2; 570,9] * |
830,9 [760,9; 885,1] ǂ |
450,4 [431,5; 462,4] * |
837,1 [602,5; 923,2] |
15,5, p=0,001 |
|
Толщина трабекулы, мкм |
368,9 [328,8; 391,8] ǂ |
481,8 [452,7; 507,2] * ǂ |
260,2 [241,3; 298,3] |
300,9 [291,0; 334,0] |
16,82, p=0,0008 |
|
Ширина межтра-бекуляр-ных пространств, мкм |
718,6 [548,9; 750,3] * |
860,9 [781,4; 952,7] |
861,3 [850,2; 920,6] |
800,6 [770,2; 822,0] |
6,5, p=0,09 |
|
Костный индекс (отношение ТР/ МП), % |
54,1 [41,9; 67,0] * ǂ |
56,8 [52,5; 63,5] * ǂ |
31,4 [28,5; 34,9] |
37,2 [35,4; 38,7] |
16,7, p=0,0008 |
|
Количе ство осте-оцитов в мм2 |
63,2 [56,0; 58,0] * ǂ |
81,0 [80,0; 84,0] * |
80,0 [76,0; 80,0] * |
106,0 [98,0; 110,0] |
19,9, p=0,0002 |
|
Количество остеобластов в мм2 |
24,0 [21,0; 26,0] * |
39,0 [37,0; 40,0] ǂ |
20,0 [18,0; 22,0] * |
38,6 [36,0; 45,0] |
18,4, p=0,0004 |
* – различия статистически значимы по сравнению с контролем, p<0,05; ǂ – различия статистически значимы по сравнению с сочетанием артериальной гипертонии и дислипидемии, p<0,05
В условиях экспериментального моделирования гиперлипидемии толщина компактной части СХК достоверно не отличалась от группы контроля (z=0,3, p=0,7), но была значимо выше по сравнению с животными из группы экспериментального моделирования сочетания АГ и гиперлипидемии (z=2,9, p=0,004). При этом толщина костных трабекул была статистически значимо выше по сравнению с группой контроля и сочетания кардио-метаболических факторов (соответственно: z=2,9, p=0,004; z=2,9, p=0,004). Костный индекс был значимо выше при гиперлипидемии относительно контроля и животных с сочетанием АГ и гиперлипидемии (соответственно: z=2,7, p=0,006; z=2,9, p=0,004). Число остеоцитов у животных с экспериментальной гиперлипидемией было достоверно ниже относительно контроля (z=-2,9, p=0,004), но значимо не различалось в сравнении с группой животных, у которых моделировали сочетание гипертонии и гипер- липидемии (z=1,1, p=0,3). При этом количество остеобластов статистически значимо не отличалось от группы контроля (z=-0,4, p=0,7), но было выше по сравнению с группой сочетания АГ и гиперлипидемии (z=2,9, p=0,004).
При сочетании АГ и гиперлипидемии (рис. 1, фрагменты Г и Д) компактное вещество пластинки субхондральной кости было представлено разнонаправленными фибриллярными элементами межклеточного матрикса. Встречались гипертрофированные остеоциты и пустые костные лакуны. На границе с суставным хрящом обнаруживали множественные очаги деструкции костной ткани в виде полостей регенерации с депонированием остеокластов и остеобластов с тонкими концентрическими пластинками. Преимущественное на границе с хрящом встречались единичные остеоны с крупнокалиберными вставочными сосудами. В глубоких слоях собственной пластинки наблюдалась картина ремоделирования кости по типу замещения остеоподобны-ми грубоволокнистым матриксом с оссификацией в сочетании с множеством кистозных полостей и элементов несовершенного остеогенеза. При сочетании АГ и гиперлипидемии обнаруживали микропереломы трабекул губчатой кости (рис. 2, фрагмент Г) на фоне активации эндостального остеокластогенеза. В трабекулах обнаруживались грубоволокнистые разнонаправленные тяжи с разной степенью минерализации. В межтрабекулярных пространствах определились множественные элементы микро-сосудистого русла.
В условиях сочетанного влияния АГ и дислипидемии отмечалось статистически значимое снижение морфометрических показателей толщины компактной пластинки СХК, костного индекса, количества остеоцитов и остеобластов (соответственно: z=-2,7, p=0,006; z=-2,7, p=0,004; z=-2,9, p=0,004; z=-2,9, p=0,004) относительно группы контроля. При этом толщина трабекул и ширина межтрабекулярных пространств статистически значимо не отличались относительного контрольной группы (соответственно: z=-1,6, p=0,1; z=1,4, p=0,1).
Обсуждение
Результаты исследования показали, что кардиоваскулярные факторы индуцируют ремоделирование субхондральной кости. Данный процесс характеризуется изменением структуры компактной и трабекулярной её частей, формируя картину неадаптивного остеогенеза. Общими чертами ремоделирования костной ткани при этом является образование каналов резорбции при дефиците полноценных остеонов, избыточная васкулариза-ция, уменьшение числа остеобластов. Важно отметить, что активация остеокластов сочетается с формированием остеоподобного матрикса и повышением массы кости, основой которого является неравномерно оссифицированная грубоволокнистая матрица. Такая гистохимическая картина СХК наиболее характерна для остеоартрита – гетерогенного заболевания, в основе которого лежит клеточный стресс и неадаптивные процессы тканевого ремоделирования суставного хряща и субхондральной кости [8]. В предыдущих исследованиях было показано, что ОА характеризуется прогрессирующим истончением собственной пластинки, эктопической выскуларизацией СХК и суставного хряща, замещением нормальной кости остеоподобным матриксом [6].
В настоящем исследовании впервые показано влияние кардиоваскулярных факторов – АГ, гиперлипидемии и их сочетаний на процессы ремоделирования СХК. Wen C.Y. и соавторы (2013) изучая остеоартрит, ассоциированный с артериальной гипертонией и сахарным диабетом 2 типа, с помощью микро-КТ показали истончение собственной пластинки СХК [9]. Исследования отечественных авторов показали возрастание костной массы СХК при остеоартрите коленного сустава [10], что в полной мере согласуется с результатами нашего исследования.
Установлено, что кардиоваскулярные факторы неодинаково влияют на процесс ремоделирования СХК. Так, при АГ наблюдается активация ангиогенеза с формированием эктопических элементов микроциркуляторного русла. В то время как в собственной пластинке преобладают процессы резорбции, приводящие к её истончению, в губчатой кости преобладают пролиферативные процессы, приводящие к утолщению костных трабекул, уменьшению межтрабекулярных пространств и увеличению костной массы. Весьма интересно, что такой вариант ремоделирования сопровождается значимым уменьшением числа остеобластов и остеоцитов. Известно, что АГ приводит к эпизодам снижения кровотока, венозной окклюзии с застоем и микроэмболией в субхондральных сосудов [11]. В условиях ишемии СХК под влиянием эндотелиального фактора роста сосудов (VEGF) формируется патологический ангиогенез [12]. VEGF-ин-дуцированный ангиогенез, с одной стороны приводит к склерозу собственной пластинки СХК через активацию системы матрикс-ных металлопротеиназ [13], с другой активирует апоптоз остео-цитов [14]. Таким образом есть основания полагать, что АГ через сосудистую ишемиюмзапускает молекулярно-клеточные механизмы, приводящие к неадаптивному ремоделированию СХК.
Для гиперлипидемии характерна картина эндохондрального остеогенеза с инвазией в зону кальцинированного хряща. В компактной кости наблюдается картина несовершенного остеогенеза. Трабекулы губчатой кости образуют остеоны и участки некальцинированного матрикса. При этом утолщение трабекул приводит к повышению массы костной ткани без сужения межтрабекулярных промежутков. Известно влияние холестерина на костную ткань, связанное с активацией активных форм кислорода, матриксных металлопротеиназ, митохондриальной дисфункцией остеоцитов и остеобластов [3]. Оксидативный стресс способен индуцировать гипертофическую дифференцировку хондроцитов базальной зоны хряща, что определяет появление эндохондральной кальцификации [15]. В условиях оксидативного стресса активируются процессы апоптоза [16], что обуславливает признаки несовершенного остеогенеза и снижение количества остеоцитов. При этом количество остеобластов существенно не снижается, что может быть обусловлено резистентностью к неблагоприятному влиянию активных форм кислорода [17], в том числе ввиду их низкой метаболической активности.
Наиболее выраженные изменения претерпевает субхондральная кость в условиях сочетанного влияния артериальной гипертонии и гиперлипидемии. Тонкая компактная пластинка на всём протяжении замещается остеоподобным матриксом с множеством бесклеточных кистозных полостей. Трабекуляр- ная кость характеризуется активацией остеокластов и истончением костных балок. В этих условиях масса кости не изменяется. Влияние на СХК сочетания АГ и гиперлипидемии ранее не изучалось. Однако мы предполагаем, что АГ вызывает ишемию СХК, венозные полнокровие, что приводит к волочению внутрикостного давления [11]. Вазоактивные вещества, такие как оксид азота, эндотелин, ангиотензин II, повышают проницаемость сосудистой стенки, способствуют хематаксису клеток врождённого иммунитета [18], апоптозу метаболически-активных осте-оцитов, сменяющийся активацией остеокластов. Повышенное костное давление, ишемия, протеазы макрофагов, тканевые металлопротеиназы и апоптоз остеоцитов могут способствовать развитию неадаптивной остеорегенерации, ремоделированию СХК в условиях сочетания АГ и гиперлипидемии. Однако молекулярные механизым сочетанного влияния кардиометаболиче-ских факторов еще предстоит изучить.
Заключение
Молекулярные и клеточные механизмы влияния артериальной гипертонии и дислипидемии на субхондральную кость изучены недостаточно, что препятствует пониманию взаимосвязей сердечно-сосудистых заболеваний и развитию дегенеративновоспалительных заболеваний суставов. В настоящем исследовании установлено, что кардиоваскулярные факторы в экспериментальных условиях оказывают влияние на СХК, приводя к изменениям, напоминающим остеоартрит. Результаты исследования показали, что АГ и гиперлипидемия способствуют повреждению и формированию неадаптивной остеорегенерации СХК. Так же установлены частные особенности патологической регенерации и ремоделирования при воздействии артериальной гипертонии, гиперлипидемии и их сочетании.
Список литературы Особенности неадаптивного остеогенеза субхондральной кости при артериальной гипертонии и дислипидемии
- Wang X, Liang H, Wang Y, Cai C, Li J, Li X, Wang M, Chen M, Xu X, Tan H. Risk factors of renal dysfunction and their interaction in level-low lead exposure paint workers. BMC Public Health, 2018, Vol. 18(1), p. 526 DOI: 10.1186/s12889-018-5475-9
- Bharosay A, Bharosay VV, Saxena K, Varma M. Role of Brain Biomark-er in Predicting Clinical Outcome in Hypertensive Cerebrovascular Ischemic Stroke. Indian J Clin Biochem, 2018, Vol. 33(2), pp. 178-183 DOI: 10.1007/s12291-017-0664-3
- Farnaghi S, Prasadam I, Cai G, Friis T, Du Z, Crawford R, Mao X, Xiao Y. Protective effects of mitochondria-targeted antioxidants and statins on cholesterol-induced osteoarthritis. FASEB J, 2017, Vol. 31(1), pp. 356-367 DOI: 10.1096/fj.201600600R
- Imhof H, Breitenseher M, Kainberger F, Trattnig S. Degenerative joint disease: cartilage or vascular disease? Skeletal Radiol, 1997, Vol. 26(7), pp. 398-403
- Tsezou A, Iliopoulos D, Malizos KN, Simopoulou T. Impaired expression of genes regulating cholesterol efflux in human osteoarthritic chondrocytes. J Orthop Res, 2010, Vol. 28(8), pp. 1033-1039
- Hashimoto K, Mori S, Oda Y. Lectin-like oxidized low density lipoprotein receptor 1-deficient mice show resistance to instability-induced osteoarthritis. Scand J Rheumatol, 2016, Vol. 45(5), pp. 412-422
- Кабалык М.А. Оценка изменений субхондральной кости при остеоартрите//Медицинский альманах. 2017. № 5(50). С. 181-184.
- Kabalyk M.A. Age-related aspects of the involvement of heat shock proteins in the pathogenesis of osteoarthritis. Adv Gerontol, 2017, Vol. 30(3), pp. 341-346
- Wen CY, Chen Y, Tang HL, Yan CH, Lu WW, Chiu KY. Bone loss at subchondral plate in knee osteoarthritis patients with hypertension and type 2 diabetes mellitus. Osteoarthritis Cartilage, 2013, Vol. 21(11), pp. 1716-1723 DOI: 10.1016/j.joca.2013.06.027
- Зайцева Е.М., Смирнов А.В., Алексеева Л.И. Оценка минеральной плотности костной ткани субхондральных отделов сбедренной и большеберцовой костей при гонартрозе//Научно-практическая ревматология. 2005. №1. С. 27-30
- Findlay D.M. Vascular pathology and osteoarthritis. Rheumatology (Oxford), 2007, Vol. 46(12), pp. 1763-1768
- Hamilton J.L., Nagao M., Levine B.R., Chen D., Olsen B.R., Im H.J. Targeting VeGF and Its Receptors for the Treatment of Osteoarthritis and Associated Pain. J Bone Miner Res, 2016, Vol. 31(5), pp. 911-924 DOI: 10.1002/jbmr.2828
- Ludin A., Sela J.J., Schroeder A., Samuni Y., Nitzan D.W. Amir G. Injection of vascular endothelial growth factor into knee joints induces osteo-arthritis in mice. Osteoarthritis Cartilage, 2013, Vol. 21(3), pp. 491-497 DOI: 10.1016/j.joca.2012.12.003
- Pufe T., Lemke A., Kurz B., Petersen W., Tillmann B., Grodzinsky A.J., Mentlein R. Mechanical overload induces VeGF in cartilage discs via hypoxia-inducible factor. Am J Pathol, 2004, Vol. 164(1), pp. 185-92
- Jonsson H., Helgadottir G.P., Aspelund T., Eiriksdottir G., Sigurdsson S., Ingvarsson T. Hand osteoarthritis in older women is associated with carotid and coronary atherosclerosis: the AGeS Reykjavik study. Ann Rheum Dis, 2009, Vol. 68, pp. 1696-700 DOI: 10.1136/ard.2008.096289
- Antony B., Venn A., Cicuttini F., March L., Blizzard L., Dwyer T., Halliday A., Cross M., Jones G., Ding C. Correlates of knee bone marrow lesions in younger adults. Arthritis Res Ther, 2016, Vol. 18, p. 31 DOI: 10.1186/s13075-016-0938-9
- Guo S., Fei H.D., Ji F., Chen F.L., Xie Y., Wang S.G. Activation of Nrf2 by MIND4-17 protects osteoblasts from hydrogen peroxide-induced oxidative stress. Oncotarget, 2017, Vol. 8(62), pp. 105662-105672 DOI: 10.18632/oncotarget
- Кабалык М.А. Молекулярные взаимосвязи сосудистого ремоделирования у больных остеоартритом с артериальной гипертонией//Вестник современной клинической медицины. 2017. Т.10, №5. С. 29-35 DOI: 10.20969/VSKM.2017.10(5).29-35


