Особенности неоинтимального заживления биорезорбируемых сосудистых каркасов в сравнении со стентами с лекарственным покрытием у пациентов со стабильной ишемической болезнью сердца
Автор: Сапожников С.С., Галеева Наталия Алимгираевна, Бессонов И.С., Мусихина Н.А., Петелина Т.И., Дьякова А.О., Горбатенко Е.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Эндоваскулярная хирургия
Статья в выпуске: 3 т.25, 2021 года.
Бесплатный доступ
Цель. Изучить особенности формирования неоинтимы у биорезорбируемых сосудистых каркасов с использованием оптической когерентной томографии у пациентов со стабильными формами ишемической болезни сердца; определить взаимосвязь между неоинтимальным заживлением и биохимическими показателями воспаления. Методы. В исследование включили 20 пациентов со стабильными формами ишемической болезни сердца и показаниями к чрескожному коронарному вмешательству. Больных рандомизировали на 2 группы по типу стента: основная группа (n = 10) - био-резорбируемый сосудистый каркас ABSORB (Abbott Laboratories, Эбботт-Парк, США); группа сравнения (n = 10) - стент с лекарственным покрытием XIENCE (Abbott Laboratories, Эбботт-Парк, США). Всем пациентам во время чрескожного коронарного вмешательства выполнили оптическую когерентную томографию. Через 12 мес. сделали контрольную коронароангиографию с оптической когерентной томографией 18 больным. Первичная конечная точка - индекс неоинтимального заживления. Вторичные конечные точки - клинические показатели (госпитализация по любым причинам, инфаркт миокарда, вероятный тромбоз стента, смерть), данные оптической когерентной томографии через 12 мес., биохимические маркеры воспаления. Результаты. Анализ исходных ангиографических данных показал более высокую частоту проведения предилатации (100 против 30 %; р = 0,003) и постдилатации (100 против 20 %; р = 0,001) у пациентов основной группы. По данным оптической когерентной томографии через 12 мес., индекс неоинтимального заживления был статистически значимо выше в группе сравнения (9,14 [1,63-17,55] против 0,0 в основной группе; р = 0,008). При оценке клинических результатов через год наблюдения в исследуемых группах не выявлено статистически значимых различий. При анализе маркеров воспаления у пациентов основной группы на 4-5-й дни после чрескожного коронарного вмешательства отмечен статистически значимо более высокий уровень CD40. По результатам корреляционного анализа выявлена обратная корреляционная связь между индексом неоинтимального заживления и CD40 на 4-5-й дни после процедуры (r = -0,576; р = 0,016). Определено пороговое значение CD40 на 4-5-й дни после чрескожного коронарного вмешательства - 47,5 нг/мл, ассоциирующееся с оптимальным неоинтимальным заживлением. Заключение. Пациенты со стабильной ишемической болезнью сердца после чрескожного коронарного вмешательства биорезорбируемыми сосудистыми каркасами, по данным оптической когерентной томографии через 12 мес., имели более высокий уровень неоинтимального заживления в сравнении с больными со стентами, покрытыми эверолимусом. Выявлена обратная корреляционная связь между индексом неоинтимального заживления и CD40 на 4-5-й дни после чрескожного коронарного вмешательства. Уровень CD40 более 47,5 нг/мл на 4-5-й дни после вмешательства повышает вероятность оптимального неоинтимального заживления по данным оптической когерентной томографии.
Ишемическая болезнь сердца, неоинтимальное заживление, оптическая когерентная томография, чрескожное коронарное вмешательство
Короткий адрес: https://sciup.org/142230800
IDR: 142230800 | DOI: 10.21688/1681-3472-2021-3-71-82
Текст научной статьи Особенности неоинтимального заживления биорезорбируемых сосудистых каркасов в сравнении со стентами с лекарственным покрытием у пациентов со стабильной ишемической болезнью сердца
А.О. Дьякова,
Е.А. Горбатенко,
Для чрескожных коронарных вмешательств (ЧКВ) рекомендованы стенты с лекарственным покрытием (СЛП) второго поколения [1]. Однако наличие постоянного металлического каркаса в коронарной артерии ассоциируется с негативными отдаленными феноменами: неоатеросклерозом, поздним тромбозом, нарушением вазомоторной реакции артерии и другими [2; 3]. Биорезорбируемые сосудистые каркасы (БСК) с лекарственным покрытием разработаны для сокращения рисков указанных неблагоприятных событий. Наиболее изучен в клинической практике БСК ABSORB (Abbott Laboratories, Эббот-Парк, США), который состоит из L-полимолочной кислоты и аморфной матрицы из L- и D-полимеров полимолочной кислоты, покрытых антипролиферативным препаратом эверолимус [4]. Деградация каркаса происходит путем гидролиза и дальнейшей полной резорбции [5]. Несмотря на многообещающие перспективы, рандомизированные исследования и метаанализы показали потенциально больший риск тромбоза БСК по сравнению с металлическими стентами, покрытыми эверолимусом [6–10]. Во многом это связано с высокими требованиями к качеству имплантации БСК [11], хотя причина увеличения риска тромбозов до конца не выяснена. В исследовании TROFI II у пациентов с острым коронарным синдромом после имплантации БСК не получили различий по характеру неоинтимального заживления в сравнении с метал- лическими стентами, покрытыми эверолимусом [12]. Однако у пациентов со стабильной ишемической болезнью сердца этот вопрос не изучен.
Ранее исследовалась роль маркеров воспаления сосудистой стенки в развитии рестеноза стента [13; 14]. Однако с внедрением в широкую клиническую практику стентов с антипролиферативным лекарственным покрытием проблема рестеноза в целом была решена. Указанное покрытие снижает интенсивность острых воспалительных реакций в ответ на повреждение артериальной стенки и постоянное наличие страт стента. С другой стороны, оно способствует замедлению заживления артериальной стенки и сохранению хронического воспаления в месте повреждения [15]. Неясно, могут ли маркеры воспаления сосудистой стенки предсказать характер неоинтимального заживления после имплантации как БСК, так и металлических стентов с лекарственным покрытием.
Цель работы — изучить особенности формирования неоинтимы при имплантации СЛП и БСК с использованием оптической когерентной томографии (ОКТ) у пациентов со стабильными формами ишемической болезни сердца; определить связь между неоинтимальным заживлением и маркерами воспаления сосудистой стенки.
Методы
В проспективное пилотное простое слепое рандомизированное исследование включили 20 пациентов со стабильными формами ишемической болезни сердца и показаниями к ЧКВ. Участников рандомизировали методом запечатанных конвертов непосредственно перед процедурой на 2 группы в зависимости от типа имплантируемого стента: основная группа (n = 10) — БСК ABSORB; группа сравнения (n = 10) — СЛП XIENCE. ЧКВ в основной группе проводили по методике, рекомендованной производителем (предилатация, определение размера скаффолда, постдилатация) [16]. В группе сравнения технические аспекты вмешательства индивидуально определял рентгенэндоваскулярный хирург. Перед ЧКВ пациенты получали антитромботи-ческую терапию, соответствующую актуальным стандартам лечения. Во время процедуры всем больным выполнили ОКТ. Через 12 мес. подвергли 18 пациентов контрольной коронароангиографии с оптической когерентной томографией.
Исследование одобрил локальный этический комитет Тюменского кардиологического научного центра — филиала Томского НИМЦ (протокол № 125 от 14.09.2016 г.), все пациенты подписали информированное согласие на участие. Исследование проведено в соответствии с положениями Хельсинкской декларации.
Выполняли ОКТ с использованием аппарата ILUMIEN (St. Jude Medical, Inc., Литл-Канада, США). Визуализацию целевой артерии проводили с автоматической аппаратной протяжкой со скоростью 20 мм/с при введении контрастного вещества в артерию. Изображения поперечного сечения (срезы) анализировали через интервал 1 мм при оценке количественных характеристик и интервал 0,2 мм — качественных. Анализ проводили по всей окружности стентированного сегмента. Исходно по данным ОКТ анализировали характер атеросклеротической бляшки, а также признаки атеросклеротического процесса: накопление липидов, кальциноз, наличие холестериновых кристаллов, интимальных сосудов, скопление макрофагов [17]. На ОКТ через 12 мес. определяли наличие и характер неоинтимальной пролиферации, непокрытых страт стента, малаппозиции страт стента, неоатеросклеро-тической бляшки внутри стента, тромба внутри стента, скопления макрофагов. Страты стента анализировали при наличии четких и ярких очертаний и характерной тени, перпендикулярной источнику света. Страты с отсутствием неоинтимы считали непокрытыми. Ма-лаппозицию (неполное прилегание к стенке артерии)
Табл. 1. Исходные клинические данные
|
Показатель |
Основная группа, n = 10 |
Группа сравнения, n = 10 |
p |
|
Мужской пол, n |
9 |
8 |
1,000 |
|
Возраст, лет |
62,50 [55,75–66,50] |
64,50 [56,25–71,25] |
0,529 |
|
Индекс массы тела |
31,65 [28,24–34,35] |
26,16 [23,69–32,55] |
0,105 |
|
1-й ст. |
1 |
0 |
1,000 |
|
Артериальная 2-й ст |
2 |
0 |
0,474 |
|
гипертония, n т. |
|||
|
3-й ст. |
7 |
9 |
0,582 |
|
безболевая форма |
1 |
3 |
0,582 |
|
Ишемическая I ФК |
0 |
1 |
1,000 |
|
болезнь сердца, n II ФК |
4 |
5 |
1,000 |
|
III ФК |
5 |
1 |
0,141 |
|
Стаж артериальной гипертонии, лет |
5,00 [1,00–11,25] |
10,00 [2,75–10,50] |
0,481 |
|
Курение, n |
0 |
3 |
0,211 |
|
Дислипидемия, n |
10 |
10 |
1,000 |
|
Сахарный диабет 2-го типа, n |
3 |
1 |
0,582 |
|
Стаж сахарного диабета 2-го типа, лет |
0,00 [0,00–3,25] |
0 |
0,436 |
|
1-й ст. |
5 |
4 |
1,000 |
|
Ожирение, n 2-й ст. |
1 |
0 |
1,000 |
|
Инфаркт миокарда в анамнезе, n |
3 |
2 |
1,000 |
|
Хроническая сердечная недостаточность 1-й стадии, n |
10 |
10 |
1,000 |
|
Ишемическая болезнь сердца + артериальная |
10 |
9 |
1,000 |
|
гипертония, n |
Примечание . ФК — функциональный класс; данные представлены как n или Me [Q1–Q3].
Табл. 2. Исходные ангиографические данные
|
Показатель |
Основная группа, n = 10 |
Группа сравнения, n = 10 |
p |
|
Количество стентов, n |
1,00 ± 0,32 |
1,00 ± 0,32 |
0,739 |
|
Диаметр стента, мм |
3,15 ± 0,24 |
3,00 ± 0,37 |
0,089 |
|
Длина стента, мм |
17,70 ± 0,95 |
19,80 ± 1,10 |
0,579 |
|
Давление имплантации, атм |
11,20 ± 1,40 |
12,80 ± 1,40 |
0,052 |
|
передняя межжелудочковая артерия |
5 |
9 |
0,141 |
|
правая коронарная артерия |
2 |
1 |
1,000 |
|
Целевая огибающая артерия |
1 |
0 |
1,000 |
|
артерия, n |
|||
|
ветвь тупого края, |
|||
|
интермедиарная артерия, |
2 |
0 |
0,474 |
|
диагональная ветвь |
|||
|
Предилатация, n |
10 |
3 |
0,003 |
|
Постдилатация, n |
10 |
2 |
0,001 |
|
Аортокоронарное шунтирование в анамнезе, n |
– |
– |
|
|
Чрескожное коронарное вмешательство в анамнезе, n |
2 |
2 |
1,000 |
Примечание . Данные представлены M ± SD или как n.
стента определяли при аблюминальной дистанции между центром страты стента и границей ближайшего просвета артерии по прямой линии более 89 мкм (89 мкм — толщина страты стента XIENCE). Малаппо-зицию БСК определяли как расстояние от центра границы аблюминального темного ядра балки каркаса до границы ближайшего просвета артерии по прямой линии более 97 мкм (толщина темного ядра балки БСК = толщина балки БСК (157 мкм) - 2 яркие кромки (30 мкм)). Оценивали протяженность малаппозиции в артерии, количество одновременно непокрытых и малаппозированных страт стента. Страты стента, локализованные в области бифуркации артерий, не анализировали.
Первичная конечная точка — индекс неоинтималь-ного заживления (ИНЗ) для каждого имплантированного стента, включающий параметры: объем интралю-минарного дефекта (ОИД), рассчитанный по формуле H.M. García-García и соавт. [18]; процент непокрытых малаппозированных страт (% НМС); процент непокрытых страт (% НС); процент малаппозированных страт (% МС). Формула расчета ИНЗ имеет вид:
ИНЗ = (ОИД × 4) + (% НМС × 3) + (% НС × 2) + (% МС × 1).
Вторичные конечные точки — клинические показатели (госпитализация по любым причинам, инфаркт миокарда, вероятный тромбоз стента, смерть), данные ОКТ через 12 мес., биохимические маркеры воспаления. В качестве последних определяли: высокочувствительный С-реактивный белок (референс- ные значения 0,0–3,0 мг/л) — иммунотурбидиметри-ческим методом аналитическим набором C-REACTIVE PROTEIN-hs (BioSystems, Барселона, Испания) на полуавтоматическом анализаторе открытого типа Clima MC-15 (RAL, Барселона, Испания); интерлейкин-1β (референсные значения 0,0–5,0 пг/мл), интерлейкин-6, интерлейкин-8, фактор некроза опухоли-α (референсные значения 0,00–8,11 пг/мл) — «сэндвич» и гомоцистеин (референсные значения 5,0–15,0 мкмоль/л), растворимый лиганд CD40 (CD40L) с использованием наборов Human sCD40L Elisa на анализаторе Stat Fax 4200 (Bender MedSystems GmbH, Вена, Австрия); рецептор CD40 и матриксную металлопротеиназу-9 (референсные значения 20,3–77,2 нг/мл) (Bender MedSystems GmbH, Вена, Австрия); тканевой ингибитор металлопротеиназы-1 (референсные значения 92–116 нг/мл) Human TIMP-1 Elisa Kit (Invitrogen, Thermo Fisher Scientific Inc., Уолтем, США) на анализаторе Personal Lab (Adaltis S.r.l., Милан, Италия). Забор крови для анализа вышеуказанных биохимических маркеров проводили до ЧКВ, на следующий день после процедуры, на 4–5-й дни, через 1, 6 и 12 мес. Для оценки динамики на ранних этапах после ЧКВ определяли дельты значений биохимических маркеров.
Статистический анализ
Статистический анализ данных проводили с использованием пакета программ SPSS Statistics 21.0 (IBM Corporation, Армонк, США). Результаты представ-
Срезы стентированного сегмента по данным оптической когерентной томографии: непосредственный результат имплантации биорезорбируемого сосудистого каркаса ABSORB (А); состояние сосудистой стенки и страт биоре-зорбируемого сосудистого каркаса ABSORB через 12 мес. Белыми стрелками отмечены покрытые, не-резорбированные страты биорезорбируемого сосудистого каркаса ABSORB (B); непосредственный результат имплантации стента с лекарственным покрытием XIENCE (C); состояние сосудистой стенки и страт стента с лекарственным покрытием XIENCE через
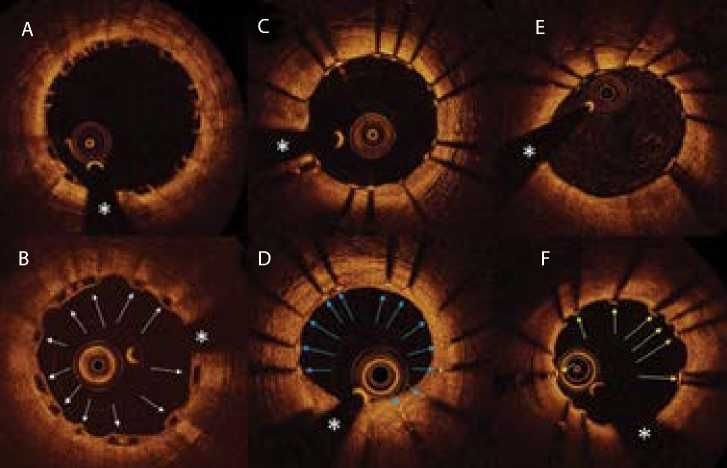
12 мес. Синими стрелками отмечены покрытые неоинтимой страты стента с лекарственным покрытием XIENCE (D); непосредственный результат имплантации стента с лекарственным покрытием XIENCE (E); состояние сосудистой стенки и страт стента с лекарственным покрытием XIENCE через 12 мес. Желтыми стрелками отмечены непокрытые неоинтимой страты стента с лекарственным покрытием XIENCE (F)
Примечание. Звездочкой отмечена оптическая тень от коронарного проводника.
лены в виде суммы среднего значения и стандартного отклонения (М ± SD) либо медианы (Ме) с интерквартильным размахом. Делали выборку малого объема и для сравнения непрерывных переменных применяли непараметрический критерий Манна – Уитни. Для сопоставления качественных переменных использовали точный критерий Фишера. Различия между группами считали статистически значимыми при р < 0,05. Для изучения связи количественных характеристик ИНЗ и биохимических показателей использовали коэффициенты ранговой корреляции Спирмена. Пороговое значение концентрации маркера CD40 определяли с помощью ROC-анализа.
Результаты
По оценке исходных клинических данных, пациенты в сравниваемых группах сопоставимы по всем характеристикам (табл. 1). Анализ исходных ангиографических данных показал более высокую частоту пре- и постдилатации у пациентов основной группы (табл. 2). Согласно исходным данным оптической когерентной томографии, больные сопоставимы по типу атеросклеротических бляшек (табл. 3). Пациенты основной группы имели большую референсную площадь просвета коронарной артерии и большую степень стеноза коронарной артерии. Кроме того, у них была значимо выше минимальная толщина фиброзной покрышки атеросклеротической бляшки. При оценке данных ОКТ непосредственно после стентирования у пациентов основной группы выявили значимо большую среднюю площадь просвета коронарной артерии, но не обнаружили различий по величине минимальной площади коронарной артерии, а также средней площади в стенте.
Через 12 мес. выполнили ОКТ у 18 пациентов ( рисунок ). Медиана наблюдения составила 12,0 ± 0,5 мес. В одном случае пациенту с БСК не проводили ОКТ из-за острой аллергической реакции на рентгеноконтрастный препарат. У одного больного за период наблюдения развился тромбоз БСК. Также исключили из анализа пациента с экстремально высоким значением ИНЗ (64,4). На основе ангиографических данных и результатов ОКТ заключили, что такое значение связано с выраженным диффузным поражением целевой артерии большого диаметра (4,8 мм).
При оценке первичной конечной точки определили, что в основной группе ИНЗ был статистически значимо ниже (табл. 4). При оценке клинических результатов через 12 мес. летальных случаев не было и не наблюдалось
Табл. 3. Исходные данные оптической когерентной томографии
|
Показатель |
Основная группа, n = 10 |
Группа сравнения, n = 10 |
p |
|
Фиброзная, n |
0 |
2 |
0,474 |
|
Классификация Фиброатерома, n |
5 |
3 |
0,650 |
|
атеросклеротиче ской бляшки Кальцинированная фиброатерома, n |
3 |
4 |
1,000 |
|
Фиброатерома с тонкой капсулой, n |
2 |
1 |
1,000 |
|
Кальций, n |
4 |
7 |
0,370 |
|
Адгезия макрофагов, n |
7 |
5 |
0,650 |
|
Кристаллы холестерина, n |
6 |
8 |
0,628 |
|
Тромбы, n |
– |
– |
|
|
Надрывы, n |
– |
– |
|
|
Микрососуды, n |
4 |
9 |
0,057 |
|
Краевая диссекция, n |
1 |
1 |
1,000 |
|
Диссекция под стентом, n |
6 |
8 |
0,628 |
|
Протрузия атероматозных масс, n |
6 |
10 |
0,087 |
|
Протрузия тромба, n |
4 |
7 |
0,370 |
|
Малаппозиция, n |
7 |
7 |
1,000 |
|
Длина поражения, мм |
11,40 [9,27–14,83] |
13,80 [8,93–17,75] |
0,579 |
|
Минимальная площадь артерии, мм |
1,75 [1,33–2,45] |
1,42 [1,10–2,15] |
0,315 |
|
Референсная площадь артерии, мм2 |
7,55 [6,42–8,69] |
4,37 [3,49–4,99] |
< 0,001 |
|
Стеноз, % |
75,95 [69,10–83,20] |
64,5 [55,3–71,3] |
0,023 |
|
Минимальная толщина фиброзной покрышки, мм |
0,18 [0,09–0,27] |
0,08 [0,06–0,11] |
0,029 |
|
Максимальная толщина кальция, мм |
0,25 [0,00–0,68] |
0,56 [0,00–0,75] |
0,436 |
|
Минимальная площадь просвета после стентирования, мм |
5,15 [2,22–5,98] |
4,23 [4,00–5,32] |
0,684 |
|
Минимальный диаметр после стентирования, мм |
2,54 [1,66–2,90] |
2,32 [2,25–2,60] |
0,579 |
|
Длина стентирования, мм |
18,00 [17,48–19,08] |
19,10 [17,75–22,55] |
0,143 |
|
Средняя площадь просвета артерии, мм2 |
7,87 [5,58–9,43] |
5,29 [4,98–6,40] |
0,019 |
|
Средняя площадь в стенте, мм2 |
7,48 [5,80–8,49] |
5,29 [4,98–6,40] |
0,089 |
|
Минимальная площадь в стенте, мм2 |
5,58 [4,55–6,36] |
4,43 [4,18–5,32] |
0,123 |
|
Максимальная дистанция малаппозиции, мм |
0,13 [0,00–0,18] |
0,17 [0,00–0,30] |
0,393 |
|
Протяженность малаппозиции, мм |
0,08 [0,00–0,12] |
0,25 [0,00–0,33] |
0,165 |
|
Количество срезов, n |
95,0 [91,5–99,0] |
97,0 [89,0–115,0] |
0,353 |
|
Количество срезов с малаппозицией, n |
4,0 [0,0–6,0] |
14,5 [0,0–18,5] |
0,165 |
|
Срезы с малаппозицией, % |
4,04 [0,00–6,54] |
13,56 [0,00–17,63] |
0,165 |
|
Страты с малаппозицией, % |
0,69 [0,00–1,02] |
2,59 [0,00–3,93] |
0,165 |
Примечание . Данные представлены как n или Me [Q1–Q3].
различий по частоте инфаркта миокарда и числу госпитализаций от любых причин (табл. 5). У одного пациента основной группы за период наблюдения развился инфаркт миокарда. При анализе количественных данных ОКТ определили большее количество срезов с непокрытыми стратами и значительно больший процент непокрытых страт у пациентов группы сравнения.
При анализе маркеров воспаления у пациентов основной группы на 4–5-й дни после ЧКВ отметили статистически значимо более высокий уровень CD40 и матриксной металлопротеиназы-9, а также более низкую концентрацию тканевого ингибитора металлопротеиназы-1 (табл. 6). Через 12 мес. наблюдения в основной группе уровень тромбоцитарного фактора роста в плазме крови был ниже. Других
Табл. 4. Данные оптической когерентной томографии через 12 мес.
|
Показатель |
Основная группа, n = 8 |
Группа сравнения, n = 9 |
p |
|
Кальций, n (%) |
2 (25) |
6 (66,7) |
0,153 |
|
Минимальный диаметр артерии, мм |
2,35 [1,72–2,62] |
2,07 [1,88–2,53] |
0,743 |
|
Минимальная площадь артерии, мм2 |
4,03 [2,33–5,45] |
3,45 [2,80–5,03] |
1,000 |
|
Средняя площадь просвета артерии, мм2 |
7,36 [4,56–7,87] |
4,38 [3,92–6,37] |
0,074 |
|
Средняя площадь в стенте, мм2 |
6,71 [3,85–7,37] |
4,38 [3,92–6,37] |
0,481 |
|
Минимальная площадь в стенте, мм2 |
4,03 [2,33–5,45] |
3,45 [2,79–5,03] |
1,000 |
|
Непокрытые страты, n (%) |
0 (0) |
7 (77,8) |
0,002 |
|
Малаппозированные страты, n (%) |
1 (12,5) |
1 (11,1) |
0,735 |
|
Непокрытые и малаппозированные страты, n (%) |
0 (0) |
1 (11,1) |
0,529 |
|
Срезы с непокрытыми стратами, % |
0 |
18,39 [3,79–25,33] |
0,006 |
|
Срезы с малаппозицией, % |
0 |
0 |
1,000 |
|
Срезы с непокрытыми и малаппозированными стратами, % |
0 |
0 |
0,963 |
|
Протяженность малаппозиции, мм |
0 |
0 |
1,000 |
|
Максимальная дистанция малаппозиции, мм |
0 |
0 |
0,963 |
|
Диаметр артерии в месте наибольшей гиперплазии неоинтимы, мм |
2,42 [2,04–2,83] |
2,19 [1,97–2,72] |
0,743 |
|
Страты с малаппозицией, % |
0 |
0 |
1,000 |
|
Непокрытые страты, % |
0 |
4,50 [0,82–8,52] |
0,006 |
|
Непокрытые и малаппозированные страты, % |
0 |
0 |
0,743 |
|
Минимальная пролиферация неоинтимы, мм |
0,05 [0,05–0,05] |
0,05 [0,05–0,05] |
1,000 |
|
Максимальная пролиферация неоинтимы, мм |
0,25 [0,15–0,55] |
0,35 [0,29–0,42] |
0,370 |
|
Средняя пролиферация неоинтимы, мм |
0,10 [0,08–0,35] |
0,19 [0,16–0,22] |
0,114 |
|
Индекс неоинтимального заживления |
0 |
9,14 [1,63–17,55] |
0,008 |
|
Примечание . Данные представлены как n (%) или Me [Q1–Q3]. |
Табл. 5. Клинические результаты через 12 мес.
|
Показатель |
Основная группа, n = 10 |
Группа сравнения, n = 10 |
p |
|
Госпитализация по любым причинам, n |
3 |
2 |
1,000 |
|
Инфаркт миокарда, n |
1 |
0 |
1,000 |
|
Вероятный тромбоз стента, n |
1 |
0 |
1,000 |
|
Смерть, n |
– |
– |
– |
Табл. 6. Данные биохимических маркеров
По результатам корреляционного анализа обнаружили обратную корреляционную связь между ИНЗ и соотношением CD40 / CD40L на следующий день после ЧКВ (r = -0,602; р = 0,010), а также между ИНЗ и CD40 на 4–5-й дни после вмешательства (r = -0,576; р = 0,016). Таким образом, более высокие значения CD40 на 4–5-й дни после ЧКВ связаны с оптимальным неоинтималь-ным заживлением. С учетом этих данных выделили группу из 8 пациентов (1 из основной группы и 7 из группы сравнения) с неоптимальным неоинтималь-ным заживлением. В нее вошли больные с непокрытыми и малаппозированными стратами либо с интра-люминарным дефектом (ИНЗ > 0). С использованием ROC-анализа определили пороговое значение CD40 на 4–5-й дни после ЧКВ — 47,5 нг/мл, ассоциирующееся с оптимальным неоинтимальным заживлением, и рассчитали вероятность оптимального заживления в зависимости от уровня CD40. Уровень CD40 более 47,5 нг/мл на 4–5-й дни после ЧКВ в 14 раз повышает вероятность оптимального неоинтимального заживления [отношение шансов 14,00; 95% доверительный интервал 1,135–172,642].
Обсуждение
По результатам нашего исследования, БСК характеризуются лучшим профилем неоинтимального заживления в сравнении со стентами, покрытыми эверолимусом. Это подтверждают ранее опубликованные данные [19; 20]. P.W. Serruys и соавт. сообщили о высоком проценте неоинтимального покрытия страт и начальных признаках резорбции через год после установки БСК [8]. Для СЛП частота определения непокрытых страт через 12 мес. после имплантации составляла 5,8–7,4 % [21]. По данным S. Brugaletta и соавт., объем и средняя толщина неоинтимы при имплантации БСК не различались через 6 и 12 мес. наблюдения [22]. Вероятно, формирование неоинтимы после имплантации БСК происходит в первые 6 мес. со слабой динамикой в дальнейшем. Быстрое неоин-тимальное заживление и последующая биорезорбция при имплантации БСК потенциально позволяют исключить риски, связанные с пролонгированным воспалительным ответом сосудистой стенки на металлический стент [23].
Основные факторы, повышающие риск тромбоза, — малаппозиция и отсутствие неоинтимального покрытия страт [24; 25]. В исследованиях о сосудистой морфологии выявили, что отсроченное заживление и неполная реэндотелизация характерны для летальных случаев тромбозов в ранее имплантированных СЛП [20; 26–28]. В нашем исследовании у пациентов после имплантации БСК непокрытых и малаппозиро-ванных страт не определялось. Закономерно они имели более низкий ИНЗ, который ассоциируется с лучшими краткосрочными и отдаленными результатами лечения [29; 30]. Более эффективное неоинтимальное заживление в БСК, вероятно, связано с особенностями платформы каркасов, поскольку и БСК, и СЛП имели идентичный антипролиферативный агент — эверо-лимус.
Мы выявили корреляцию между ИНЗ и концентрацией CD40: более высокая концентрация CD40 коррелировала с меньшим значением ИНЗ (чем меньше ИНЗ, тем полнее неоинтимальное заживление). CD40 является рецептором лиганда CD40 и относится к семейству рецепторов факторов некроза опухоли. В свою очередь, фактор некроза опухоли-α — продукт клеток воспаления: моноцитов / макрофагов, Т-лимфоцитов и тучных клеток [31]. S. Diaz-Rodriguez и соавт. показали, что страты СЛП через 7 дней после имплантации покрыты неструктурированной тканью, состоящей из фибрина, лейкоцитов и макрофагов [32]. Предполагаем, именно этот комплекс участвует в формировании неоинтимы. Соответственно, уровень CD40 может отражать динамику эндотелизации страт стента.
Изначально изучалась роль лиганда CD40 в формировании неоинтимы. По данным G. Li и соавт., у мышей после повреждения сонной артерии с искусственно заблокированным лигандом CD40 отмечалось менее интенсивное формирование неоинтимы (уменьшение размера на 50 % и снижение содержания нео-интимальных макрофагов на 56 %) [33]. F. Willecke и соавт. отмечали, что блокирование передачи сигналов CD40L–CD40 также снижает образование неоинтимы [34]. M.M. Donners и соавт. показали, что ингибирование передачи сигналов лиганда CD40 не снижает образование неоинтимы у мышей. Однако мыши с блокированным CD40 действительно имеют более низкую интенсивность формирования неоинтимы. Авторы заключили, что именно CD40, а не лиганд CD40, играет важную роль в формировании неоинтимы [35]. Наши результаты совпадают с экспериментальными данными и определяют актуальность изучения связи CD40 и неоинтимального заживления. В первом приближении представляется возможным прогнозировать характер неоинтимального заживления после имплантации стентов путем определения уровня CD40 в раннем периоде после чрескожного коронарного вмешательства.
Несмотря на высокие показатели неоинти-мального заживления, результаты рандомизированных исследований и регистров показали постоянный риск тромботических осложнений, связанных с БСК, после года наблюдения [9; 36]. Основная вероятная причина — нарушение целостности БСК вследствие резорбции [37]. Дополнительным фактором риска тромбоза БСК является его применение при сложных протяженных поражениях коронарного русла, а также в артериях малого диаметра [38]. По нашим данным, несмотря на отсутствие статистически значимых различий по частоте неблагоприятных событий между группами БСК и СЛП, в одном случае после имплантации БСК у пациента развился острый инфаркт миокарда с элевацией сегмента ST. Больному выполняли догоспитальный тромболизис, на контрольной коронарографии кровоток по артерии был полностью восстановлен. Несмотря на отсутствие признаков тромбоза, с учетом локализации острой ишемии миокарда по критериям Академического исследовательского консорциума (англ. Academic Research Consortium, ARC) случай расценили как вероятный тромбоз био-резорбируемого сосудистого каркаса [39].
Ограничения
С учетом неудовлетворительного профиля безопасности БСК ABSORB не рекомендованы к применению, тем не менее разработка новых БСК продолжается, изучение профиля неоинтимального заживления и выраженности воспалительного ответа при различных конструкциях БСК представляется важным. Ограничением также является малочисленная выборка, которая обусловливает вероятность ложноположительных результатов.
Заключение
По данным ОКТ через 12 мес., пациенты со стабильной ишемической болезнью сердца после ЧКВ БСК имеют более высокий уровень неоинтимально-го заживления в сравнении с больными со стентами, покрытыми эверолимусом. Выявлена обратная корреляционная связь между ИНЗ и соотношением CD40 / CD40L на следующий день после ЧКВ, а также между ИНЗ и CD40 на 4–5-й дни после ЧКВ. По данным ОКТ через 1 год, уровень CD40 более 47,5 нг/мл на 4–5-й дни после ЧКВ повышает вероятность оптимального неоинтимального заживления.
Список литературы Особенности неоинтимального заживления биорезорбируемых сосудистых каркасов в сравнении со стентами с лекарственным покрытием у пациентов со стабильной ишемической болезнью сердца
- Palmerini T., Benedetto U., Biondi-Zoccai G., Deila Riva D., Bacchi-Reggiani L., Smits P.C., Vlachojannis G.J., Jensen L.O., Christiansen E.H., Berencsi K., Valgimigli M., Orlandi C., Petrou M., Rapezzi C., Stone G.W. Long-term safety of drug-eluting and bare-metal stents: evidence from a comprehensive network meta-analysis. J Am Coll Cardiol. 2015;65(23):2496-2507. PMID: 26065988. https://doi.org/10.10167i.jacc.2015.04.017
- Gada H., Kirtane A.J., Newman W., Sanz M., Hermiller J.B., Mahaffey K.W., Cutlip D.E., Sudhir K., Hou L., Koo K., Stone G.W. 5-year results of a randomized comparison of XIENCE V everolimus-eluting and TAXUS paclitaxel-eluting stents: final results from the SPIRIT III trial (clinical evaluation of the XIENCE V everolimus eluting coronary stent system in the treatment of patients with de novo native coronary artery lesions). JACC Cardiovasc Interv. 2013;6(12):1263-1266. PMID: 24239202. https://doi.org/10.10167i.icin.2013.07.009
- Yamaji K., Räber L., Zanchin T., Spitzer E., Zanchin C., Pilgrim T., Stortecky S., Moschovitis A., Billinger M., Schönenberger C., Eberli F., Jüni P., Lüscher T.F., Heg D., Windecker S. Ten-year clinical outcomes of first-generation drug-eluting stents: the Sirolimus-Eluting vs. Paclitaxel-Eluting Stents for Coronary Revascularization (SIRTAX) VERY LATE trial. Eur Heart J. 2016;37(45):3386-3395. PMID: 27578808. https://doi. org/10.1093/eurhearti/ehw343
- de Pommereau A., de Hemptinne Q., Varenne O., Picard F. Bioresorbable vascular scaffolds: Time to absorb past lessons or fade away? Arch Cardiovasc Dis. 2018;111(4):229-232. PMID: 29678390. https://doi.org/10.1016/_i.acvd.2018.04.001
- Brie D., Penson P., Serban M.-C., Toth P.P., Simonton Ch., Serruys P.W., Banach M. Bioresorbable scaffold — A magic bullet for the treatment of coronary artery disease? Int J Cardiol. 2016;215:47-59. PMID: 27111160. https://doi.org/10.1016Xi. iicard.2016.04.027
- Ellis S.G., Kereiakes D.J., Metzger D.C., Caputo R.P., Rizik D.G., Teirstein P.S., Litt M.R., Kini A., Kabour A., Marx S.O., Popma J.J., McGreevy R., Zhang Z., Simonton C., Stone G.W.; ABSORB III Investigators. Everolimus-eluting bioresorbable scaffolds for coronary artery disease. N Engl J Med. 2015;373(20):1905-1915. PMID: 26457558. https://doi.org/10.1056/NEJMoa1509038
- Kang S.-H., Chae I.-H., Park J.-J., Lee H.S., Kang D.-Y., Hwang S.-S., Youn T.-J., Kim H.-S. Stent thrombosis with drug-eluting stents and bioresorbable scaffolds: evidence from a network metaanalysis of 147 trials. JACC Cardiovasc Interv. 2016;9(12):1203-1212. PMID: 27262860. https://doi.org/10.1016/i. icin.2016.03.038
- Serruys P.W., Chevalier B., Dudek D., Cequier A., Carrie D., Iniguez A., Dominici M., van der Schaaf R.J., Haude M., Wasungu L., Veldhof S., Peng L., Staehr P., Grundeken M.J., Ishibashi Y., Garcia-Garcia H.M., Onuma Y. A bioresorbable everolimus-eluting scaffold versus a metallic everolimus-eluting stent for ischaemic heart disease caused by de-novo native coronary artery lesions (ABSORB II): an interim 1-year analysis of clinical and procedural secondary outcomes from a randomised controlled trial. Lancet. 2015;385(9962):43-54. PMID: 25230593. https://doi.org/10.1016/S0140-6736(14)61455-0
- Wykrzykowska J.J., Kraak R.P., Hofma S.H., van der Schaaf R.J., Arkenbout E.K., IJsselmuiden A.J., Elias J., van Dongen I.M., Tiissen R.Y.G., Koch K.T., Baan J. Jr, Vis M.M., de Winter R.J., Piek J.J., Tiissen J.G.P., Henriques J.P.S.; AIDA Investigators. Bioresorbable scaffolds versus metallic stents in routine PCI. N Engl J Med. 2017;376(24):2319-2328. PMID: 28402237. https://doi.org/10.1056/NEJMoa1614954
- Прохорихин А.А., Фартаков Е.И., Малаев Д.У., Бойков А.А., Ойдуп-Оол С.В., Байструков В.И., Гражданкин И.О., Зубарев Д.Д., Покушалов Е.А., Кретов Е.И. Оценка эффективности и безопасности биодеградируемого каркаса Absorb: 6-месячные результаты регистра Gabi R: Russia. Патология кровообращения и кардиохирургия. 2019;23(1 Suppl 1):S26-S33. [Prokhorikhin A.A., Fartakov E.I., Malaev D.U., Boykov A.A., Oidup-Ool S.V., Baystrukov V.I., Grazhdankin I.O., Zubarev D.D., Pokushalov E.A., Kretov E.I. Efficacy and safety of bioresorbable vascular scaffold Absorb: 6-month outcomes of GABI-R: Russia registry. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2019;23(1 Suppl 1 ):S18-S25. (In Russ.)] http://doi.org/10.21688/1681-3472-2019-1S-S26-S33
- Stone G.W., Abizaid A., Onuma Y., Seth A., Gao R., Ormiston J., Kimura T., Chevalier B., Ben-Yehuda O., Dressler O., McAndrew T., Ellis S.G., Kereiakes D.J., Serruys P.W. Effect of technique on outcomes following bioresorbable vascular scaffold implantation: Analysis from the ABSORB trials. J Am Coll Cardiol. 2017;70(23):2863-2874. PMID: 29100704. https:// doi.org/10.1016/j.jacc.2017.09.1106
- Gomez-Lara J., Brugaletta S., Ortega-Paz L., Vandeloo B., Moscarella E., Salas M., Romaguera R., Roura G., Ferreiro J.L., Teruel L., Gracida M., Windecker S., Serruys P.W., Gomez-Hospital J.-A., Sabate M., Cequier A. Long-term coronary functional assessment of the infarct-related artery treated with everolimus-eluting bioresorbable scaffolds or everolimus-eluting metallic stents: Insights of the TROFI II trial. JACC Cardiovasc Interv. 2018;11 (16):1559-1571. PMID: 29805111. https://doi.org/10.1016/j.jcin.2018.04.026
- Pleva L., Kusnierova P., Plevova P., Zapletalova J., Karpisek M., Faldynova L., Kovarova P., Kukla P. Increased levels of MMP-3, MMP-9 and MPO represent predictors of in-stent restenosis, while increased levels of ADMA, LCAT, ApoE and ApoD predict bare metal stent patency. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2015;159(4):586-594. PMID: 26365933. https://doi.org/10.5507/bp.2015.037
- Gabbasov Z., Kozlov S., Melnikov I., Byazrova S., Saburova O., Prokofieva L., Caprnda M., Curilla E., Gaspar L., Rodrigo L., Kruzliak P., Smirnov V. Novel biomarkers for coronary restenosis occurrence after drug-eluting stent implantation in patients with diabetes having stable coronary artery disease. Clin Appl Thromb Hemost. 2018;24(8):1308-1314. PMID: 29716394; PMCID: PMC6714775. https://doi. org/10.1177/1076029618771752
- Costa M.A., Simon D.I. Molecular basis of restenosis and drug-eluting stents. Circulation. 2005;111(17):2257-2273. PMID: 15867193. https://doi.org/10.1161/01.CIR.0000163587.36485. AZ
- Ortega-Paz L., Brugaletta S., Sabate M. Impact of PSP technique on clinical outcomes following bioresorbable scaffolds implantation. J Clin Med. 2018;7(2):27. PMID: 29415486; PMCID: PMC5852443. https://doi.org/10.3390/jcm7020027
- Бабунашвили А.М., Созыкин А.В. Оптическая когерентная томография коронарных артерий. Атлас для клинического применения. М.: Издательство АСВ, 2019. 148 с. [Babunashvili A.M., Sozykin A.V. Optical coherence tomography of the coronary arteries. Atlas for clinical use. Moscow: ASV Publ.; 2019. 148 p. (In Russ.)]
- García-García H.M., Muramatsu T., Nakatani Sh., Lee I.S., Holm N.R., Thuesen L., van Geuns R.-J., van der Ent M., Borovicanin V., Paunovic D., Onuma Y., Serruys P.W. Serial optical frequency domain imaging in STEMI patients: the follow-up report of TROFI study. Eur Heart J Cardiovasc Imaging. 2014;15(9):987-995. PMID: 24662443. https://doi.org/10.1093/ ehici/ieu042
- Serruys P.W., Onuma Y., Ormiston J.A., de Bruyne B., Regar E., Dudek D.,Thuesen L., Smits P.C., Chevalier B., McClean D., Koolen J., Windecker S., Whitbourn R., Meredith I., Dorange C., Veldhof S., Miquel-Hebert K., Rapoza R., García-García H.M. Evaluation of the second generation of a bioresorbable everolimus drug-eluting vascular scaffold for treatment of de novo coronary artery stenosis: six-month clinical and imaging outcomes. Circulation. 2010;122(22):2301-2312. PMID: 21098436. https:// doi.org/10.1161/CIRCULATIONAHA.110.970772
- Onuma Y., Sotomi Y., Shiomi H., Ozaki Y., Namiki A., Yasuda S., Ueno T., Ando K., Furuya J., Igarashi K., Kozuma K., Tanabe K., Kusano H., Rapoza R., Popma J.J., Stone G.W., Simonton C., Serruys P.W., Kimura T. Two-year clinical, angiographic, and serial optical coherence tomographic follow-up after implantation of an everolimus-eluting bioresorbable scaffold and an everolimus-eluting metallic stent: insights from the randomised ABSORB Japan trial. EuroIntervention. 2016;12(9):1090-1101. PMID: 27597270. https://doi. org/10.4244/EIJY16M09 01
- Gutiérrez-Chico J.L., van Geuns R.J., Regar E., van der GiessenWJ., Kelbaek H., Saunamáki K., Escaned J., Gonzalo N., di Mario C., Borgia F., Nüesch E., García-García H.M., Silber S., Windecker S., Serruys P.W. Tissue coverage of a hydrophilic polymer-coated zotarolimus-eluting stent vs. a fluoropolymer-coated everolimus-eluting stent at 13-month follow-up: an optical coherence tomography substudy from the RESOLUTE All Comers trial. Eur Heart J. 2011;32(19):2454-2463. PMID: 21659439; PMCID: PMC3184229. https://doi.org/10.1093/ eurhearti/ehr182
- Brugaletta S., Radu M.D., Garcia-Garcia H.M., Heo J.H., Farooq V., Girasis C., van Geuns R.J., Thuesen L., McClean D., Chevalier B., Windecker S., Koolen J., Rapoza R., Miquel-Hebert K., Ormiston J., Serruys P.W. Circumferential evaluation of the neointima by optical coherence tomography after ABSORB bioresorbable vascular scaffold implantation: can the scaffold cap the plaque? Atherosclerosis. 2012;221(1):106-112. PMID: 22209268. https://doi.org/10.1016/i.atherosclerosis.2011.12.008
- Mori H., Atmakuri D.R., Torii S., Braumann R., Smith S., Jinnouchi H., Gupta A., Harari E., Shkullaku M., Kutys R., Fowler D., Romero M., Virmani R., Finn A.V. Very late pathological responses to cobalt-chromium everolimus-eluting, stainless steel sirolimus-eluting, and cobalt-chromium bare metal stents in humans. J Am Heart Assoc. 2017;6(11):e007244. PMID: 29150493; PMCID: PMC5721792. https://doi.org/10.1161/ JAHA.117.007244
- Farb A., Burke A.P., Kolodgie F.D., Virmani R. Pathological mechanisms of fatal late coronary stent thrombosis in humans. Circulation. 2003;108(14):1701-1706. PMID: 14504181. https:// doi.org/10.1161/01.CIR.0000091115.05480.B0
- Finn A.V., Joner M., Nakazawa G., Kolodgie F., Newell J., John M.C., Gold H.K., Virmani R. Pathological correlates of late drug-eluting stent thrombosis: strut coverage as a marker of endothelialization. Circulation. 2007;115(18):2435-2441. PMID: 17438147. https://doi.org/10.1161/ CIRCULATIONAHA.107.693739
- Taniwaki M., Radu M.D., Zaugg S., Amabile N., GarciaGarcia H.M., Yamaji K., Jorgensen E., Kelbœk H., Pilgrim T., Caussin C., Zanchin T., Veugeois A., Abildgaard U., Jüni P., Cook S., Koskinas K.C., Windecker S., Räber L. Mechanisms of very late drug-eluting stent thrombosis assessed by optical coherence tomography. Circulation. 2016;133(7):650-660. PMID: 26762519. https://doi.org/10.1161/ CIRCULATI0NAHA.115.019071
- Heeger C.H., Busjahn A., Hildebrand L., Fenski M., Lesche F., Meincke F., Kuck K.-H., Bergmann M.W. Delayed coverage of drug-eluting stents after interventional revascularisation of chronic total occlusions assessed by optical coherence tomography: the ALSTER-OCT-CTO registry. EuroIntervention. 2016;11 (9):1004-1012. PMID: 25287264. https://doi. org/10.4244/EIJY14M10 01
- Serruys P.W., Chevalier B., Sotomi Y., Cequier A., Carrié D., Piek J.J., Van Boven A.J., Dominici M., Dudek D., McClean D., Helqvist S., Haude M., Reith S., de Sousa Almeida M., Campo G., Iniguez A., Sabaté M., Windecker S., Onuma Y. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II): a 3 year, randomised, controlled, singleblind, multicentre clinical trial. Lancet. 2016;388(10059):2479-2491. PMID: 27806897. https://doi.org/10.1016/S0140-6736(16)32050-5
- Prati F., Romagnoli E., Gatto L., La Manna A., Burzotta F., Limbruno U., Versaci F., Fabbiocchi F., Di Giorgio A., Marco V., RamazzottiV., DiVito L.,Trani C., Porto I., Boi A.,Tavazzi L., Mintz G.S. Clinical impact of suboptimal stenting and residual intrastent plaque / thrombus protrusion in patients with acute coronary syndrome: The CLI-OPCI ACS Substudy (Centro per la Lotta Contro L'Infarto-Optimization of Percutaneous Coronary Intervention in Acute Coronary Syndrome). Circ Cardiovasc Interv. 2016;9(12):e003726. PMID: 27965297. https://doi. org/10.1161/CIRCINTERVENTIQNS.115.003726
- Prati F., Romagnoli E., Burzotta F., Limbruno U., Gatto L., La Manna A., Versaci F., Marco V., Di Vito L., Imola F., Paoletti G., Trani C., Tamburino C., Tavazzi L., Mintz G.S. Clinical impact of OCT findings during PCI: The CLI-OPCI II Study. JACC Cardiovasc Imaging. 2015;8(11 ):1297-1305. PMID: 26563859. https://doi. org/10.1016/j.jcmg.2015.08.013
- Singh M.P., Sethuraman S.N., Ritchey J., Fiering S., Guha C., Malayer J., Ranjan A. In-situ vaccination using focused ultrasound heating and anti-CD-40 agonistic antibody enhances T-cell mediated local and abscopal effects in murine melanoma. Int J Hyperthermia. 2019;36(sup1):64-73. PMID: 31795832; PMCID: PMC6897315. https://doi.org/10.1080/026 56736.2019.1663280
- Diaz-Rodriguez S., Rasser C., Mesnier J., Chevallier P., Gallet R., Choqueux C., Even G., Sayah N., Chaubet F., Nicoletti A., Ghaleh B., Feldman L.J., Mantovani D., Caligiuri G. Coronary stent CD31-mimetic coating favours endothelialization and reduces local inflammation and neointimal development in vivo. Eur Heart J. 2021;42(18):1760-1769. PMID: 33580685; PMCID: PMC8106951. https://doi.org/10.1093/eurheartj/ ehab027
- Li G., Sanders J.M., Bevard M.H., Sun Z., Chumley J.W., Galkina E.V., Ley K., Sarembock I.J. CD40 ligand promotes Mac-1 expression, leukocyte recruitment, and neointima formation after vascular injury. Am J Pathol. 2008;172(4):1141-1152. PMID: 18349125; PMCID: PMC2276409. https://doi. org/10.2353/ajpath.2008.070633
- Willecke F., Tiwari S., Rupprecht B., Wolf D., Hergeth S., Hoppe N., Dufner B., Schulte L., Anto Michel N., Bukosza N., Marchini T., Jackel M., Stachon P., Hilgendorf I., Zeschky K., Schleicher R., Langer H.F., von Zur Muhlen C., Bode C., Peter K., Zirlik A. Interruption of classic CD40L-CD40 signalling but not of the novel CD40L-Mac-1 interaction limits arterial neointima formation in mice. Thromb Haemost. 2014;112(2):379-389. PMID: 24652469. https://doi.org/10.1160/TH13-08-0653
- Donners M.M.P.C., Beckers L., Lievens D., Munnix I., Heemskerk J., Janssen B.J., Wijnands E., Cleutjens J., Zernecke A., Weber C., Ahonen C.L., Benbow U., Newby A.C., Noelle R.J., Daemen M.J.A.P., Lutgens E. The CD40-TRAF6 axis is the key regulator of the CD40/CD40L system in neointima formation and arterial remodeling. Blood. 2008;111(9):4596-4604. PMID: 18195092; PMCID: PMC5726330. https://doi.org/10.1182/ blood-2007-05-088906
- Caixeta A., Campos C.M., Felix C., Chieffo A., Capranzano P., Kawamoto H., Tamburino C., Diletti R., de Ribamar Costa J. Jr., Onuma Y., van Geuns R.J., Bartorelli A.L., Colombo A., Tamburino C., Serruys P.W., Abizaid A. Predictors of long-term adverse events after Absorb bioresorbable vascular scaffold implantation: a 1,933-patient pooled analysis from international registries. EuroIntervention. 2019;15(7):623-630. PMID: 30375335. https://doi.org/10.4244/EIJ-D-16-00796
- Onuma Y., Serruys P.W., Muramatsu T., Nakatani S., van Geuns R.-J., de Bruyne B., Dudek D., Christiansen E., Smits P.C., Chevalier B., McClean D., Koolen J., Windecker S., Whitbourn R., Meredith I., Garcia-Garcia H.M., Veldhof S., Rapoza R., Ormiston J.A. Incidence and imaging outcomes of acute scaffold disruption and late structural discontinuity after implantation of the Absorb Everolimus-Eluting fully bioresorbable vascular scaffold: optical coherence tomography assessment in the ABSORB cohort B Trial (A Clinical Evaluation of the Bioabsorbable Everolimus Eluting Coronary Stent System in the Treatment of Patients With De Novo Native Coronary Artery Lesions). JACC Cardiovasc Interv. 2014;7(12):1400-1411. PMID: 25523532. https://doi.org/10.1016/_i.jcin.2014.06.016
- Lhermusier T., Carrie D., Cayla G., Fajadet J., Sainsous J., Elhadad S., Tarragano F., Chevalier B., Ranc S., Curinier C., Le Breton H., Koning R.; FRANCE ABSORB Investigators. Three-year clinical outcomes with the ABSORB bioresorbable vascular scaffold in real life: Insights from the France ABSORB registry. Catheter Cardiovasc Interv. 2020. PMID: 33211387. https://doi. org/10.1002/ccd.29369 [Epub ahead of print]
- Garcia-Garcia H.M., McFadden E.P., Farb A., Mehran R., Stone G.W., Spertus J., Onuma Y., Morel M.-A., van Es G.-A., Zuckerman B., Fearon W.F., Taggart D., Kappetein A.-P., Krucoff M.W., Vranckx P., Windecker S., Cutlip D., Serruys P.W.; Academic Research Consortium. Standardized end point definitions for coronary intervention trials: The Academic Research Consortium-2 consensus document. Eur Heart J. 2018;39(23):2192-2207. PMID: 29897428. https://doi. org/10.1093/eurheartj/ehy223


