Особенности окислительного метода синтеза органических соединений сурьмы (обзор)
Автор: Шарутин Владимир Викторович, Шарутина Ольга Константиновна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 13 (272), 2012 года.
Бесплатный доступ
Представлены результаты по методу синтеза органических соединений пятивалентной сурьмы окислением органических производных Sb(III). Основное внимание уделено реакциям окислительного присоединения с участием триорганилсурьмы, пероксида водорода и кислоты.
Окисление триорганилсурьмы
Короткий адрес: https://sciup.org/147160220
IDR: 147160220 | УДК: 547.53
Текст обзорной статьи Особенности окислительного метода синтеза органических соединений сурьмы (обзор)
В последние годы большое внимание уделяется разработке методов синтеза органических производных Sb(V) (Ar 3 SbX 2 , (Ar 3 SbX) 2 O, Ar 3 SbL и т. д.) и поиску эффективных окисляющих агентов, позволяющих получать соединения заданного строения в одну стадию.
В основе важнейшего одностадийного способа синтеза органических соединений Sb(V) лежат реакции окислительного присоединения. В настоящем обзоре рассматриваются особенности и потенциальные возможности реакций окисления производных Sb(III) в присутствии различных окисляющих агентов.
Реакции триорганилсурьмы с галогенами
В большинстве случаев дигалогениды триорганилсурьмы синтезируют взаимодействием триорганилсурьмы с галогенами, которое протекает в растворах органических растворителей [1]. Однако в качестве галогенирующих реагентов можно применять и другие соединения.
Фторирование трис (пентафторфенил)сурьмы молекулярным фтором в растворе трихлор-фторметана при –40 °С приводит к образованию соответствующего дифторида с выходом 98 % [2]. Практически количественные выходы дифторидов триорганилсурьмы получены фторированием триорганилсурьмы тетрафторборатом тетраэтиламмония в растворе ацетонитрила на платиновом аноде (20 °С, аргон) [3]. Дифторид трис (пентафторфенил)сурьмы может быть получен с количественным выходом из трис (пентафторфенил)сурьмы и дифторида ксенона в растворе ацетонитрила при –30 °С [4].
Для фторирования трифенилсурьмы может быть использована дифтордифенилсера (дейтерированный хлороформ, 30 °С); выход целевого продукта близок к количественному [5]:
Ph 3 Sb + Ph 2 SF 2 → Ph 3 SbF 2 + Ph 2 S
Хлорирование трис (пентафторфенил)сурьмы протекает не только при действии молекулярного хлора, но и хлоридов таллия (ΙII) и меди (II) [6]:
(C 6 F 5 ) 3 Sb + Cl 2 → (C 6 F 5 ) 3 SbCl 2
(C 6 F 5 ) 3 Sb + TlCl 3 → (C 6 F 5 ) 3 SbCl 2 + TlCl
(C 6 F 5 ) 3 Sb + 2CuCl 2 → (C 6 F 5 ) 3 SbCl 2 + 2CuCl
Бромирование этого соединения требует охлаждения реакционной смеси, так как дибромид трис (пентафторфенил)сурьмы медленно разлагается при комнатной температуре с образованием свободного галогена. С иодом трис (пентафторфенил)сурьма не реагирует.
Попытки синтеза дихлорида трицимантренилсурьмы из триарилсурьмы и хлора при комнатной температуре не привели к успеху. Галогенирование осуществляли дихлоридом или дибромидом меди в растворе ацетона при 50–60 °С [7]:
[(CO) 3 MnC 5 H 4 ] 3 Sb + 2 CuX 2 → R 3 SbX 2 + 2 CuX
Аналогично был получен дихлорид трис (N,N-диметиламинофенил)сурьмы [8].
Возможно окисление триарилсурьмы дигалогенидами ртути [9] и трихлоридом железа [10].
Смешаннолигандное соединение – ацетилхлорид триарилсурьмы – синтезировано взаимодействием 3,5-динитробензоилхлорида с триарилсурьмой в растворе кипящего бензола или хлористого метилена [11]:
Ar 3 Sb + RCOCl → Ar 3 Sb(COR)Cl
Ar= Ph, 4-MeC 6 H 4 ; R=3,5-(NO 2 ) 2 C 6 H 3
Бензоил-, ацетил-, хлорацетилхлориды не образуют с триарилсурьмой продуктов аналогичного строения.
Реакции триорганилсурьмы с пероксидами и кислородом воздуха
Изучены реакции триарилсурьмы с окислителями, приводящие к образованию оксидов Sb(V) различного строения. Так, продуктом взаимодействия триарилсурьмы с диоксидом селена в растворе кипящего бензола или спирта являются аддукт Ar 3 SbO · SeO 2 и элементарный селен. При проведении реакции в присутствии влаги образуется другой аддукт Ar 3 SbO · H 2 SeO 2 [12].
Окисление трифенилсурьмы π- комплексом молибдена, содержащим пероксогруппу, протекает с образованием оксида трифенилсурьмы [13]:
Me
Me
Me Me
+ Ph 3 Sb
+
Ph 3 SbO
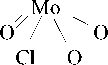
Cl
Трифенилсурьма окисляется пероксодисульфатом калия в водном растворе ацетонитрила до оксида с точкой плавления 280 ° С, нерастворимого в органических растворителях, который, как предполагают авторы, имеет полимерное строение [14]:
Ph 3 Sb + S 2 O 82- + H 2 O → Ph 3 SbO + 2 SO 42- + 2H +
Пероксид водорода окисляет триарилсурьму до оксида Ar 3 SbO (Ar = Ph, p- Tol) или дигидроксида Ar 3 Sb(OН) 2 (Ar = 2,4,6-Me 3 C 6 H 2 ) в зависимости от объема органического радикала у атома сурьмы [15, 16]. Трифенилсурьма окисляется стехиометрическим количеством трет бутилгидропероксида с образованием оксида трифенилсурьмы, который олиго- и полимеризуется [17–19]. В присутствии избытка гидропероксида продуктами являются устойчивыe дипероксиды трифенилсурьмы Ph 3 Sb(OOBu- t ) 2 и (Ph 3 SbOOBu- t ) 2 О [20].
Как установлено рядом авторов, эффективными окислителями триарилсурьмы являются хиноны. Так, взаимодействие трифенилсурьмы с 1,4-бензохиноном, п -толуолохиноном, 2,5-дифенил-1,4-бензохиноном и 1,4-нафтохиноном в растворе эфира с последующей обработкой реакционной смеси соляной кислотой приводит к образованию дихлорида трифенилсурьмы, соответствующего гидрохинона и небольшого количества 2-фенилгидрохинона [21]:
O
OH
+ Ph 3 SbCl 2
При повышении температуры до 80 оС и замене растворителя на бензол происходит увеличение выхода фенилированного гидрохинона. Следует отметить, что 2,5-дитретбутил-1,4-бензохинон не реагирует с трифенилсурьмой даже при кипячении в ксилоле.
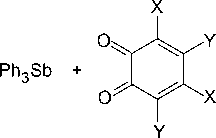
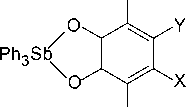
Трифенилсурьма окисляется орто-бензохинонами с образованием катехолатов трифенил- сурьмы с выходом 99 % [22]:
toluene
X=Y=Cl, Br
X=CMe3 , Y=H
X
Y
Реакция протекает уже при комнатной температуре с высокой скоростью.
Позже исследование реакций замещенных орто -хинонов и орто- аминофенолов с трифенил-сурьмой было проведено в работах [23–25], например:
Ph3 Sb
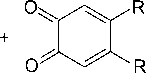
toluene
R = H, OMe
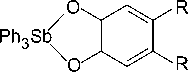
Установлено, что катехолаты трифенилсурьмы (Ph 3 Sb(4-MeO-Cat), Ph 3 Sb(4-MeO-Cat)·MeOH, Ph 3 Sb(4,5-(OMe) 2 -Cat) и Ph 3 Sb(4,5-(OMe) 2 -Cat)·MeCN), о -амидофеноляты трифенилсурьмы (Ph 3 Sb(AP-Me) и Ph 3 Sb(AP- i -Pr), комплекс Ph 3 Sb[PhenCat] и др.) способны обратимо взаимодействовать с молекулярным кислородом в мягких условиях с образованием циклических эндопероксидных комплексов, содержащих пятичленный триоксастиболановый цикл, например [26–35]:
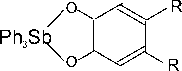
o 2
OO
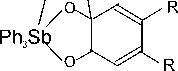
R = H, OMe
Предложен механизм этого превращения, ключевой стадией которого является одноэлектон-ное окисление молекулярным кислородом дианионного лиганда ( о -амидофенолятного, катехо-латного, фенантрен-9,10-диолатного) в анион-радикальный. Для доказательства предлагаемого механизма привлечен метод ЭПР.
Взаимодействие трифенилсурьмы с тетраметил-1,2-диоксетаном в дейтерохлороформе при комнатной температуре приводит к образованию комплекса, в котором остаток диоксетана выступает как бидентатный лиганд [36]:
O CMe3
O CMe3
Ph3 Sb
O CMe 3
Ph3Sb +
O CMe3
Выход продукта составляет 77 %. Часть диоксетана (23 %) в условиях опыта разлагалась до ацетона. Количественный выход может быть достигнут только при наличии большого избытка диоксетана. В дейтерированном бензоле выход целевого продукта достигает лишь 30 %, в то время как 70 % диоксетана подвергается разложению.
Из литературных данных следует, что дикарбоксилаты триарилсурьмы могут быть получены различными способами. Например, диацетат трифенилсурьмы образуется при взаимодействии эквимолярных количеств трифенилсурьмы и азотной кислоты в растворе уксусного ангидрида при 0 ºС [37]. Авторы считают, что вначале происходит окисление трифенилсурьмы до оксида, который затем при взаимодействии с ангидридом превращается в диацетат трифенилсурьмы. Чтобы подтвердить это предположение была проведена реакция оксида трифенилсурьмы с уксусным ангидридом, которая привела к образованию диацетата трифенилсурьмы. К диацетату трифенилсурьмы приводит взаимодействие трифенилсурьмы с тетраацетатом свинца [38].
Дибензоат трифенилсурьмы синтезирован по реакции дибензоилпероксида с трифенилсурь-мой при 60-80 ° С [1]:
Ph 3 Sb + PhC(O)OO(O)CPh ^ РЬ з 8Ъ[ОС(О)РЬ] 2
Реакции триорганилсурьмы с кислотами
Как полагают авторы [39], при взаимодействии с триарилсурьмой карбоновые кислоты, содержащие один или более атомов галогена в « -положении, сами выступают в роли окислителей:
Ar 3 Sb + 2 RC(O)OH ^ Ar 3 Sb[OC(O)R] 2 + H
Ar = Ph, p -Tol; R = CH 2 Cl, CH 2 Br, CH 2 F, CCl 3 , CF 3 , 3,5-( NO 2 ) 2 C 6 H 3
Реакция протекает при 100 ° С в толуоле.
Оригинальный метод синтеза диацетата трифенилсурьмы с выходом 85 %, который заключается в нагревании раствора трифенилсурьмы в смеси уксусной кислоты и уксусного ангидрида (2:1) в присутствии пероксида водорода, был предложен Тепе с сотрудниками [40]:
Ph 3 Sb + 2 CH 3 COOH + H 2 O 2 → Ph 3 Sb[OC(O)CH 3 ] 2 + 2 H 2 O
Метод, предложенный авторами [40], получил развитие в работах В.А. Додонова и А.В. Гущина. По реакции окислительного присоединения были синтезированы другие дикарбоксилаты трифенилсурьмы Ph 3 Sb[OC(O)R] 2 (R= CH 3 , C 2 H 5 , Ph, CH=CH 2 ) [41]. В качестве окислителей были использованы трет -бутилгидропероксид или пероксид водорода. Реакции протекали в диэтиловом эфире с высоким выходом продукта (76–90 %) даже при комнатной температуре.
Исследование реакций триарилсурьмы с карбоновыми кислотами различного строения было продолжено другими авторами. Установлено, что взаимодействие трифенил- и три- пара -толилсурьмы с кислотами, содержащими гетероатомы в органическом радикале [42], а также имеющие органичеcкие радикалы большого объема [43, 44], в присутствии водного раствора пероксида водорода протекает гладко в эфире и сопровождается образованием дикарбоксилатов триарилсурьмы с практически количественными выходами. Подобным образом протекают реакции триарилсурьмы с производными бензойной кислоты, содержащими как электронодонорные метильные заместители, так и электроноакцепторные атомы фтора или хлора [45, 46].
Реакция трифенилсурьмы, пероксида водорода и салициловой кислоты протекает с количественным образованием μ -оксо бис [(2-оксибензоато)трифенилсурьмы] [47]:
2 Ph 3 Sb + 2 H 2 O 2 + 2 HOC(O)C 6 H 4 -OH-2 → [Ph 3 SbOC(O)C 6 H 4 -OH-2] 2 O + 3 H 2 O
Образование соединения мостикового типа в данной реакции может быть предпочтительным, если принимать во внимание пространственные затруднения, которые создает заместитель в орто- положении бензольного кольца карбоновой кислоты: между атомом водорода гидроксильной группы и атомом кислорода карбонильной группы образуется водородная связь.
Установлено, что окислителем в реакциях триарилсурьмы с кислотами может выступать кислород воздуха. Так были получены бис (метилбензоаты) триарилсурьмы (толуол, 90 ° С, 100 часов), однако вследствие медленной диффузии кислорода выход продуктов не превышал 40 % [48]:
Ar 3 Sb + ^O 2 + 2 HOC(O)Ar‘ ^ Ar 3 Sb[OC(O)Ar’] 2 + H 2 O
Ar’ = С 6 Н 4 СН 3 -3; С 6 Н 4 СН 3 -4
Вместо карбоновых кислот в реакциях окислительного присоединения триарилсурьмы могут быть использованы другие органические ОН-кислоты.
Исследована реакция трифенилсурьмы с представителем фосфиновых кислот (дифенацилфосфиновой кислотой) в присутствии пероксида водорода (эфир, 20 °С, 12–18 часов), приводящая к образованию бис (дифенацилфосфината) трифенилсурьмы [49]:
Ph 3 Sb + H 2 O 2 + 2 HOP(O)[CH 2 C(O)Ph] 2 → Ph 3 Sb{OP(O)[CH 2 C(O)Ph] 2 } 2 + 2 H 2 O
В работе [50] cообщается о синтезе производных сурьмы Ph 3 Sb(OSiR 3 ) 2 , Ph 3 Sb(OCH 2 CH 2 ) 2 NH, Ph 3 Sb(OCH 2 CH 2 NMe 2 ) 2 из трифенилсурьмы, соответствующих спиртов и гидропероксида третичного бутила в толуоле, например:
Ph 3 Sb + t -BuOOH + 2 HOSiR 3 ^ Ph 3 Sb(OSiR 3^ + t -BuOH + 2 H 2 O R = Me, Ph
Трифенилсурьма реагирует с вицинальными диолами в присутствии гидропероксида третичного бутила с образованием гетероциклических соединений сурьмы(V) с выходом 71–91% [51]:
Ph3Sb
HO
+G
HO
t-BuOOH
O
Ph Sb G+t-BuOH+H O 32
O
G = CH 2 CH 2 , CHMeCHMe, CMe 2 CMe 2 , CPh 2 CPh 2 , CH 2 CH(CH 2 OH), 1,2-C 6 H 4
Окислительный метод синтеза соединений Sb (V) позволяет получать сурьмаорганические производные диоксибензолов, строение которых определяется положением гидрокси-групп в ароматическом кольце [52]:
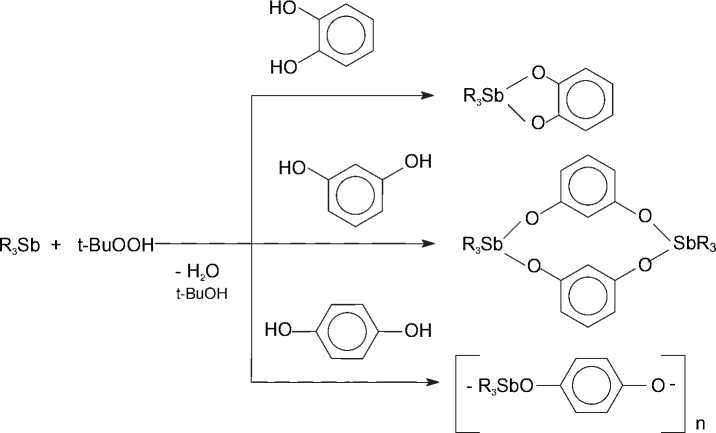
Как было установлено, строение продукта взаимодействия трифенилсурьмы с фенолами в присутствии пероксида водорода зависит от природы заместителей в нем. Так, реакции с фенолом или 4-нитрофенолом приводят к образованию соответствующего диароксида трифенилсурь-мы с выходом до 96 % [53]:
Ph 3 Sb + H 2 O 2 + 2 HOAr → Ph 3 Sb(OAr) 2 + 2 H 2 O
Ar = Ph, C 6 H 4 NO 2 -4
При взаимодействии триарилсурьмы, пероксида водорода и полифункциональных фенолов наряду с диароксидами триарилсурьмы из реакционной смеси выделяется µ- оксобис[(ароксо)трифенилсурьма], выход которой, например, в случае 2,4,6-трибромфенола достигает 44 % [54, 55]:
Ar 3 Sb(OAr’) 2 + 2 H 2 O 45-62%
3 Ar 3 Sb + 3 H 2 O 2 + 4 HОAr’
[Ar 3 SbOAr’] 2 O + 3 H 2 O 32–44 %
Ar = Ph, 4-MeС 6 H 4 ; Ar’ = C 6 H 2 Br 3 -2,4,6; С 6 H 3 (СHO-2),Br-4; C 6 H 2 (ОН-3)[OC(O)Me-4]
Диароксиды трифенилсурьмы, в отличие от µ -оксо бис [(ароксо)трифенилсурьмы], более легкоплавки и обладают лучшей растворимостью в органических растворителях. Образование соединений сурьмы с мостиковым атомом кислорода авторы объясняют гидролизом образующихся диароксидов трифенилсурьмы.
В реакции окислительного присоединения с участием триарилсурьмы, пероксида водорода и фенола, содержащего электроноакцепторные заместители в орто- и пара- положениях, при мольном соотношении исходных реагентов 1:1:1 единственным сурьмаорганическим продуктом является соединение ангидридного строения с выходом до 83 % [47]:
2 A^Sb + 2 H 2 O 2 + 2 HOAr ' ^ [MSbOAr'hO + 3 H 2 O
Ar = Ph, 4-MeC 6 H 4 ; Ar ' = C 6 H 2 Br 3 -2,4,6; C 6 H 3 (CHO-2),Br-4; C 6 H 3 (OH-3),Ac-4; С бВД -4
При избытке пероксида водорода продуктом реакции является тетраядерный сурьмаоргани-ческий пероксид (Ar2SbO)4(O2)2 (Ar = Ph, т.пл. 280 ° С; Ar = Tol- p , т. пл. 269 ° С), в состав которого остатки фенолов не входят [56]:
4 A^Sb + 6 H 2 O 2 + 4 HOAr ' ^ (A^SbOMO 2 ) 2 + 8 Н 2 О Ar = Ph, 4-MeC 6 H 4 ; Ar ' = С б Н д СМ, C 6 H 4M , C 6 H 4 -NO-4
По данным рентгеноструктурного анализа, особенностью строения комплексов является присутствие двух пероксидных мостиков, соединяющих две пары атомов Sb. Четыре атома Sb, находящиеся практически в одной плоскости, имеют октаэдрическую коорднацию. Молекулы центросимметричны с центром симметрии на середине расстояний О-О.
Образование тетраядерного сурьмаорганического пероксида может иметь место в результате деструкции и окисления д -оксо бис [(ароксо)трифенилсурьмы] пероксидом водорода:
2 [A^SbOAr'^O + 2 H 2 O 2 ^ (A^SbO^^b + 2 H 2 O
Ar = Ph, 4-MeC 6 H 4 ; Ar ' = C 6 H 4 I-4, C 6 H 4 Cl-4
Можно также предположить, что образование тетраядерного пероксида протекает через стадию синтеза биядерного пероксида Ar3(OAr ' )SbOOSb(OAr ' )Ar3:
2 A^Sb + 3 H 2 O 2 + 2 HOAr ' ^ Ar 3 (Ar ' O)SbOOSb(OAr ' )Ar 3 + 4 Н 2 О
2 Ar 3 (OAr ' )SbOOSb(OAr ' )Ar 3 ^ (A^SbO^^b + 4 Ar-Ar '
Действительно, биядерный пероксид - д -пероксо бис [(4-бромфеноксо)три- п -толилсурьму] (т. пл. 132 ° С) - удалось выделить из реакции три- п -толилсурьмы, 4-бромфенола и пероксида водорода [57]:
2 p -Tol 3 Sb + 3 H 2 O 2 + 2 HOC 6 H 4 Br-4 ^ p -Tol 3 Sb(OC 6 H 4 Br-4)OOSb(OC 6 H 4 Br-4)(Tol- p ) 3 + 4 H 2 O p -Tol = 4-MeC 6 H 4
Отметим, что тетраядерный пероксид (2-MeC 6 H 4 ) 2 SbO) 4 (O 2 ) 2 был синтезирован ранее из тетра- орто -толилстибина [58, 59]:
O 2 H 2 O 2
(2-MeC 6 H 4 ) 2 SbSb(C 6 H 4 Me-2) 2 → (2-MeC 6 H 4 ) 2 Sb) 4 O 6 → ((2-MeC 6 H 4 ) 2 SbO) 4 (O 2 ) 2
Oдностадийный метод для синтеза диоксиматов триарилсурьмы был впервые применен авторами работ [60, 61]. Реакции протекают в растворе эфира при комнатной температуре в течение 12–24 часов, в качестве окисляющего агента использовался водный раствор пероксида водорода:
Ar3Sb + H 2 O 2 + 2 HON=CRR/ ^ Ar 3 Sb(ON=CRR , ) 2 + 2 H 2 O Ar = Ph, 4-MeC6H 4 ; R = Ph, R ' = Me; R = R ' = Ph; R = H, R ' = C 4 H 3 O
Реакции с 2-гидрокси-5-бромбензальоксимом и салицилальоксимом, содержащими две функциональные группы, в которых подвижность атомов водорода различна, приводят к синтезу соответствующих диоксиматов трифенилсурьмы [62, 63]. При использовании оксима бензофенона наряду с бис(бензофеноноксиматом) трифенилсурьмы (72 %) имеет место образование µ-оксобис[(бензофеноноксимато)трифенилсурьма] (26 %). Выход µ-оксобис[(фурфуральоксимато)-трифенилсурьмы] значительно превышает выход бис(фурфуральоксимата) трифенилсурьмы.
Следует отметить, что авторы работы [64], используя для синтеза диоксиматов трифенил- и триметилсурьмы в качестве окисляющего агента трет-бутилгидропероксид (R3Sb : t-BuOOH : HON=CR’R’’ = 1:1:2, гексан), получали целевой продукт с выходами 87–96 %.
При взаимодействии триарилсурьмы, пероксида водорода и оксима при соотношении исходных реагентов (1:1:1 мольн.) имеет место образование только одного сурьмаорганического продукта - д -оксо бис [(оксимато)триарилсурьмы] с выходом 60-87 % [65]:
2 Лг з 8Ъ + 2 H 2 O 2 + 2 HON=CRR ' ^ [Ar 3 Sb(ON=CRR ' )] 2 O + 3 H 2 O Ar = Ph, 4-MeC 6 H 4 ; R = R ' = Ph; R = H, R ' = C 4 H 3 O
При прибавлении к µ -оксо бис [(оксимато)трифенилсурьме] пероксида водорода не происходит дальнейшего окисления соединения.
Бис (аренсульфонаты) и бис (алкансульфонаты) триарилсурьмы по реакции окислительного присоединения были впервые синтезированы авторами [66–68]. Взаимодействие триарилсурьмы, пероксида водорода и сульфоновой кислоты (1:1:2 мольн.) проходит в диэтиловом эфире при комнатной температуре в течение нескольких часов:
Ar 3 Sb + H 2 O 2 + 2HOSO 2 R → Ar 3 Sb(OSO 2 R) 2 + 2H 2 O
Ar = Ph, 4-MeC 6 H 4 ; 2-MeC 6 H 4 ; 3-MeC 6 H 4 ; R = Ph, C 6 H 4 Me-4, C 6 H 4 Me-2, C 6 H 4 Me-3, C 6 H 4 Me 2 -2,5, C 6 H 4 Me 2 -2,4, CF 3 , CH 2 Ph
Выход бис (аренсульфонатов) и бис (алкансульфонатов) триарилсурьмы достигает 98 %. По аналогичной схеме реагируют с триарилсурьмой нафталинсульфоновые кислоты. Однако увеличение объема аренсульфонатной группы приводит к значительному понижению выхода продукта (до 25 %).
Примечательной является реакция трифенилсурьмы с хлорангидридом фенилметансульфо-новой кислоты в присутствии пероксида водорода, протекающая с образованием сурьмаоргани-ческого цвиттер-иона, который после перекристаллизации из горячего толуола выделяли в виде бесцветных кристаллов (т. пл. 232 °С с разложением) с выходом 91 % [69]:
HO
Ph 3 Sb + ClSO 2 CH 2 Ph 2 2 Ph 3 SbCH(Ph)SO 2 O
По данным рентгеноструктурного анализа, бетаин является кристаллосольватом с толуолом. Атом сурьмы в нем имеет искаженную тетраэдрическую координацию.
Взаимодействие триарилсурьмы с аренсульфоновой кислотой в присутствии пероксида водорода при мольном соотношении 1:1:1 в диэтиловом эфире приводит к образованию д -оксо бис [(аренсульфонато)триарилсурьмы] [47, 70 ] :
2Аг з 8Ъ + 2HOSO 2 Ar ' + 2H 2 O 2 ^ (Ar з SbOSO 2 Ar , ) 2 О + ЗН 2 О
Ar = Ph, 4-МеС б Н д ; 2-МеС б Н д ; Ar ' = Ph, С б Н д Ме-4, С б Н з Ме 2 —2,4, С б Н з Ме 2 —2,5, C 6 H 3 Me 2 -3,4, C 6 H 4 (OH)-2, C 6 H 4 (OH)-4, C 10 H 7 -1, C 10 H 7 -2
Увеличение объема арильного радикала сульфоновой кислоты сопровождается незначительным понижением выхода целевого продукта.
Продуктом реакции трифенилсурьмы с ацетилацетоном в присутствии пероксида водорода является гидроксиацетилацетонат трифенилсурьмы [71, 72]:
Ph 3 Sb + ROOH + СН з С(О)СН 2 С(О)СН з ^ Ph 3 Sb(OH)[CH 3 C(O)CHC(O)CH 3 ] + ROH
R = t -Bu, H
По аналогичной схеме протекают реакции триарилсурьмы с бензоилацетоном и дибензоил-метаном [48].
Пивалоилтрифторацетон реагирует с трифенилсурьмой в присутствии трет бутилгидропероксида с образованием диолатного комплекса с выходом 85 % [71], в присутствии пероксида водорода выход комплекса понижался до 59 % [48]. Oсновным продуктом взаимодействия трифенилсурьмы, нафтолоилтрифторацетона и пероксида водорода является также сурьма-органический диолатный комплекс:
Ph3Sb + CF 3 C(O)CH 2 C(O)C 10 H 7
Заключение
Таким образом, из реакций окисления триорганилсурьмы наиболее перспективными с точки зрения синтеза являются реакции, позволяющие получать целевой продукт – соединение пятивалентной сурьмы – в одну стадию. На строение продукта оказывает влияние природа окислителя и его концентрация. Взаимодействие триарилсурьмы с карбоновыми, сульфоновыми кислотами и спиртами (HX) в присутствии окислителя (пероксид водорода или органический пероксид) при мольном соотношении реагентов 1:2:1 приводит преимущественно к образованию продукта Ar 3 SbX 2 независимо от природы кислоты, наличия потенциальных координирующих центров в заместителях Х, а также функциональных групп; увеличение объема Х сопровождается понижением выхода целевого продукта. При уменьшении концентрации кислоты НХ в реакционной смеси (мольное соотношение 1:1:1) сурьмаорганический продукт имеет другое строение – (Ar 3 SbX) 2 О. При избытке пероксида возможно образование би- и тетраядерных пероксидных соединений сурьмы.
На строение образующегося продукта в реакции окислительного присоединения может оказывать влияние также природа используемой кислоты (синтез сурьмаорганического цвиттериона, (гидрокси) ^ -дикетонатов триарилсурьмы, диолатных комплексов).
Список литературы Особенности окислительного метода синтеза органических соединений сурьмы (обзор)
- Кочешков, К. А. Методы элементоорганической химии. Сурьма, висмут/К.А. Кочешков, A.П. Сколдинов, Н.Н. Землянский. -М.: Наука, 1976. -483 с.
- Kasemann, R. Low temperature liquid phase fluorination of pentafluorophenyl compounds. Preparation and properties of (C6F5)3AsF2, (C6F5)3SbF2, (C6F5)2SeF2, (C6F5)SeO, C6F5TeF3, Cs[(C6F5)3EF3] (E = As, Sb)/R. Kasemann, D.Naumann//J. Fluorine Chem. -1988. -V. 41. -N. 3. -P. 321-334.
- Электрохимическое фторирование третичных соединений сурьмы/Е.В. Никитин, А. А. Казакова, О.В. Паракин, Ю.М. Каргин//Журн. общ. химии. -1982. -Т. 52. -Вып. 9. -C. 2027-2029.
- Tyrra, W. On pentavalent perfluoroorgano bithmuth compounds/W. Tyrra, D. Naumann//Can. J. Chem. -1989. -V. 67. -N. 11. -P. 1949-1951.
- Ruppert, I. Diorganylchalkogen (S, Se, Te) -difluoride durch Direktfluorierung der Sulfide, Selenide und Telluride/I. Ruppert//Chem. Ber. -1979. -Bd. 112. -N. 8. -S. 3023-3030.
- Ray, P. The preparation of pentafluorophenil antimony (III) and antimony (V) halides and mixed halides./P. Ray, A.K. Aggarval, A.K. Saxena//J. Fluorine Chem. -1989. -V. 42. -N. 2. -P. 163-172.
- Реакции трицимантренилсурьмы и трицимантренилвисмута с CuX2 (X = Cl, Br)/B.В. Шарутин, В.Т. Бычков, Ю.Н. Сафьянов и др.//Журн. общ. химии. -1985. -Т. 55. -Вып. 7. -C. 1652-1653.
- Синтез и строение бис(4-метилбензоата) трис(4-N,N-диметиламинофенил)сурьмы/В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина, О.В. Чагарова//Журн. общ. химии. -2011. -Т. 81. -№ 11. -С. 1789-1792.
- Bhattacharya, S.N. Oxidative addition reactions of triarylarsines and triarylstibines with copper (II) and mercury (II) salts/S.N. Bhattacharya, M. Singh//Indian J. Chem. -1979. -V. 18 A. -N. 6. -P. 515-516.
- Metal derivatives of organoantimony compounds; reactions of anhydrous ferric chloride with arylantimony compounds/H.K. Sharma, S. Singh, S.N. Dubey, D.M. Puri//Indian J. Chem. Seet. A. -1982. -V. 21 A. -P. 619-621.
- Asthana, A. Acyl derivaties of main group metals: preparation of benzoyl derivatives of some group V and VI metals and metalloids/A. Asthana, R.C. Srivastava//J. Organomet. Chem. -1989. -V. 366. -N. 3. -P. 281-285.
- Reactions of triaryl derivatives of group 5 with selenium dioxide/S.I.A. El Sheikh, M.S. Patel, B.C. Smith, C.B. Waller//J. Chem. Soc. Dalton Trans. -1997. -N. 7. -P. 641-644.
- Faller, J.W. Reactions and properties of oxo-derivatives of (pentamethylcyclopentadienyl) -molybdenium and tungsten/J.W. Faller, Y. Ma//J. Organomet. Chem. -1989. -V. 368. -N. 1. -P. 45-56.
- Srinivasan, C. Mechanism of oxidation of triphenylphosphine, triphenylarsine and triphenylstibine by potassium eroxydisulfate/C. Srinivasan, K. Pitchumani//Int. J. Chem. Kinet. -1982. -V. 14. -N. 12. -P. 1315-1324.
- Ruther, R. Triorganoantymon und Triorganobismutdisulfonate Kristal-und Molekul-Structuren von (C6H5)3M(O3SC6H5)2 (M = Sb, Bi)/R. Ruther, F. Huber, H. Preut//Z. Anorg. Allg. Chem. -1986. -Bd. 539. -N. 8. -S. 110-126.
- Westhoff, T. Synthesis of tris(2,4,6-trimethylphenyl) hydroxoantimony carboxylates. Crystall structure of tris(2,4,6-trimethylphenyl)hydroxoantimony 1-adamantylcarboxylate/T. Westhoff, F. Huber, H. Preut//J. Organometal. Chem. -1988. -V. 348. -N. 2. -Р. 185-191.
- Hiatt, R. The reaction of Hydroperoxides with Triphenylarsine and Triphenylstibine/R. Hiatt, C.McColeman, G.R. Howe//Canad. J. Chem. -1975. -V. 53. -N. 4. -Р. 559-563.
- Термохимия реакции трифенилфосфора, -мышьяка и -сурьмы с гидроперекисью третичного бутила/В.Г. Цветков, Ю.А. Александров, В.Н. Глушакова и др.//Журн. общ. химии. -1980. -Т. 50. -Вып. 2. -С. 256-258.
- Reactions of Organometallic Compounds with Organic Peroxides/G.A. Razuvaev, V.A. Shushunov, V.A. Dodonov, T.G. Brilkina//In: Organic Peroxides. -N. Y.: J. Willey and Sons. -1972. -V. 3. -Р. 141-270.
- Пероксидные соединения трифенилсурьмы, их синтез и строение/И.Е. Покровская, В.А. Додонов, З.А. Старикова и др.//Журн. oбщ. химии. -1981. -Т. 51. -Вып. 6. -С. 1247-1253.
- Alberola, A. The reaction of p-quinones with triphenylstibine/A. Alberola, A.M. Gonzaleer, F.J. Pulido//Rev. Roum. Chim. -1984. -V. 29. -N. 5. -P. 441-446.
- Tetaarylbutyldimethylantimony -a new Sb source for Low-temperature organometallic vapor phase epitazial growth of In Sb/С.Н. Chen, G.B. Stringfellow, DC. Gordon et al.//Appl. Phys. Lett. -1992. -V. 61. -N. 2. -P. 204-206.
- 0xidative addition reaction of o-quinones to triphenylantimony. Novel triphenylantimony catecholate complexes/V.K. Cherkasov, E.V. Grunova, A.I. Poddel’sky et al.//J. 0rganomet. Chem. -2005. -V. 690. -N. 5. -P. 1273-1281.
- Hexacoordinate triphenylantimony(V) complex with tridentate bis-(3,5-di-tert-butyl-phenolate-2-yl)-amine ligand. Synthesis, NMR and X-ray study/A.I. Poddel’sky, N.V. Somov, Yu.A. Kurskii et al.//J. 0rganomet. Chem. -2008. -V. 693. -N. 21-22. -P. 3451-3455.
- The binuclear trimethyl/triethylantimony(V) bis-catecholate derivatives of four-electron reduced 4,4’-di-(3-methyl-6-tert-butyl-o-benzoquinone)/A.I. Poddel'sky, N.V. Somov, N.O. Druzhkov et al.//J. 0rganomet. Chem. -2011. -V. 696. -N. 2. -P. 517-522.
- Radical scavenging activity of sterically hindered catecholate and o-amidophenolate complexes of LSbVPh3 type/I.V. Smolyaninov, N.A. Antonova, A.I. Poddel’sky et al.//J. Organomet. Chem. -2011. -V. 696. -N. 13. -P. 2611-2620.
- Reversible Binding of Dioxygen by a Non-transition-Metal implex/G.A.Abakumov A.I.Poddel’sky, E.V.Grunova et al.//Angew. Chem. Int. Ed. -2005. -V. 44. -P. 2767-2771.
- Циклические эндопероксиды на основе катехолатов трифенилсурьмы(V). Обратимое связывание молекулярного кислорода/Г.А. Абакумов, В.К. Черкасов, Е.В. Грунова и др.//Докл. АН. -2005. -Т. 405. -№ 2. -С. 199-203.
- Triphenylantimony(V) Catecholates and o-Amidophenolates: Reversible Binding of Molecular 0xygen/V.K. Cherkasov, G.A. Abakumov, E.V. Grunova et al.//Chem. Eur. J. -2006. -V. 12. -N. 14. -P. 3916-3927.
- Новые инертные по отношению к молекулярному кислороду катехолатные комплексы трифенилсурьмы(V) на основе о-хинонов с электроноакцепторными группами/А.И. Поддельский, И.В. Смолянинов, Ю.А. Курский и др.//Изв. АН. Сер. «Химия». -2009. -№ 3.-С. 520-525.
- Triethylantimony(V) complexes with bidentate O,N-, O,O-and tridentate 0,N,O’-coordinating o-iminoquinonato/o-quinonato ligands: Synthesis, Structure and some Properties/A.I. Poddel’sky, N.N. Vavilina, N.V. Somov et al.//J. Organomet. Chem. -2009. -V. 694. -N. 21. -P. 3462-3469.
- New morpholine-and piperazine-functionalised triphenylantimony(V) catecholates: The spectroscopic and electrochemical studies/A.I. Poddel’sky, I.V. Smolyaninov, Yu.A. Kurskii et al.//J. Organomet. Chem. -2010. -V. 695. -N. 8. -P. 1215-1224.
- Электрохимические превращения катехолатных и о-амидофенолятных комплексов трифенилсурьмы(V)/И.В. Смолянинов, А.И. Поддельский, Н.Т. Берберова и др.//Коoрд. химия. -2010. -Т. 36. -N. 9. -С. 650-657.
- The triphenylantimony(V) o-amidophenolates with unsymmetrical N-aryl group for a reversible dioxygen binding/A.I. Poddel'sky, Yu.A. Kurskii, A.V. Piskunov et al.//Appl. Organomet. Chem. -2011. -V. 25. -N. 3. -P. 180-189.
- Experimental and Theoretical Investigation of Topological and Energetic Characteristics of Sb Complexes Reversibly Binding Molecular Oxygen/G.K. Fukin, E.V. Baranov, C. Jelsch et al.//J. Phys. Chem. A. -2011. -V. 115. -N. 29. -P. 8271-8281.
- Baumstark, A.L. Insertion reaction of triphenylarsine and triphenylantimony with tetrametyl-1,2-dioxetane: preparation of 2,2-dihydro-4,4,5,5-tetramethyl-2,2,2-triphenyl-1,3,2-dioxarsolane and -dioxastibolane/A.L. Baumstark, M.E. Laandis, P.J. Brooks//J. Org. Chem. -1979. -V. 44. -N. 24. -P.4251-4253.
- Reactivity of triphenyl derivatives of group VA elements towards nitric acid/E. Maccarone, A. Passerini, R. Passerini, G. Tassone//Gazz. Chim. Ital. -1989. -V. 119. -N. 10. -P. 545-548.
- Лодочников, В.И. Изучение реакционной способности соединений ArPbX3. Взаимодействие с (C6H5)3Sb/В.И. Лодочников, Е.М. Панов, К.А. Кочешков//Журн. общ. химии. -1964. -Т. 34. -Вып. 3. -С. 946-949.
- Bhattacharya, S.N. Oxidative addition reactions of triarylarsines and triarylstibines with copper (II) and mercury (II) salts/S.N. Bhattacharya, М. Singh//Indian J. Chem. -1979. -V. 18A. -N. 6. -P. 515-516.
- Improved methods for the sinthesis of antimony triacetate, triphenylantimonyldiacetate and pentaphenylantimony/T.C. Thepe, R.J. Garascia, M.A. Selvoski, A.N. Patel//Ohio J. Sci. -1977. -V. 77. -N. 3. -P. 134-135.
- Гущин, А.В. Получение органических производных сурьмы(V), висмута(V) и применение их в органическом синтезе: дис.... д-ра хим. наук/А.В. Гущин. -Нижний Новгород, 1998. -283 с.
- Синтез и строение дикарбоксилатов триарилсурьмы Ar3Sb[OC(O)R]2 (Ar = Ph, n-Tol; R = 2-C4H3O, 3-C5H4N)/В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др.//Коорд. химия. -2003. -Т. 29 -№ 10. -С. 750-759.
- Синтез и строение бис(1-адамантанкарбоксилато)-трифенилсурьмы/В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др.//Журн. неорг. химии. -2008. -Т. 53. -№ 8. -С. 1335-1341.
- Синтез бис(фенилкарборанилацетата) трифенилсурьмы/В.В. Шарутин, В.С. Сенчурин, В.И. Брегадзе, Г.Г. Жигарева//Журн. общ. химии. -2010. -Т. 80. -Вып. 6. -С. 1045.
- Синтез и строение фторбензоатов тетра-и триарилсурьмы)/В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др.//Коорд. химия. -2002. -Т. 28. -№ 5. -С. 356-363.
- Особенности строения дикарбоксилатов триорганилсурьмы R3Sb[OC(O)R’)]2/B.В. Шарутин, О.К. Шарутина, А.П. Пакусина др.//Коорд. химия. -2003. -Т. 29. -№ 11. -C. 843-851.
- Синтез, строение и реакции соединений сурьмы (Ar3SbX)2O, X = Hal, NO2, NO3, OSO2R, OC(O)R, OAr/В.В. Шарутин, А.П. Пакусина, О.К. Шарутина и др.//Химия и компьютерное моделирование. Бутлеровские сообщения. -2002. -№11. -С. 13-22.
- Пакусина, А.П. Особенности химического поведения и строения арильных соединений сурьмы: дис.... д-ра хим. наук/А.П. Пакусина; Иркут. ин-т химии. -Иркутск, 2006. -323 с.
- Синтез и строение дифенацилфосфината тетрафенилсурьмы/В.В. Шарутин, А.П. Пакусина, С.А. Смирнова, Г.К. Фукин//Коорд. химия. -2004. -Т. 30. -№ 6. -С. 421-425.
- One-step synthesis of pentavalent triphenylantimony derivatives Ph3Sb(OSiR3)2, Ph3Sb(OCH2CH2)2NH and Ph3Sb(OCH2CH2NMe2)2: X-ray molecular structure of Ph3Sb(OSiMe3)2/E.Y.Ladilina, V.V.Semenov, G.K.Fukin et al.//J. Organomet. Chem. -2007. -V. 692. -N. 26. -P.5701-5708.
- Реакции трифенилсурьмы с α-диолами в присутствии гидропероксида третичного бутила/В.А. Додонов, С.Н. Забурдяева, Н.Н. Невкина//Металлорг. хим. -1989. -Т. 2. -№ 6. -С. 1296-1297.
- Синтезы производных сурьмы (V) из триметил-и трифенилсурьмы (III), двухатомных фенолов и гидропероксида третичного бутила/В.А. Додонов, А.Ю. Федоров, Р.И. Усятинский и др.//Изв. АН. Сер. «Химия». -1995. -№ 4. -С. 748-751.
- Новый метод синтеза арокситетраарильных соединений сурьмы/В.В. Шарутин, А.П. Пакусина, М.А. Пушилин и др.//Журн. общ. химии. -2001. -Т. 71. -Вып. 6. -С. 1045-1046.
- Синтез и строение бис(2,4,6-трибромфенокси)трифенилсурьмы./В.В. Шарутин, А.П. Пакусина, М.А. Пушилин и др.//Коорд. химия. -2002. -Т. 28. -№ 6. -С. 408-411.
- Сурьмаорганические производные 2,4,6-трибромфенола/В.В. Шарутин, А.П. Пакусина, М.А. Пушилин и др.//Журн. общ. химии. -2003. -Т. 73. -Вып. 4. -С. 573-577.
- Синтез и строение сурьмаорганических пероксидов/В.В. Шарутин, А.П. Пакусина, О.К. Шарутина и др.//Коорд. химия. -2004. -Т. 30. -№ 5. -С. 336-343.
- Синтез и строение μ-пероксо-бис[бромфеноксо)-три-п-толилсурьмы]/В.В. Шарутин, А.П. Пакусина, О.В. Субачева и др.//Коорд. химия. -2003. -Т. 29. -№ 6. -C. 423-427.
- Breunig, H.J. Ein μ4-Peroxokomplex des Antimons: Synthese und Struktur von (o-Tol2SbO)4(O2)2/H.J. Breunig, Т. Kruger, Е. Lork//Angew. Chem. -1997. -V. 109. -N. 6. -S. 654-655.
- Breunig, H.J. 0xidation of tetraaryldistibanes: syntheses and crystal strucrures of diarylantimony oxides and peroxides, (R2Sb)20, (R2Sb)406 and (R2Sb0)4(O2)2 (R = Ph, oTol, p-Tol/H.J. Breunig, Т. Kruger, Е. Lork//J. Organomet. Chem. -2002. -V. 648. -N. 2. -Р. 209-213.
- Синтез и строение бис(ацетофеноноксимата) трифенилсурьмы/В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др.//Коорд. химия. -2002. -Т. 28 -№ 7. -С. 497-500.
- Синтез и строение оксиматов тетра-и триарилсурьмы/В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др.//Журн. общ. химии. -2001. -Т. 71. -Вып. 8. -С. 1317-1321.
- Синтез и строение диоксиматов триарилсурьмы./В.В. Шарутин, О.В. Молокова, О.К. Шарутина и др.//Журн. общ. химии. -2004. -Т. 74. -Вып. 10. -С. 1600-1607.
- Шарутина О.К. Арильные соединения сурьмы(V). Синтез, строение, строения, реакционная способность: дис.... д-ра хим. наук/О.К. Шарутина; Иркут. ин-т химии. -Иркутск, 2001. -287 с.
- Синтез и строение оксиматов трифенилсурьмы/В.А. Додонов, А.В. Гущин, Д.А. Горькаев и др.//Изв. РАН. -Сер. хим. -2002. -№ 6. -С. 965-971.
- Синтез и строение μ-оксобис[трифенил (фурфуральоксимато)сурьмы (V)]/В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др.//Журн. общ. химии. -2001. -Т. 71. -Вып. 9. -С. 1507-1510.
- Сульфонаты тетра-и триарилсурьмы/В.В. Шарутин, О.К. Шарутина, Л.П. Панова, В.К. Бельский//Журн. общ. химии. -1997. -Т. 67. -Вып. 9. -С. 1531-1535.
- Синтез и строение дитозилата три-n-толилсурьмы/В.В. Шарутин, О.К. Шарутина, Л.П. Панова и др.//Журн. общ. химии. -2002. -Т. 72. -Вып. 2. -С. 249-251.
- Синтез и строение бис(аренсульфонатов)триарилсурьмы/В.В. Шарутин, О.К. Шарутина, Т.П. Платонова и др.//Журн. общ. химии. -2003. -Т. 73. -Вып. 3. -С. 380-384.
- Синтез и строение органосульфонатов тетра-и трифенилсурьмы/В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др.//Коорд. химия. -2004. -Т. 30. -№ 1. -С. 15-24.
- Синтез и строение μ-оксобис[три-п-толил(2,5-диметилбензолсульфонато)-сурьмы(V)]/B.В. Шарутин, О.К. Шарутина, Н.В. Насонова и др.//Изв. АН. Сер. хим. -1999. -№ 12. -C. 2346-2349.
- Goel, R.G. Organoantimony compounds. VIII. Cleavage of Sb-0-Sb bonds in μ-oxybis(triphenylchloroantimony) and triphenylantimony oxide by methanol and acetylacetone/R.G. Goel, D.R. Ridley//J. Organomet. Chem. -1979. -V. 182. -P. 207-212.
- Синтез гидрокси(дикетонатов) трифенилсурьмы окислительным методом./А.В. Гущин, В.А. Додонов, Р.И. Усятинский и др.//Изв. АН. Сер. хим. -1994. -№ 7. -С. 1302-1304.


