Особенности продукции интерлейкина-19 у пациентов с атеросклерозом
Автор: Саранчина Ю.В., Дутова С.В., Килина О.Ю., Ханарин Н.В., Кулакова Т.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.36, 2021 года.
Бесплатный доступ
Цель: изучить особенности локальной и системной продукции интерлейкина-19 у пациентов с атеросклерозом.Материал и методы. Обследованы 46 пациентов, проходивших лечение по поводу артериальной гипертензии в терапевтическом отделении Республиканской клинической больницы им. Г.Я. Ремишевской, из них 26 женщин и 20 мужчин. Верификация атеросклеротического поражения сосудов проводилась с помощью ультразвукового исследования. Средний возраст обследуемых составил 63,4 ± 3,2 года. В контрольную группу вошли 40 человек (23 женщины и 17 мужчин, средний возраст - 44,7 ± 5,5 лет), не имеющих атеросклероза (АС). Изучению подвергались образцы атеросклеротических бляшек (АБ) и венозная кровь. АБ были получены путем эндартерэктомии, затем они подвергались гомогенизации с последующим ферментативным гидролизом в течение 1 ч при температуре 37 °С коллагеназой IV Gibco (Thermo Scientific) в присутствии ингибиторов протеиназ III Gibco (Thermo Scientific). Регистрировался сывороточный уровень цитокинов (в контрольной группе и у пациентов с АС) и в гомогенате АБ (у пациентов с АС) методом иммуноферментного анализа. Для оценки цитокин-продуцирующей способности лейкоцитов крови и лейкоцитов, выделенных из АБ, определялась спонтанная и фитогемагглютинин (ФГА)-индуцированная продукция цитокинов при их культивировании в среде RPMI-1640.Результаты. Сывороточный уровень ИЛ-19 у больных АС не имел статистически значимых различий по сравнению с группой контроля. В группе больных с АС наблюдалось статистически значимое увеличение спонтанной экспрессии ИЛ-19 лейкоцитами крови по сравнению с контрольной группой в 2 раза. При сравнении содержания ИЛ-19 в сыворотке крови и гомогенате АБ у пациентов с АС статистически значимых различий не установлено (р = 0,182). Уровень ФГА-индуцированной продукции ИЛ-19 лейкоцитами бляшки был статистически значимо ниже, чем у лейкоцитов крови.Выводы. Таким образом, выявлено, что резервные возможности к синтезу ИЛ-19 у лейкоцитов, входящих в состав АБ, снижаются, что приводит к прогрессированию воспаления. Полученные результаты свидетельствуют о противоатерогенной роли ИЛ-19 и о том, что в АБ сохраняются механизмы отрицательной регуляции воспаления за счет продукции ИЛ-19.
Интерлейкин-19, лейкоциты, атеросклероз, атеросклеротическая бляшка, воспаление
Короткий адрес: https://sciup.org/149136653
IDR: 149136653 | УДК: 616.13-004.6-097:612.017.1 | DOI: 10.29001/2073-8552-2021-36-2-52-60
Текст научной статьи Особенности продукции интерлейкина-19 у пациентов с атеросклерозом
Saranchina J.V., Dutova S.V., Kilina O.Y., Khanarin N.V., Kulakova T.S. Features of interleukin-19 production in patients with atherosclerosis. The Siberian Journal of Clinical and Experimental Medicine. 2021;36(2):52–60.
Сердечно-сосудистые заболевания (ССЗ), в частности, ишемическая болезнь сердца и ее осложнение – инфаркт миокарда, являются главной причиной смертности населения как в России, так и в зарубежных странах (по данным Росстата, 2019). Одной из ключевых причин развития ССЗ является атеросклероз (АС). АС коронарных сосудов опасен своими осложнениями, такими как окклюзия сосуда, разрыв атеросклеротической бляшки (АБ) с последующим тромбообразованием, что может привести к острому коронарному синдрому и внезапной сердечной смерти. Осложнения АС являются одними из наиболее частых причин инвалидности и смертности в большинстве стран мира.
АС представляет собой комплексное мультифактор-ное заболевание средних и крупных артерий, в котором задействованы множественные генетические и экологические факторы. В связи с высокой заболеваемостью и смертностью от ССЗ, особенно в трудоспособном возрасте, с каждым годом возрастает значимость раннего прогнозирования их риска развития.
К настоящему моменту выполнено большое количество исследований, раскрывающих этиологию и механизмы развития АС, выявлено много потенциальных маркеров, в том числе содержащихся в сыворотке крови, ассоциированных с развитием АС [1–3]. Установлено, что решающее значение для развития АБ имеет воспалительный процесс, клеточные и гуморальные компоненты которого принимают участие на разных этапах атероге-неза. Именно от взаимодействия про- и противовоспалительных реакций зависит исход патологического процесса при АС и его осложнениях [4]. Несмотря на доказанную значимость цитокиновой регуляции в данном патологическом процессе, роль отдельных цитокинов продолжает изучаться.
Одним из возможных кандидатов на роль ингибирования таргетирования воспаления является интерлейкин-19 [5–8]. Тем не менее функции и возможности использования этого цитокина не вполне исследованы и описаны, в связи с чем необходимо более подробно изучить его роль в патогенезе АС.
Цель исследования: изучение особенностей локальной и системной продукции интерлейкина-19 у пациентов с АС.
Материал и методы
В исследовании приняли участие 46 пациентов (26 женщин и 20 мужчин), проходивших лечение по поводу артериальной гипертензии в терапевтическом отделении Республиканской клинической больницы им. Г.Я. Реми-шевской. Верификация атеросклеротического поражения сосудов проводилась с помощью ультразвукового исследования. Ультразвуковое исследование брахиоцефальных артерий выполнялось на ультразвуковом сканере Philips En Visor (Philips, Нидерланды) с многочастотным датчиком с рабочей частотой 5–10 МГц. АБ определялись как локальное утолщение стенки сосуда на 50% или больше по сравнению с окружающими участками стенки или как очаговое утолщение комплекса интима-медиа более 1,5 мм выступающего в просвет сосуда. Оценивалось наличие АБ и стенозов в 6 областях брахиоцефального бассейна: обе общие сонные артерии, обе бифуркации и обе внутренние сонные артерии. Процент стеноза был рассчитан локально в поперечном сечении в области максимального сужения просвета сосуда (Рекомендации Европейского общества сосудистых хирургов, 2017). Средний возраст обследуемых составил 63,4 ± 3,2 года. В контрольную группу вошли 40 человек (23 женщины и 17 мужчин, средний возраст 44,7 ± 5,5 лет), не имеющих атеросклеротического поражения стенок сосудов, острых и хронических заболеваний в фазе обострения, не принимающих противовоспалительные и антимикробные препараты.
Исследование проводилось в соответствии с Хельсинкской декларацией и получило положительное заключение этического комитета Хакасского государственного университета им. Н.Ф. Катанова (г. Абакан, 27.01.2017 г., протокол № 5). Все испытуемые дали письменное информированное согласие на участие в исследовании.
В качестве материала для исследования в группе пациентов с АС (основная группа) выступали образцы АБ и венозная кровь, в контрольной группе – только венозная кровь. АБ были получены путем эндартерэктомии, затем они подвергались гомогенизации с последующим ферментативным гидролизом в течение 1 ч при температуре 37 °С коллагеназой IV Gibco (Thermo Scientific) в присутствии инигибиторов протеиназ III Gibco (Thermo Scientific). Из полученного гомогената АБ центрифугированием выделяли мононуклеарные лейкоциты на градиенте плотности фиколл-урографин 1,077 г/см3, доводили до концентрации 2 млн клеток в 1 мл культуральной среды. Выделенные мононуклеары культивировали в полной среде RPMI-1640 в пенициллиновых флаконах в течение 24 ч при температуре 37 °С. Выделение мононуклеар-ных лейкоцитов из крови проводили по вышеописанному методу. Для оценки цитокин-продуцирующей способности лейкоцитов крови и лейкоцитов, выделенных из АБ, определяли спонтанную и митоген-индуцированную продукцию цитокинов. В качестве митогена для стимуляции Т-лимфоцитов использовали фитогемагглютинин (ФГА) (Sigma-Aldrich) в рабочей концентрации 6 мкг/мл (добавляли 10 мкл на 1 мл культуральной среды).
Уровень ИЛ-19 определяли в сыворотке крови, гомогенате АБ и супернатантах спонтанной и ФГА-индуциро-ванной лейковзвеси методом иммуноферментного анализа с помощью наборов фирмы eBioscence (Австрия).
Статистический анализ данных включал описание количественных показателей медианами ( Ме ) и межквартильными интервалами ( Q1; Q3 ). Для сравнения групп использовали непараметрические критерии Манна – Уитни и Вилкоксона. Для оценки взаимосвязи между изучаемыми показателями проводили подсчет коэффициента корреляции Спирмена. Статистически значимыми считали различия и корреляции при р ≤ 0,05. Статистическую обработку результатов проводили с помощью пакета программ STATISTICA 8.0.
Результаты
Сывороточный уровень ИЛ-19 у больных АС не имел статистически значимых различий по сравнению с группой контроля и составил 113,5 (88,91–120,29) пг/мл и 116,67 (108,22–142,02) пг/мл соответственно (табл. 1).
При оценке спонтанной продукции цитокина было установлено, что в группе больных с АС наблюдалось статистически значимое увеличение экспрессии ИЛ-19 по сравнению с контрольной группой в 2 раза [204,78 (108,22–257,88) пг/мл и 103,39 (84,09–110,64) пг/мл соответственно, р = 0,05].
Таблица 1. Уровень ИЛ-19 в сыворотке крови и индуцированная продукция интерлейкина лейкоцитами крови
Table 1. Blood serum levels of IL-19 and its induced production by blood leukocytes
|
Показатели Indicators |
Контрольная группа Control group |
Больные с АС Patients with atherosclerosis |
р |
|
|
Сывороточный уровень ИЛ-19, пг/мл Serum level of IL-19, pg/mL |
116,67 (108,22–142,02) |
113,05 (88,91–120,29) |
0,46 |
|
|
Продукция ИЛ-19 лейкоцитами крови, пг/мл IL-19 production by blood leukocytes, pg/mL |
Спонтанная продукция Spontaneous production |
103,39 (84,09–110,64) |
204,78 (108,22–257,88) |
0,05 |
|
ФГА-индуцированная продукция PHA-induced production |
110,64 (102,19–127,53) |
174,60 (114,26–756,33) |
0,07 |
|
|
Индекс стимуляции Stimulation Index |
1,13 (1,02–1,17) |
1,19 (0,79–2,57) |
0,91 |
|
Примечание: жирным шрифтом и закрашенными ячейками выделены статистически значимые различия по показателям.
Note: the boldface and shaded cells indicate statistically significant differences between the indicators.
Полученные данные отражают активацию клеток-продуцентов in vivo . ФГА-индуцированная продукция данного цитокина также имела тенденцию к повышению у больных с АС, однако статистически значимых различий не выявлено. Результаты расчета индекса стимуляции в обеих обследуемых группах находились на одном уровне и не имели статистически значимых различий. Следовательно, резервные возможности лейкоцитов крови больных с АС к продукции ИЛ-19 сохраняются на высоком уровне, что, вероятно, может быть обусловлено началом или разгаром процессов, регулируемых этим цитокином.
При сравнении содержания ИЛ-19 в сыворотке крови и гомогенате АБ у пациентов с АС статистически значимых различий не установлено ( р = 0,182). Так, сывороточный уровень цитокина составил 113,05 (88,91– 120,29) пг/мл, в то время как в гомогенате АБ – 96,15 (88,91–108,22) пг/мл. Результаты корреляционного анализа показали отрицательную связь между уровнем ИЛ-19 в сыворотке и гомогенате АБ, однако она не имела статистической значимости ( R = –0,009; р = 0,97). Так как в данном случае происходит сравнение продукции цитокинов на местном и системном уровне, то очевидным является то, что при снижении уровня продукции цитокинов в АБ повышается продукция цитокинов лейкоцитами, находящимися в системном кровотоке, т. е. происходит вовлечение в патологический процесс всего организма, что свидетельствует о протективной роли данного цитокина.
Повышение продукции данного цитокина в сыворотке крови приводит к изменению соотношения Th1/Th2 в сторону Th2 в результате угнетения выработки INFγ и усиления продукции IL-4 и IL-13, усиливает синтез клетками внутриклеточных белковых факторов-регуляторов апоптоза (молекул bсl-2). Кроме того, IL-19 влияет на дифференцировку Th-клеток, вызывая секрецию IL-10, что приводит к подавлению воспалительного процесса [9–11].
Таким образом, ИЛ-19 способствует стабилизации бляшки, а значит, снижает риск ее разрыва и осложнений. Однако, как мы видим, этот механизм регуляции иммунного ответа является неэффективным. Вероятно, это обусловлено взаимодействием ИЛ-19 с другими регуляторными цитокинами, которые не дают проявиться его функции в полной мере. Также, возможно, неэффективность ИЛ-19 обусловлена наличием полиморфизма генов, приводящего к низкой продукции цитокина, или низкой эффективностью его связывания с рецепторами.
Спонтанная продукция ИЛ-19 лейкоцитами, выделенными из АБ, не имела статистически значимых различий по сравнению с уровнем данного цитокина, продуцируемого лейкоцитами крови, и составила 113,05 (87,10– 157,71) пг/мл и 204,78 (108,22–257,88) пг/мл соответственно (табл. 2).
Уровень ФГА-индуцированной продукции ИЛ-19 лейкоцитами АБ был равен 111,84 (89,52–182,45) пг/мл, что было статистически значимо ниже, чем у лейкоцитов крови 174,60 (114,26–756,33) пг/мл ( р = 0,04).
Таблица 2. Результаты определения уровня продукции ИЛ-19 лейкоцитами крови и лейкоцитами, выделенными из атеросклеротической бляшки, у пациентов с атеросклерозом
Table 2. Results of determining the level of IL-19 production by blood leukocytes and white blood cells isolated from the atherosclerotic plaques in patients with atherosclerosis
|
Продукция ИЛ-19, пг/мл IL-19 production, pg/mL |
Лейкоциты, выделенные из крови White blood cells isolated from the blood |
Лейкоциты, выделенные из АБ White blood cells isolated from the atherosclerotic plaques |
р |
|
Спонтанная продукция Spontaneous production |
204,78 (108,22–257,88) |
113,05 (87,10–157,71) |
0,13 |
|
ФГА-индуцированная продукция PHA-induced production |
174,60 (114,26–756,33) |
111,84 (89,52–182,45) |
0,04 |
|
Индекс стимуляции Stimulation Index |
1,19 (0,79–2,57) |
1,00 (0,80–1,39) |
0,34 |
Примечание: жирным шрифтом и закрашенными ячейками выделены статистически значимые различия по показателям.
Note: the boldface and shaded cells indicate statistically significant differences between the indicators.
Соответственно, индекс стимуляции лейкоцитов АБ был снижен по сравнению с лейкоцитами периферической крови, но статистически значимых различий выявлено не было. Таким образом, у лейкоцитов крови существуют резервные возможности к продукции ИЛ-19, а у лейкоцитов в составе АБ значительно снижены, что приводит к прогрессированию патологического процесса, т. е. в отношении синтеза ИЛ-19 у лейкоцитов формируется дефект на местном уровне.
Результаты корреляционного анализа между показателями продукции ИЛ-19 лейкоцитами крови и АБ показали, что при снижении местного уровня данного цитокина наблюдается его гиперпродукция в сыворотке, что может рассматриваться как благоприятный прогностический признак (табл. 3).
Таблица 3. Результаты корреляционного анализа продукции ИЛ-19 лейкоцитами крови и атеросклеротической бляшки
Table 3. The results of correlation analysis of IL-19 production by blood and atherosclerotic plaque leukocytes
|
Показатели Indicators |
ИС продукции ИЛ-19 лейкоцитами крови Stimulation Index of IL-19 production by blood leukocytes |
ФГА-индуцированная продукция ИЛ-19 лейкоцитами АБ PHA-induced IL-19 production by atherosclerotic plaque leukocytes |
|
|
Сывороточный уровень ИЛ-19 Serum level of IL-19 |
R |
– 0,57 |
– |
|
p |
0,018 |
– |
|
|
Спонтанная продукция ИЛ-19, синтезируемая лейкоцитами крови Spontaneous production of IL-19 by blood leukocytes |
R |
–0,03 |
0,63 |
|
p |
0,91 |
0,04 |
|
Примечание: R – коэффициент корреляции Спирмена, р – уровень статистической значимости, жирным шрифтом и закрашенными ячейками выделены статистически значимые различия по показателям.
Note: R – the Spearman correlation coefficient, p – the level of statistical significance. The boldface and shaded cells indicate statistically significant differences between the indicators.
Обсуждение
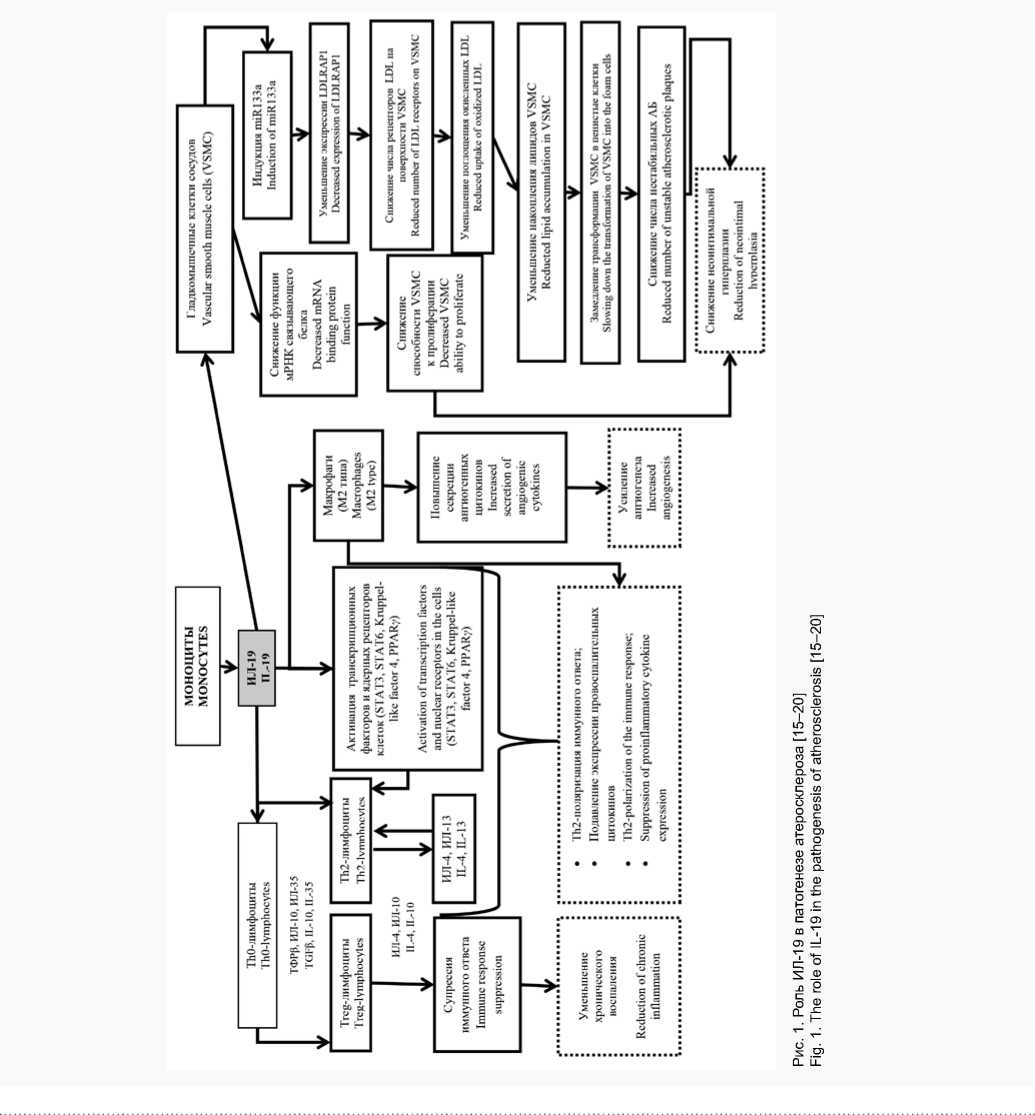
Существует мнение, что дефицит IL-19 может вызвать активацию пролиферации сосудистых гладкомышечных клеток (Vascular Smooth Muscle Cells, VSMC) и синтеза провоспалительных цитокинов (включая IL-1β и TNFα) [12, 13], что подтверждено исследованиями с использованием нокаутных по IL-19 мышей [14, 15]. Полученные данные позволили авторам предположить возможность использования IL-19 в качестве мощного супрессора развития АС.
В настоящее время появились новые факты в пользу этого предположения. Целью исследования группы ученых Медицинских университетов Филадельфии и Нью-Йорка в 2016 г. явилось определение возможности экзогенного IL-19 снижать прогрессирование атеросклеротического поражения сосудов и описание возможных молекулярных механизмов действия этого противовоспалительного цитокина. Мышам, нокаутным по рецептору липопротеинов низкой плотности (LDLR-/-), давали корм с повышенным содержанием холестерина в течение 12 нед., затем вводили рекомбинантный IL-19 (животным контрольной группы – фосфатно-буферный солевой раствор) в течение еще 8 нед. Авторы статьи считают, что
IL-19 остановил прогрессирование АС, так как только у мышей контрольной группы констатировали увеличение числа макрофагов на 54%. Кроме того, при анализе атеросклеротических поражений сосудов у мышей экспериментальной группы (получавших IL-19) выявили ключевые показатели регрессии АС: уменьшение общего числа макрофагов и увеличение содержания маркеров макрофагов фенотипа M2 (участвуют в иммунных реакциях Th2 типа, стимулируют процессы пролиферации и ангиогенеза). Дополнительные исследования показали, что IL-19 способствует активации основных путей, ведущих к поляризации иммунного ответа в сторону увеличения числа Th2 лимфоцитов и M2 макрофагов: сигнальных белков-активаторов транскрипции (Signal transducer and activator of transcription, STAT3, STAT6), транскрипционного Kruppel 4 подобного фактора (Kruppel-like factor 4) и ядерных рецепторов гамма, активируемых пероксисомными пролифераторами (Peroxisome proliferator-activated receptors gamma PPARγ). Поэтому IL-19 может уменьшать индуцированное цитокинами воспаление in vivo . Таким образом, авторы описали новую роль IL-19 в регулировании липидного метаболизма макрофагов с помощью γ-рецепторной регуляции поглощения холестерина, зависимой от пероксисомных пролифераторов, а также увеличения оттока холестерина, опосредованного АТФ-связы-вающим кассетным транспортером (ATP-binding cassette transporter – ABCA1). Эти факты свидетельствуют о том, что IL-19 может останавливать прогрессирование АС, регулируя как роль макрофагов в воспалении, так и метаболизм липидов макрофагов [14].
Результаты еще одного исследования показали важную роль IL-19 в пролиферации и трансформации VSMC. Именно трансформация VSMC в пенистые клетки приводит к увеличению размера АБ и снижению их стабильности, является ключевым, но недостаточно понимаемым этапом атерогенеза. Авторы статьи установили, что IL-19 индуцирует экспрессию мышечно-специфичной микроРНК (miR133a) в VSMC. По мнению авторов, miR133a может уменьшать экспрессию белкового адаптера рецептора липопротеинов низкой плотности 1 (Low-density lipoprotein receptor adapter protein 1 – LDLRAP1) – адаптерного белка, который необходим для интернализации рецептора липопротеинов низкой плотности (LDL). Таким образом, IL-19 уменьшает накопление липидов в VSMC и поглощение ими окисленных LDL в miR133a-зависимом механизме. Исследователи доказали, что LDLRAP1 экспрессируется в АБ и неоин-тимальном слое VSMC мышей и участках артерий человека, поврежденных атеросклеротическим процессом. Возможность стимуляции экспрессии miR133a в VSMC с помощью IL-19 доказывает неизвестную ранее связь между метаболизмом сосудистых липидов и воспалением и может рассматриваться в качестве новой терапевтической мишени для борьбы с сосудистыми воспалительными заболеваниями [15].
Еще один факт, свидетельствующий о важной роли IL-19 в процессе пролиферации VSMC, описан в работе A. Herman и соавт. [16]. Авторы приводят доказательства того, что противовоспалительный IL-19 снижает функцию мРНК-связывающего белка (mRNA-Stability Protein HuR) в VSMC человека, что, возможно, снижает их способность к пролиферации. При анализе многочисленных современных данных о роли цитокинов в иммунных процессах, связанных с АС, полученных с помощью животных модельных систем, D.P. Ramji и T.S. Davies (2015) отмечают, что IL-19 действительно способствует уменьшению проявлений АС [8].
В настоящее время экспериментально установлены следующие механизмы противоатерогенного действия IL-19: Th2-поляризация иммунного ответа, уменьшение адгезии лейкоцитов, подавление экспрессии генов про-воспалительных цитокинов, снижение неоинтимальной гиперплазии путем уменьшения активации VSMC [17].
Основным продуцентом ИЛ-19 в АБ являются моноциты. Активация Тh0 ведет к поляризации иммунного ответа по Th2- типу за счет продукции ИЛ-4 и ИЛ-10, что в свою очередь приводит к подавлению продукции провос-палительных цитокинов. Также активируются Treg-лимфоциты, супрессирующие иммунный ответ и способству- ющие уменьшению хронического воспаления. Активация транскрипционных факторов и ядерных рецепторов клеток (STAT3, STAT6, Kruppel-like factor 4, PPARγ) приводит к активации макрофагов М2-типа, что способствует повышению ангиогенных цитокинов и усилению ангиогенеза. Кроме того, ИЛ-19 оказывает влияние на гладкомышечные клетки за счет снижения функции мРНК связывающего белка, что ведет к снижению способности VSMC к пролиферации и индукции miR133a, который уменьшает экспрессию LDLRAP1, что снижает неоинтимальную гиперплазию, лежащую в основе формирования АБ [17, 18]. В результате ранее проведенного обзора литературы о функциональном значении ИЛ-19 в воспалительных процессах и атерогене-за, а также на основании полученных результатов была обобщена роль ИЛ-19 в патогенезе АС (рис. 1).
По результатам проведенного исследования можно предположить, как происходит регуляция функций ИЛ-19 в патогенезе АС. На ранних этапах формирования АБ макрофаги продуцируют провоспалительные цитокины, такие как ФНО-альфа, ИФН-гамма и другие, что приводит к развитию воспалительных реакций в стенке сосуда. В то же время повышение продукции провоспалитель-ных цитокинов запускает каскад активации противовоспалительных цитокинов, что приводит к увеличению экспрессии и интерлейкина-19 [19]. ИЛ-19 способствует угнетению воспаления в бляшке за счет активации Т-ре- гуляторных лимфоцитов, Th2-поляризации иммунного ответа и снижения неоинтимальной гиперплазии [20]. Однако при длительном воспалении наблюдается истощение резервов продукции ИЛ-19, что запускает порочный круг при воспалительном процессе в АБ. Но при этом наблюдается повышение продукции ИЛ-19 на системном уровне, что также способствует подавлению воспаления и стабилизации бляшки (рис. 2).
В этом заключается проатерогенный эффект ИЛ-19, который реализуется именно за счет генерализованной продукции.
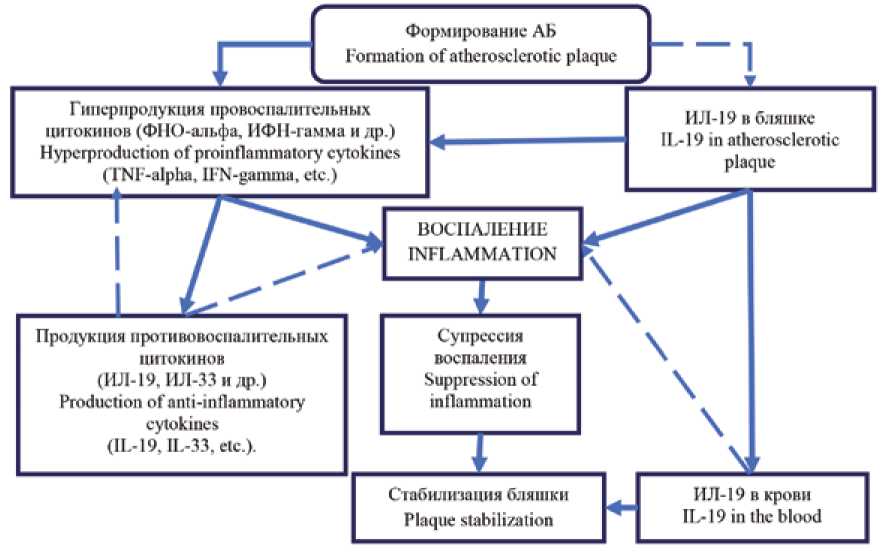
Рис. 2. Регуляция воспалительного процесса в патогенезе развития атеросклероза ИЛ-19 Примечание: сплошные стрелки – активационный сигнал, стрелки пунктиром – ингибирующий сигнал.
Fig. 2. The IL-19-dependent regulation of inflammatory process in the pathogenesis of atherosclerosis Note: the solid arrows are the activation signal; the dotted arrows are the inhibitory signal.
Согласно нашим исследованиям, индуцированная продукция цитокина в АБ находится в положительной взаимосвязи со спонтанной продукцией лейкоцитов крови, т. е. продукции этого цитокина должно быть достаточно для остановки формирования воспаления в АБ, но по каким-то причинам этого не происходит. Вероятно, на одном из этапов патогенеза действие цитокина оказывается неэффективным. Возможными причинами данного явления могут быть следующие: во-первых, нарушение экспрессии рецепторов на клетках-мишенях; во-вторых, подавление активности экспрессии цитокина другими интерлейкинами, например, ИЛ-33, который обладает схожими эффектами с ИЛ-19 по запуску Th2-лимфоцитов. Кроме того, ИЛ-33 снижает активность моноцитов и их адгезии к стенке сосуда, а продуцентами ИЛ-19 как раз являются моноциты; в-третьих, возможно, происходит выработка антагонистов рецепторов ИЛ-19, которая ме- шает цитокинам связываться с рецепторами на клетках, это также может быть обусловлено полиморфизмом генов цитокиновых рецепторов.
Заключение
Таким образом, при снижении резервных возможностей лейкоцитов, входящих в состав АБ, происходит подавление активности ИЛ-19, что приводит к прогрессированию воспаления. Однако за счет компенсаторного повышения экспрессии цитокина на системном уровне механизмы привлечения моноцитов и пролиферации гладкомышечных клеток в стенке сосуда ингибируются, и формируется стабильная бляшка. Полученные результаты свидетельствуют в пользу противоатерогенной роли ИЛ-19 и того, что в АБ сохраняются механизмы отрицательной регуляции воспаления за счет продукции ИЛ-19.
Список литературы Особенности продукции интерлейкина-19 у пациентов с атеросклерозом
- Логаткина А.В., Бондарь С.С., Аржников В.В., Терехов И.В. Продукция цитокинов, растворимых форм костимуляторных молекул и окиси азота у пациентов с ишемической болезнью сердца на фоне низкоинтенсивной микроволновой терапии. Вестник новых медицинских технологий. 2016;(1):82-92. DOI: 10.12737/18560.
- Синеглазова А.В., Мезенцева Е.А., Никушкина К.В. Ведущие провос-палительные цитокины и атеросклероз при ревматоидном артрите у женщин. Российский иммунологический журнал. 2015;9(2):105-109.
- Хадарцев А.А., Логаткина А.В., Терехов И.В., Бондарь С.С., Бондарь Н.В. Влияние ингибитора ангиотензинпревращающего фермента на концентрацию в плазме крови цитокинов и вазоактивных молекул у больных ишемической болезнью сердца и артериальной гипертонией. Терапевтический архив. 2017;89(12):97-102. DOI: 10.17116/terarkh2017891297-102.
- Anuradha R., Munisankar S., Dolla C., Kumaran P., Nutman T.B., Babu S. Modulation of CD4(+) and CD8(+) T-cell function by inter-leukin 19 and interleukin 24 during filarial infections. J. Infect. Dis. 2016;213(5):811-815. DOI: 10.1093/infdis/jiv497.
- Auguet T., Aragones G., Guiu-Jurado E., Berlanga A., Curriu M., Martinez S. et al. Adipo/cytokines in atherosclerotic secretomes: increased visfatin levels in unstable carotid plaque. BMC Cardiovasc. Disord. 2016;16(1):149. DOI: 10.1186/s12872-016-0320-5.
- Bobryshev Y.V., Ivanova E.A., Chistiakov D.A., Nikiforov N.G., Orekhov A.N. Macrophages and their role in atherosclerosis: Pathophysiology and transcriptome analysis. BiomedRes. Int. 2016;2016:9582430. DOI: 10.1155/2016/9582430.
- Bruns D.R., Ghincea A.R., Ghincea C.V., Azuma Y.-T., Watson P.A., Autieri M.V. et al. Interleukin-19 is cardioprotective in dominant negative cyclic adenosine monophosphate response-element binding protein-mediated heart failure in a sex-specific manner. World J. Cardiol. 2017;9(8):673-684. DOI: 10.4330/wjc.v9.i8.673.
- Ramji D.P., Davies T.S. Cytokine s in atherosclerosis: Key players in all stages of disease and promising therapeutic targets. Cytokine Growth Factor Rev. 2015;26(6):673-685. DOI: 10.1016/j.cytogfr.2015.04.003.
- Fatkhullina A.R., Peshkova I.O., Koltsova E.K. The role of cytokines in the development of atherosclerosis. Biochemistry (Mosc.). 2016;81(11):1358-1370. DOI: 10.1134/s0006297916110134.
- Fujimoto Y., Azuma Y.-T., Matsuo Y., Kuwamura M., Kuramoto N., Miki M. et al. Interleukin-19 contributes as a protective factor in experimental Th2-mediated colitis. Naunyn Schmiedebergs Arch. Pharmacol. 2017;390(3):261-268. DOI: 10.1007/s00210-016-1329-0.
- Gabunia K., Ellison S., Kelemen S., Kako F., Cornwell W.D., Rogers T.J. et al. IL-19 halts progression of atherosclerotic plaque, polarizes, and increases cholesterol uptake and efflux in macrophages. Am. J. Pathol. 2016;186(5):1361-1374. DOI: 10.1016/j.ajpath.2015.12.023.
- Gabunia K., Herman A.B., Ray M., Kelemen S.E., England R.N., Cadena R.D. et al. Induction of MiR133a expression by IL-19 targets LDLRAPI and reduces oxLDL uptake in VSMC. J. Mol. Cell. Cardiol. 2017;(105):38-48. DOI: 10.1016/j.yjmcc.2017.02.005.
- Herman A., Haines D., Autieril M.V. The anti-inflammatory cytokine IL-19 reduces mRNA-stability protein HuR function in human vascular smooth muscle cells. FASEB J. 2016;30(S1):1209.11. DOI: 10.1096/ fasebj.30.1_supplement.1209.11.
- Kako F., Gabunia K., Ray M., Kelemen S.E., England R.N., Kako B. et al. Interleukin-19 induces angiogenesis in the absence of hypoxia by direct and indirect immune mechanisms. Am. J. Physiol. Cell Physiol. 2016;310(11):C931-C941. DOI: 10.1152/ajpcell.00006.2016.
- Li L., Yu Zh.-Q., Hu J.-Y., Xu J.Y., Liu F., Zhao G.C. et al. Association between interleukin-19 and angiopoietin-2 with vascular complications in type 2 diabetes. J. Diabetes Investig. 2016;7(6):895-900. DOI: 10.1111/ jdi.12519.
- Min X., Lu M., Tu S., Wang X., Zhou C., Wang S. et al. Serum cytokine profile in relation to the severity of coronary artery disease. Biomed Res. Int. 2017;2017:4013685. DOI: 10.1155/2017/4013685.
- Дутова С.В., Саранчина Ю.В., Килина О.Ю., Ханарин Н.В., Кулакова Т.С., Евельсон Ю.А. Интерлейкин 19: роль в атерогенезе и воспалительных процессах, перспективы использования (обзор литературы). Вестник новых медицинских технологий. 2019;26(3):68-74. DOI: 10.24411/1609-2163-2019-16311.
- SteinertA., Linas I., Kaya B., Ibrahim M., Schlitzer A., Hruz P. et al. The stimulation of macrophages with TLR ligands supports increased IL-19 expression in inflammatory bowel disease patients and in colitis models. J. Immunol. 2017;199(7):2570-2584. DOI: 10.4049/jimmunol.1700350.
- Xie W., Fang L., Gan S., Xuan H. Interleukin-19 alleviates brain injury by anti-inflammatory effects in a mice model of focal cerebral ischemia. Brain Res. 2016;1650:172-177. DOI: 10.1016/j.brainres.2016.09.006.
- Yan W., Song Y., Zhou L., Jiang J., Yang F., Duan Q. et al. Immune cell repertoire and their mediators in patients with acute myocardial infarction or stable angina pectoris. Int. J. Med. Sci. 2017;14(2):181-190. DOI: 10.7150/ijms.17119.


