Особенности раневого процесса при травме сердца в случаях проникающих колото-резаных ранениях груди
Автор: Новоселов Владимир Павлович, Савченко Сергей Владимирович, Грицингер Валентина Александровна, Чикинев Юрий Владимирович, Надеев Александр Петрович, Агеева Татьяна Августовна, Старостин Сергей Александрович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Морфология и патоморфология
Статья в выпуске: 2 т.18, 2014 года.
Бесплатный доступ
Представлены данные о раневом процессе, патоморфологических изменениях миокарда и развитии клеточной реакции, возникающих при колото-резаных ранениях сердца, развивающихся в различных зонах раневого канала, в различные временные промежутки от момента травмы. Исследование проводили с использованием световой и поляризационной микроскопии.
Повреждение миокарда, зоны раневого канала, давность повреждений
Короткий адрес: https://sciup.org/142140603
IDR: 142140603 | УДК: 616
Текст научной статьи Особенности раневого процесса при травме сердца в случаях проникающих колото-резаных ранениях груди
В настоящее время отсутствуют конкретные рекомендации по оценке патомор-фологических изменений миокарда при проникающих ранениях груди с повреждением сердца [1–3]. Такая ситуация негативно влияет на оценку давности воспалительного процесса в зоне поврежденных тканей и может привести к неправильной трактовке полученных данных. Поэтому вопрос о прижизненности и давности образования повреждений остается актуальным и требует глубокого изучения и выявления пато-морфологических критериев, в том числе и для различных периодов течения раневого процесса.
Раневой процесс – многофакторный комплекс гомеостатических реакций организма, развивающихся в ответ на повреждение тканей и направленных на их регенерацию [4–6]. С позиций общей патологии, раневой процесс представлен воспалением, обусловленным альтеративным воздействием, при этом важными условиями его развития являются не только общие реакции организма, но и органоспецифические изменения, связанные с регенеративной репарацией конкретного органа [7, 8].
При различных механических повреждениях органов груди наиболее часто травмируется сердце [9, 10]; такая травма имеет особенности регенеративной репарации [3, 10]. Это следует учитывать при экспертной оценке патоморфологических изменений травмированного миокарда с целью установления прижизненности и давности образования повреждения органа [11, 12]. Оценивать морфологические изменения травмированных тканей необходимо с учетом современных данных об альтерации, острых дистрофических и некробиотических изменениях, а также возникающих нарушениях крово- и лимфообращения в зоне травмы и развития воспаления [5, 8, 13–16].
Цель исследования – оценка раневого процесса при травме сердца в случаях проникающих колото-резаных ранениях груди. В процессе исследования проведен сравнительный морфологический анализ миокарда при травме сердца колюще-режущими орудиями, при этом оценены патоморфо-логические изменения миокарда в участках раневого канала, проходящего в сердце, в различные сроки посттравматического периода, а также в местах оперативного вмешательства в миокарде.
Материал и методы
Материал для микроскопического исследования был получен от 134 трупов лиц обоих полов, в возрасте от 18 до 82 лет (в среднем 45,0±14,5 года), поступивших в танатологический отдел ГБУЗ «Новосибирское областное клиническое бюро судебно-медицинской экспертизы» в 2007–2012 гг. Микроскопическое исследование проводили на микроскопе Carl Zeiss Axio Scope A.1 с видеокамерой Axio Cam ICc 3 с разрешением 3.5 Мп, а также Leica DM 1000, с видеокамерой Leica EC3, укомплектованном анализатором и поляризатором [17].
Все исследованные случаи разделены на 7 групп в соответствии со следующими
Альтеративные повреждения кардиомиоцитов, * р<0,05 различия при 95% уровне значимости
В качестве одной из контрольных групп для сравнения патоморфологических изменений кардиомиоцитов при колото-резаных ранениях сердца и хирургических манипуляциях на сердце использованы участки миокарда из областей хирургических разрезов при оперативных вмешательствах на сердце. Всего 6 случаев, средний возраст погибших составил 46,4±21,7 года.
Результаты выявленных патоморфологических изменений были подвергнуты математической обработке с вычислением статистических показателей. М – средняя арифметическая величина, σ – среднеквадратическое отклонение. М±σ, m – средняя ошибка средней величины, t – критерий Стьюдента. Значимыми считали различия при р<0,05 [18].
Результаты и обсуждение
При оценке выявленных патоморфологических изменений миокарда в раневом канале были выделены две зоны (рис. 1): 1) краевая, или концевая, зона раневого канала, образованная участками миокарда – стенками раневого канала; 2) прикраевая зона раневого канала – участок миокарда, располагавшийся по окружности краевой зоны. Кроме того, патоморфологические изменения исследовали в просвете раневого канала, а также в участках миокарда, расположенных вне раневого канала, но прилежащих к нему.
В исследуемых наблюдениях травмы сердца фазы альтерации при проникающих колото-резаных ранениях груди характеризовались появлением в просвете раневого канала первичных, т. е. образовавшихся в результате механического воздействия клинком орудия кровоизлияний, а также фрагментов поврежденных кардиомиоцитов, травмированных стенок мелких сосудов, интрамуральных волокон соединительной ткани и инородных микрочастиц (загрязнений). Кроме того, при травматизации сердца пересекались мышечные волокна миокарда, что сопровождалось их пересокращением сразу же после рассечения. В связи с этим можно было наблюдать появление в области краевой зоны деформированных кардиомиоцитов в виде трапециевидных участков расширения с основанием, расположенным в просвет раневого канала.
При сравнительном анализе кардиомиоцитов из области колото-резаных ранений сердца и фрагментов миокарда из операционных ран выявлено: травмированные кардиомиоциты при колото-резаных ранениях имеют большую площадь некроза, чем при оперативных вмешательствах, большее количество кардиомиоцитов с острыми альтеративными повреждениями. Это, по-видимому, можно объяснить нанесением хирургических разрезов с использованием принципов асептики и антисептики, антибактериальной послеоперационной терапии, адекватной инфузионной терапии в условиях стресса организма, а также проведением оперативных вмешательств с использованием различных методов гипотермии. Всё это, вероятно, является «щадящими» условиями для кардиомиоцитов [16] ( таблица ).
Фаза альтерации протекала в течение первых 30 минут, после чего она сменялась на экссудативную, которая была отмечена у лиц первой исследуемой группы, со временем наступления смерти до 30 мин. Фаза экссудации характеризовалась развитием сосудистых и клеточных реакций. В развитии нарушений сосудистого русла при раневом процессе важное значение имеет совместное действие вазоактивных веществ, появляющихся в очаге поражения, таких как ацетилхолин, гистамин, серотонин, брадикинин и некоторых других [5]. Сосудистая реакция характеризуется появлением вазоконстрикции с последующим развитием вазодилатации, при этом отмечено характерное замедление кровотока, нарушение реологических свойств крови, увеличение проницаемости сосудов, что способствует краевому стоянию с последующей миграцией клеток за пределы сосудистого русла и образованием воспалительного экссудата.
Некоторое увеличение кровотока при спазме и его замедление при парезе сосудов вызывало застойные явления в кровеносных и лимфатических сосудах [5, 13]. Кроме того, в результате замедления кровотока отмечен выход жидкой части крови за пределы сосудистой стенки (экс-травазация жидкости). В период от 30 мин до 1 ч с момента травмы сердца в исследуемых нами случаях при микроскопии срезов миокарда выявляли сосуды с гомогенизированной, эозинофильно окрашенной стенкой, набухшим эндотелием. Это было связано с плазматическим пропитыванием сосудистой стенки и развитием отека сосудов и стромы в краевой и прикраевой зонах раневого канала.
Первые тромбы можно было обнаружить практически в первые минуты после травмы непосредственно в поврежденных сосудах краевой зоны раневого канала.
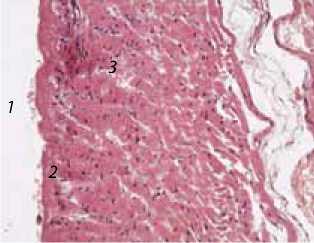
Рис. 1. Раневой канал: 1 – просвет раневого канала, 2 – краевая зона, 3 – прикраевая. Окраска гематоксилином и эозином. Ув. × 200.
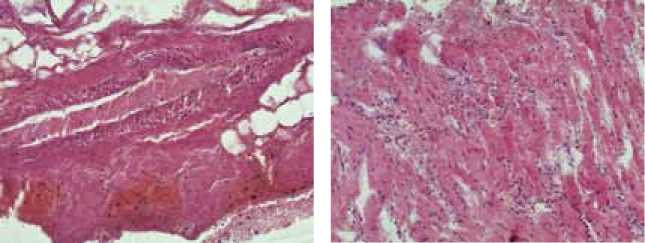
Рис. 2. Миграция нейтрофильных лейкоцитов за пределы сосудистого русла. Окраска гематоксилином и эозином. Ув. × 200.
Рис. 3. Кровоизлияния и лейкоцитарная инфильтрация в межмышечных пространствах миокарда краевой и прикраевой зон раневого канала. Ув. × 200.
Наряду с этим возникли острые расстройства кровообращения в виде стазов. В связи с различной плотностью эритроцитов и нейтрофильных лейкоцитов выпадение последних из осевого кровотока и прилипание к сосудистой стенке вызывало феномен краевого стояния нейтрофильных лейкоцитов с последующей миграцией клеток за пределы сосудистого русла и в более поздние сроки образованием воспалительного экссудата (рис. 2).
По мере развития воспаления воздействие его медиаторов на сосудистую стенку вызывало набухание эндо-телиоцитов, за счет чего они выступали в просвет сосуда. Это сопровождалось еще большим снижением кровотока и повышением проницаемости сосудистой стенки, а также альтеративным повреждением кардиомиоцитов [5, 16]. Клеточная реакция при раневом процессе характеризуется выраженной ферментативной активностью моноцитов, гистиоцитов, макрофагов, гигантских клеток, полиморфноядерных лейкоцитов, а также усилением активности ферментов гидролаз, окислительно-восстановительных их ферментов в фибробластах и полиморфноядерных лейкоцитах [8]. Основным источником медиаторов воспаления служат лаброциты, тромбоциты, базофилы, нейтрофилы, макрофаги, лимфоциты, которые имеют существенное значение для нормальных функций организма и в значительной степени определяют гомеостатические механизмы внутренней среды [5, 8].
Спустя 30–40 мин после травмы в сосудах травмированного миокарда краевой и прикраевой зон можно было наблюдать пристеночно расположенные нейтрофильные лейкоциты; часть нейтрофилов постепенно мигрировала через сосудистую стенку за пределы сосудистого русла – периваскулярно. К концу первого часа их количество постепенно увеличивалось, в некоторых полях зрения пери-васкулярно можно было обнаружить единичные, хорошо различимые нейтрофильные лейкоциты, мигрировавшие из сосудистого русла в периваскулярное пространство.
В период времени от 3 до 6 ч при микроскопии отмечали увеличение числа нейтрофильных лейкоцитов, распо- ложенных периваскулярно. Кроме того, наблюдали их постепенное распространение, что характерно для перехода от очаговой клеточной реакции к диффузной инфильтрации в краевой и прикраевой зонах раневого канала.
Нейтрофильные лейкоциты были диффузно расположены в кровоизлияниях, находящихся в просвете раневого канала к концу четвертого временного интервала (от 3 до 6 ч). В краевой и прикраевой зонах раневого канала нейтрофильными лейкоцитами были инфильтрированы межмышечные и межпучковые пространства (рис. 3). Максимально большое скопление нейтрофилов можно было увидеть в дистальных участках трапециевидно расширенных кардиомиоцитов, обращенных в просвет раневого канала. В некоторых полях зрения, в различных зонах раневого канала, в кровоизлияниях можно было обнаружить рыхлые массы фибрина и мелкие очаги распадающихся нейтрофильных лейкоцитов [13].
При микроскопии в период времени от 6 до 12 ч после травмы в краевой и прикраевой зонах раневого канала отчетливо просматривалось формирование лейкоцитарного вала, отграничивающего область раневого канала от интактных участков миокарда. При оценке диффузной лейкоцитарной инфильтрации наблюдали большое количество распадающихся нейтрофильных лейкоцитов в виде базофильной пыли. В кровоизлияниях просвета раневого канала, краевой и прикраевой зонах преобладали эритроциты с бледной, выщелоченной цитоплазмой. К концу этого периода в кровоизлияниях можно было обнаружить единичные макрофаги.
Считается, что лимфоциты начинают эмигрировать за пределы сосудистого русла позже других лейкоцитов. Тканевые макрофаги относятся к долгоживущим клеткам, и их участие в воспалении, а именно в фагоцитозе, многогранно. Наиболее вероятно, в ходе всего периода воспаления с учетом морфофункциональных особенностей макрофаг может менять спектр вырабатываемых медиаторов, участвующих в воспалении таким образом, что начинает влиять не только на ход альтерации и экссудации, но и на пролиферативно-репаративные процессы в очаге воспаления [5, 8].
Итак, патоморфологические изменения при колоторезаных ранения груди с повреждением сердца можно разделить не несколько периодов: первый период охватывал ранние реактивные изменения, возникающие в срок от нескольких минут до конца первого часа с момента получения травмы, и соответствовал фазе альтерации. Второй период (развитие клеточной реакции) – в промежуток времени от нескольких минут до 3 ч с момента получения травмы наблюдали последовательную смену фазы альтерации на экссудативную. К концу первых суток в поврежденном органе активно развивалась клеточная реакция, а в кардиомиоцитах формировались различной степени выраженности острые альтеративные повреждения, представленные контрактурными повреждениями, миоцитолизисом и глыбчатым распадом миофибрилл, увеличивалась зона некроза в раневом канале. В период времени после первых до третьих суток посттравматического периода – начало резорбции в очаге, завершение экссудации, начало пролиферации с последующим формированием заместительного кардиосклероза в очаге бывшего повреждения. Проведенным морфологическим исследованием установлено, что острые альтеративные изменения кардиомиоцитов представляют неспецифическую морфологическую реакцию миокарда на травму вне зависимости от этиологии повреждающего воздействия.
Полученные в результате проведенного исследования данные позволяют заключить, что воспалительные изменения в раневом канале сердца при травме колющережущими орудиями зависят от продолжительности посттравматического периода и характеризуются в срок: а) до 30 мин – пристеночным расположением нейтрофильных лейкоцитов; б) от 30 мин до 1 ч – началом выхода нейтрофильных лейкоцитов за пределы сосудистого русла; в) от 1 до 3 ч – развитием очаговой лейкоцитарной реакции; г) от 3 до 6 ч – переходом лейкоцитарной реакции от очаговой к диффузной; д) от 6 до 12 ч – обнаружением первых макрофагов в кровоизлияниях; е) от 12 до 24 ч – полиморфноклеточной реакцией с выраженным демаркационным валом; ж) от первых до третьих суток – макрофагально-гистиоци-тарной реакцией и началом резорбции в очаге.


