Особенности развития амнезии после нарушения реконсолидации памяти антагонистом АМРА рецепторов глутамата
Автор: Никитин В.П.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Эксперимент
Статья в выпуске: 1 (72) т.14, 2018 года.
Бесплатный доступ
На виноградных улитках исследовали особенности развития амнезии после нарушения реконсолидации памяти антагонистом АМРА ((+)-a-amino-3-hydroxy-5-methylisoxazole-4-propionic acid hydrate) рецепторов глутамата DNQX (6,7-Dinitroquinoxaline-2,3(1H,4H)-dione). Сочетанные предъявления банана (условного стимула) с электрошоком приводили к увеличению латентных периодов консуматорных реакций с 20-35 с до 100-120 с (критерий обученности). Через 2 дня после обучения животным инъецировали DNQX и индуцировали реконсолидацию памяти (предъявляли напоминающие условные стимулы). Тестирование улиток спустя 1 и 10 дней выявило развитие амнезии: латентные периоды реакций на условный стимул (20-40 с) не отличались от таковых на дифференцировочный стимул (вареная морковь; p>0,1). Повторное обучение через 10 дней после индукции амнезии не приводило к формированию долговременной памяти, несмотря на то, что число сочетаний условного и подкрепляющего стимулов было большим, чем при первоначальном обучении. Вместе с тем при повторном обучении выявлено формирование кратковременной памяти. Предположено, что нарушение реконсолидации памяти условной пищевой аверсии антагонистом АМРА рецепторов глутамата вызывает формирование специфической антероградной амнезии, в основе которой лежат избирательные, зависимые от процессов транскрипции изменения пластичности синаптических связей нейронов.
Реконсолидация памяти, амнезия, нейротрансмиттеры, рецепторы глутамата, виноградная улитка
Короткий адрес: https://sciup.org/140225909
IDR: 140225909 | УДК: 576.32
Текст научной статьи Особенности развития амнезии после нарушения реконсолидации памяти антагонистом АМРА рецепторов глутамата
Согласно современным представлениям, консолидированная долговременная память через различные сроки после обучения может вновь трансформироваться в лабильное состояние (дестабилизироваться) при воспроизведении памяти и затем повторно консолидироваться (реконсолидировать-ся) [12, 20]. Обнаружено, что нарушение реконсолидации памяти амнестическими агентами, в том числе антагонистами рецепторов нейротрансмиттеров, вызывало развитие амнезии. Особое внимание среди нейротрансмиттеров вызывают глутаматер-гические системы, которые вовлечены в механизмы реконсолидации пищедобывательных навыков, пассивного избегания, пространственной памяти и др. [11, 18].
Ранее, в исследованиях, проведенных на виноградных улитках, мы изучили механизмы реконсолидации долговременной ассоциативной памяти отвергания определенного вида пищи. Обнаружено, что предъявление животным условных пищевых стимулов (напоминание), сочетанное с инъекциями антагонистов NMDA рецепторов глутамата, рецепторов серотонина или ингибиторов синтеза белка через два дня после обучения приводили к индукции амнезии, а также подавлению облегчения ответов интернейронов оборонительного поведения на условный стимул, характерного для условной пищевой аверсии [2, 4, 16, 17]. Действие указанных веществ без сочетания с напоминанием влияния на воспроизведение памяти не оказывало. Установлено, что NMDA рецепторы глутамата тесно взаимодействуют в синаптических контактах в процессе регуляции их пластических перестроек, вовлекаемых в механизмы обучения и памяти [10].
В настоящей работе, используя специфический антагонист АМРА рецепторов глутамата, исследо- вано участие этих рецепторов в механизмах реконсолидации памяти условной пищевой аверсии у виноградной улитки, а также в механизмах развития амнезии, вызванной нарушением процессов реконсолидации.
Методика исследования.
У виноградных улиток ( Helix lucorum ) вырабатывали условную пищевую аверсию по ранее описанной методике [17]. За 3 дня до обучения и перед тестированием сохранности навыка животных лишали пищи. Улиток фиксировали за раковину таким образом, что они могли относительно «свободно» перемешаться по пластиковому шару, плавающему в воде. В качестве условного стимула (УС) использовали банан, а дифференцировочного стимула (ДС) – вареную морковь. В момент первых консумматорных реакций через пищу и тело улитки пропускали электрический ток (50 Гц, 300 мс, 1,2 мА). Пищу животным предъявляли в течение 120 с. Сочетанные предъявления пищи и электрического тока осуществляли через каждые 15-20 мин. Проводили три сеанса обучения улиток - ежедневно, в течение 3-х дней. УС предъявляли 12 раз, ДС – 8 раз.
Через 2 дня после обучения улиткам вводили растворы веществ и проводили процедуру напоминания: животных помещали в обстановку обучения (на пластиковые шары) [2, 3], предъявляли 3 раза УС с интервалом 10-15 мин. Регистрировали латентные периоды консумматорных реакций в течение 120 с. Если животные пытались поедать пищу, ее убирали, без применения подкрепляющего стимула. Ответы на пищевые стимулы тестировали за 1 ч до обучения (тест 1), через 1 день после обучения (тест 2), а также через 1 (тест 3) и 10 (тест 4) дней после индукции амнезии. При тестировании улиток помещали в обстановку обучения на 30 мин, предъявляли УС и ДС с интервалом 15 мин и в течение 120 с измеряли латентные периоды консумматор-ных реакций. При попытках поедать пищу, тестирование прекращали без применения электрошока. Через 10 дней после действия веществ/напоминания спустя 1 ч после тестирования у улиток повторно вырабатывали навык отвергания банана. Навык тестировали через 24 ч после повторного обучения (тест 5).
Исследовали эффекты антагониста АМРА ((+)-a-amino-3-hydroxy-5-methylisoxazole-4-propionic acid hydrate)/каинатных рецепторов глутамата DNQX (6,7-Dinitroquinoxaline-2,3(1H,4H)-dione) («Sigma»). DNQX предварительно растворяли в DMSO, а затем разводили в физиологическом растворе (объем раствора вводимого в улитку составил 0,25 мл, конечное содержание DMSO составило 0,5%). Доза составила 12 мг/кг веса. В указанной дозе DNQX эффективно влиял на процессы обучения у моллюсков
-
[3] . Контрольным улиткам через 2 дня после обучения, перед напоминанием инъецировали раствор DMSO.
Данные усредняли, вычисляли стандартную ошибку средней (±SEM). Для сравнения ЛП реакций двух групп животных использовали непараметрический критерий Манн-Уитни, для сравнения ЛП, полученных у улиток одной и той же группы, применяли критерий Вилкоксона.
Результаты исследования.
У необученных улиток латентные периоды консумматорных реакций на предъявление банана и вареной моркови составляли, в среднем, 20-30 с (тест 1). При тестировании улиток всех исследованных групп через 1 день после обучения латентные периоды консумматорных реакций на предъявление УС достигали 100-120 с и были больше, чем латентные периоды ответов на ДС ( p <0,01), а также исходных реакций на предъявление банана перед обучением ( p <0,01).
Изолированные инъекции DNQX или инъекции DNQX после напоминания.
Через 2 дня после обучения улиткам инъецировали DMSO (n=8) или DNQX (n=8) без последующей процедуры напоминания (рис. 1). Третьей группе животных вводили DNQX (n=7) через 2 ч после напоминания. Тестирование через 1 и 10 дней после действия веществ показало (рис. 1), что латентные периоды реакций на УС составляли 100120 с не отличались у всех трех групп животных ( p> 0.5) и были больше латентных периодов реакций на ДС (20-35 с; p<0.01), а также реакций на предъявления банана перед обучением (p<0.01). Таким образом, изолированное назначение DNQX или его инъекции после напоминания не вызывали нарушения воспроизведения памяти.
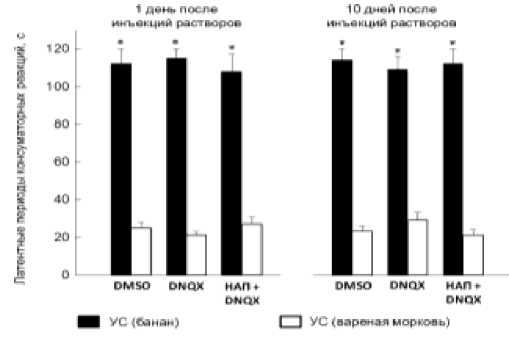
Рис. 1. Воспроизведение памяти условной пищевой аверсии у улиток после изолированных инъекций антагониста АМРА рецепторов глутамата DNQX, а также его инъекций после напоминания. Через 2 дня после обучения улиткам инъецировали DNQX (n=8) или DMSO (n=8) без последующего предъявления напоминания либо вводили DNQX (n=7) через 3 ч после напоминания. УС - условный стимул (банан); ДС – дифференцировочный стимул (вареная морковь). По оси ординат – латентные периоды консуматорных реакций в сек. * -p<0,01 (УС по отношению к ДС). У всех трех групп исследованных животных не выявлено изменений воспроизведения памяти.
Инъекции DNQX перед напоминанием.
Через 2 дня после обучения улиткам инъецировали раствор DMSO (n=8) или DNQX (n=8) и проводили процедуру напоминания. Тестирование через 1 и 10 дней после назначения ве-ществ/напоминания показало (рис. 2), что латентные периоды консумматорных реакций на УС у улиток, получавших DNQX/напоминание, были меньше таковых у контрольных животных (DMSO/напоминание; p<0.001) и не отличались от латентных периодов ответов на ДС (p>0,5), а также реакций на предъявление банана перед обучением (p>0,4). Таким образом, назначение DNQX перед напоминанием приводило к развитию амнезии, сохранявшейся более 10 дней.
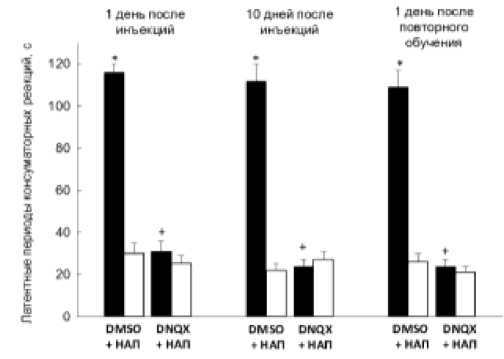
Рис. 2. Эффекты DNQX при его инъекциях перед напоминанием. Через 2 дня после обучения улиткам вводили DMSO (n=8) или DNQX (n=8) и предъявляли напоминание. Через 10 дней после индукции амнезии (DNQX/напоминание) улиток повторно обучали отверганию банана. + - p>0.05 (УС улиток, получавших DNQX/напоминание по отношению УС у животных, получавших DMSO/напоминание. Остальные обозначения как на рис. 1. У улиток получавших DNQX / напоминание повторное обучение не приводило к формированию долговременной памяти.
Через 10 дней после индукции амнезии у улиток проводили повторное обучение отвергания банана. Обнаружено, что три дня повторного обуче- ния не вызывало формирования долговременной памяти: тестирование через 1 день после повторного обучения показало (рис. 2, тест 5), что латентные периоды реакций на УС были меньше таковых у контрольных улиток (p<0,001) и не отличались от латентных периодов реакций на предъявление ДС (p>0,3), а также реакций на предъявление банана перед обучением (p>0,1). При повторном обучении число сочетаний условного и подкрепляющего стимулов было большим, чем при исходном обучении: 10,2±0,8 и 6,8±0,5, соответственно (p=0,01).
Важно отметить, что у животных сохранялась способность к формированию кратковременной памяти. В частности, в течение каждого из трех дней повторного обучения латентные периоды ответов на УС увеличивались и были больше, чем таковые в ответах на ДС (р<0,05). Однако при предъявлении УС на каждый следующий день обучения латентные периоды реакций на УС и ДС не отличались (p>0,05).
Таким образом, через 10 дней после индукции амнезии повторное обучение животных приводило к формированию кратковременной памяти, которая, однако, не трансформировалась в долговременную память.
Обсуждение.
В настоящей работе обнаружено, что назначение антагониста АМРА рецепторов глутамата (DNQX) сочетанные с напоминанием УС через 2 дня после обучения условной пищевой аверсии у улиток приводило к развитию амнезии, которая сохранялась не менее 10 дней. Память не восстанавливалась спонтанно. Изолированные инъекции DNQX (без последующего напоминания) или инъекции DNQX после напоминания не оказывали влияния на память. Повторное обучение через 10 дней после индукции амнезии не приводило к формированию долговременной памяти, не смотря на то, что число сочетанных раздражений условного и подкрепляющего стимулов было большим, чем при исходном обучении.
Амнезия, устойчивая к повторному обучению условной пищевой аверсии у улиток, обнаружена также при нарушении реконсолидации памяти антагонистами NMDA рецепторов глутамата и ингибиторами синтеза белка [4, 16, 17]. Кроме того, стойкое нарушение памяти условной пищевой аверсии выявлено нами при действии амнестических агентов и использовании в качестве напоминающих УС разных видов пищи: банана, сырой моркови, яблока [2].
Важно отметить, что стойкая амнезия характерна для разных форм памяти и видов животных. В частности, амнезия, устойчивая к повторному обучению, обнаружена у крыс после нарушения реконсолидации памяти условной запаховой авер- сии [5] или реконсолидации пространственной памяти в водном лабиринте Морриса [19]. Нарушение обучения пассивному избеганию у цыплят так же индуцировало амнезию, при которой повторное обучение не приводило к восстановлению навыка [6].
Вместе с тем, очевидно, что необходимы дальнейшие исследования с целью выявления определенных (пограничных) условий возникновения устойчивой амнезии у разных видов животных и с использованием различных форм обучения.
Механизмы специфического нарушения консолидации долговременной памяти остаются не ясными. Стойкая NMDA-зависимая амнезия не может быть объяснена нарушением воспроизведения или стирания «следа» памяти, а также процессами уга-шения. В этих случаях следовало бы ожидать восстановления памяти или формирования новой памяти при повторном обучении. Одной из причин развития устойчивой амнезии может быть «разрушение» морфологических «носителей» энграммы, например, вследствие гибели нейронов или элиминации синаптических связей, функционально необходимых для поддержания следа памяти [8, 9]. Однако ранее [17] и в настоящей работе обнаружено, что во время стойкой амнезии у улиток сохранялась способность формирования кратковременной памяти и, следовательно, сохранялась структурная основа для ее формирования. В исследованиях на моллюсках и млекопитающих показано, что молекулярные механизмы кратковременной и долговременной синаптической пластичности, лежащей в основе памяти, локализуются в одних и тех же нервных клетках, хотя и существенно различаются [8, 13]. Показано также, что при нарушении памяти или долговременного синаптического облегчения происходит уменьшение числа синаптических контактов между нейронами до уровня, зарегистрированного до обучения (базового уровня) [8, 13]. Ранее нами обнаружено, что обучение условной пищевой аверсии у улитки коррелирует с облегчением ответов интернейронов оборонительного повеления ЛПл1 и ППл1 плевральных ганглиев ЦНС на условный стимул, а развитие амнезии после нарушения реконсолидации памяти, с подавлением этого облегчения [2]. В целом эти данные позволяют предположить, что в процессе развития стойкой амнезии, выявленной в наших опытах, происходило уменьшение числа синаптических связей между нейронами, но какая-то «базовая» часть синапсов сохранялась и являлась основой для формирования и воспроизведения кратковременной памяти, которая, не трансформировалась в долговременную память.
Возможными механизмами стабильной амнезии может быть устойчивое изменение транскрипции генов, вовлеченных в долговременную регуляцию синаптической пластичности [7, 9, 13]. В качестве долговременных регуляторов синаптической пластичности все большее внимание привлекают эпигенетические механизмы, например, такие как метилирование ДНК, которое имеет несколько адаптивных преимуществ для хранения информации: его эффекты длительны, зависимы от активности и весьма специфичны [1, 7]. Ранее нами было показано, что процессы метилирования ДНК могут быть одним из механизмов развития амнезии, индуцируемой нарушением памяти условной пищевой аверсии у улиток [15]. Идентифицированы также другие факторы регуляции транскрипции, которые вносят вклад в долговременные синаптические изменения при различных формах обучения и у разных видов животных [7, 12]. Однако, недостаток экспериментальных данных не позволяет определить конкретную роль какого-либо из упомянутых процессов в механизмах стойкой амнезии.
Каково биологическое значение стойкой амнезии, может ли она быть полезной адаптивной реакцией мозга по отношению к определенным нега-тивнным раздражителям? Или такой вид амнезии является следствием патологических процессов в нервной системе в результате различных ее нарушений или заболеваний? Прямых ответов на эти вопросы нет. Среди возможных аналогов стойкой амнезии обращает на себя внимание феномен антероградной амнезии, которую определяют, как неспособность сформировать новую память о фактах и событиях, произошедших после начала амнезии [14]. Для антероградной амнезии (так же как для стойкой амнезии) характерна возможность формирования кратковременной, но не долговременной памяти. Антероградная амнезия выявлена при синдроме Корсакова, алкогольной интоксикации, действии бензодиазепинов, медленной фазе сна [14]. Принципиальным отличием описанной нами стойкой амнезии от «классической» антероградной амнезии является то, что последняя неспецифична по отношению к определенной памяти. Тем не менее, не исключено, что, по крайней мере, от части, механизмы антероградной амнезии родственны механизмам стойкой амнезии.
Список литературы Особенности развития амнезии после нарушения реконсолидации памяти антагонистом АМРА рецепторов глутамата
- Гринкевич Л.Н. Эпигенетика и формирование долговременной памяти//Росс. Физиол. Журн. им. И.М. Сеченова. -2012. -Т. 98, № 5. -С. 553-574.
- Козырев С.А., Никитин В.П. Нейронные механизмы реактивации ассоциативного аверсивного навыка на пищу у виноградной улитки//Росс. физиол. журн. им. И.М. Сеченова. -2009. -Т. 95, № 6. -С. 652-662.
- Солнцева С.В., Никитин В.П. Синтез белков необходим для индукции амнезии, возникающей при нарушении реконсолидации долговременной памяти//Росс. физиол. журн. им. И.М. Сеченова. -2010. -Т. 96, № 3. -С. 247-258.
- Солнцева С.А., Никитин В.П., Козырев С.А. Ингибирование синтеза белка во время реактивации ассоциативной памяти у виноградной улитки вызывает транзиторную или необратимую амнезию//Росс. физиол. журн. им. И.М. Сеченова. -2006. -Т. 92, № 9. -С. 1058-1068.
- Сторожева З.И., Солнцева С.В., Никитин В.П. Необратимая амнезия у крысы и виноградной улитки при нарушении реактивации ассоциативной памяти антагонистом рецепторов NMDA глутамата//Бюлл. эксперим. биол. и мед. -2010. -Т. 150, № 9. -С. 153-158.
- Тиунова А.А., Комиссарова Н.В., Безряднов Д.В., Анохин К.В. Парадоксальное влияние блокады NMDA-рецепторов на обучение и память в модели пассивного избегания у цыплят//Бюлл. эксперим. биол. и мед. -2016. -Т. 162, № 7. -С. 4-6
- Alberini C.M., Kandel E.R. The regulation of transcription in memory consolidation//Cold. Spring. Harb. Perspect. Biol. -2014. -V. 7, № 1): a021741.
- Bailey C.H., Kandel E.R., Harris K.M. Structural components of synaptic plasticity and memory consolidation//Cold. Spring. Harb. Perspect. Biol. -2015. -V. 7, № 7. pii: a021758.
- Chen S., Cai D., Pearce K., Sun P. Y.-W. Reinstatement of longterm memory following erasure of its behavioral and synaptic expression in Aplysia//Elife. -2014. -V. 3. e03896
- Collingridge G.L., Volianskis A., Bannister N. The NMDA receptor as a target or cognitive enhancement//Neuropharmacol. -2013. -V. 64. -P. 13-26.
- Daniel O.G., Kioko G.R., Federico B.R. Differential involvement of glutamatergic and catecholaminergic activity within the amygdala during taste aversion retrieval on memory expression and updating//Behav. Brain Res. -2016. -V. 307. -P. 120-125.
- Finnie P.S., Nader K. The role of metaplasticity mechanisms in regulating memory destabilization and reconsolidation//Neurosci. Biobehav. Rev. -2012. -V. 36. -P. 1667-1707.
- Hu J., Schacher S. Persistent associative plasticity at an identified synapse underlying classical conditioning becomes labile with shortterm homosynaptic activation//J. Neurosci. -2015. -V. 35, № 49. -P. 16159 -16170.
- Kopelman M.D. Disorders of memory//Brain. 2002. 125 (Pt 10). -P. 2152-2190.
- Nikitin V.P., Solntseva S.V., Nikitin P.V., Kozyrev S.A. The role of DNA methylation in the mechanisms of memory reconsolidation and development of amnesia//Behav. Brain Research. -2015. -V. 279. -P. 148-154.
- Nikitin V.P., Solntseva S.V., Kozyrev S.A., Nikitin P.V. Different components of conditioned food aversion memory//Brain Res. 2016. pii: S0006-8993(16)30138-X.
- Nikitin V.P., Solntseva S.V., Kozyrev S.A., Nikitin P.V., Shevelkin A.V. NMDA or 5-HT receptor antagonists impair memory reconsolidation and induce various types of amnesia//Behav. Brain Res. -2018. -V. 345. -P. 72-82.
- Reichelt A.C., Lee J.L. Memory reconsolidation in aversive and appetitive settings//Front. Behav. Neurosci. -2013. -№ 7. -Р. 118.
- Storozheva Z.I., Gruden M.A., Proshin A.T., Sewell R.D. Learning ability is a key outcome determinant of GSK-3 inhibition on visuospatial memory in rats//J. Psychopharmacol. -2015. -V. 29, № 7. -P. 822-835.
- Tronson N.C., Taylor J.R. Molecular mechanisms of memory reconsolidation//Nat. Rev. Neurosci. -2007. -V. 8. -P. 262-275.


