Особенности развития фиброза печени на фоне формирования синдрома дистрофическиqдегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе
Автор: Жураковский И.П., Архипов С.А., Пустоветова М.Г., Кунц Т.А., Битхаева М.В., Маринкин И.О.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3-2 т.26, 2011 года.
Бесплатный доступ
Изучено развитие фиброза печени на фоне формирования синдрома дистрофически дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе у 12 крыс-самцов Вистар с моделью вторичной дезорганизации соединительной ткани. В качестве контроля использовали 6 интактных животных. Полученные данные свидетельствуют о возможности существования дополнительного механизма развития фиброза печени при наличии фокальной персистирующей инфекции. Так, наряду с классическим вариантом развития фиброза, реализующимся вследствие активации макрофагами звездчатых клеток печени, присутствует альтернативный механизм, заключающийся в активировании фибробластов портальных трактов тучными клетками.
Фиброз печени, коллаген, гликозаминогликаны, пролиферация фибробластов, тучные клетки
Короткий адрес: https://sciup.org/14919547
IDR: 14919547 | УДК: 616.36-002.4:616-006.3-091.8]:616-002.2
Текст научной статьи Особенности развития фиброза печени на фоне формирования синдрома дистрофическиqдегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе
Фиброз печени характеризуется избыточным развитием соединительной ткани в результате повторных и/или длительных повреждений, воздействующих на орган. При его развитии преимущественно нарастает содержание коллагенов I, V, VI типов, ламинина, эластина, гликозаминогликанов [3].
В настоящее время является установленной следующая последовательность развития фиброза печени. Так, при гепатитах различной этиологии в результате повреж- дения гепатоцитов из них выделяются различные биологически активные вещества, включающие перекиси и протеазы. Эти вещества активируют макрофаги печени, а также эндотелий синусоидов. Активированные клетки, в свою очередь, начинают секретировать биологически активные вещества, вызывающие активацию звездчатых клеток. К разряду подобных веществ относятся провос-палительные цитокины – интерлейкин-1 (IL-1), фактор некроза опухоли альфа (TNFα), перекиси, оксид азота, эндотелин, но главная роль в активации звездчатых клеток принадлежит тромбоцитактивирующему фактору
(PDGF), активатору плазминогена, трансформирующему фактору роста бета 1 (TGF β 1). Под их воздействием звездчатые клетки выходят из состояния покоя, становятся активированными и трансформируются в миофиброб-ластоподобный фенотип, приобретая способность к продукции компонентов экстрацеллюлярного матрикса, в том числе коллагена и протеогликанов. Однако вопрос возможности развития фиброзных изменений на фоне формирования синдрома дистрофически-дегенератив-ных изменений мезенхимальных производных при локальном хроническом воспалительном процессе остается открытым, поскольку в этом случае выраженных деструктивных изменений гепатоцитов не наблюдается. В этой связи является актуальным изучение возможности развития фиброза печени путем задействования дополнительных альтернативных механизмов.
Материал и методы
Эксперимент проведен на 18 половозрелых крысах-самцах Вистар с исходной массой 180–220 г, у 12 из которых с помощью Золотистого стафилококка (штамм 209) воспроизведена адаптированная для мелких лабораторных животных модель вторичной дезорганизации соединительной ткани [1]. Животных выводили из эксперимента через 2 и 3 мес. Группу контроля составляли 6 интактных животных. Эксперимент выполнялся с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинской декларации по защите позвоночных животных, используемых для лабораторных и иных целей.
Объекты печени фиксировали в 12% формалине и жидкости Теллесницкого. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Коллагеновые волокна выявлялись пикрофуксином по Ван Гизону; сульфатированные гликозаминогликаны – альциановым синим при рН 1,0; популяция тучных клеток оценивалась после окраски препаратов альциановым синим при рН 1,25 без или с последующей докраской кармалюмом Майера. Популяция звездчатых клеток печени оценивалась на полутонких срезах, окрашенных толуидиновым синим. Для изучения маркера пролиферации Ki-67 (белка, эксп-рессирующегоуся на всех стадиях клеточного цикла, кроме G0) использовали двухэтапный иммуногистохимический метод.
С помощью программного обеспечения ImageJ 1.42g (National institutes of Health, USA) определялась площадь, занимаемая коллагеновыми волокнами и сульфатированными гликозаминогликанами в области триад, образованных вокругдольковыми и междольковыми сосудами. Статистическую обработку результатов проводили с использованием программы STATISTICA 6.0: высчитывали средние величины (M) и их стандартные ошибки (m). Достоверность различий оценивали с использованием непараметрического критерия Манна–Уитни при 95-процентном уровне значимости.
Результаты и обсуждение
На срезах печени через 2 мес. после воспроизведения очага хронического воспаления, окрашенных пик-рофуксином по Ван Гизону, отмечалось достоверное увеличение площади коллагеновых волокон межклеточного вещества соединительной ткани в области триад, образованных как мелкими (вокругдольковыми) сосудами на 161,4%, так и более крупными (междольковыми) сосудами – на 98,8% по сравнению с интактными животными, таблица.
При окраске альциановым синим отмечалось достоверное увеличение площади сульфатированных гликозаминогликанов основного вещества соединительной ткани в области триад, образованных междольковыми сосудами на 37,6% по сравнению с интактными животными. При этом достоверных отличий в распределении хондроитинсульфатов в области триад, образованных более мелкими (вокругдольковыми) сосудами не отмечалось.
Необходимо отметить, что в печени данной группы крыс отмечалось достоверное увеличение популяции звездчатых клеток по сравнению с интактными животными (на 220,0%), рисунок 1.
Таблица
Площади коллагеновых волокон и сульфатированных гликозаминогликанов в области портальных трактов, стенках и окружении центральных вен в мкм2 (M±m)
|
Площади |
Интактные животные |
Через 2 мес. после создания модели |
Через 3 мес. после создания модели |
|
Площадь, занимаемая коллагеновыми волокнами в портальных трактах, образованных вокругдольковыми сосудами |
155,64±17,54 |
406,8732,96* |
1584,12±105,46* |
|
Площадь, занимаемая коллагеновыми волокнами в портальных трактах, образованных междольковыми сосудами |
910,97±98,03 |
1810,86±193,49* |
5606,39±496,87* |
|
Площадь, занимаемая коллагеновыми волокнами в стенках и окружении центральных вен |
188,70±18,10 |
457,8540,08* |
2654,30±314,46* |
|
Площадь, занимаемая сульфатированными гликозаминогликанами в портальных трактах, образованных вокругдольковыми сосудами |
225,92±14,97 |
209,4815,07 |
273,16±13,91* |
|
Площадь, занимаемая сульфатированными гликозаминогликанами в портальных трактах, образованных междольковыми сосудами |
991,65±85,44 |
1364,0481,49* |
1278,82±104,83* |
|
Площадь, занимаемая сульфатированными гликозаминогликанами в стенках и окружении центральных вен |
87,00±5,44 |
209,18±15,58* |
235,53±18,88* |
Примечание: * – значимость различий с интактными животными при р<0,05.
Вместе с тем при изучении экспрессии маркера пролиферативной активности клеток отмечалось некоторое увеличение количества фибробластов, экспрессирующих Ki-67 в ядрах, что могло свидетельствовать о начале развития фиброзных процессов. При оценке популяции тучных клеток на срезах, окрашенных альциановым синим при рН 1,25, было отмечено возросшее, по сравнению с контролем, количество масто-цитов в области триад.
Через 3 мес. после воспроизведения модели на срезах печени, окрашенных пикрофуксином по Ван Гизону, отмечалось выраженное, более чем в 10 раз увеличение площади коллагеновых волокон межклеточного вещества соединительной ткани в области триад, образованных мелкими (вокругдольковыми) сосудами. В междольковых сосудах площадь коллагеновых волокон возрасла более чем в 6 раз по сравнению с интактными животными. На срезах, окрашенных альциановым синим, в отличие от предыдущего срока отмечалось достоверное увеличение площади сульфатированных гликозаминогликанов основного вещества соединительной ткани в области триад, образованных вокругдольковыми сосудами на 20,9% по сравнению с интактными животными. Распределение хондроитинсульфатов в области триад, образованных более крупными (междольковыми) сосудами также было достоверно увеличенным (на 29,0%). Морфометрическая оценка популяции звездчатых клеток позволила выявить их достоверное увеличение по сравнению с интактными животными (на 230,1%).
При оценке маркера пролиферативной активности клеток отмечалось существенное увеличение количества фибробластов, экспрессирующих Ki-67 в ядрах, что может свидетельствовать о развитии фиброзных процессов. При этом количество тучных клеток в области триад сохранялось существенно повышенным.
Достаточно существенным является тот факт, что при персистенции бактериальной инфекции наблюдается морфологическая картина сочетания венулярного и пе-рипортального фиброза. Не исключено, что это может быть связано как с теми биологически активными веществами, которые в большом количестве присутствуют в крови при воспалительном процессе, так и с цитокинами клеток воспалительных инфильтратов, локализованных в портальных трактах. При других вариантах развития фиброза печени, когда синтез коллагена осуществляется преимущественно клетками Ито, расположенных в пространстве Диссе, отмечается, особенно на начальных этапах, перицеллюлярный фиброз [3].
Определенную роль в развитии фиброза печени при персистенции бактериальной инфекции, по-видимому, играет наблюдаемая нами рекрутизация тучных клеток в портальные тракты. На эту возможность обращается внимание в ряде исследований, посвященных изучению взаимодействия мастоцитов и фибробластов при других па-
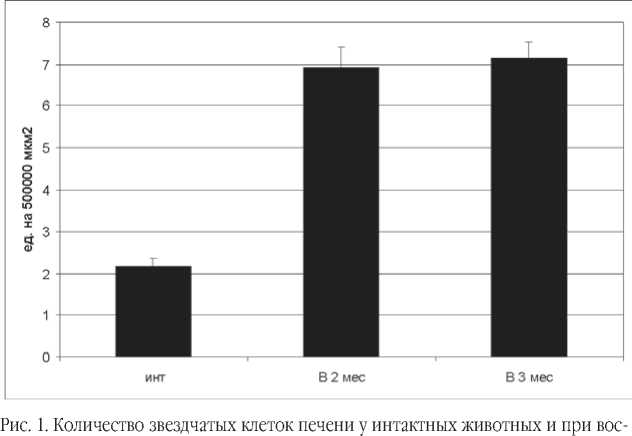
произведении модели вторичной дезорганизации соединительной ткани на площади 500000 мкм2
тологических состояниях [5, 8], при этом отмечается, что тучные клетки могут стимулировать как пролиферативную активность фибробластов, так и выработку ими внеклеточного матрикса [4, 6, 7].
Заключение
Таким образом, настоящее исследование позволило выявить некоторые особенности развития фиброза печени при формировании синдрома дистрофически-де-генеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе. Так, наряду с классическим вариантом развития фиброза, реализующимся вследствие активации макрофагами звездчатых клеток печени, присутствует альтернативный механизм, заключающийся в активировании фибробластов портальных трактов тучными клетками. Это может быть связано, с одной стороны, с умеренными деструктивными процессами в паренхиме печени, что не позволяет в полной мере реализоваться классическому варианту. С другой стороны, при наличии очага хронического воспаления происходят вторичные изменения мезенхимальных производных, выражающиеся в разрастании соединительной ткани в органах с достаточной васкуляризацией, в отличие от брадитрофных тканей, где преобладают дистрофически-дегенеративные изменения [2]. Полученые данные подтверждают возможность участия тучных клеток в процессе развития фиброза печени при наличии отдаленного очага хронической инфекции. Это может служить поводом к поиску специальных методов защиты паренхиматозных органов при развитии синдрома сочетанных дистрофически-дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе.
Список литературы Особенности развития фиброза печени на фоне формирования синдрома дистрофическиqдегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе
- Жураковский И.П., Рыжов А.И., Мичурина С.В. Способ моделирования вторичной дезорганизации соединительной ткани: пат. 2307397 Рос. Федерации; опубл. 27.09.2007, Бюл. № 27.
- Команденко Н.И., Рыжов А.И., Жураковский И.П. Остеохондроз позвоночника: монография. -Новосибирск: Сибмедиздат НГМУ, 2006. -246 с.
- Павлов Ч.С., Шульпекова Ю.О., Золотаревский В.Б. и др. Современные представления о патогенезе, диагностике и лечении фиброза печени//Российский журнал гастроэнтерологии, гепатологии, колопроктологии. -2005. -№ 2. -С. 13-20.
- Berton A., Levi Schaffer F., Emonard H. et al. Activation of fibroblasts in collagen lattices by mast cell extract: a model of fibrosis//Clin. Exp. Allergy. -2000. -Vol. 30. -P. 485-492.
- Diegelmann R.F., Evans M.C. Wound healing: an overview of acute, fibrotic and delayed healing//Front Biosci. -2004. -Vol. 9. -P. 283-289.
- Garbuzenko E., Nagler A., Pickholtz D. et al. Human mast cells stimulate fibroblast proliferation, collagen synthesis and lattice contraction: a direct role for mast cells in skin fibrosis//Clin. Exp. Allergy. -2002. -Vol. 32. -P. 237-246.
- Garbuzenko E., Berkman N., Puxeddu I. et al. Mast cells induce activation of human lung fibroblasts in vitro//Exp. Lung. Res. -2004. -Vol. 30. -P. 705-721.
- Gruber B.L. Mast cells in the pathogenesis of fibrosis//Curr. Rheumatol. Rep. -2003. -Vol. 5. -P. 147-153.


