Особенности редокс-зависимой модификации белков в эритроцитах больных немелкоклеточным раком легкого в зависимости от стадии заболевания
Автор: Белоногов Р.Н., Титова Н.М., Дыхно Ю.А., Савченко А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (42), 2010 года.
Бесплатный доступ
С целью определения уровня показателей окислительной модификации белков в эритроцитах больных немелкокле- точным раком легкого на различных стадиях заболевания обследовано 108 человек. В эритроцитах больных оценивалось содержание карбонильных производных белков, среднемолекулярных пептидов, SH-групп белков. Наиболее выраженное возрастание интенсивности процессов редокс-зависимой модификации белков в эритроцитах происходит у больных раком легкого II и IV стадий. Окислительная модификация белков в составе эритроцитов играет роль в нарушении их функций, что может приводить к различным гематологическим нарушениям, выраженность которых изменяется в зависимости от стадии заболевания.
Рак легкого, окислительный стресс, окислительная модификация белков
Короткий адрес: https://sciup.org/14055691
IDR: 14055691
Текст научной статьи Особенности редокс-зависимой модификации белков в эритроцитах больных немелкоклеточным раком легкого в зависимости от стадии заболевания
В патогенезе рака легкого существенную роль играет системное действие опухоли на организм. Опухоль постоянно испытывает на себе влияние нормальных клеток, элементов внеклеточного матрикса и иммунной системы. Сами раковые клетки продуцируют различные метаболиты, токсические вещества, онкобелки, факторы роста, гормоны, воздействующие на весь организм. Все это приводит к формированию характерных изменений в пораженном органе и в системном кровотоке, выраженность которых соотносится с основными параметрами опухолевого роста: размером опухоли, поражением лимфатических узлов, наличием или отсутствием метастазов [10–12]. Развитие злокачественных новообразований легких довольно часто сопровождается гематологическими реакциями, которые являются результатом действия опухоли на организм. Однако патогенез большей части системных реакций так и остается неясным [7]. Развитие окислительного стресса играет немаловажную роль в происхождении
Таблица 1
|
Показатель |
Контроль (n=35) |
II стадия (n=14) |
III стадия (n=26) |
IV стадия (n=20) |
|
Альдегидные формы карбонильных производных белков |
2,65 (1,69; 4,39) |
5,78 (2,22; 8,55) p1<0,05 |
5,43 (2,03; 6,31) p1<0,05 |
2,73 (2,01; 9,13) |
|
Кетонные формы карбонильных производных белков |
1,84 (1,39; 2,95) |
8,84 (5,62; 11,23) p1<0,05 |
2,53 (1,50; 3,56) p2<0,05 |
5,47 (2,93; 7,99) p1,3<0,05 |
Примечание: p1 – статистически значимые различия с показателями контрольной группы; р2 – статистически значимые различия с показателями больных РЛ II стадии; р3 – статистически значимые различия с показателями больных РЛ III стадии.
Содержание карбонильных производных белков в эритроцитах в зависимости от стадии рака легкого, у.е./г Hb (Ме (С25;С75))
многих из них [9, 12]. В свою очередь, данные нарушения приводят к выраженному усилению окислительных процессов в эритроцитах. Белки эритроцитов, подвергшиеся окислительной деструкции, имеют длительный период распада, что делает их перспективным маркером интенсивности свободно-радикального окисления [4, 5, 7].
Целью работы явилось определение показателей редокс-зависимой модификации белков в эритроцитах больных немелкоклеточным раком легкого в зависимости от стадии заболевания
Материал и методы
На базе Красноярского краевого онкологического диспансера обследовано 108 больных мужского пола с немелкоклеточным раком легкого в возрасте 35–70 лет (средний возраст – 53,4 ± 2,4 года). У 30 больных раком легкого диагностирована II стадия, у 44 – III стадия, у 34 – IV стадия заболевания. Окончательный диагноз устанавливался после оперативного вмешательства и гистологического исследования образцов опухоли врачами онкологического диспансера. В качестве контрольной группы были обследованы 35 здоровых доноров аналогичного возраста.
Кровь забиралась из локтевой вены в гепаринизированные пробирки, утром, натощак, на следующий день после поступления больного в стационар. Эритроциты отделялась центрифугированием, после чего в них проводилось определение показателей редокс-зависимой модификации белков (карбонильные производные, молекулы средней массы, тиоловые группы).
Об уровне карбонильных производных белков (КПБ) судили по реакции взаимодействия окисленных аминокислотных остатков белков с 2,4-динитрофенилгидразином с образованием 2,4-динитрофенилгидразонов [13]. Оптическую плотность образовавшихся производных дини-трофенилгидразонов регистрировали спектрофотометрически при различных длинах волн: 356 нм – алифатические кетодинитрофенилги-дразоны нейтрального характера; 370 нм – алифатические альдегиддинитрофенилгидразоны нейтрального характера [4]. О содержании молекул средней массы (МСМ) судили на основании прямой спектрометрии депротеинизированного супернатанта, полученного после осаждения белков раствором трихлоруксусной кислоты при длине волны 254 нм [3]. Метод определения количества свободных тиоловых групп в белках основан на взаимодействии SH-групп с 5,5’-дитио-бис-2-нитробензойной кислотой. Интенсивность окраски регистрировали спектрофотометрически при длине волны 412 нм. Для определения быстрореагирующих SH-групп оптическую плотность пробы измеряли через две минуты после начала реакции. Для определения медленно реагирующих SH-групп измерение оптической плотности производили через каждые 5 мин до тех пор, пока ее значение не станет постоянным. Для выявления замаскированных SH-групп готовили пробу, в состав которой также входил 8 М раствор мочевины [2]. Содержание гемоглобина в эритроцитах определяли цианметгемоглобиновым методом [6].
Для всех данных определяли медиану (Ме) и интерквартальный разброс в виде подсчета
Таблица 2
|
Показатель |
Контроль (n=35) |
II стадия (n=30) |
III стадия (n=44) |
IV стадия (n=34) |
|
Быстрореагирующие |
16,79 |
20,31* |
19,77 |
22,31 |
|
тиоловые группы |
(11,78; 21,23) |
(16,70; 25,58) |
(16,52; 27,46) |
(12,50; 26,90) |
|
Медленно реагирующие |
7,08 |
6,46 |
6,19 |
8,19 |
|
тиоловые группы |
(3,85; 9,91) |
(4,57; 12,73) |
(4,91; 11,79) |
(5,98; 12,18) |
|
Замаскированные тиоловые |
12,82 |
14,58* |
16,17 |
15,83 |
|
группы |
(10,14; 17,28) |
(12,92; 23,28) |
(11,30; 18,95) |
(13,54; 17,54) |
Примечание: * – статистически значимые различия с показателями контрольной группы (p1<0,05)
Содержание тиоловых групп белков в эритроцитах в зависимости от стадии рака легкого, мкмоль/мг Hb (Ме (С25; С75))
-
25- (С25) и 75-процентилей (С75). Достоверность различий между группами оценивалась при помощи непараметрического критерия Манна– Уитни. Статистический анализ осуществлялся с помощью пакетов прикладных программ Statistica версия 7,0 (StatSoft Inc., 2004).
Результаты и обсуждение
Динамика изменения уровня карбонильных производных белков в эритроцитах приведена в табл. 1. У больных раком легкого (РЛ) II стадии в эритроцитах происходит увеличение содержания альдегидных форм КПБ на 119 %, III стадии – их уровень снижается до 105 %, а на IV стадии падает до уровня контрольной группы. Уровень кетонных форм КПБ при РЛ II стадии значительно возрастает, при III стадии резко снижается, при РЛ IV стадии – снова существенно возрастает. У больных РЛ II стадии он увеличивается на 380 %, III стадии – на 37 %, IV стадии – на 197 %. Уровень молекул средней массы в эритроцитах при II стадии увеличивается на 24 %, при III – на 22 % и при IV стадии – на 16 % (рис. 1).
Содержание быстрореагирующих SH-групп в эритроцитах при РЛ II стадии возрастает на 21 %, при III стадии – на 18 %, при IV стадии – на 33 % в сравнении с эритроцитами людей контрольной группы. Содержание медленно реагирующих тиоловых групп белков в эритроцитах при РЛ II и III стадии снижается по сравнению с контролем на 9 % и 13 % соответственно. При РЛ IV стадии содержание SH-групп возрастает на 16 %. Содержание замаскированных тиоловых групп в плазме в сравне- нии с контролем повышается на 14, 26, 23 % при II, III IV стадиях рака легкого соответственно (табл. 2). Уровень суммарных тиоловых групп существенно возрастает при РЛ II и IV стадий, при III стадии заболевания значимых отличий от контроля не наблюдается (рис. 2).
Окислительный стресс при раке легкого оказывает повреждающее воздействие на белки, что выражается в их фрагментации и образовании белковых агрегатов, о чем может свидетельствовать уровень альдегидных и кетонных форм карбонильных производных белков соответственно [4]. Отражением степени фрагментации белковых молекул, происходящей либо в результате непосредственного действия активных форм кислорода, либо в результате повышения их чувствительности к протеолизу в условиях окислительного стресса, может служить также содержание молекул средней массы [5]. Увеличение содержания МСМ может быть связано как с их образованием в самих эритроцитах, так и с адсорбцией на поверхности эритроцитов из плазмы. Кроме того, МСМ, образуясь в результате действия свободных радикалов, сами способны выполнять функцию антиоксидантов. Повышение уровня сульфгидрильных групп белков может происходить в результате увеличения активности тиол-зависимых защитных механизмов, в частности тиоредоксиновой системы, что отмечается некоторыми исследователями при раке легкого [11]. Поскольку тиоловые группы белков могут выполнять антиоксидантную функцию, повышение их уровня, вероятно, происходит с целью компенсации недостатка низкомолекулярных антиоксидантов [1, 11].
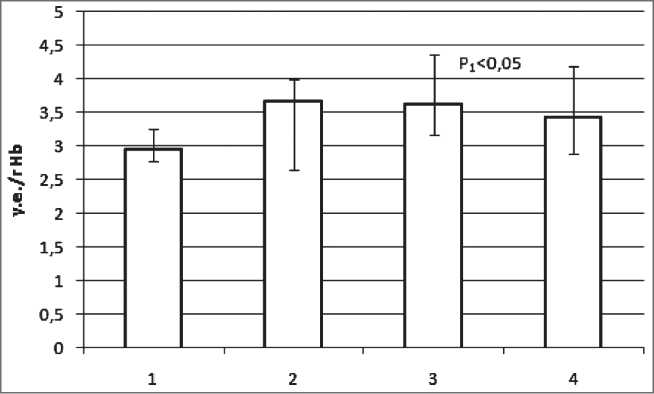
Рис. 1. Содержание молекул средней массы в эритроцитах больных раком легкого в зависимости от стадии заболевания. Примечания: 1 – контрольная группа; 2 – больные РЛ II стадии;
3 – больные РЛ III стадии; 4 – больные РЛ IV стадии
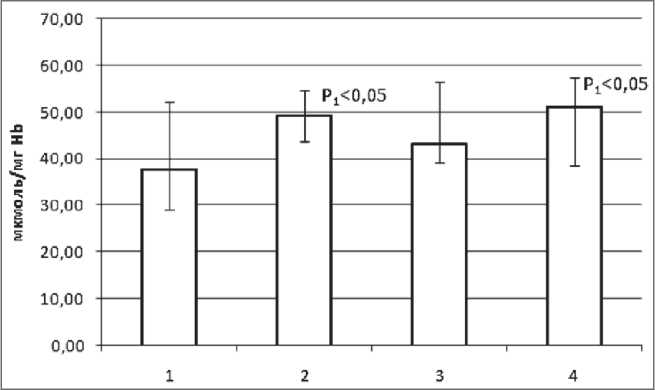
Рис. 2. Содержание суммарных тиоловых групп белков в эритроцитах в зависимости от стадии рака легкого. Примечания: 1 – контрольная группа; 2 – больные РЛ II стадии;
3 – больные РЛ III стадии; 4 – больные РЛ IV стадии
В эритроцитах содержится основное количество антиоксидантов крови. Активные формы кислорода из плазмы могут легко проникать в эритроциты через анионные каналы или диффундировать через мембрану. В связи с этим эритроциты могут выступать в роли эффективных скевенджеров свободных радикалов [15]. Воздействие активных форм кислорода на эритроциты влияет на физиологический статус клетки: регуляцию гликолиза, изменение формы и объема эритроцитов, мембранный транспорт и др. [8, 10, 14]. Усиление окислительных процессов в эритроцитах, в частности окислительная модификация гемоглобина, может вести к снижению их способности к переносу кислорода, что может приводить к развитию гипоксии.
Таким образом, окислительная модификация белков эритроцитов, играет роль в нарушении их функций, что может приводить к различным гематологическим нарушениям, выраженность которых изменяется в зависимости от стадии заболевания.


