Особенности репаративного тендогенеза под влиянием поля отрицательного электрета в эксперименте
Автор: Алексеевский С.А., Бойко А.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4-2 т.23, 2008 года.
Бесплатный доступ
При репаративном тендогенезе неизбежно возникают рубцовые сращения между сухожилиями и окружающими мягкими тканями, что является одной из причин неудовлетворительных результатов лечения. Целью исследования явилась экспериментальная оценка влияния имплантатов с отрицательными электретными покрытиями на основе пятиокиси тантала на тендогенез, которую изучали при изолированной механической травме у белых крыс. Сухожильный регенерат оценивали морфологически. Проведенные исследования доказали оптимизирующее влияние отрицательного электрета на процессы репарации сухожилия, что выражалось в более упорядоченном расположении, правильной ориентации коллагеновых волокон, соответствии толщины сухожилия в зоне регенерации интактным участкам, что свидетельствует о перспективности использования и дальнейшего изучения имплантатов с отрицательным электретным покрытием Ta2O5.
Сухожилие, регенерат, изолированное механическое повреждение, электрет, хирургическое восстановление, тендогенез
Короткий адрес: https://sciup.org/14918968
IDR: 14918968 | УДК: 616-001;
Текст научной статьи Особенности репаративного тендогенеза под влиянием поля отрицательного электрета в эксперименте
Одной из причин высокой частоты неудовлетворительных результатов лечения повреждений сухожилий является неизбежное, биологически закономерное образование рубцовых сращений между сухожилиями и окружающими мягкими тканями. Для формирования полноценного регенерата различными авторами предложено множество методик лечения. Несмотря на это, частота неудовлетворительных результатов оперативного лечения остается высокой (19,5%) [1]. Для успешного восстановления скольжения сухожилий сгибателей пальцев кисти предложено использование пленок ПТФЭ (сверхтонкие пленки толщиной 25-40 мкм из политетрафторэтилена), расположенных между группами поверхностных и глубоких сухожилий, а в отдельных случаях, и в пространстве Пирогова [1].
Тем не менее отсутствуют доступные данные о влиянии имплантатов из полимерных пленок на качество сухожильного регенерата. Перспективным может оказаться применение полимерных пленок с покрытиями, оптимизирующими структуру поврежденного сухожилия. В качестве последних возможно использование тонкопленочных электретных покрытий. Электретом является диэлектрик, способный длительное время находиться в наэлектризованном состоянии, за счёт чего и создается электростатическое поле в окружающем его пространстве (до 3-5 мм от поверхности) [3, 4].
В доступной отечественной и зарубежной литературе большинство работ посвящено изучению влияния поля электрета на основе политетрафторэтилена (ПТФЭ) на различные ткани с целью стимуляции репарации [2, 5]. Вместе с тем вопросы, касающиеся использования электретных пленок на основе пяти-окиси тантала (Та2О5) и их клинического применения, освещены недостаточно, экспериментальную оценку влияния поля тонкопленочных покрытий на основе Ta2O5 на репаративные процессы в тканях при изолированном механическом повреждении не проводили.
Цель исследования заключалась в экспериментальной оценке влияния отрицательных электретных тонкопленочных покрытий Ta2O5 на репаративные процессы в сухожилиях после его хирургического восстановления при изолированном механическом поражении.
Задачи исследования:
-
1. Оценка влияния имплантатов с отрицательными электретными покрытиями на процессы репарации сухожилия (ахиллова) при изолированном механическом поражении в эксперименте.
-
2. Разработка практических рекомендаций по применению имплантатов с отрицательными тонкопленочными электретными покрытиями для оптимизации тендогенеза.
МАТЕРИАЛ И МЕТОДЫ
В опыте были использованы крысы массой 180220 г, полученные из питомника РАМН им. Раппо-лова и содержащиеся на обычном пищевом рационе. Имплантат для установки на сухожилия представлял собой полимерную пленку толщиной 40 мкм, на которую было нанесено покрытие состава Ta2O5. Гис-томорфологические исследования проводили на кафедре патологической анатомии Санкт-Петербургского государственного медицинского университета им. академика И.П. Павлова.
Исследование проведено на 18 беспородных белых крысах – самцах. У всех животных в асептических условиях под сочетанной анестезией: внутрибрюшинно — 0,7 мл 1%-ного раствора пропофола и местно — 1 мл 2%-ного раствора лидокаина, однотипно выполняли поперечную тенотомию ахиллова сухожилия в средней трети с последующим сшиванием по Кюнео. Для выполнения шва сухожилия использовали шовный материал Еthilon 4/0.
Животные были разделены на три равные серии (по 6 животных в каждой). Всем крысам выполняли пересечение ахиллова сухожилия в средней трети на правой нижней конечности с последующим восстановлением по Кюнео. У животных 1-й серии имплантаты не использовались. Животным 2-й серии на зону шва устанавливали полимерную пленку с покрытием из пятиокиси тантала без электретного заряда, животным 3-й серии — пленку с отрицательным электретным покрытием состава Ta2O5 с эффективной плотностью заряда не менее 4x10-5 Кл/м2, изготовленного по оригинальной технологии. Профилактику инфекционных осложнений проводили цефотаксимом в дозировке 0,05 г 1 р/с п/к в течение 5 дней.
Через 21 день после установки имплантатов животные из каждой серии были выведены с последующим забором материала ахиллова сухожилия правой нижней конечности на гистологическое исследование. Оценивали приготовленные по стандартной методике парафиновые срезы, окрашенные гематоксилином и эозином.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При гистологической оценке у животных 1-й серии в зоне резекции отмечали наличие сформированной соединительной ткани. Структура ее характеризовалась неупорядоченным, разнонаправленным расположением коллагена. Между волокнами располагались очаговые скопления гистиоцитарных клеток и фибробластов с формированием гранулем. Вокруг остатков шовного материала наблюдали скопления лимфоцитов, плазмоцитов, макрофагов, эпителиоидных клеток. Встречались единичные гигантские клетки. В краевых зонах отмечалась выраженная очаговая инфильтрация сегментоядерными лейкоцитами с примесью макрофагов. Местами инфильтрат располагался вдоль пучков коллагена. Имеется разрастание грануляционной ткани с новообразованием мелких сосудов, в отдельных случаях отмечался склероз стенок артериол сухожилий. В одном из случаев в зоне регенерации выявлена очаговая хонд-роидизация новообразованной соединительной ткани (рис. 1).
У животных 2-й серии в зоне повреждения была обнаружена оформленная волокнистая ткань, характеризующаяся преимущественно упорядоченным строением волокон, отличающаяся от нормальной большим количеством клеточных элементов, преимущественно фибробластов с резко базофильными ядрами, и сосудов, включая единичные со склерозированной стенкой. В краевых зонах — умеренно выраженная лимфо-макрофагальная инфильтрация с единичными гигантскими клетками инородных тел (рис. 2).
У животных 3-й серии структура сухожилия сохранена на всем его протяжении. В зоне пластики — сформированная плотная оформленная соединительная ткань, практически полностью соответствующая нормальной ткани сухожилия. В зоне регенерации толщина сухожилия соответствует рядом лежащим участкам. Коллагеновые волокна расположены упорядоченно, ориентированы правильно. В одном случае имелась незначительная пикринофи-лия при окраске по Ван-Гизон, отражающая незавершенность процессов коллагеногенеза и наличие свободных гликозаминогликанов. По периферии в примыкающей жировой клетчатке — единичные лимфоидные и гистиоцитарные клетки (рис. 3).
ОБСУЖДЕНИЕ
При анализе результатов визуального и гисто-морфологического исследований сухожильного регенерата в проведенных экспериментальных исследованиях было выяснено, что установка тонкопленочного имплантата с отрицательным электретным
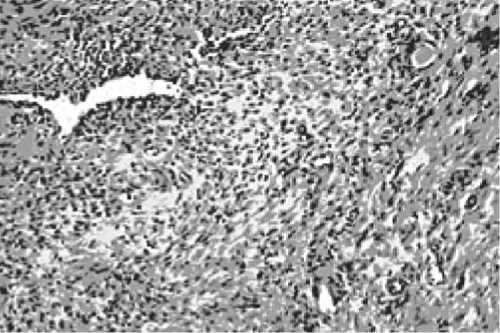
Рис.1. Фотография гистологического среза сухожилия у животного 1-й серии. Окраска: гематоксилин и эозин.
Увеличение × 400
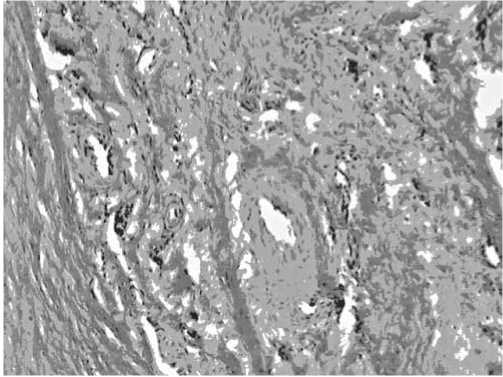
Рис. 2. Фотография гистологического среза сухожилия у животного 2-й серии. Окраска: гематоксилин и эозин.
Увеличение × 400

Рис. 3. Фотография гистологического среза сухожилия у животного 3-й серии. Окраска: гематоксилин и эозин.
Увеличение × 400
покрытием состава Та2О5 в зону хирургического восстановления сухожилия способствует формированию полноценного сухожильного регенерата. Так, у животных в 3-й группе в зоне регенерации толщина сухожилия соответствует интактным участкам, коллагеновые волокна расположены упорядоченно, ориентированы правильно. Подобные изменения характеризуют не только изолирующие свойства тонкопленочных имплантатов с отрицательным электретным покрытием Та2О5, но и подтверждают их позитивное влияние на процессы тендогенеза в зоне повреждения у животных третьей серии.
Возможные механизмы действия отрицательного электрета связаны с регулирующим влиянием на активацию факторов роста фибробластов, пространственную ориентацию коллагеновых волокон, про-тективное действие при процессах апоптоза, а также с изменением мембранных потенциалов близлежащих клеток из-за поляризации от электростатического поля.
Целесообразно дальнейшее изучение особенностей использования электретных покрытий для оптимизации репаративных процессов, что может быть практически использовано у больных при выполнении реконструкции сухожилий в зонах с высоким риском образования спаечного процесса (например, в зоне сгибателей пальцев кисти) либо при значительной вероятности несостоятельности регенерата.
Список литературы Особенности репаративного тендогенеза под влиянием поля отрицательного электрета в эксперименте
- Губочкин Н.Г., Шаповалов В.М. Избранные вопросы хирургии кисти.-СПб., 2000. -С. 37-60.
- Руцкий В.В., Филев Л.В., Мальцев С.И., Тихилов Р.М. Влияние электростатического поля электретов (ЭСПЭ) на рост фибробластов и энхондральный остеогенез//Ортопедия, травматология и протезирование. -1990. -№ 6. -C. 21-25.
- Сесслер Г. Электреты. -М., 1983. -С. 400-412.
- Ткаченко С.С., Руцкий В.В., Хомутов В.П. Накостный электромеханический остеосинтез//Хирургия. -1984. -№ 1. -С. 123127.
- Basset C.A.L. J. Bone Yoint Surg. -1962. -Vol. 44. -A. -P. 1217-1244.


