Особенности синтеза и строения дикарбоксилатов трифенилвисмута
Автор: Кощеева Людмила Вячеславовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.14, 2022 года.
Бесплатный доступ
Взаимодействием трифенилвисмута с хлоруксусной и пентафторбензойной кислотами в присутствии трет -бутилгидропероксида или пероксида водорода в эфире получены бис (хлорацетат) трифенилвисмута (1) и бис (2,3,4,5,6-пентафторбензоат) трифенилвисмута (2). По данным рентгеноструктурного анализа, проведенном при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо К α-излучение, λ = 0,71073 Å, графитовый монохроматор) кристаллов 1 [C22H19O4Cl2Bi, M 627,25; сингония триклинная, группа симметрии P -1; параметры ячейки: a = 8,891(5), b = 10,401(5), c = 12,452(5) Å; α = 86,38(2) град., β = 73,97(2) град., γ = 87,15(3) град.; V = 1104,0(9) Å3; размер кристалла 0,41×0,28×0,1 мм; интервалы индексов отражений -15 ≤ h ≤ 15, -17 ≤ k ≤ 17, -21 ≤ l ≤ 21; всего отражений 76809; независимых отражений 11945; Rint 0,0525; GOOF 1,041; R 1 = 0,0330, wR 2 = 0,0665; остаточная электронная плотность 1,30/-2,28 e/Å3] и 2 [C32H15O4F10Bi, M 862,42; сингония триклинная, группа симметрии P -1; параметры ячейки: a = 12,168(8), b = 12,260(8), c = 12,720(8) Å; α = 72,43(3) град., β = 63,39(3) град., γ = 61,46(2) град.; V = 1481,0(16) Å3; размер кристалла 0,37×0,2×0,1 мм; интервалы индексов отражений -16 ≤ h ≤ 16, -16 ≤ k ≤ 16, -16 ≤ l ≤ 16; всего отражений 51260; независимых отражений 7342; Rint 0,0416; GOOF 1,047; R 1 = 0,0251, wR 2 = 0,0524; остаточная электронная плотность 0,84/-0,91 e/Å3], атомы висмута имеют искаженную тригонально-бипирамидальную координацию. Аксиальные углы OBiO равны 173,07(7)° и 172,24(8)°, суммы углов CBiC в экваториальной плоскости составляют 359,93° и 359,92°. Длины аксиальных связей Bi-O равны 2,303(2), 2,323(2) Å и 2,272(3),2,315(3) Å; интервалы изменения длин экваториальных связей Bi-C составляют 2,190(3)-2,214(3)Å и 2,194(3)-2,206(3)Å соответственно. В структурах 1 и 2 присутствуют внутримолекулярные контакты между атомами висмута и кислорода карбоксилатных лигандов. Расстояния Bi···O=С составляют 2,904(3), 2,908(3) Å(1) и 2,947(4), 3,167(4) Å (2), что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å). В кристалле 1 присутствуют межмолекулярные контакты Cl∙∙∙Cl (3,43 Å) и H∙∙∙O (2,43, 2,57 Å); а в кристалле 2 - только H∙∙∙O (2,50 Å). Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 1991198 (1), № 2042930 (2); deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Пероксид водорода, трет-бутилгидропероксид, трифенилвисмут, хлоруксусная, пентафторбензойная кислота, дикарбоксилат трифенилвисмута, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147236622
IDR: 147236622 | УДК: 546.87+547.29+548.312.5 | DOI: 10.14529/chem220105
Текст научной статьи Особенности синтеза и строения дикарбоксилатов трифенилвисмута
Взаимодействием трифенилвисмута с хлоруксусной и пентафторбензойной кислотами в присутствии трет-бутилгидропероксида или пероксида водорода в эфире получены бис(хлорацетат) трифенилвисмута (1) и бис(2,3,4,5,6-пентафторбензоат) трифенилвисмута (2). По данным рентгеноструктурного анализа, проведенном при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD – детектор, Мо Кα-излучение, λ = 0,71073 Å, графитовый монохроматор) кристаллов 1 [C22H19O4Cl2Bi, M 627,25; сингония триклинная, группа симметрии P–1; параметры ячейки: a = 8,891(5), b = 10,401(5), c = 12,452(5) Å; α = 86,38(2) град., β = 73,97(2) град., γ = 87,15(3) град.; V = 1104,0(9) Å3; размер кристалла 0,41×0,28×0,1 мм; интервалы индексов отражений –15 ≤ h ≤ 15, –17 ≤ k ≤ 17, –21 ≤ l ≤ 21; всего отражений 76809; независимых отражений 11945; Rint 0,0525; GOOF 1,041; R1 = 0,0330, wR2 = 0,0665; остаточная электронная плотность 1,30/–2,28 e/Å3] и 2 [C32H15O4F10Bi, M 862,42; сингония триклинная, группа симметрии P–1; параметры ячейки: a = 12,168(8), b = 12,260(8), c = 12,720(8) Å; α = 72,43(3) град., β = 63,39(3) град., γ = 61,46(2) град.; V = 1481,0(16) Å3; размер кристалла 0,37×0,2×0,1 мм; интервалы индексов отражений –16 ≤ h ≤ 16, –16 ≤ k ≤ 16, –16 ≤ l ≤ 16; всего отражений 51260; независимых отражений 7342; Rint 0,0416; GOOF 1,047; R1 = 0,0251, wR2 = 0,0524; остаточная электронная плотность 0,84/–0,91 e/Å3], атомы висмута имеют искаженную тригонально-бипирамидальную координацию. Аксиальные углы OBiO равны 173,07(7)° и 172,24(8)°, суммы углов CBiC в экваториальной плоскости составляют 359,93° и 359,92°. Длины аксиальных связей Bi-O равны 2,303(2), 2,323(2) А и 2,272(3),2,315(3) Å; интервалы изменения длин экваториальных связей Bi–C составляют 2,190(3)–2,214(3)Å и 2,194(3)–2,206(3)Å соответственно. В структурах 1 и 2 присутствуют внутримолекулярные контакты между атомами висмута и кислорода карбоксилатных лигандов. Расстояния Bi···O=С составляют 2,904(3), 2,908(3) Å(1) и 2,947(4), 3,167(4) Å (2), что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å). В кристалле 1 присутствуют межмолекулярные контакты Cl∙∙∙Cl (3,43 Å) и H∙∙∙O (2,43, 2,57 Å); а в кристалле 2 - только H-O (2,50 А). Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 1991198 (1), № 2042930 (2); ; .
В последние годы активно изучается биологическая активность дикарбоксилатов триарилвисмута [1–6]. Число структурно охарактеризованных дикарбоксилатов трифенилвисмута, по данным Кембриджского банка структурных данных [7], превышает четыре десятка и постоянно растет из-за найденных возможностей их практического использования. В связи с этим вопросы синтеза дикарбоксилатов триарилвисмута имеют большое значение.
Известно, что дикарбоксилаты триарилвисмута успешно получают по реакции окислительного присоединения из триарилвисмута и карбоновой кислоты в диэтиловом эфире в присутствии гидропероксидов [8–15]. Синтез дикарбоксилатов триарилвисмута проводили, как правило, с использованием гидропероксида третичного бутила в диэтиловом эфире.
Ar3Bi + fBuOOH + 2 HOC(O)R----* Ar3Bi(OC(O)R)2 + H2O + fBuOH
Однако в случае триарилвисмута, содержащего в своем составе потенциальные координирующие центры, например трис (2-метокси-5-бромфенил)висмута, целесообразнее было использовать в реакции в качестве окислителя пероксид водорода [16]. Целевые продукты выделяли из реакционной смеси с выходом не менее 70 %.
Серия дикарбоксилатов трифенилвисмута общей формулы Ph 3 Bi[OC(O)R(OH)] 2 получена по этой же схеме с целью определения их антилейшманиозной активности [17, 18]. Аналогично были синтезированы одиннадцать дикарбоксилатов трифенилвисмута на основе функционализированных производных бензойной или салициловой кислот, которые показали хорошую активность против лейшманиоза [19]. Также была синтезирована другая серия дикарбоксилатов тритолилвисмута Tol3Bi[OC(O)R]2 на основе функционализированных производных бензойной или салициловой кислот с орто -, мета - или пара -толильными лигандами [20], из которых пятнадцать производных были оценены на токсичность по отношению к промастиготам лейшмании и клеткам фибробластов человека, а с десятью проводилась последующая оценка против амастигот паразитов. Наилучшая активность и селективность наблюдалась у соединений висмута, содержащих о- и м- толиловые лиганды. Замена диэтилового эфира на изопропиловый спирт не изменяет схемы реакции. В этом случае из трифенилвисмута, карбоновой кислоты и пероксида водорода в растворе изопропанола были получены дикарбоксилаты трифенилвисмута Ph 3 Bi[OC(O)R] 2 (R = 5-Br-2-OH-C 6 H 3 , 2-OH-C 6 H 4 , 2,6-(OH) 2 -C 6 H 3 , 3-Me-2-NH 2 -C 6 H 3 , Ph, Me) с более высокими выходами, чем в известных способах синтеза целевых продуктов [21].
В настоящей работе рассматриваются особенности синтеза и строения дикарбоксилатов трифенилвисмута на примере бис (хлорацетата) трифенилвисмута и бис (2,3,4,5,6-пентафторбензоата) трифенилвисмута, полученных из трифенилвисмута и карбоновой кислоты в присутствии трет бутилгидропероксида или пероксида водорода (1:2:1 мольн.).
Экспериментальная часть
Синтез соединений 1 и 2 проводили по методикам, приведенным в [11, 17].
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [22]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [23] и OLEX2 [24]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
Значение |
|
|
1 |
2 |
|
|
Формула |
C 22 H 19 O 4 Cl 2 Bi |
C 32 H 15 O 4 F 10 Bi |
|
М |
627,25 |
862,42 |
|
Сингония |
Триклинная |
Триклинная |
|
Пр. группа |
P –1 |
P –1 |
|
a , Å |
8,891(5) |
12,168(8) |
|
b, Å |
10,401(5) |
12,260(8) |
|
c, Å |
12,452(5) |
12,720(8) |
|
α, град. |
86,38(2) |
72,43(3) |
|
β, град. |
73,97(2) |
63,39(3) |
|
γ, град. |
87,15(3) |
61,46(2) |
|
V , Å3 |
1104,0(9) |
1481,0(16) |
|
Z |
2 |
2 |
|
ρ (выч.), г/см3 |
1,887 |
1,934 |
|
µ , мм–1 |
8,252 |
6,053 |
|
F (000) |
600,0 |
824,0 |
Окончание табл. 1
|
Параметр |
Значение |
|
|
1 |
2 |
|
|
Форма кристалла (размер, мм) |
обломок (0,41×0,28×0,1) |
обломок (0,37×0,2×0,1) |
|
Область сбора данных по 9 , град. |
6,08–76,46 |
6,36–56,62 |
|
Интервалы индексов отражений |
–15 ≤ h ≤ 15, –17 ≤ k ≤ 17, –21 ≤ l ≤ 21 |
–16 ≤ h ≤ 16, –16 ≤ k ≤ 16, –16 ≤ l ≤ 16 |
|
Измерено отражений |
76809 |
51260 |
|
Независимых отражений |
11945 |
7342 |
|
R int |
0,0525 |
0,0416 |
|
Переменных уточнения |
262 |
424 |
|
GOOF |
1,041 |
1,047 |
|
R -факторы по F 2 > 2 о ( F 2) |
R 1 = 0,0330, wR 2 = 0,0665 |
R 1 = 0,0251, wR 2 = 0,0524 |
|
R -факторы по всем отражениям |
R 1 = 0,0566, wR 2 = 0,0732 |
R 1 = 0,0337, wR 2 = 0,0556 |
|
Остаточная электронная плотность (min/max), e/A3 |
1,30/–2,28 |
0,84/–0,91 |
Таблица 2
|
Связь d , Å |
Угол го, ° |
||
|
1 |
|||
|
Bi(1)–O(1) |
2,303(2) |
O(1)Bi(1)O(3) |
173,07(7) |
|
Bi(1)–O(3) |
2,323(2) |
C(1)Bi(1)C(11) |
106,70(10) |
|
Bi(1)∙∙∙O(2) |
2,904(2) |
C(11) Bi (1)C(21) |
144,58(10) |
|
Bi(1)∙∙∙O(4) |
2,908(3) |
C(1) Bi (1)C(21) |
108,65(10) |
|
Bi(1)–C(1) |
2,214(3) |
C(1)Bi(1)O(1) |
86,65(9) |
|
Bi(1)–C(11) |
2,192(2) |
C(11)Bi(1)O(1) |
92,44(9) |
|
Bi(1)–C(21) |
2,190(3) |
C(21)Bi(1)O(1) |
91,90(9) |
|
O(1)–C(7) |
1,291(3) |
C(1)Bi(1)O(3) |
86,58(9) |
|
O(2)–C(7) |
1,221(4) |
C(11)Bi(1)O(3) |
90,95(9) |
|
O(3)–C(9) |
1,299(3) |
C(21)Bi(1)O(3) |
88,84(9) |
|
O(4)–C(9) |
1,221(3) |
||
|
2 |
|||
|
Bi(1)–O(1) |
2,272(3) |
O(1)Bi(1)O(3) |
172,24(8) |
|
Bi(1)–O(3) |
2,315(3) |
C(1)Bi(1)C(11) |
109,14(12) |
|
Bi(1)∙∙∙O(2) |
3,167(3) |
C(11) Bi (1)C(21) |
111,80(14) |
|
Bi(1)∙∙∙O(4) |
2,947(3) |
C(1) Bi (1)C(21) |
138,98(13) |
|
Bi(1)–C(1) |
2,200(4) |
C(1)Bi(1)O(1) |
93,12(11) |
|
Bi(1)–C(11) |
2,206(3) |
C(11)Bi(1)O(1) |
85,60(11) |
|
Bi(1)–C(21) |
2,194(3) |
C(21)Bi(1)O(1) |
92,42(11) |
|
O(1)–C(37) |
1,282(4) |
C(1)Bi(1)O(3) |
90,91(10) |
|
O(2)–C(37) |
1,219(4) |
C(11)Bi(1)O(3) |
86,81(11) |
|
O(3)–C(47) |
1,270(4) |
C(21)Bi(1)O(3) |
88,88(10) |
|
O(4)–C(47) |
1,223(4) |
||
Длины связей и валентные углы в структурах 1 и 2
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1991198 (1), № 2042930 (2); ; .
Обсуждение результатов
Целью данной работы было изучение эффективности использования пероксида водорода и трет-бутилгидропероксида в реакциях окислительного присоединения трифенилвисмута с участием таких карбоновых кислот, как хлоруксусная и пентафторбензойная. Данный метод хорошо изучен для трифенилвисмута и различных карбоновых кислот [11, 15–21, 25–27], но сравнительный анализ выхода целевых продуктов, получаемых в присутствии разных окислителей, ранее не проводили. Известно лишь, что соединение 1 синтезировали с выходом 83 % из трифенилвисмута, карбоновой кислоты и пероксида водорода в эфире [17], а выход соединения 2, полученного в аналогичной реакции с использованием трет-бутилгидропероксида, достигал 89 % [10].
Ph 3 Bi + 2 НO(O)CR + Н 2 О 2 → Ph 3 Bi[OC(O)RCH 2 Cl] 2 + 2 Н 2 О
R = CH 2 Cl ( 1 ), C 6 F 5 ( 2 )
В настоящей работе показано, что проведение указанных реакций в аналогичных условиях (эфир, комнатная температура, 1 ч), но в присутствии трет- бутилгидропероксида приводит к образованию соединений 1 и 2 с выходами 85 и 92 % соответственно, что свидетельствует об эффективности органического пероксида по сравнению с пероксидом водорода.
Ph 3 Bi + 2 НO(O)CR + t -BuОOH → Ph 3 Bi[OC(O)CR] 2 + t -BuOH + Н 2 О
R = CH 2 Cl ( 1 ), C 6 F 5 ( 2 )
Строение соединений 1 и 2 было изучено с помощью РСА в работах [10, 17], в настоящей работе их структура значительно уточнена.
Известно, что в дикарбоксилатах триарилвисмута реализуется внутримолекулярное взаимодействие атома висмута с карбонильными атомами кислорода - потенциальными координирующими центрами карбоксилатных лигандов, что позволяет отнести эти производные к комплексам высококоординированного висмута [14-21, 25 - 34]. Прочность внутримолекулярных контактов Bi-"O(=C), основой которых являются донорно-акцепторные взаимодействия, во многом определяется природой заместителей в арильных кольцах при атоме металла (влияют на акцепторные способности металла) и в органическом радикале остатка карбоновой кислоты (усиливают или ослабляют донорные свойства карбонильного кислорода). Показано, что внутримолекулярные расстояния Bi-"O(=C) различаются между собой в большей степени: меньшему расстоянию Bi-"O(=C), соответствует большая длина связи Bi-O, что свидетельствует о перераспределении электронной плотности при возникновении прочного донорно-акцепторного взаимодействия. Меньшим расстояниям Bi --- O(=C) в соединениях Ar3Bi[OC(O)R]2 соответствует большая длина связи Bi–O, что свидетельствует о перераспределении электронной плотности при возникновении прочного донорно-акцепторного взаимодействия. Самые слабые внутримолекулярные взаимодействия наблюдаются в молекулах тех дикарбоксилатов триарилвисмута, в которых донорные способности карбонильного атома кислорода ослаблены из-за смещения электронной плотности, обусловленного наличием электроотрицательных заместителей в органическом радикале кислоты (- I -эффект). В молекулах дикарбоксилатов триарилвисмута с одинаковыми арильными заместителями при атомах висмута невалентные взаимодействия усиливаются с повышением донорных свойств карбонильного атома кислорода за счет +М- эффекта радикала. Все рассуждения о структуре дикарбоксилатов триарилвисмута применимы и к обсуждаемым в статье соединениям.
Так, атомы висмута в 1 и 2 имеют искаженную тригонально-бипирамидальную координацию (рис. 1, 2). Аксиальные углы OBiO равны 173,07(7) и 172,24(8) ° , сумма углов CBiC в экваториальной плоскости составляет 359,93 ° и 359,92 ° . Длины аксиальных связей Bi-O равны 2,303(2), 2,323(2) Å и 2,272(3), 2,315(3) Å; интервал изменения длин экваториальных связей Bi–C составляет 2,190(3)–2,214(3) Å и 2,194(3)–2,206(3) Å. В структурах 1 и 2 присутствуют внутримолекулярные контакты между атомами висмута и кислорода карбоксилатных лигандов. Расстояния Bi···O=С составляют 2,904(3), 2,908(3) Å и 2,947(4), 3,167(4) Å, что меньше суммы ван-дер-ваальсовых радиусов висмута и кислорода (3,59 Å) [35]. В кристалле 1 присутствуют межмолекулярные контакты Cb-Cl (3,43 А) и Н-Ю (2,43, 2,57 А); в кристалле - только H—O (2,50 А). В молекулах дикарбоксилатов укорочение расстояний Bi-"O(=C) коррелирует с увеличением одного из экваториальных углов CBiC [144,58(10)°, 138,98(13) ° ] со стороны внутримолекулярных контактов. Следует отметить, что в кристалле 1 присутствуют межмолекулярные контакты Cb-Cl (3,43 А) и H—O (2,43, 2,57 А); а в кристалле 2 - только H—O (2,50 А).
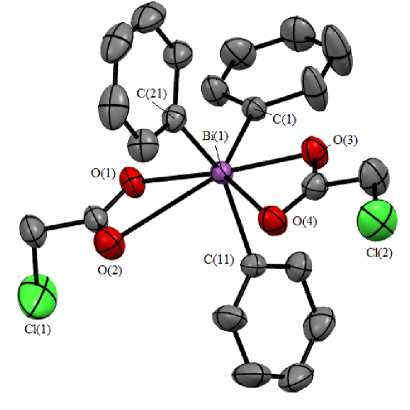
Рис. 1. Общий вид молекулы бис (хлорацетата) трифенилвисмута (атомы водорода не показаны)
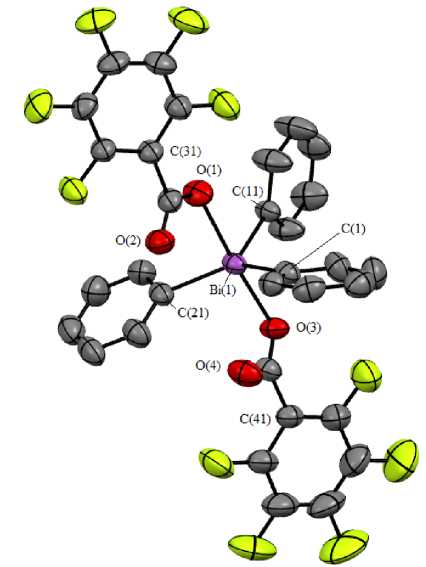
Рис. 2. Общий вид молекулы бис (2,3,4,5,6-пентафторбензоата) трифенилвисмута (атомы водорода не показаны)
Выводы
Установлено, что взаимодействие трифенилвисмута с хлоруксусной и пентафторбензойной кислотами в эфире более эффективно протекает в присутствии трет -бутилгидропероксида по сравнению с пероксидом водорода. Уточнено строение бис (хлорацетата) трифенилвисмута и бис (2,3,4,5,6-пентафторбензоата) трифенилвисмута, в которых карбоксилатные лиганды, имеющие в составе карбоксильных групп атомы кислорода с неподеленными электронными парами, обусловливают дополнительную координацию с центральным атомом висмута, что приводит к увеличению его координационного числа до 7.
Выражаю благодарность проф. В.В. Шарутину за рентгеноструктурный анализ кристаллов дикарбоксилатов трифенилвисмута.
Список литературы Особенности синтеза и строения дикарбоксилатов трифенилвисмута
- Stability and Toxicity of Tris-tolyl Bismuth(V) Dicarboxylates and Their Biological Activity Towards / Y.C. Ong, V.L. Blair, L. Kedzierski et al. // Leishmania Major. Dalton Trans. – 2015. – V. 44. – P. 18215–18226. DOI: 10.1039/c5dt03335g.
- Tiekink, E.R.T. Antimony and Bismuth Compounds in Oncology / E.R.T. Tiekink // Crit. Rev. Oncol. / Hematol. – 2002. – V. 42, № 3. – P. 217–224. DOI: org/10.1016/S1040-8428(01)00217-7.
- Synthesis, Characterization and in vitro Cytotoxicity Screening of Some Triarylbismuth(V) Di(N‐salicylidene)amino Carboxylates and the Crystal Structure of (2‐HOC6H4CH=NCH2CO2)2Bi(C6H5)3 / G.-C. Wang, J. Xiao, Y.-N. Lu et al. // Appl. Organomet. Chem. – 2005. – V. 19, № 1. – P. 113–117. DOI: 10.1002/aoc.749.
- Synthesis, Crystal Structures, DNA Interaction and Anticancer Activity of Organobismuth(V) Complexes / L. Cui, C. Bi, Y. Fan et al. // Inorgan. Chim. Acta. – 2015. – V. 437, № 1. – P. 41–46. DOI: 10.1016/j.ica.2015.07.008.
- Synthesis, Characterization and Cytotoxicity of Some Triarylbismuth(V) Di(N‐p‐toluenesulfonyl) Aminoacetates and the Crystal Structure of (4‐CH3C6H4SO2NHCH2CO2)2Bi(C6H4Cl‐4)3 / L.Yu, Y.-Q. Ma, G.-C. Wang et al. // Appl. Organomet. Chem. – 2004. – V. 18, № 4. – P. 187–190. DOI: 10.1002/aoc.609.
- Comparative Stability, Toxicity and Anti-leishmanial Activity of Triphenyl Antimony(V) and Bismuth(V) α-Hydroxy Carboxylato Complexes / R.N. Duffin, V.L. Blair, L. Kedzierski et al. // Dalton Trans. – 2018. – V. 47. – P. 971–980. DOI: 10.1039/C7DT04171C.
- Cambridge Crystallographic Data Center. 2019. (deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
- Шарутин, В.В. Синтез и строение дикарбоксилатов три-мета-толилвисмута / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорган. химии. – 2014. – Т. 59, № 1. – С. 42–46. DOI: 10.7868/S0044457X14010164.
- Андреев, П.В. Строение аддукта бис(хлорацетата) три(о-толил)висмута с хлоруксусной кислотой / П.В. Андреев // Вестник ЮУрГУ. Серия «Химия». – 2019. – Т. 11, № 3. – С. 59–65. DOI: 10.14529/chem190307.
- Синтез и строение бис(фторбензоатов) трифенилвисмута / В.В. Шарутин, И.В. Егорова, О.К. Шарутина и др. // Коорд. химия. – 2003. – Т. 29, № 7. – С. 496–501.
- Шарутин, В.В. Дикарбоксилаты триарилвисмута Ar3Bi[OC(O)R]2, Ar = p-Tol, R = CH2Cl; Ar = Ph, R = C6Н4OMe-2, CН=CHPh / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Журн. неорган. химии. – 2019. – Т. 64, № 2. – С. 159–164. DOI: 10.1134/S0044457X19020181.
- Decomposition of Triphenylbismuth Dicrotonate in Light in the Presence of 2-Methyl-2- nitrosopropane / A.V. Gushchin, O.S. Kalistratova, A.I. Maleeva, V.A. Kuropatov // Вестник ЮУрГУ. Серия «Химия». – 2016. – Т. 8, № 1. – С. 51–56. DOI: 10.14529/chem160108.
- Гущин, А.В. Синтез и строение диметакрилата трифенилсурьмы / А.В. Гущин, Д.В. Шашкин, Л.К. Прыткова и др. // Журн. общ. химии. – 2011. – Т. 81, № 3. – С. 397–400.
- Шарутин, В.В. Синтез и строение бис(1-адамантанкарбоксилата) трифенилвисмута / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина / Журн. неорган. химии. – 2011. – Т. 56, № 10. – С. 1644–1646.
- Синтез и структура бис[3-(2-фурил)акрилата]трифенилвисмута Ph3Bi[O2CCH=CH(C4H3O)]2 и ди-мета-нитроциннамата трифенилвисмута Ph3Bi(O2CCH=CH–C6H4NO2-м)2 / А.А. Гусаковская, О.С. Калистратова, П.В. Андреев и др. // Кристаллография. –2018. – Т. 63, № 2. – С. 203–207. DOI: 10.7868/S0023476118020066.
- Синтез и строение дикарбоксилатов трис(5-бром-2-метоксифенил)висмута: [(C6H3(Br-5)(MeO-2)]3Bi[OC(O)CHal3]2 (Hal = F, Cl) / В.В. Шарутин, О.К. Шарутина, В.А. Ермакова и др. // Журн. неорган. химии. – 2017. – Т. 62, № 8. – С. 1049–1056. DOI: 10.7868/S0044457X17080050.
- Comparative Stability, Toxicity and Anti-Leishmanial Activity of Triphenyl Antimony(V) and Bismuth(V) α-Hydroxy Carboxylato Complexes / R.N. Duffin, V.L. Blair, L. Kedzierski, P.C. Andrews // Dalton Trans. – 2018. – V. 47. – P. 971–980. DOI: 10.1039/c7dt04171c.
- Comparative Stability, Cytotoxicity and Anti-Leishmanial Activity of Analogous Organometallic Sb(V) and Bi(V) Acetato Complexes: Sb Confirms Potential While Bi Fails The Test / R.N. Duffin, V.L. Blair, L. Kedzierski, P.C. Andrews // J. Inorg. Biochem. – 2018. – V. 189. – P. 151–162. DOI: 10.1016/j.jinorgbio.2018.08.015.
- Stability and Toxicity of Heteroleptic Organometallic Bi(V) Complexes Towards Leishmania Major / Y.C. Ong, V.L. Blair, L. Kedzierski, P.C. Andrews // Dalton Trans. 2014. – V. 43. – P. 12904 – 12916. DOI: 10.1039/c4dt00957f.
- Stability and Toxicity of Tris-Tolyl Bismuth(V) Dicarboxylates and their Biological Activity Towards Leishmania Major / Y.C. Ong, V.L. Blair, L. Kedzierski et al. // Dalton Trans. –2015. – V. 44. – P. 18215–18226. DOI: 10.1039/c5dt03335g.
- Facile One-Pot Synthesis of Triphenylbismuth(V) Bis(carboxylate) Complexes / I. Kumar, P. Bhattacharya, K.H. Whitmire // Organometallics. – 2014. – V. 33. – P. 2906–2909. DOI: 10.1021/om500337z.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. – 2009. – V. 42. – P. 339–341. DOI: 10.1107/S0021889808042726.
- Synthesis, Crystal Structures, DNA Interaction and Anticancer Activity of Organobismuth(V) Complexes / L. Cui, C. Bi, Y. Fan et al. // Inorg. Chim. Acta. – 2015. – V. 437. – P. 41–46. DOI: 10.1016/j.ica.2015.07.008.
- Triphenylbismuth(V) Di[(iso)nicotinates] – Transmetallation Agents or Divergent Organometalloligands? First Organobismuth(V)-Based Silver(I) Coordination Polymers / A.B. Kiran, T. Mocanu, A. Pollnitz et al. // Dalton Trans. – 2018. – V. 47. – P. 2531–2542. DOI: 10.1039/C7DT04516F.
- A New Organobismuth(V) Complex with Fluorobenzoic Ligands: Synthesis, Crystal Structure, Photodegradation Properties / X.-Y. Zhang, R.-X. Wu, C.-F. Bi et al. // Inorg. Chim. Acta. – 2018. – V. 483. – P. 129–135. DOI: 10.1016/j.ica.2018.07.027.
- Synthesis and Structural Study of Triphenylbismuth Bis(salicylate) / K. Feham, A. Benkadari, A. Chouaih et al. // Cryst. Struct. Theory Appl. – 2013. – V. 2. – P. 28–33. DOI: 10.4236/csta.2013.21004
- Synthesis and Structure of Triphenylbismuth Bis(3-phenylprop-2-enoate) / P.V. Andreev, N.V. Somov, O.S. Kalistratova et al. // Crystallogr. Rep. – 2015. – V. 60. – P. 517–520. DOI: 10.1134/S1063774515040057.
- Шарутин, В.В. Синтез и строение бис(2-фениламинобензоата) трифенилвисмута / В.В. Шарутин, И.В. Егорова, М.А. Казаков и др. // Журн. неорган. химии. – 2009. – Т. 54, № 7. – С. 1156–1159.
- Особенности строения дикарбоксилатов трифенилвисмута / В.В. Шарутин, Т.К. Иваненко, Н.А. Николаева, А.А. Молоков, Г.К. Фукин // Коорд. химия. – 2006. – Т. 32, № 9. – С. 672–679.
- Шарутин, В.В. Синтез и строение бис(фенилкарборанилкарбоксилата) трифенилвисмута / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. – 2010. – Т. 80, № 10. – С. 1630–1633.
- Шарутин, В.В Синтез и строение бис(3,4-диметилбензолсульфоната) триc(3-метилфенил)висмута / В.В. Шарутин, О.К. Шарутина // Журн. общ. химии. – 2016. – Т. 86, № 5. – С. 811–814.
- Шарутин, В.В. Синтез и строение бис(3,4-диметилбензолсульфоната) трифенилвисмута / В.В Шарутин, О.К. Шарутина, В.С. Сенчурин // Журнал. неорган. химии. – 2016. – Т. 61, № 3. – С. 334–337. DOI: 10.7868/S0044457X16030211.
- Consistent Van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. – 2009. – V. 113, iss. 19. – P. 5806–5812. DOI: 10.1021/jp8111556.


