Особенности строения µ2-оксо-бис[(арокси)триарилсурьмы]:[Ar3Sb(OAr’)]2O, Ar = Ph, Ar’ = C6H2Cl3-2,4,6, C6H2Br2-2,6-(t-Bu)-4; Ar = p-Tol, Ar’ = C6H2(NO2)3-2,4,6
Автор: Шарутин Владимир Викторович, Шарутина Ольга Константиновна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.8, 2016 года.
Бесплатный доступ
Взаимодействием триарилсурьмы с 2,4,6-трихлорфенолом, 2,6-дибром-4-третбутилфенолом и три(пара-толил)сурьмы с 2,4,6-тринитрофенолом в присутствии третбутилгидропероксида в водно-эфирном растворе получены с высоким выходом µ2-оксо-бис[(2,4,6-трихлорфеноксо)трифенилсурьма] (1), µ2-оксо-бис[(2,6-дибром-4-трет-бутилфеноксо)трифенилсурьма] (2), µ2-оксо-бис[(2,4,6-тринитрофеноксо)три(пара-толил)сурьма] (3). В биядерных молекулах 1, 2, 3 фрагменты SbOSb имеют угловое строение. Атомы сурьмы характеризуются искаженной тригонально-бипирамидальной координацией с атомами кислорода в аксиальных положениях. Длины связей атомов сурьмы с мостиковым атомом кислорода короче, чем с атомами кислорода арокси-групп.
Окислительный синтез, µ-оксо-бис[(ароксо)триарилсурьма], строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147160374
IDR: 147160374 | УДК: 546.865+547.53.024+547.563.4+548.312.5 | DOI: 10.14529/chem160408
Текст научной статьи Особенности строения µ2-оксо-бис[(арокси)триарилсурьмы]:[Ar3Sb(OAr’)]2O, Ar = Ph, Ar’ = C6H2Cl3-2,4,6, C6H2Br2-2,6-(t-Bu)-4; Ar = p-Tol, Ar’ = C6H2(NO2)3-2,4,6
Биядерные производные сурьмы общей формулы (Ar 3 SbX) 2 O, где Х – галоген или другой электроотрицательный заместитель, известны [1]. К настоящему моменту строение более тридцати соединений такого типа установлено методом рентгеноструктурного анализа [2]. Имея много общих закономерностей в строении координационного полиэдра атомов сурьмы, молекулы этих соединений могут существенно отличаться геометрией фрагмента Sb–O–Sb [3]. Валентный угол при мостиковом атоме кислорода в известных структурах варьирует от 130 до 180°. В молекулах с линейным строением центрального фрагмента длина связей Sb–O короче, а значит прочнее, чем в молекулах с угловым строением. Однако соединений с молекулами второго типа большинство. Причины, вызывающие искажение линейного угла, неоднократно обсуждались в литературе [4– 7], тем не менее, до сих пор невозможно спрогнозировать, какую форму будет иметь фрагмент Sb–O–Sb в молекуле того или другого соединения.
Так, в молекулах µ 2 -оксо- бис [(ароксо)трифенилсурьмы] (Ph 3 SbOC 6 H 3 OH-3-Ac-4) 2 O, [Ph 3 SbOC 6 H 3 (CHO)-2-Br-4] 2 O [8], (Ph 3 SbOC 6 H 2 Br 3 -2,4,6) 2 O [9] (Ph 3 SbOC 6 H 3 Сl 2 -2,6) 2 O, (Ph 3 SbOC 6 H 2 Br 2 -2,6-NO 2 -4) 2 O [10] угол SbOSb изменяется в интервале 142–147°, тогда как в толильном производном ( p- Tol 3 SbOC 6 H 4 I) 2 O указанный угол равен 180° [11].
В работе [4] при обсуждении строения биядерных элементоорганических соединений с мостиковым атомом кислорода (Х–М–О–М–Х) была обнаружена корреляция между длиной связи атомом металла М с терминальным лигандом X и величиной угла МОМ: чем меньше длина связи М–Х, тем больше значение угла. Вероятно, такую корреляцию уместно проводить только в ряду соединений с однотипными терминальными лигандами. Отметим, что в структурно охарактеризованных соединениях [Ph 3 SbOC 6 H 3 (CHO)-2-Br-4] 2 O, (Ph 3 SbOC 6 H 3 OH-3-Ac-4) 2 O [8], (Ph 3 SbOC 6 H 3 Сl 2 -2,6) 2 O, [10] (Ph 3 SbOC 6 H 2 Br 3 -2,4,6) 2 O [9], (Ph 3 SbOC 6 H 2 Br 2 -2,6-NO 2 -4) 2 O [10] наоборот, удлинение связи Sb–O(Ar) (средние значения 2,135, 2,141, 2,145, 2,177, 2,213 Å соответственно) сопровождается увеличением угла SbOSb (142,4, 143,2, 142,7, 144,0, 147,6º).
С целью подтверждения наблюдаемой корреляции в настоящей работе синтезированы бия-дерные ароксиды триарилсурьмы с мостиковым атомом кислорода: (Ph 3 SbOC 6 H 2 Cl 3 -2,4,6)] 2 O ( 1 ),
[Ph 3 SbOC 6 H 2 Br 2 -2,6-4-( t -Bu)] 2 O ( 2 ), [p-Tol 3 SbOC 6 H 2 (NO 2 ) 3 -2,4,6] 2 O ( 3 ) и изучены особенности их строения.
Экспериментальная часть
Синтез µ 2 -оксо- бис [(ароксо)триарилсурьмы] 1 , 2 , 3 проводили по методике, описанной в [9].
Рентгеноструктурный анализ ( РСА ) кристаллов 1 , 2 , 3 проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [12]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [13]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, геометрические характеристики координационного полиэдра атома сурьмы – в табл. 2.
Taблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур соединений 1-3
|
Параметры |
Значения |
||
|
1 |
2 |
3 |
|
|
Сингония |
Tриклинная |
Tриклинная |
Tриклинная |
|
Пространственная группа |
P¯ 1 |
P¯ 1 |
P¯ 1 |
|
a , Å |
12,9431(5) |
14,0394(5) |
11,7172(11) |
|
b , Å |
13,3057(5) |
14,0693(6) |
13,0140(13) |
|
c, Å |
15,6069(7) |
15,7425(7) |
22,487(2) |
|
α , град. |
86,496(2) |
73,694(2) |
75,504(4) |
|
β, град. |
69,320(2) |
86,544(2) |
79,018(4) |
|
γ , град. |
67,631(2) |
66,991(2) |
66,915(4) |
|
V , Å3 |
2317,02(16) |
2742,7(2) |
3037,5(5) |
|
Z |
2 |
2 |
2 |
|
ρ (вычисл.) , г/см |
1,598 |
1,618 |
1,380 |
|
–1 µ , мм |
1,552 |
3,939 |
0,954 |
|
F (000) |
1100,0 |
1308,0 |
1268,0 |
|
Размер кристалла, мм |
1,07 × 0,62 × 0,48 |
0,23 × 0,15 × 0,12 |
0,47 × 0,39 × 0,18 |
|
Область сбора данных по θ , град. |
5,92–77,48 |
4,04–51,68 |
4,26–50,8 |
|
Интервалы индексов отражений |
–22 ≤ h ≤ 16, –23 ≤ k ≤ 20, –27 ≤ l ≤ 27 |
–17 ≤ h ≤ 17, –17 ≤ k ≤ 17, –19 ≤ l ≤ 19 |
–14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –27 ≤ l ≤ 27 |
|
Измерено отражений |
43124 |
46355 |
47491 |
|
Независимых отражений |
22730 |
10394 |
11121 |
|
R int |
0,0295 |
0,0785 |
0,0326 |
|
Переменных уточнения |
532 |
592 |
700 |
|
GOOF |
1,234 |
0,992 |
1,068 |
|
R- фактор по F 2 > 2 σ ( F 2) |
R 1 = 0,0871, wR 2 = 0,1667 |
R 1 = 0,0383, wR 2 = 0,0680 |
R 1 = 0,0489, wR 2 = 0,1271 |
|
R- факторы по всем отражениям |
R 1 = 0,1336, wR 2 = 0,1880 |
R 1 = 0,0857, wR 2 = 0,0805 |
R 1 = 0,0626, wR 2 = 0,1416 |
|
Остаточная электронная плотность (min/max), e /Å3 |
3,63/–2,35 |
1,05/–0,74 |
2,05/–0,57 |
Таблица 2
Основные длины связей ( d ) и валентные углы ( ω ) в структурах соединений 1 – 3
|
Связь |
d, К |
Угол |
ω , град. |
|
1 |
|||
|
Sb(1)–C(1) |
2,111(5) |
Sb(1)O(3)Sb(2) |
143,6(2) |
|
Sb(1)–C(11) |
2,094(5) |
O(3)Sb(1)O(1) |
179,34(14) |
|
Sb(1)–C(21) |
2,090(5) |
O(3)Sb(2)O(2) |
177,22(16) |
|
Sb(1)–O(3) |
1,968(4) |
C(11)Sb(1)C(1) |
121,9(2) |
|
Sb(1)–O(1) |
2,180(3) |
C(21)Sb(1)C(1) |
117,73(18) |
|
Sb(1)–O(1) |
1,307(6) |
C(21)Sb(1)C(11) |
119,24(19) |
|
Sb(2)–C(41) |
2,094(5) |
C(11)Sb(1)O(1) |
84,99(17) |
|
Sb(2)–C(61) |
2,105(5) |
C(41)Sb(2)C(61) |
123,0(2) |
|
Sb(2)–C(51) |
2,102(5) |
C(41)Sb(2)C(51) |
116,2(2) |
|
Sb(2)–O(2) |
2,161(4) |
C(51)Sb(2)C(61) |
120,1(2) |
|
Sb(2)–O(3) |
1,973(4) |
O(3)Sb(2)C(51) |
98,08(17) |
|
C(71)–O(2) |
1,317(6) |
C(51)Sb(2)O(2) |
84,60(18) |
|
2 |
|||
|
Sb(1)–O(1) |
1,971(3) |
Sb(1)O(1)Sb(2) |
143,66(16) |
|
Sb(1)–O(2) |
2,160(3) |
O(1)Sb(1)O(2) |
177,24(12) |
|
Sb(1)–C(1) |
2,099(5) |
O(1)Sb(2)O(3) |
175,99(12) |
|
Sb(1)–C(11) |
2,118(4) |
C(1)Sb(1)C(11) |
119,64(19) |
|
Sb(1)–C(21) |
2,101(5) |
C(1)Sb(1)C(21) |
118,7(2) |
|
Sb(2)–O(1) |
1,979(3) |
C(21)Sb(1)C(11) |
121,14(19) |
|
Sb(2)–O(3) |
2,140(3) |
C(1)Sb(1)O(2) |
86,29(14) |
|
Sb(2)–C(41) |
2,104(5) |
O(1)Sb(1)C(1) |
96,40(15) |
|
Sb(2)–C(61) |
2,102(4) |
C(61)Sb(2)C(41) |
116,00(19) |
|
Sb(2)–C(51) |
2,102(5) |
C(61)Sb(2)C(51) |
116,44(18) |
|
O(3)–C(71) |
1,338(5) |
C(51)Sb(2)C(41) |
127,2(2) |
|
O(2)–C(31) |
1,329(5) |
C(51)Sb(2)O(3) |
89,76(15) |
|
3 |
|||
|
Sb(1)–O(1) |
1,946(4) |
Sb(1)O(1)Sb(2) |
143,2(2) |
|
Sb(1)–O(2) |
2,364(3) |
O(1)Sb(1)O(2) |
175,37(14) |
|
Sb(1)–C(1) |
2,103(5) |
O(1)Sb(2)O(9) |
176,70(15) |
|
Sb(1)–C(21) |
2,115(5) |
C(1)Sb(1)C(21) |
114,1(2) |
|
Sb(1)–C(11) |
2,111(5) |
C(1)Sb(1)C(11) |
111,22(19) |
|
Sb(2)–O(1) |
1,971(3) |
C(11)Sb(1)C(21) |
131,22(19) |
|
Sb(2)–O(9) |
2,246(4) |
C(1)Sb(1)O(2) |
82,07(16) |
|
Sb(2)–C(41) |
2,105(5) |
O(1)Sb(1)C(1) |
101,87(17) |
|
Sb(2)–C(51) |
2,102(5) |
C(51)Sb(2)C(41) |
115,6(2) |
|
Sb(2)–C(61) |
2,106(6) |
C(51)Sb(2)C(61) |
112,2(2) |
|
O(2)–C(31) |
1,265(6) |
C(41)Sb(2)C(61) |
131,0(2) |
|
O(9)–C(7) |
1,266(6) |
O(1)Sb(2)C(41) |
93,35(17) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1046113 для 1, № 1052057 для 2, № 1049892 для 3; ; .
Обсуждение результатов
Комплексы 1–3 были получены из триарилсурьмы, фенола и трет бутилгидропероксида при мольном соотношении 1:1:1 с высоким выходом.
2 Ar 3 Sb + 2 HOAr’ + 2 HOOBu- t → (Ar 3 SbOAr’) 2 O + H 2 O + 2 HOOBu- t Ar = Ph, Ar’ = C 6 H 2 Cl 3 -2,4,6 ( 1 ), C 6 H 2 Br 2 -2,6-4-( t -Bu) ( 2 ); Ar = p -Tol, Ar’ = C 6 H 2 (NO 2 ) 3 -2,4,6 ( 3 )
По данным рентгеноструктурного анализа, геометрические характеристики молекул соединений 1 , 2 , 3 имеют близкие значения. Два фрагмента Ar 3 SbOAr’ связаны через атом кислорода (рис. 1, 2, 3).
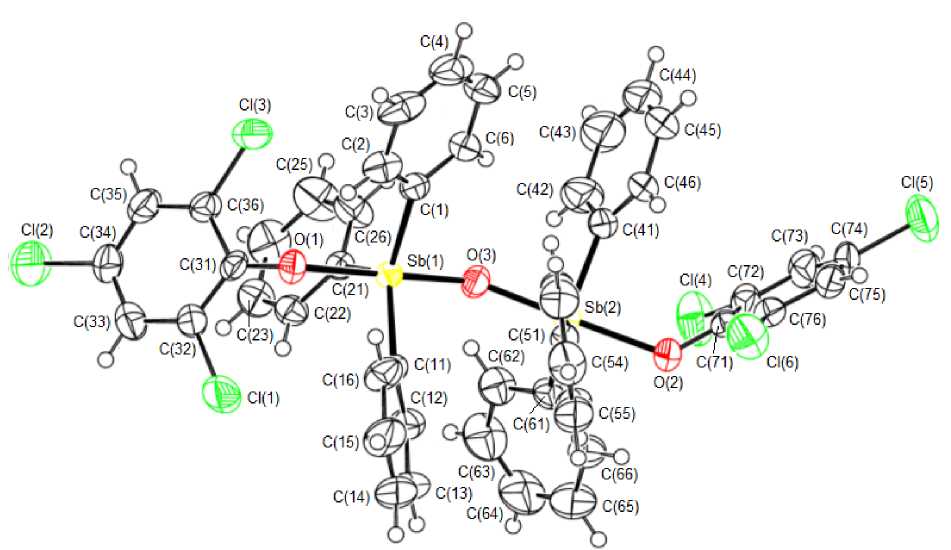
Рис. 1. Строение молекулы соединения 1
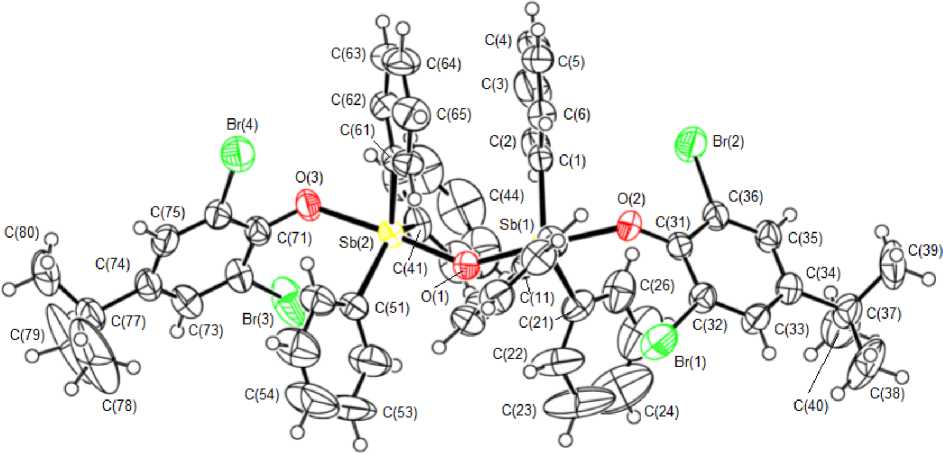
Рис. 2. Строение молекулы соединения 2
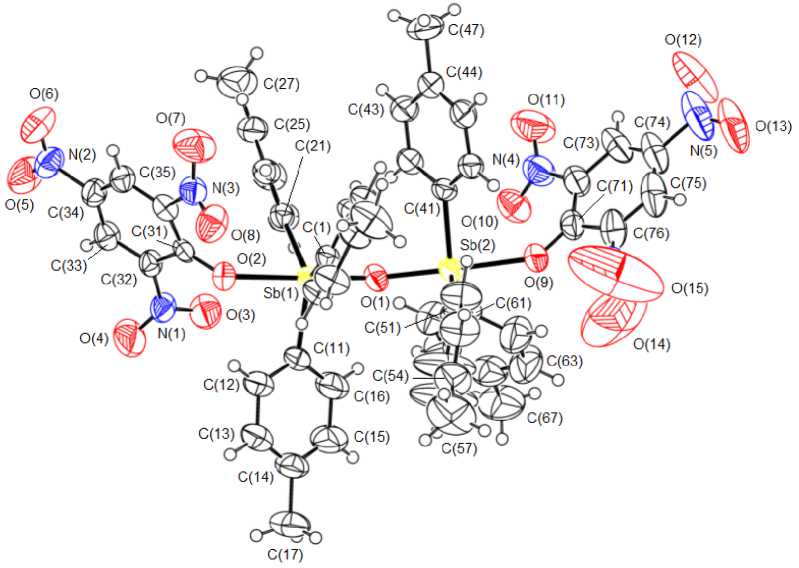
Рис. 3. Строение молекулы соединения 3
Арильные циклы двух группировок Ar3Sb находятся относительно друг друга в более энергетически выгодной заторможенной конформации. Углы между плоскостями арокси-групп в молекулах 1 , 2 , 3 равны 56,16 ° , 69,70°, 68,89 ° соответственно. Атомы сурьмы имеют искаженную три-гонально-бипирамидальную координацию с атомами кислорода (мостиковым О м и ароксильным О а ) в аксиальных положениях. Аксиальные углы O м SbO а составляют 179,34(14)о, 177,22(16)о ( 1 ), 177,24(12)о, 175,99(12)о ( 2 ) и 175,37(14)о, 176,70(15)о ( 3 ). Углы СSbС в экваториальной плоскости изменяются в интервалах 116,2(2)–123,0(2)º, 118,7(2)–127,2(2)º ( 2 ) и 111,22(19)–131,22(19)º ( 3 ), что можно объяснить стерическими затруднениями, связанными с увеличением объема заместителей в арокси-группах.
Атомы сурьмы выходят из экваториальной плоскости в сторону мостикового атома кислорода: в 1 – Sb(1) на 0,126 Å, Sb(2) на 0,107 Å; в 2 – Sb(1) на 0,090 Å, Sb(2) на 0,071 Å; в 3 – Sb(1) на 0,226 Å, Sb(2) на 0,134 Å, что приводит к отклонению углов между аксиальными и экваториальными связями от теоретического значения 90º. Центральные фрагменты в молекулах 1 – 3 имеют угловое строение, углы SbOSb равны 143,6(2) ° , 143,66(16) ° , 143,2(2) ° соответственно.
Длины связей Sb(1,2)–O м (1,968(4), 1,973(4) Å ( 1 ); 1,971(3), 1,979(3) Å ( 2 ); 1,946(4), 1,971(3) Å ( 3 ) близки к значениям аналогичных связей в молекулах подобных соединениях сурьмы [8–10]. В ряду соединений 2, 1, 3 расстояния Sb(1,2)–O а возрастают (2,140(3), 2,160(3) Å; 2,161(4), 2,180(3) Å; 2,246(4), 2,364(3) Å соответственно), что коррелирует со значительным смещением электронной плотности в ароматическое кольцо при усилении электроноакцепторных свойств функциональных групп в ароксильных лигандах. Так, в молекуле 3 плоскости ароматических колец и нитро-групп, находящихся в пара -положении ароксильных дигандов, практически совпадают (углы между соответствующими плоскостями равны 3,02º и 6,78º), что обусловливают проявление этими электроотрицательными группами и индуктивного эффекта (– I ) и эффекта сопряжения (– M ). О перераспределении электронной плотности свидетельствует укорочение связей О–С(Ar) в рассматриваемом ряду (1,337(5), 1,328(5) Å; 1,317(7), 1,307(7) Å; 1,266(6), 1,265(7) Å в 2 , 1 , 3 соответственно). Отметим, что при различающихся средних значениях терминальных связей Sb– O (2,150(3) Å, 2,170(4) Å, 2,305(4) Å) углы SbOSb в молекулах приведенных соединений имеют близкие значения.
Выводы
Таким образом, анализ данных рентгеноструктурных исследований соединений [Ph 3 SbOC 6 H 2 Br 2 -2,6-4-( t -Bu)] 2 O, (Ph 3 SbOC 6 H 2 Cl 3 -2,4,6)] 2 O, [p-Tol 3 SbOC 6 H 2 (NO 2 ) 3 -2,4,6] 2 O показал, что геометрические параметры координационных узлов атомов сурьмы в их молекулах имеют близкие значения. Наблюдаемое удлинение связей Sb-Oа в приведенном ряду соединений связано с повышением электроноакцепторных способностей функциональных групп в ароксильных лигандах. Зависимости между длиной терминальной связи Sb–O и значением валентного угла при мостиковом атоме кислорода не выявлено.
Список литературы Особенности строения µ2-оксо-бис[(арокси)триарилсурьмы]:[Ar3Sb(OAr’)]2O, Ar = Ph, Ar’ = C6H2Cl3-2,4,6, C6H2Br2-2,6-(t-Bu)-4; Ar = p-Tol, Ar’ = C6H2(NO2)3-2,4,6
- Кочешков, К.А. Методы элементоорганической химии. Сурьма, висмут/К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский; под ред. А.Н. Несмеянова. -М.: Наука, 1976. -483 с.
- Cambridge Crystallografic Database. Release 2015. Cambridge.
- Шарутина, О.К. Молекулярные структуры органических соединений сурьмы (V)/О.К. Шарутина, В.В. Шарутин. -Челябинск: Издательский центр ЮУрГУ, 2012. -395 с.
- Glidewell, C. The Structures of Hexaorgano-substituted Triatomics R31M1XM2R32 and Related Species/C. Glidewell//J. Orgnomet. Chem. -1988. -V. 356, № 2. -P. 151-158.
- Tiekink, E.R.T.The Crystal and Molecular Structure of μ-Oxobis-benzene Solvate(12)/E.R.T. Tiekink//J. Orgnomet. Chem. -1987. -V. 333, № 2. -P. 199-204.
- Recognition on Linear Bent Forms of Solid μ-Oxo-bis (Ph3SbI)2O/M.J. Taylor, L.-J. Baker, C.E.F. Rickard et al.//J. Organomet. Chem. -1995. -V. 498, № 1. -P. С14-С16.
- Adduct Formation between (Ph3SbI)2O and I2/M.J. Almond, M.G.B. Drew, D.A. Rice et al.//J. Organomet. Chem. -1996. -V. 522, № 2. -P. 265-269.
- Синтез, строение и реакции соединений сурьмы (Ar3SbX)2O, X = Hal, NO2, NO3, OSO2R, OC(O)R, OАr/В.В. Шарутин, А.П. Пакусина, Н.В. Насонова и др.//Химия и компьютерное моделирование. Бутлеровские сообщения. -2002. -Т. 3, № 11. -С. 13-22.
- Сурьмаорганические производные 2,4,6-трибромфенола/В.В. Шарутин, А.П. Пакусина, М.А. Пушилин и др.//Журн. общ. химии. -2003. -Т. 73, № 4. -С. 573-577.
- Шарутин, В.В. Синтез и строение μ-оксо-бис и μ-оксо-бис/В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин//Бутлеровские сообщения. -2013. -Т. 36, № 10. -С. 52-56.
- Синтез и строение µ-оксо-бис 2O/В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др.//Бутлеровские сообщения. -2011. -Т. 27, № 14. -С. 36-40.
- Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
- Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.

![Особенности строения µ2-оксо-бис[(арокси)триарилсурьмы]:[Ar3Sb(OAr’)]2O, Ar = Ph, Ar’ = C6H2Cl3-2,4,6, C6H2Br2-2,6-(t-Bu)-4; Ar = p-Tol, Ar’ = C6H2(NO2)3-2,4,6 Особенности строения µ2-оксо-бис[(арокси)триарилсурьмы]:[Ar3Sb(OAr’)]2O, Ar = Ph, Ar’ = C6H2Cl3-2,4,6, C6H2Br2-2,6-(t-Bu)-4; Ar = p-Tol, Ar’ = C6H2(NO2)3-2,4,6](/file/cover/147160374/osobennosti-stroenija-2-okso-bis-aroksi-triarilsurmyar3sb-oar-2o-ar.png)
