Особенности строения иодида бис[(3-трифторметил)фенил)]висмута
Автор: Шарутин В.В., Сенчурин В.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Строение иодида бис[(3-трифторметил)фенил]висмута (3-CF3C6H4)2BiI (1), полученного из триарилвисмута и иодистоводородной кислоты, доказано методом рентгеноструктурного анализа (РСА). По данным РСА кристаллы 1 полимерного строения [C14H8BiF6I, M 626,09; сингония моноклинная, группа симметрии P21/с; параметры ячейки: a = 9,920(5), b = 9,047(5), c = 18,901(9) Å; a = 90,00°, β = 102,27(2)°, g = 90,00°; V = 1657,6(15) Å3; Z = 4; rвыч = 2,5086 г/см3; 2q 6,16-57 град.; всего отражений 59710; независимых отражений 4194; число уточняемых параметров 222; Rint = 0,1022; GOOF 1,053; R1 = 0,0825, wR2 = 0,2477; остаточная электронная плотность (max/min): 5,19/-6,52 e/Å3], состоящие из тригонально-бипирамидальных молекул Ar2BiI, связанные между собой мостиковыми атомами иода (аксиальные углы IBiI составляют 174,7°). В экваториальной плоскости при центральном атоме металла располагаются два арильных лиганда (CBiC 95,1(16)°) и свободная электронная пара. Длины связей Bi-C составляют 2,215(13) и 2,234(14) Å; валентные углы IBiC равны 86,2(4)-92,5(4)°. Наименьшие межмолекулярные расстояния F(1)∙∙∙F(41) (2,9(6) Å) значительно превышают сумму двух ван-дер-ваальсовых радиусов атомов фтора (2,7 Å). Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2235080 (1), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Иодид бис[(3-трифторметил)фенил]висмута, особенности строения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147246066
IDR: 147246066 | УДК: 546.87+547.53.024+546.15+548.312.5 | DOI: 10.14529/chem240405
Текст научной статьи Особенности строения иодида бис[(3-трифторметил)фенил)]висмута
Аннотация. Строение иодида бис[(3-трифторметил)фенил]висмута (3-CF3C6H4)2BiI (1), полученного из триарилвисмута и иодистоводородной кислоты, доказано методом рентгеноструктурного анализа (РСА). По данным РСА кристаллы 1 полимерного строения [C14H8BiF6I, M 626,09; сингония моноклинная, группа симметрии P21/с; параметры ячейки: a = 9,920(5), b = 9,047(5), c = 18,901(9) Å; а = 90,00°, в = 102,27(2)°, Y = 90,00°; V = 1657,6(15) A3; Z = 4; рвыч = 2,5086 г/см3; 20 6,16-57 град.; всего отражений 59710; независимых отражений 4194; число уточняемых параметров 222; Rint = 0,1022; GOOF 1,053; R1 = 0,0825, wR2 = 0,2477; остаточная электронная плотность (max/min): 5,19/-6,52 e/A3], состоящие из тригонально-бипирамидальных молекул Ar2BiI, связанные между собой мостиковыми атомами иода (аксиальные углы IBiI составляют 174,7°). В экваториальной плоскости при центральном атоме металла располагаются два арильных лиганда (CBiC 95,1(16)°) и свободная электронная пара. Длины связей Bi-C составляют 2,215(13) и 2,234(14) Å; валентные углы IBiC равны 86,2(4)-92,5(4)°. Наименьшие межмолекулярные расстояния F(1)—F(41) (2,9(6) A) значительно превышают сумму двух ван-дер-ваальсовых радиусов атомов фтора (2,7 Å). Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2235080 (1), ; .
Арильные производные трехвалентного висмута (Ar 3 Bi, Ar 2 BiX и ArBiX 2 , Х – электроотрицательный лиганд) привлекают внимание многих исследователей. Для получения производных висмута несимметричного строения используют преимущественно реакции деарилирования триарилвисмута кислотами НХ [1 - 3]. Полнота деарилирования триарилвисмута определяется соотношением исходных реагентов, природой кислоты и условиями проведения реакций. Так, при взаимодействии триарилвисмута с уксусной или трифторуксусной кислотой в эфире в зависимости от количества исходных реагентов замещаются одна или две арильные группы [4]. Эти же авторы получили бензолсульфонат дифенилвисмута и 4-метилбензолсульфонат ди-( пара -толил)висмута внедрением оксида серы (VI) по связи Bi-C в триарилвисмуте или деарилировани-ем триарилвисмута аренсульфоновой кислотой [5].
В [6] описан синтез бис (2,5-диметилбензолсульфоната) фенилвисмута, представляющего собой координационный полимер, который получали из трифенилвисмута и 2,5-диметилбензолсульфоновой кислоты в толуоле. О получении двух координационных полимеров винилсульфонатов висмута(III) сообщалось в [7]. Три органосульфоната дифенилвисмута были синтезированы взаимодействием эквимолярных количеств трифенилвисмута и органосульфоновой кислоты в спирте [8]. По аналогичной схеме был получен трифлат дифенилвисмута [9]. В публикациях [10, 11] описан синтез аренсульфонатов диарилвисмута из трифенилвисмута [три( пара -толил)висмута] и аренсульфоновой кислоты в эфире с выходом до 99 %. Оптимальное время протекания реакций при комнатной температуре составляет 48 ч. Полученные аренсуль-фонаты диарилвисмута представляют собой мелкокристаллические неокрашенные вещества, нерастворимые в ароматических и алифатических углеводородах и хорошо растворимые в таких органических растворителях, как ацетон и диметилсульфоксид.
Одним из основных методов синтеза карбоксилатов висмута BiX 3 , PhBiX 2 , Ph 2 BiX [Х = OC(O)R] является взаимодействие трифенилвисмута с карбоновой кислотой. Полнота замещения фенильных групп определяется мольным соотношением реагентов, природой кислоты и растворителя, растворимостью образующихся карбоксилатов.
Найдено, что трифенилвисмут дефенилируется 1-адамантанкарбоновой кислотой (1:3 мольн.) при нагревании (90 ° С) в гептане, толуоле или хлороформе с образованием соответствующего трикарбоксилата висмута. Изменение мольного соотношения реагентов (1:1, 1:2 мольн.) и условий проведения реакции (20 ° С) не уменьшает полноту замещения фенильных групп [12].
Ph3Bi + 3 НОС(О)С10Н15 ^ Bi[OC(O)C10H15]3 + 3 PhH
Бесцветные кристаллы соединения имели высокую температуру плавления (318 ° С с разл.), что свидетельствовало о его полимерном или олигомерном строении. Из данных РСА комплекса (рис. 1) следовало, что его кристалл состоит из тетрамеров, образующих шестнадцатичленный цикл, включающий атомы висмута (4), кислорода (8) и углерода (4). Все атомы висмута симметрически эквивалентны.
В работе [13] описаны синтез и особенности строения 2-фенилкарборанилкарбоксилата дифенилвисмута, который получали из трифенилвисмута и 2-фенилкарборанилкарбоновой кислоты (1:1 мольн.) в бензоле при нагревании. После перекристаллизации соединения из смеси бензол-октан его структура подтверждена методами ИК-спектроскопии и рентгеноструктурного анализа. Атомы висмута имеют бисфеноидную координацию с апикально расположенными атомами кислорода 2-фенилкарборанилкарбоксилатных заместителей. В экваториальной плоскости находят- ся два фенильных лиганда и неподеленная электронная пара. Свой вклад в искажение координационного полиэдра атомов металла вносят большие по объему карбоксилатные лиганды и непо-деленная электронная пара, занимающая большую часть экваториальной плоскости.
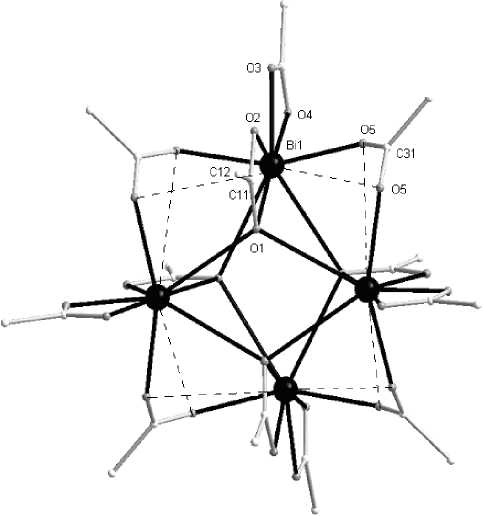
Рис. 1. Строение комплекса Bi[OC(O)C 10 H 15 ] 3
При нагревании эквимолярных количеств трифенилвисмута и бензойной кислоты в течение 2 ч наблюдалось отщепление двух арильных групп с образованием дибензоата фенилвисмута с выходом 44 % [14].
Сведения о деарилировании триарилвисмута кислотами в литературе не систематизированы. Показано, что продуктом реакции трифенилвисмута с 3-метилбензойной кислотой (20 ° С, 2 ч) в хлороформе, независимо от соотношения исходных реагентов, являлся трикарбоксилат висмута. Взаимодействие трифенилвисмута с 3-метилбензойной кислотой (1:2 и 1:3 мольн., толуол, 90 ° С, 2 ч) протекало с образованием студнеобразных систем, которые при удалении растворителя разрушались, но не восстанавливались при растворении полученного твердого остатка в толуоле [15]. Образующиеся в реакциях вещества, содержащие углерод, водород и висмут, имели одинаковую температуру плавления (268 ° С с разл.) и их состав соответствовал формуле трис (3-метилбензоата) висмута, высокая температура плавления которого предполагала для него полимерное строение.
Ph s Bi + 3 НОС(О)С б Н 4 Ме-3 ^ Bi[OC(O)C 6 H 4 Me-3] s + 3 PhH
Образование одного и того же комплекса при различных соотношениях трифенилвисмута и 3-метилбензойной кислоты связано, вероятно, с его устойчивостью, обусловленной возникновением дополнительных взаимодействий. Действительно, по данным РСА, комплекс Bi[OC(O)C6H4Me-3]3 в кристалле представляет собой трехмерный координационный полимер [Bi(O2CC6H4Me-3)3] OT . В отдельно выделенном фрагменте BiХ з хелатные карбоксилатные лиганды координируются c атомом висмута несимметрично. Молекулы трис (3-метилбензоата) висмута связаны в кристалле посредством донорно-акцепторных взаимодействий Bi···O c атомами кислорода карбоксилатных групп соседних молекул, то есть карбоксилатные лиганды являются три-дентатными хелатно-мостиковыми. При эквимолярном соотношении трифенилвисмута и 3-метилбензойной кислоты основным продуктом реакции в растворе толуола является дикарбоксилат фенилвисмута. Его образование также имеет место в гептане при любых мольных соотношениях реагентов. Установлено, что трифенилвисмут реагирует с 2-метилбензойной, 4-метилбензойной, фенилантраниловой и 3-нитробензойной кислотами аналогично.
Найдено, что в присутствии кислорода воздуха взаимодействие трифенилвисмута с 3,4,5-трифторбензойной кислотой в толуоле при любом соотношении реагентов (90 ° С, 2 ч) протекает c образованием крупных кристаллов тетраядерного комплекса Bi4O2[OC(O)C6H2F3-3,4,5] 8 • 2 C 6 H 5 Me (рис. 2) [16]. Поглощение кислорода воздуха в реакции было доказано специальным опытом.
4 Ph 3 Bi + 8 C 6 H 2 F3C(O)OH + О 2 ^ Bi 4 O 2 [ОС(O)C 6 H 2 F3] 8 • 2 С б Н 5 Ме + 8 PhH + 2 Ph-Ph
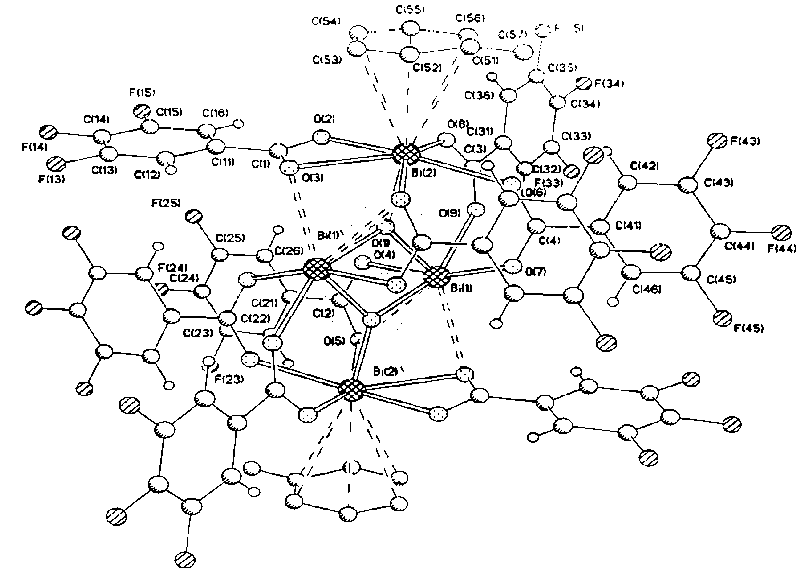
Рис. 2. Строение комплекса Bi 4 O 2 [OC(O)C 6 H 2 F 3 -3,4,5] 8 • 2 С б Н 5 Ме
Четыре атома висмута в комплексе связаны между собой мостиковыми карбоксилатными лигандами и атомами кислорода. Каждый центральный атом Bi соединен с одним из терминальных атомов висмута посредством двух мостиковых карбоксилатных лигандов и мостикового атома О, а с другим терминальным атомом Bi – посредством одного мостикового карбоксилатного лиганда и мостикового атома О. Мостиковые атомы кислорода при этом одновременно связывают два центральных атома висмута. Длины связей между мостиковыми атомами кислорода и атомами висмута (2,083; 2,119 и 2,276 Å) меньше, чем сумма их ковалентных радиусов (2,31 Å [17]). Два терминальных структурно эквивалентных атома висмута имеют в своей координационной сфере еще по одному карбоксилатному лиганду и координированной сольватной молекуле толуола.
Следует отметить, что реакция трифенилвисмута с 3,4,5-трифторбензойной кислотой независимо от соотношения исходных реагентов, проведенная в растворе бензола или п -ксилола при 20 ° С, сопровождалась образованием комплексов аналогичного строения Bi4O2[OC(O)C6H2F3-3,4,5]8 • 2PhH и Bi4O2[OC(O)C6H2F3-3,4,5]8 • 2С6Н 4 Ме2-1,4 [18]. В координационную сферу терминальных атомов Bi последних трех комплексов входят сольватные молекулы растворителя: толуол, бензол и п -ксилол, при этом расстояния Bi— ^ 6 -арен составляют 3,156; 3,024 и 3,131 А соответственно.
Установлено, что в о - и м -ксилоле при температуре 20 ° С взаимодействие трифторбензойной кислоты с трифенилвисмутом независимо от мольного соотношения реагентов приводило к отщеплению двух фенильных групп и образованию бис (3,4,5-трифторбензоата) фенилвисмута димерного строения [15].
2 Ph 3 Bi + 4 C 6 H 2 F 3 C(O)OH ^ {PhBi[OC(O)C 6 H 2 F 3 ] 2 } 2 + 4 PhH
В кристалле молекулы объединены в димеры посредством мостиковых карбоксилатных лигандов (рис. 3). Расстояния Bi-О(1) и Bi-О(2) в цикле составляют 2,620 и 2,304 Å соответственно.
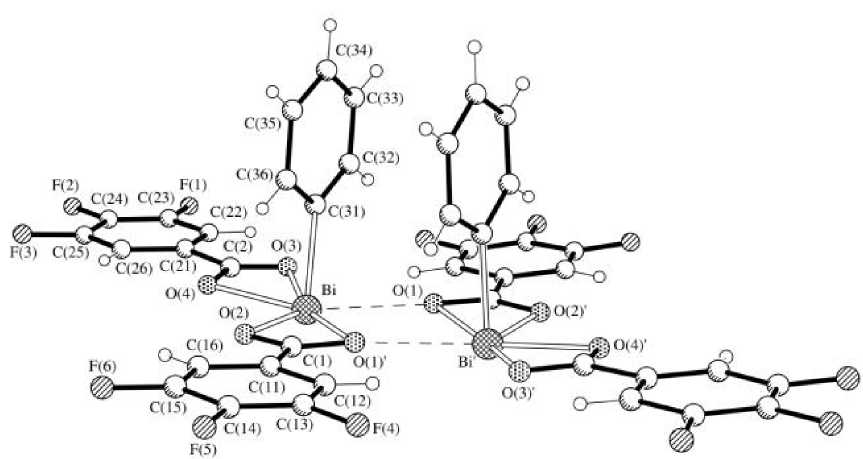
Рис. 3. Строение комплекса {PhBi[ОС(O)С 6 Н 2 F 3 ] 2 } 2
Мостиковые карбоксилатные лиганды являются тридентатными, при этом расстояние Bi···О(1)’ равно 2,674 Å. Кроме того, в координационной сфере каждого атома висмута находятся по одной хелатной карбоксилатной группе (расстояния Bi···О(3) и Bi-О(4) составляют 2,498 и 2,301 Å) и по одному фенильному лиганду (длина связи Bi-С равна 2,223 Å). Отметим, что в хлороформе независимо от соотношения трифенилвисмута и 3,4,5-трифторбензойной кислоты имеет место образование трикарбоксилата висмута.
Изучены реакции дефенилирования трифенилвисмута алифатическими галогенсодержащими карбоновыми кислотами в различных растворителях, при различных температурах и мольных соотношениях реагентов в присутствии кислорода воздуха [19]. Показано, что в хлороформе взаимодействие трифенилвисмута с трихлоруксусной кислотой, независимо от соотношения реагентов и температуры, протекает по одной схеме с отщеплением всех фенильных групп и образованием трикарбоксилата висмута.
CHCl 3
Ph 3 Bi + 3 С1 з С(0)С0Н ^ Bi[OC(O)CCl 3 ] 3 + 3 PhH
Бромуксусная кислота в указанных условиях реагирует с трифенилвисмутом аналогично.
Однако в толуоле при комнатной температуре дефенилирование трифенилвисмута трихлоруксусной кислотой приводит к образованию преимущественно бис (трихлорацетата) фенилвисмута (мольное соотношение реагентов 1:2) и трис (трихлорацетата) висмута (1:3 мольн.).
TolH
Ph 3 Bi + 2 С1 з С(0)С0Н ^ PhBi[OC(O)CCl 3 ] 2 + 2 PhH Ph 3 Bi + 3 С1 з С(0)С0Н ^ Bi[OC(O)CCl 3 ] 3 + 3 PhH
Минорным продуктом в первом случае является трикарбоксилат висмута, а во втором – дикарбоксилат фенилвисмута. При эквимолярном соотношении исходных реагентов также имеет место синтез бис (трихлорацетата) фенилвисмута. Нагревание реакционной смеси до 90 ° С увеличивает выход основного продукта до 91 %. В алифатическом растворителе взаимодействие трифенилвисмута с трихлоруксусной кислотой приводит преимущественно к образованию дикарбоксилата фенилвисмута.
Хлоруксусная и бромуксусная кислоты реагируют с трифенилвисмутом аналогично трихлоруксусной кислоте. Как в гептане, так и в толуоле при нагревании или без нагревания, при различном соотношении исходных реагентов образуется смесь висмутсодержащих карбоксилатов, в которых основным продуктом является дикарбоксилат фенилвисмута (мольное соотношение
1:1, 1:2) или трикарбоксилат висмута (1:3 мольн.). В реакциях дефенилирования трифенилвисмута хлоруксусной и бромуксусной кислотами обнаружены небольшие количества дикарбоксилата трифенилвисмута (до 4 %), образующегося, по-видимому, в результате протекания окислительно-восстановительных реакций.
По данным РСА (рис. 4), хлорацетатные лиганды в бис (хлорацетате) фенилвисмута являются тридентатными хелатно-мостиковыми, связывающими через атомы кислорода соседние молекулы в полимерные цепочки [20]. Атомы хлора в хлорметильных группах симметрично располагаются друг относительно друга, при этом в кристалле пространство напротив фенильной группы заполнено атомом хлора соседней молекулы (расстояние Bi(1) ⋅⋅⋅ Cl(1А) составляет 3.61 Å, что несколько меньше суммы ван-дер-ваальсовых радиусов атомов Bi и Cl (4.20 Å [17]), поэтому координационный полиэдр центрального атома имеет вид искаженной гексагональной бипирамиды.
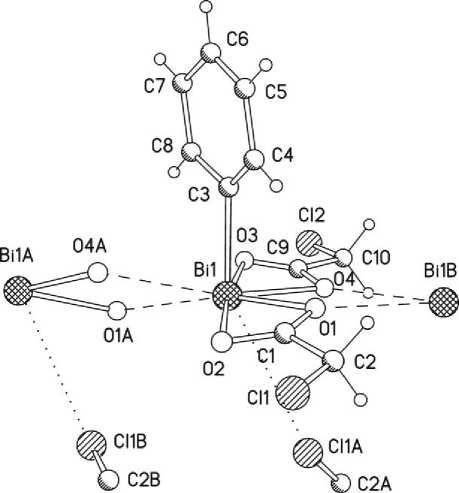
Рис. 4. Строение бис (хлорацетата) фенилвисмута
Таким образом, на небольшом количестве примеров показано многообразие химических реакций триарилвисмута с сульфоновыми и карбоновыми кислотами.
В монографии [3] детально исследовано взаимодействие триарилвисмута с хлористоводородной и бромистоводородной кислотами, которые способны легко отщеплять от атома висмута, в зависимости от соотношения исходных реагентов, один, два или три арильных лиганда, однако реакции триарилвисмута с иодистоводородной кислотой изучены в меньшей мере [21–23]. В настоящей работе исследована реакция трис [(3-трифторметил)фенил]висмута с иодистоводород-ной кислотой в эфире.
Экспериментальная часть
Трис (3-трифторметилфенил)висмут синтезировали по методике [3] из трихлорида сурьмы и 3-трифторметилфенилмагния в эфире. После охлаждения реакционной смеси в водяной бане со льдом и прибавления избыточного количество иодистоводородной кислоты удаляли растворитель, растворяли в эфире. После фильтрования и концентрирования фильтрата получили небольшое количество красно-коричневых кристаллов 1 , которые анализировали методом РСА. Найдено, %: С 26,79; Н 1,34. Для C 14 H 8 BiF 6 I вычислено, %: С 26,84; Н 1,28. Элементный анализ проводили на анализаторе Euro EA3028-НТ.
Рентгеноструктурный анализ проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [24]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [25] и OLEX2 [26]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Длины связей и валентные углы в структуре 1
|
Параметр |
1 |
|
Формула |
C 14 H 8 BiF 6 I |
|
М |
626,09 |
|
Сингония |
Моноклинная |
|
Пр. группа |
P 2 1 / с |
|
a , Å |
9,920(5) |
|
b, Å |
9,047(5) |
|
c, Å |
18,901(9) |
|
α, град. |
90,00 |
|
β, град. |
102,27(2) |
|
γ, град. |
90,00 |
|
V , Å3 |
1657,6(15) |
|
Z |
4 |
|
ρ выч , г/см3 |
2,5086 |
|
µ , мм–1 |
12,548 |
|
F (000) |
1111,9 |
|
Размер кристалла (мм) |
0,3 × 0,29 × 0,06 |
|
Область сбора данных по 2 θ , град. |
6,16–57 |
|
Интервалы индексов отражений |
–16 ≤ h ≤ 17, –15 ≤ k ≤ 15, –32 ≤ l ≤ 32 |
|
Измерено отражений |
59710 |
|
Независимых отражений |
4194 |
|
Переменных уточнения |
222 |
|
GOOF |
1,053 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0825, wR 2 = 0,2477 |
|
R -факторы по всем отражениям |
R 1 = 0,0939, wR 2 = 0,2618 |
|
Остаточная электронная плотность (min/max), e /Å3 |
5,19/–6,52 |
Таблица 2
|
Связь d , Å |
Угол ω , град. |
||
|
Bi(1)–C(11) |
2,234(14) |
C(1)Bi(1)C(11) |
95,1(6) |
|
Bi(1)–C(1) |
2,215(13) |
I(11)Bi(1)C(11) |
92,5(4) |
|
Bi(1)–I(1) |
2,8595(19) |
I(1)Bi(1)C(11) |
86,7(4) |
|
Bi(1)–I(11) |
2,9104(19) |
I(11)Bi(1)C(1) |
86,2(4) |
|
C(12)–C(11) |
1,39(2) |
I(1)Bi(1)C(1) |
88,7(4) |
|
C(12)–C(13) |
1,39(2) |
C(13)C(12)C(11) |
120,9(16) |
|
C(11)–C(16) |
1,38(2) |
C(12)C(11)Bi(1) |
122,9(11) |
|
C(13)–C(14) |
1,36(3) |
C(16)C(11)Bi(1) |
118,7(13) |
|
C(13)–C(17) |
1,42(3) |
C(6)C(1)Bi(1) |
123,1(13) |
|
C(6)–C(1) |
1,38(3) |
C(2)C(1)Bi(1) |
120,0(11) |
|
C(6)–C(5) |
1,35(3) |
F(1)C(7)F(1) |
106(3) |
|
C(3)–C(2) |
1,37(2) |
F(2)C(7)F(1) |
110(3) |
|
C(3)–C(4) |
1,33(3) |
F(2)C(7)F(3) |
105(2) |
|
C(3)–C(7) |
1,51(2) |
F(1)C(7)C(3) |
114,0(18) |
|
F(1)–C(7) |
1,28(3) |
F(6)C(17)F(4) |
104(4) |
|
F(3)–C(7) |
1,30(4) |
F(5)C(17)F(6) |
103(3) |
|
F(2)–C(7) |
1,32(3) |
C(1)C(2)C(3) |
121,7(16) |
|
Преобразования симметрии: 11 – x, ½ + y, ½ - z |
|||
Полные таблицы координат атомов, длин связей и валентных углов соединения 1 депонированы в Кембриджском банке структурных данных (CCDC 2235080; ; .
Обсуждение результатов
В литературе описаны особенности синтеза и строения полиядерных галогенсодержаших комплексов трехвалентного висмута [27 - 32]. Интерес к получению комплексных соединений висмута обусловлен найденными для некоторых из них ценными свойствами: сегнетоактивность, сверхпроводимость, различные по природе фазовые переходы [33].
Именно поэтому нами была сделана попытка осуществить синтез подобного комплекса висмута из трис [(3-трифторметил)фенил]висмута и иодистоводородной кислоты.
Найдено, что деарилирование трис [(3-трифторметил)фенил]висмута иодистоводородной кислотой в мягких условиях (эфир, 20 ° С, 10 ч) приводит к образованию иодида бис [(3-трифторметил)фенил]висмута полимерного строения ( 1 ), в котором молекулы Ar 2 BiI связаны между собой мостиковыми атомами иода (аксиальные углы IBiI составляют 174,7 ° ) (рис. 5).
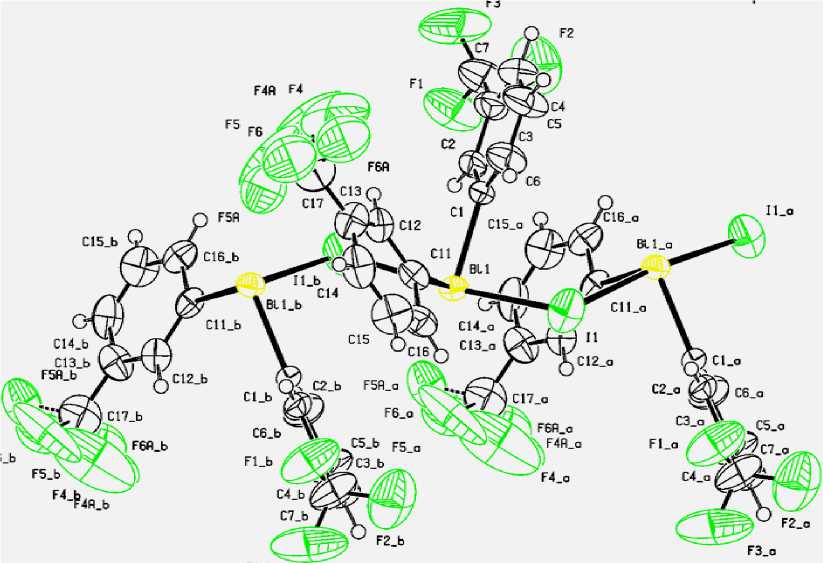
F3_b
Рис. 5. Строение комплекса [(3-CF 3 )C 6 H 4 ] 2 BiI (1)
В экваториальной плоскости при центральном атоме металла располагаются два арильных лиганда (CBiC 95,1(16) ° ) и свободная электронная пара. Длины связей Bi-C составляют 2,215(13) и 2,234(14) А; валентные углы IBiC равны 86,2(4) - 92,5(4)°. Наименьшие межмолекулярные расстояния F(1)∙∙∙F(41) (2,9(6) Å) значительно превышают сумму двух ван-дер-ваальсовых радиусов атомов фтора (2,7 Å).
Заключение
Таким образом, деарилирование трис [(3-трифторметил)фенил]висмута иодистоводородной кислотой в эфире при комнатной температуре протекает с отщеплением арильной группы и образованием иодида бис [(3-трифторметил)фенил]висмута, кристалл которого состоит из полимерных цепочек тригонально-бипирамидальных молекул Ar 2 BiI с аксиальными мостиковыми атомами иода и двух арильных лигандов со свободной электронной парой в экваториальных плоскостях.
Список литературы Особенности строения иодида бис[(3-трифторметил)фенил)]висмута
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2021. Т. 47, № 12. С. 719. DOI: 10.31857/S0132344X21120021
- Шарутин В.В., Мосунова Т.В. // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 3. С. 7. DOI: 10.14529/chem200301
- Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Методы элементоорганической химии // Сурьма, висмут. М.: Наука, 1976. 483 с.
- Deacon G.B., Jackson W.R., Pfeiffer J.M. // Aust. J. Chem. 1984. V. 37. P. 527. DOI: 10.1071/CH9840527
- Deacon G.B., Felder P. W., Domagala M. et al. // Inorg. Chim. Acta. 1986. V. 113, No. 1. P. 43. DOI: 10.1016/S0020-1693(00)86855-3
- Шарутин В.В., Шарутина О.К. // Журнал неорган. химии. 2014. Т. 59, № 10. С. 1356. DOI: 10.7868/S0044457X14100183
- Wrobel L., Rüffer T., Korb M. et al. // Chemistry. A European Journal. 2018. V. 24, No. 62. P. 16630. DOI: 10.1002/chem.201803664
- Andrews P.C., Busse M., Deacon G.B. et al. // Dalton Trans. 2010. V. 39, No. 40. P. 9633. DOI: 10.1039/c0dt00629g
- Gupta A., Kumar S., Singh H.B. // Proc. Natl. Acad. Sci., India, Sect. A Phys. Sci. 2016. V. 86. P. 465. DOI: 10.1007/s40010-016-0301-1
- Шарутин В.В., Шарутина О.К., Житкевич М.В. // Журн. общ. химии. 2000. Т. 70, № 5. С. 737. EDN: RIMYCG
- Калимуллина Л.В., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 4. С. 55. DOI: 10.14529/chem220405
- Шарутин В.В., Егорова И.В., Шарутина О.К. и др. // Журнал неорган. химии. 2008. Т. 53, № 11. С. 1853. EDN: JSJUXP
- Брегадзе В.И., Глазун С.А., Ефремов А.Н., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 1. С. 5. DOI: 10.14529/chem200101
- Peach M.E. // J. Inorg. Nucl. Chem. 1977. V. 39, No. 4. P. 565. DOI: 10.1016/0022-1902(77)80566-6
- Шарутин В.В., Егорова И.В., Иваненко Т.К. и др. // Коорд. химия. 2004. Т. 30, № 5. С. 331. EDN: OWBFEN
- Шарутин В.В., Егорова И.В., Шарутина О.К. и др. // Коорд. химия. 2003. Т. 29, № 12. С. 902. EDN: OOFNUN
- Бацанов С.С. // Журн. неорг. химии. 1991. Т. 36, № 12. С. 3015.
- Шарутин В.В., Егорова И.В., Шарутина О.К. и др. // Коорд. химия. 2005. Т. 31, № 1. С. 4. EDN: HRZYDD
- Егорова И.В. Арильные соединения висмута. Синтез, строение, применение: дис.... д-ра хим. наук: 02.00.08. Нижегородский государственный университет. Н. Новгород. 1998. 282 с.
- ЕгороваИ.В., Шарутин В.В., Иваненко Т.К. и др. // Коорд. химия. 2006. Т. 32, № 5. С. 336. EDN: HTPICD
- Fritzsche A.-M., Scholz S., Krasowska M. et al. // Phys. Chem. Chem. Phys. (PCCP). 2020. V. 22, No. 18. P. 10189. DOI: 10.1039/C9CP06924K
- Dunaj T., Dollberg K., Ritter C. et al. // Eur. J. Inorg. Chem. 2021. V. 2021, No. 9. P. 870. DOI: 10.1002/ejic.202001019
- Ramler J., Hofmann K., Lichtenberg C. // Inorg. Chem. 2020. V. 59, No. 6. P. 3367. DOI: 10.1021/acs.inorgchem.9b03189
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.43.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Шарутин В.В., Егорова И.В., Дорофеева О.А. и др. // Журн. общ. химии. 2002. Т. 72, № 9. С. 1576. EDN: WXQSKQ
- Шарутин В.В., Егорова И.В., Шарутина О.К. и др. // Коорд. химия. 2004. Т. 30, № 12. С. 925. EDN: OVZTHX
- Шарутин В.В., Егорова И.В., Дорофеева О.А. и др. // Журн. неорган. химии. 2004. Т. 49, № 11. С. 1821. EDN: OQOWYT
- Шарутин В.В., Егорова И.В., Левчук М.В. и др. // Коорд. химия. 2002. Т. 28, № 9. С. 654. EDN: ECTWFR
- Шарутин В.В., Егорова И.В., Пакусина А.П. и др. // Журн. общ. химии. 2006. Т. 76, № 8. С. 1393. EDN: HUZRNR
- Шарутин В.В., Егорова И.В., Шарутина О.К. и др. // Коорд. химия. 2008. Т. 34, № 6. С. 469. EDN: ILAKUZ
- Давидович Р.Л., Логвинова В.Б., Ткачев В.В. и др. // Коорд. химия. 1995. Т. 21, № 11. С. 819. EDN: YGKZLD

![Особенности строения иодида бис[(3-трифторметил)фенил)]висмута Особенности строения иодида бис[(3-трифторметил)фенил)]висмута](/file/cover/147246066/osobennosti-stroenija-iodida-bis-3-triftormetil-fenil-vismuta.png)
