Особенности строения пентафенилсурьмы, пента(пара-толил)сурьмы и их сольватов с органическими растворителями
Автор: Шарутин Владимир Викторович, Головин Михаил Сергеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.14, 2022 года.
Бесплатный доступ
Методом рентгеноструктурного анализа определено строение пентафенилсурьмы, пента( пара -толил)сурьмы и их сольватов с бензолом, диоксаном, тетрагидрофураном и ксилолом. По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо K α-излучение, λ = 0,71073 Å, графитовый монохроматор) в кристаллах пентафенилсурьмы Ph5Sb (1) [C30H25Sb, M 507,25; сингония триклинная, группа симметрии Р -1; параметры ячейки: a = 10,286(3), b = 10,510(4), c = 13,590(4) Å; a = 68,29(2)°, β = 79,364(14)°, g = 61,272(12)°; V = 1196,9(7) Å3; Z 2; размер кристалла 0,5×0,38×0,29 мм; интервалы индексов отражений -21 ≤ h ≤ 21, -21 ≤ k ≤ 21, -28 ≤ l ≤ 28; всего отражений 177843; независимых отражений 22858; Rint 0,0446; GOOF 1,067; R 1 = 0,0440, wR 2 = 0,0848; остаточная электронная плотность 1,09/-0,86 e/Å3, сольвата пентафенилсурьмы с бензолом Ph5Sb∙0,5PhH (2) [C66H56Sb2, M 1092,61; сингония триклинная, группа симметрии Р -1; параметры ячейки: a = 13,165(11), b = 14,394(16), c = 15,193(13) Å; a = 90,22(3)°, β = 113,71(2)°, g = 94,23(5)°; V = 2627(4) Å3; Z 2; размер кристалла 0,49×0,38×0,33 мм; интервалы индексов отражений -16 ≤ h ≤ 16, -18 ≤ k ≤ 18, -19 ≤ l ≤ 19; всего отражений 61668; независимых отражений 11757; Rint 0,0395; GOOF 1,022; R 1 = 0,0270, wR 2 = 0,0585; остаточная электронная плотность 0,43/-0,63 e/Å3, сольвата пентафенилсурьмы с диоксаном Ph5Sb∙0,5С4H8O2 (3) [C32H29OSb, M 551,30; сингония триклинная, группа симметрии Р -1; параметры ячейки: a = 10,451(5), b = 10,462(4), c = 13,323(5) Å; a = 75,647(11)°, β = 69,648(19)°, g = 86,300(19)°; V = 1322,8(9) Å3; Z 2; размер кристалла 0,43 × 0,35 × 0,27 мм; интервалы индексов отражений -18 ≤ h ≤ 18, -18 ≤ k ≤ 18, -23 ≤ l ≤ 23; всего отражений 99009; независимых отражений 15054; Rint 0,0505; GOOF 1,036; R 1 = 0,0554, wR 2 = 0,1038; остаточная электронная плотность 1,04/-0,58 e/Å3, пента( пара -толил)сурьмы p -Tol5Sb (4) [C35H35Sb, M 577,38; сингония моноклинная, группа симметрии Р 21/ n ; параметры ячейки: a = 14,472(6), b = 12,084(7), c = 17,009(6) Å; β = 102,934(14)°; V = 2899(2) Å3; Z 4; размер кристалла 0,38×0,26×0,24 мм; интервалы индексов отражений -19 ≤ h ≤ 19, -16 ≤ k ≤ 16, -22 ≤ l ≤ 22; всего отражений 106229; независимых отражений 7238; Rint 0,0296; GOOF 1,081; R 1 = 0,0239, wR 2 = 0,0548; остаточная электронная плотность 0,59/-0,69 e/Å3. Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 2124594 (1), 2121835 (2), 2124972 (3), 2124962 (4); deposit@ccdc.cam.ac.uk; https://www.ccdc.cam.ac.uk).
Пентафенилсурьма, пента(пара-толил)сурьма, сольват, бензол, диоксан, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147237506
IDR: 147237506 | УДК: 546.865+547.47+548.312.5
Текст научной статьи Особенности строения пентафенилсурьмы, пента(пара-толил)сурьмы и их сольватов с органическими растворителями
Строение пентаарильных соединений сурьмы общей формулы Ph5Sb ранее изучалось в [1–6], однако в настоящей работе удалось уточнить строение пентафенилсурьмы ( 1 ) и впервые определить структуры ее сольватов с бензолом ( 2 ) и диоксаном ( 3 ). Не менее важным соединением в химии пентаарильных производных сурьмы является пента( пара -толил)сурьма и ее производные, особенности строения которых обсуждались в [7, 8]. Об использовании пентаарилсурьмы в элементоорганическом синтезе сообщалось в [9].
Молекулы всех структурно охарактеризованных к настоящему времени соединений пятикоординированной сурьмы имеют тригонально-бипирамидальную конфигурацию. Исключением
Химия элементоорганических соединений является пентафенилсурьма, молекула которой обладает структурой искаженной квадратной пирамиды (надо отметить, что до сих пор это один из немногих примеров для соединений элементов 15 группы). Рентгеноструктурные исследования пентафенилсурьмы (1) были проведены несколько раз [3, 4, 6]. Согласно полученным данным, в молекуле 1 расстояния Sb–C изменяются в интервалах 2,05–2,23 Å [3], 2,128–2,225 Å [4] и 2,208–2,212 Å [6], при этом аксиальная связь (2,05 Å [3], 2,128 Å [4], 2,129 Å [6]) значительно короче экваториальных (2,12–2,23 Å [3], 2,202– 2,225 Å [4], 2,208–2,212 Å [6]). Валентные углы CSbC в экваториальной плоскости квадратной пирамиды близки к 90° (84-91° [3], 86,7-88,6° [4] и 86,80-88,91° [6]), их суммы равны 350, 351,5 и 351,42° соответственно. Углы между аксиальным и экваториальными атомами углерода составляют 95-109° [3], 96,4-106,0° [4], 96,47-105,64° [6] и значительно отличаются от теоретического значения, что свидетельствует об искажении квадратной пирамиды в сторону тригональной бипирамиды. Если же принять за основу конфигурации молекулы 1 тригональную бипирамиду, то ее искажение от «идеала» будет более заметным: аксиальный и экваториальные углы будут иметь значения 163; 104; 109; 147° [3]; 164,0; 104,8; 106,0; 149,2° [4] и 164,26; 104,04; 105,64; 150,31° [6], что сильно отличается от теоретических углов 180 и 120° тригональной бипирамиды. Расчеты по методу, предложенному в работе [10], показывают, что вклад тригонально-бипирамидальной структуры в молекуле 1 составляет 26,7 % [3] и 24,7 % [4]. Приблизительная симметрия молекулы 1 С2v, вместо идеальной С4v, которой характеризуется квадратная пирамида, что проявляется в различии углов СэквSbСакс: два из них меньше 100°, а два - больше 100°; существенно различаются также «диагональные» углы в экваториальной плоскости. Плоскости фенильных колец повернуты относительно экваториальной плоскости примерно на 25, 27, 66 и 69°.
Вероятно, конфигурация искаженной квадратной пирамиды получает преимущество по сравнению с конфигурацией тригональной бипирамиды в кристалле соединения 1 в результате совокупного действия межмолекулярных и внутримолекулярных сил. Так, в работе [11] обсуждается роль кулоновских взаимодействий в объяснении «аномальной» структуры пентафенилсурь-мы. Однако авторы [12] на основании данных спектральных методов исследования установили, что и при растворении пентафенилсурьмы в дихлорметане или дибромметане квадратнопирамидальная координация центрального атома в молекуле сохраняется. Поэтому можно полагать, что эффекты кристаллической упаковки не оказывают решающего влияния на выбор возможной структуры при формировании полиэдра вокруг центрального атома в пентафенилсурьме.
Уже отмечалось, что конфигурация тригональной бипирамиды энергетически ненамного более предпочтительна, чем конфигурация квадратной пирамиды. Поэтому неудивительно, что какие-либо факторы могут в определенных случаях привести к тому, что структура квадратной пирамиды будет преобладать над тригональной бипирамидой. Для тяжелых элементов с объёмной валентной оболочкой, где взаимодействие между аксиальными и экваториальными парами сравнительно невелико, разница в энергии между альтернативными структурами становится пренебрежимо малой. В кристаллосольвате с циклогексаном Ph5Sb • 0,5 cyclo- C6H12 молекула пентафе-нилсурьмы характеризуется тригонально-бипирамидальной структурой [5]. Авторы при этом отмечают отсутствие контактов молекулы циклогексана с молекулами пентафенилсурьмы, способных изменить координацию центрального атома. Подчеркивается сравнительно легкая потеря кристаллом молекул циклогексана. Предполагается, что на конечном этапе эксперимента содержание циклогексана в кристалле составило приблизительно 85 % от исходного. Тригонально-бипирамидальное строение имеет и молекула пентафенилсурьмы в ее кристаллосольвате с тетрагидрофураном Ph5Sb • 0,5 C4H8O [6].
Результаты и их обсуждение
Обнаружено, что перекристаллизация пентафенилсурьмы из ацетонитрила не сопровождалась встраиванием его молекул в кристаллическую решетку. Определение структуры 1 в лаборатории ЮУрГУ проведено с большей точностью (R = 4,46 %), чем ранее в работах [1–6].
В то же время показано, что кристаллизация пентафенилсурьмы из бензола и диоксана привела к образованию сольватов пентафенилсурьмы с бензолом Ph5Sb • 0,5 C6H6 (2) и диоксаном Ph5Sb • 0,5 C4H8O2 (3) соответственно, имеющих тригонально-бипирамидальное строение. Температуры разложения сольватов 2 и 3 значительно ниже температуры плавления чистой пентафе- нилсурьмы, что подтверждает потерю кристаллами сольватов молекул бензола и диоксана соответственно.
Показано, что в кристалле 2 (рис. 1) присутствуют две кристаллографически независимые молекулы пентафенилсурьмы (А и В), геометрические характеристики которых [расстояния Sb–C (2,129(3)-2,228(3) А), аксиальный валентный угол CSbC (178,41(9) ° ), экваториальные валентные углы CSbC (119,23(10) ° ; 119,60(12) ° ; 121,17(10) ° ), их сумма 360 ° для молекулы А и соответственно 2,131(3)-2,146(3) А; 179,50(9) ° ; 118,53(10) ° -121,58(11) ° ; 359,99 ° для молекулы В] практически не отличаются от наблюдаемых в сольватах пентафенилсурьмы с циклогексаном [5] и тетрагидрофураном [6].
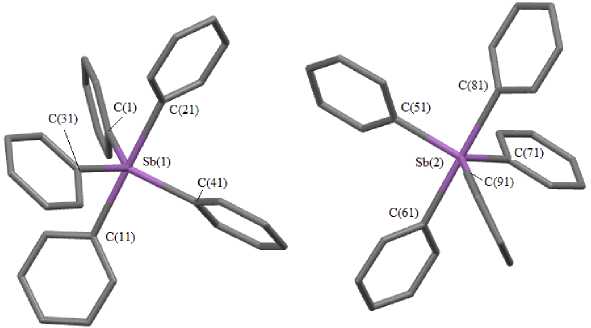
Рис. 1. Строение соединения 2 (молекулы сольватного бензола и атомы водорода не показаны)
В сольвате 3 (рис. 2) расстояния Sb–C составляют 2,143(2)–2,244(2) Å (что несколько больше суммы ковалентных радиусов атомов-партнеров (2,14 Å [13]), аксиальный валентный угол CSbC и экваториальные валентные углы CSbC равны 179,68(8) ° и 118,55(0) ° ; 120,66(9) ° ; 120,79(0) ° соответственно, при сумме экваториальных углов CSbC 360 ° . Отметим, что в кристалле 3 не наблюдаются значительные межмолекулярные и внутримолекулярные контакты, однако расстояния С(44)∙∙∙Н(24) (2,8 Å) несколько меньше суммы ван-дер-ваальсовых радиусов указанных атомов (2,9 Å [14]), что свидетельствует о наличии так называемых «опорных» контактов в кристалле.
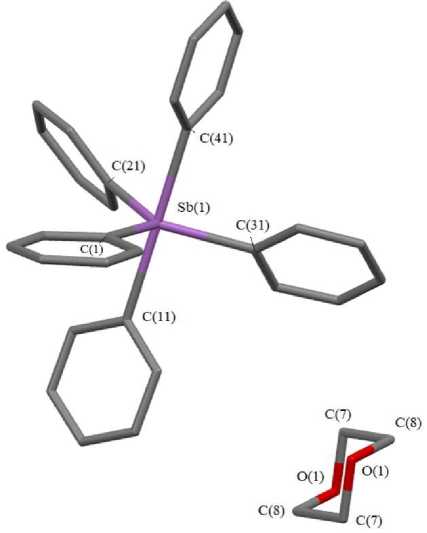
Рис. 2. Строение соединения 3 (атомы водорода не показаны)
Химия элементоорганических соединений
Интервалы длин связей Sb–C 2,130(3)–2,244(2) Å в сольватах 2 и 3 несколько выше аналогичных расстояний в молекулах трифенилсурьмы ( ∼ 2,143 Å [15]), три- п -толилсурьмы ( ∼ 2,143 Å [16]) и трис (4- N,N -диметиламинофенил)сурьмы ( ∼ 2,140 Å [17], трис (5-бром-2-метоксифенил)сурьмы ( ∼ 2,160 Å) [18] и трис (2-метокси,5-хлорфенил)сурьмы ( ∼ 2,169 Å) [19].
Таким образом, определяющим фактором в выборе молекулами координационных полиэдров является энергия решетки кристалла, и достаточно небольших изменений упаковки молекул в кристалле для осуществления перехода квадратно-пирамидальной конфигурации в тригональ-но-бипирамидальную.
Отметим, что перекристаллизация пента( пара -толил)сурьмы ( 4 ) из ацетона, орто -, мета -, пара -ксилолов, бензола, диоксана и тетрагидрофурана не сопровождалась образованием соответствующих сольватов. Во всех случаях из растворов были выделены кристаллы 4 , строение которых было определено с бóльшей точностью (R = 2,4 %), чем ранее [7, 8].
В ИК-спектрах соединений присутствуют полосы, характеризующие арильные лиганды при атоме сурьмы. Кроме того, в ИК-спектре 3 наблюдается полоса при 1121 см –1 , относящаяся к колебаниям C–O в молекулах сольватного диоксана [20–22].
Экспериментальная часть
Элементный анализ на C и H выполнен на элементном анализаторе «Carlo Erba CHNS-O EA 1108». ИК-спектры записаны на ИК Фурье-спектрометре Shimadzu IRAffinity-1S в области 4000– 400 см –1 в матрице KBr. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
Сольват пентафенилсурьмы с бензолом (2). После перекристаллизации пентафенилсурьмы из бензола получили бесцветные кристаллы с с т. разл. 135,5 °С.
ИК-спектр ( ν , см –1 ): 3059, 3035,3011, 1572, 1476, 1429, 1298, 1258, 1182, 1055, 1018, 729, 693, 681, 642, 474, 446. Найдено, %: C 72,32, Н 5,30. Для C 66 H 56 Sb 2 вычислено, %: С 72,46, Н 5,12.
Сольват пентафенилсурьмы с диоксаном (3). После перекристаллизации пентафенилсурь-мы из диоксана получили бесцветные кристаллы с т. разл. 150 °С.
ИК-спектр ( ν , см –1 ): 3059, 3038, 3007, 2961, 2849, 1572, 1475, 1431, 1252, 1121, 1055, 997, 874, 731, 696, 623, 474, 457, 446. Найдено, %: C 69,51, Н 5,37. Для C 32 H 29 OSb вычислено, %: С 69,65, Н 5,26.
Рентгеноструктурный анализ ( РСА ) кристаллов проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [24], OLEX2 [25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)) . Кристаллографические данные и результаты уточнения структур приведены в табл. 1, геометрические характеристики координационного полиэдра атома сурьмы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1-4
|
Параметр |
1 |
2 |
3 |
4 |
|
Формула |
C 30 H 25 Sb |
C 66 H 56 Sb 2 |
C 32 H 29 OSb |
C 35 H 35 Sb |
|
М |
507,25 |
1092,61 |
551,30 |
577,38 |
|
Т , К |
293 |
293 |
293 |
293 |
|
Сингония |
Триклинная |
Триклинная |
Триклинная |
Моноклинная |
|
Пр. группа |
P -1 |
P -1 |
P -1 |
P 2 1 / n |
|
a , Å |
10,286(3) |
13,165(11) |
10,451(5) |
14,472(6) |
|
b, Å |
10,510(4) |
14,394(16) |
10,462(4) |
12,084(7) |
|
c, Å |
13,590(4) |
15,193(13) |
13,323(5) |
17,009(6) |
|
α , град. |
68,29(2) |
90,22(3) |
75,647(11) |
90,00 |
|
β, град. |
79,364(14) |
113,71(2) |
69,648(19) |
102,934(14) |
|
γ , град. |
61,272(12) |
94,23(5) |
86,300(19) |
90,00 |
Окончание табл. 1
|
Параметр |
1 |
2 |
3 |
4 |
|
V , Å3 |
1196,9(7) |
2627(4) |
1322,8(9) |
2899(2) |
|
Z |
2 |
2 |
2 |
4 |
|
ρ (выч.), г/см3 |
1,407 |
1,381 |
1,384 |
1,323 |
|
–1 µ , мм |
1,166 |
1,068 |
1,064 |
0,972 |
|
F (000) |
512,0 |
1108,0 |
560,0 |
1184,0 |
|
Размер кристалла, мм |
0,5 × 0,38 × 0,29 |
0,49 × 0,38 × 0,33 |
0,43 × 0,35 × 0,27 |
0,38 × 0,26 × 0,24 |
|
Область сбора данных по 2 θ , град. |
5,52–96,22 |
5,86–54,74 |
6,4–77,5 |
5,776–56,774 |
|
Интервалы индексов отражений |
–21 ≤ h ≤ 21, –21 ≤ k ≤ 21, –28 ≤ l ≤ 28 |
–16 ≤ h ≤ 16, –18 ≤ k ≤ 18, –19 ≤ l ≤ 19 |
–18 ≤ h ≤ 18, –18 ≤ k ≤ 18, –23 ≤ l ≤ 23 |
–19 ≤ h ≤ 19, –16 ≤ k ≤ 16, –22 ≤ l ≤ 22 |
|
Измерено отражений |
177843 |
61668 |
99009 |
106229 |
|
Независимых отражений |
22858 |
11757 |
15054 |
7238 |
|
R int |
0,0446 |
0,0395 |
0,0505 |
0,0296 |
|
Переменных уточнения |
280 |
614 |
311 |
331 |
|
GOOF |
1,067 |
1,015 |
1,036 |
1,081 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0440, wR 2 = 0,0848 |
R 1 = 0,0269, wR 2 = 0,0583 |
R 1 = 0,0554, wR 2 = 0,1038 |
R 1 = 0,0239, wR 2 = 0,0548 |
|
R -факторы по всем oтражениям |
R 1 = 0,0840, wR 2 = 0,0991 |
R 1 = 0,0433, wR 2 = 0,0652 |
R 1 = 0,1145, wR 2 = 0,1202 |
R 1 = 0,0319, wR 2 = 0,0599 |
|
Остаточная электронная плотность (min/max), e/A3 |
–0,86/1.09 |
–0,51/0,50 |
–0,58/1,04 |
–0,69/0,59 |
Таблица 2
Длины связей и валентные углы в соединениях 2 и 3
|
Связь |
d , Å |
Угол |
ω , град. |
|
2 |
|||
|
Sb(1)–С(41) |
2,130(3) |
С(41)Sb(1)С(11) |
91,87(10) |
|
Sb(1)–С(11) |
2,227(3) |
C(41)Sb(1)C(1) |
119,23(10) |
|
Sb(1)–С(1) |
2,141(3) |
C(41)Sb(1)C(31) |
121,17(10) |
|
Sb(1)–С(31) |
2,143(3) |
C(41)Sb(1)C(21) |
87,55(11) |
|
Sb(1)–С(21) |
2,231(3) |
C(11)Sb(1)С(21) |
178,43(9) |
|
Sb(2)–С(61) |
2,231(3) |
C(1)Sb(1)С(31) |
119,60(12) |
|
Sb(2)–С(81) |
2,233(3) |
C(61)Sb(2)C(81) |
179,49(9) |
|
Sb(2)–С(51) |
2,136(3) |
C(51)Sb(2)C(91) |
119,88(10) |
|
Sb(2)–С(91) |
2,141(3) |
C(51)Sb(2)C(71) |
118,53(10) |
|
Sb(2)–С(71) |
2,146(3) |
C(91)Sb(2)С(71) |
121,58(11) |
|
Преобразования симметрии: 12–x, 2–y, 2–z; 22–x, 1–y, 1–z |
|||
|
3 |
|||
|
Sb(1)–С(31) |
2,155(2) |
С(41)Sb(1)С(11) |
179,68(8) |
|
Sb(1)–С(21) |
2,145(2) |
C(21)Sb(1)C(31) |
120,79(9) |
|
Sb(1)–С(1) |
2,143(2) |
C(1)Sb(1)С(31) |
120,66(9) |
|
Sb(1)–С(11) |
2,244(2) |
C(1)Sb(1)С(21) |
118,55(9) |
|
Sb(1)–С(41) |
2,237(2) |
C(31)Sb(1)С(41) |
89,09(9) |
|
Преобразования симметрии: 12–х, 1–y, –z |
|||
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2124594 для 1, № 2121835 для 2, № 2124972 для 3, № 2124962 для 4; ; .
Химия элементоорганических соединений
Выводы
Перекристаллизацией пентафенилсурьмы из бензола и диоксана получены соответствующие сольваты пентафенилсурьмы (Ph 5 Sb∙0,5PhH и Ph 5 Sb∙0,5С 4 H 8 O 2 ), строение которых установлено рентгеноструктурным анализом. Атомы сурьмы в сольватах имеют искаженную тригонально-бипирамидальную координацию. Уточнено строение пентафенилсурьмы и пента( пара -толил)сурьмы.
Список литературы Особенности строения пентафенилсурьмы, пента(пара-толил)сурьмы и их сольватов с органическими растворителями
- Cambridge Crystallographic Data Center. 2020. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
- Wittig, G. Pentaphenylarsen und Pentaphenylantimon / G. Wittig, K. Clauss // Ann. - 1952. - Bd. 577. - S. 26-39. DOI: 10.1002/JLAC.19525770104
- Wheatley, P.J. An X-ray Diffraction Determination of the Crystal and Molecular Structure of Pentaphenylantimony / P.J. Wheatley // J. Chem. Soc. - 1964. - P. 3718-3723. DOI: 10.1039/JR9640003718
- Beauchamp, A.L. A Reinvestigation of the Crystal and Molecular Structure of Pentaphenylantimony / A.L. Beauchamp, M.J. Bennett, F A. Cotton // J. Am. Chem. Soc. - 1968. - V. 90. - P. 66756680. DOI: 10.1021/ja01026a020.
- Brabant, C. Structure Crystalline du Pentaphenylantimone Dans le Solvate Cycljhexanique (C6H5)5Sb • / C6H12 / C. Brabant, B. Blanck, A.L. Beauchamp // J. Organomet. Chem. - 1974. - V. 82. - P. 231-234. DOI: 10.1016/S0022-328X(00)90360-7.
- Geometry of Pentaphenylantiminy in Solution: Support for a Trigonal Bipyramidal Assignment from X-ray Absorption Spectroscopy and Vibrational Spectroscopic Data / B. Lindquist-Kleissler, M. Weng, P. Le Magueres, G.N. George, T.C. Johnstone // Inorg. Chem. - 2021. - V. 60. - P. 85668574. DOI: 10.1021/acs.inorgchem.lc00496.
- Brabant, C. The Crystal and Molecular Structure of Penta-p-tolylantimony, (p-CH3C6H4)5Sb / C. Brabant, J. Hubert, A.L. Beauchamp // Can. J. Chem. - 1973. - V. 51. - P. 2952-2955. DOI: 10.1139/v73-439.
- Schröder, G. Syntheses, Crystal and Solution Structures, Ligand-exchange and Ligand-coupling Reactions of Mixed Pentaarylantimony I G. Schröder, T. Okinaka, Y. Mimura et al. II Chem. -Eur. J. - 2007. - V. 13. - P. 2517-2529. DOI: 10.1002/chem.200601439
- Шapyтин, В.В. Синтез, pеaкции и сфоение apильных соединений пятивалентной сypьмы I B.В. Шapyтин, А.И. Поддельский, O.K. Шapyтинa II Koopд. химия. - 2020. - Т. 46, № 10. - C. 579-648. DOI: 10.31857/S0132344X20100011.
- Holmes, R.R. Structural Distortions of Cyclic Phosphoranes and the Berry Exchange Coordinate. A Quantitative Description / R.R. Holmes, J.A. Deiters // J. Amer. Chem. Soc. - 1977. - V. 99, № 10. - P. 3318-3326. DOI: 10.1080/10426509508036945.
- Brock, C.P. The Role of Coulombic Interactions in Explaining the Anomalous Structure of Pentaphenylantimony / C.P. Brock // Acta Crystallogr. - 1977. - V. 33A, № 1. - P. 193-197. DOI: 10.1107/S0567739477000394.
- Beattie, I.R. The Shape of Pentaphenylantimony and Pentaphenylarsenic in Solution / I.R. Beattie, K.M.S. Livingston // J. Chem. Soc. Dalton Trans. - 1972. - № 7. - P. 784-786. DOI: 10.1039/DT9720000784.
- Covalent Radii Revisited I B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. - 2008. - Iss. 21. - P. 2832-2838. DOI: 10.1039/B801115J.
- Consistent Van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. - 2009. - V. 113, iss. 19. - P. 5806-5812. DOI: 10.1021/jp8111556.
- Structural Characterization of Some Novel Oxidation Products of Triphenylstibine / E.W.J. Grigsby, R.D. Hart, C.L. Raston, B.W. Skelton, A H. White // Aust. J. Chem. - 1997. - V. 50, № 6. - P. 675-682. DOI: 10.1071/C96042.
- Structure Analysis of Triaryl Derivatives of the Group V Elements. Crystal and Molecular Structure of Tri-p-tolylantimony, C21H21Sb / A.N. Sobolev, I.P. Romm, V.K. Belskii, E.N. Gur'yanova // J. Organomet. Chem. - 1979. - V. 179, № 2. - P. 153-157. DOI:10.1016/S0022-328X(00)95217-3.
- Кристаллическая и молекулярная структура трис(4-К,К-диметиламинофенил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина, О.В. Чагарова // Журн. неорган. химии. - 2012. -Т. 57, № 8. - С. 1149-1154.
- 2-Метокси-5-бромфенильные соединения сурьмы и висмута. Синтез и строение / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина, О.В. Чагарова // Журн. общ. химии. - 2011. -Т. 81, № 10. - С. 1649-1652.
- Шарутин, В.В., Трис(2-метокси-5-хлорфенил)сурьма: синтез и реакции окислительного присоединения / В.В. Шарутин, О.К. Шарутина // Журн. общ. химии. - 2020. - Т. 90, № 10. - С. 15771582. DOI: 10.31857/S0044460X20100133.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е В. Гриненко, А.О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Spectral Database for Organic Compounds, SDBS. Release 2021. National Institute of Advanced Industrial Science and Technology.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/ S0021889808042726.


