Особенности строения продуктов реакций деарилирования пентаарилсурьмы полифункциональными кислотами
Автор: Пупкова Ю.О., Шарутина О.К., Шарутин В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Установлено, что в реакциях с пентафенилсурьмой 2,3-дигидроксибензойная и 5-гидроксипиридин-2-карбоновая кислоты проявляют себя как бифункциональные соединения и образуют биядерные продукты [Ph4Sb]+[Ph4Sb(O,O¢-C6H3COOH-3]- (I), Ph4SbOC(O)C5H3NOSbPh4-4 (II) соответственно. Реакция с 2,3-дигидроксибензойной кислотой протекает с участием только гидроксигрупп, с 5-гидроксипиридин-2-карбоновой кислотой - с участием гидрокси- и карбокси-групп. 2,6-Дигидроксибензойная кислота реагирует с пента( пара -толил)сурьмой только по карбоксильной группе, давая 2,6-дигидроксибензоат тетра( пара -толил)сурьмы p -Tol4SbOC(O)C6H3(OH)2-2,6 (III). Строение соединений I-III охарактеризовано методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, в кристалле I присутствуют катионы [Ph4Sb]+ с искаженной тетраэдрической координацией атома сурьмы (углы CSbC 99,18(14)°-118,07(16)°, связи Sb-С 2,093(4)-2,119(3) Å) и анионы, содержащие пятичленный металлоцикл [SbO2C2], в котором атом сурьмы гексакоординирован ( цис- углы CSbC 91,52(13)°-102,90(13)°; CSbО 85,06(12)°-94,73(13)°, ОSbО 76,22(9)°). Расстояния Sb-О в цикле составляют 2,122(2) и 2,215(2) Å. Связи Sb-С варьируют в интервале 2,175(3)-2,187(4) Å. В молекуле II атомы сурьмы структурно неэквивалентны. Один из атомов, связанный с атомом кислорода гидроксигруппы, имеет координацию искаженной тригональной бипирамиды (аксиальный угол ОSbC 174,5(2)°, углы CSbC в экваториальной плоскости 116,2(3)-120,9(3)°; расстояния Sb-О и Sb-С равны 2,256(5) Å и 2,108(7)-2,174(7) Å соответственно). Координационное число второго атома сурьмы, связанного с кислородом карбоксильной группы, увеличено до 6 за счет координации атома азота пиридинового цикла, расположенного в орто -положении по отношению к карбоксильной группе (расстояние Sb×××N равно 2,402(6) Å). Координационный полиэдр атома - искаженный октаэдр ( цис- углы при атоме сурьмы изменяются в интервале 72,22(19)°-103,6(3)°). Длина связи Sb-О равна 2,194(5) Å, расстояния Sb-С составляют 2,165(7)-2,189(7) Å. В молекуле III координация атома сурьмы - искаженная тригональная бипирамида: аксиальный угол ОSbC 170,30(8)°, углы CSbC в экваториальной плоскости 112,17(9)°-122,09(9)°; связи Sb-О 2,527(2) Å, Sb-С 2,031(2)-2,258(3) Å.
Пентафенилсурьма, пента(пара-толил)сурьма, 2, 3-дигидроксибензойная кислота, 5-гидроксипиридин-2-карбоновая кислота, 2, 6-дигидроксибензойная кислота, деарилирование, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147244633
IDR: 147244633 | УДК: 546.865 | DOI: 10.14529/chem240204
Текст научной статьи Особенности строения продуктов реакций деарилирования пентаарилсурьмы полифункциональными кислотами
В основной части публикаций, посвященных вопросам практического использования органических соединений сурьмы, изучаются различные аспекты их биологической активности [1 - 6]. Специфичность свойств конкретного соединения обусловлена природой лигандов, связанных с атомом сурьмы. Синтез новых органических производных сурьмы с лигандами, проявляющими биологическую активность, позволяет увеличить разнообразие соединений с полезными свойствами.
Известно, что большинство органических ОН-кислот дефенилируют пентафенилсурьму, образуя производные Ph4SbX (X – остаток кислоты) [7–10]. Реакции пентаарилсурьмы с органическими соединениями, содержащими несколько реакционноспособных функциональных групп, представляют интерес, поскольку могут приводить к образованию комплексов сурьмы, в которых лиганд выполняет различные структурные функции. С другой стороны, для органических соеди- нений, содержащих различные функциональные группы с подвижным атомом водорода, реакции с пентаарилсурьмой являются своеобразным показателем их активности в этих группах. Так, при взаимодействии пентафенилсурьмы с сульфосалициловой кислотой сначала происходит замещение атома водорода в сульфонатной группе, при избытке пентафенилсурьмы в реакцию вступает карбоксильная группа, а гидроксильная группа участия в реакции не принимает [11]. При взаимодействии пентафенилсурьмы с салициловой кислотой реагирует только карбоксильная группа [12], в то время как реакция пентафенилсурьмы с 4-гидроксибензойной кислотой в толуоле в присутствии метоксида натрия протекает и по карбоксильной, и по гидроксильной группам [13]. В реакции пентафенилсурьмы с 2,4-дигидроксибензойной кислотой независимо от соотношения реагентов участвуют карбоксильная и пара-гидроксильная группы, образуя биядерный комплекс - 2-гидрокси-4-тетрафенилстибоксибензоат тетрафенилсурьмы, в молекуле которого три-гонально-бипирамидальная координация двух атомов сурьмы искажена в разной степени [14].
Настоящая работа посвящена изучению реакций пентаарилсурьмы с 2,3-, 2,6-дигидроксибензойными и 5-гидроксипиридин-2-карбоновой кислотами, а также установлению особенностей строения полученных продуктов.
Экспериментальная часть
Синтез 3-карбоксикатехолато-О,О’-тетрафенилстиботат тетрафенилстибония [Ph 4 Sb]+[Ph 4 Sb(O,O ′ -C 6 H 3 COOH-3] - ( I ). Cмесь 0,25 г (0,49 ммоль) пентафенилсурьмы и 0,076 г (0,245 ммоль) 2,3-дигидроксибензойной кислоты в 5 мл толуола помещали в стеклянную ампулу и запаивали. Смесь нагревали на водяной бане в течение часа. После охлаждения и медленного удаления растворителя получили 0,445 г (89 %) светло-коричневых кристаллов с т. пл. 210 °С.
ИК-спектр (ν, см–1): 3053, 3032, 2355, 1675, 1570, 1551, 1495, 1470, 1435, 1292, 1260, 1202, 1180, 1161, 1018, 995, 970, 839, 741, 729, 723, 701, 650, 613, 513, 498.
Найдено, %: С 65,21, Н 4,43. Для C 55 H 44 O 4 Sb 2 вычислено, %: C 65,25, H 4,39.
Синтез 5-тетрафенилстибокси-пиридин-2-карбоксилат тетрафенилсурьмы Ph 4 SbOC(O)C 5 H 3 NOSbPh 4 -4 ( II ). Смесь 0,25 г (0,49 ммоль) пентафенилсурьмы и 0,034 г (0,245 ммоль) 5-гидроксипиридин-2-карбоновой кислоты в 5 мл бензола помещали в стеклянную ампулу и запаивали. Смесь нагревали на водяной бане в течение часа, охлаждали до комнатной температуры. Ампулу вскрывали, раствор концентрировали. Получили 0,18 г (72 %) бесцветных кристаллов с т. пл. 189 °С (с разл.). Для C 54 H 43 NO 3 Sb 2 вычислено, %: С 65,00; Н 4,31. Найдено, %: С 64,89; H 4,42. ИК-спектр (ν, см-1 ): 3397, 3273, 3050, 1643, 1570, 1591, 1479, 1429, 1384, 1333, 1273, 1225, 1177, 1161, 1133, 1104, 1065, 1019, 997, 889, 866, 800, 733, 694, 644, 536, 461.
Синтез 2,6-дигидроксибензоата тетра( пара -толил)сурьмы p -Tol 4 SbOC(O)C 6 H 3 (OH) 2 -2,6 (III). Смесь 0,25 г (0,43 ммоль) пента- пара -толилсурьмы и 0,066 г (0,43 ммоль) 2,6-дигидроксибензойной кислоты в 5 мл бензола помещали в стеклянную ампулу и запаивали, затем смесь нагревали на водяной бане в течение часа. Растворитель удаляли, получили 0,22 г (81 %) бесцветных кристаллов с т. пл. 179 °С. Найдено, %: С 65,51; Н 5,26. Для C 35 H 33 O 4 Sb вычислено, %: С 65,72; Н 5,16. ИК-спектр (ν, см-1 ): 3269, 3055, 3019, 2924, 2855, 1643, 1611, 1582, 1491, 1456, 1396, 1350, 1321, 1294, 1250, 1213, 1190, 1157, 1117, 1057, 1032, 1011, 849, 818, 799, 762, 704, 667, 610, 588, 534, 482, 459.
ИК-спектры соединения I - III записывали на ИК-спектрометре Shimadzu IRAffinity-1S в таблетках KBr в области 4000–400 см–1.
РСА кристаллов I - III проведен на дифрактометре D8 Quest фирмы Bruker (Mo K α-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT- Plus [15]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [16] и OLEX2 [17]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур приведены в табл. 1, основные длины связей и валентные углы - в табл. 2.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2013238 (I), № 1974750 (II), № 2070390 (III); или .
Таблица 1
|
Параметр |
I |
II |
III |
|
1 |
2 |
3 |
4 |
|
Формула |
C 55 H 44 O 4 Sb 2 |
C 54 H 43 NO 3 Sb 2 |
C 35 H 33 O 4 Sb |
|
М |
1012,4 |
997,39 |
639,36 |
|
Сингония |
Моноклинная |
Триклинная |
Ромбическая |
|
Пр. группа |
Сс |
Р - 1 |
Pbca |
|
a , Å |
9,826(3) |
10,352(5) |
16,384(8) |
|
b , Å |
17,696(5) |
13,853(8) |
17,705(9) |
|
c, Å |
26,015(7) |
16,591(14) |
20,724(12) |
|
α , град |
90,00 |
84,78(3) |
90,00 |
|
β, град |
93,059(16) |
85,22(3) |
90,00 |
|
γ , град |
90,00 |
83,74(2) |
90,00 |
|
V , Å3 |
4517(2) |
2349(3) |
6011(6) |
|
Z |
8 |
2 |
8 |
|
ρ (выч.), г/см3 |
1,487 |
1,410 |
1,413 |
|
-1 µ , мм |
1,242 |
1,193 |
0,955 |
|
F (000) |
2032,0 |
1000,0 |
2608,0 |
|
Размер кристалла, мм |
0,36 × 0,36 × 0,08 |
0,2 × 0,08 × 0,05 |
0,39 × 0,17 × 0,16 |
|
Область сбора данных по 2 θ , град. |
5,81 - 57 |
5,74 - 53,6 |
5,58 - 66,46 |
|
Интервалы индексов отражений |
- 13 ≤ h ≤ 13, - 23 ≤ k ≤ 23, - 34 ≤ l ≤ 34 |
- 13 ≤ h ≤ 13, - 17 ≤ k ≤ 17, - 20 ≤ l ≤ 20 |
- 29 ≤ l ≤ 29 |
|
Измерено отражений |
53074 |
54699 |
127127 |
|
Независимых отражений |
11399 |
9935 |
9207 |
|
R int |
0,0313 |
0,0844 |
0,0760 |
|
Переменных уточнения |
551 |
541 |
369 |
|
GOOF |
1,031 |
1,090 |
1,026 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0225, w R 2 = 0,0435 |
R 1 = 0,0557, wR 2 = 0,1615 |
R 1 = 0,0378, wR 2 = 0,0714 |
|
R -факторы по всем отражениям |
R 1 = 0,0281, wR 2 = 0,0449 |
R 1 = 0,0984, wR 2 = 0,1913 |
R 1 = 0,0801, wR 2 = 0,0843 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,39/ - 0,38 |
3,33/ - 1,20 |
0,43/ - 0,73 |
Таблица 2
|
Связь \ |
d, Å 1 |
Угол 1 |
ω , град |
|
I |
|||
|
Sb(1) - О(1) |
2,122(2) |
О(1)Sb(1)О(2) |
76,21(7) |
|
Sb(1) - О(2) |
2,215(2) |
О(1)Sb(1)С(1) |
86,98(9) |
|
Sb(1) - С(1) |
2,188(3) |
О(1)Sb(1)С(11) |
102,91(10) |
|
Sb(1) - С(11) |
2,179(2) |
О(1)Sb(1)С(21) |
164,15(8) |
|
Sb(1) - С(21) |
2.176(3) |
О(1)Sb(1)С(31) |
85,82(9) |
|
Sb(1) - С(31) |
2,182(3) |
О(2)Sb(1)С(1) |
85,04(9) |
|
Sb(2) - С(51) |
2,093(3) |
О(2)Sb(1)С(11) |
169,07(8) |
|
Sb(2) - С(61) |
2,119(2) |
О(2)Sb(1)С(21) |
88,01(8) |
|
Sb(2) - С(71) |
2,111(3) |
О(2)Sb(1)С(31) |
85,82(9) |
|
Sb(2) - С(81) |
2,111(2) |
С(1)Sb(1)С(11) |
94,72(10) |
|
О(1) - С(41) |
1,337(3) |
С(1)Sb(1)С(21) |
93,30(10) |
|
О(2) - С(42) |
1,342(3) |
С(1)Sb(1)С(31) |
169,51(10) |
Окончание табл. 2
|
Связь |
d, A |
Угол |
® , град |
|
О(3) - С(47) |
1,301(4) |
С(11)Sb(1)С(21) |
102,91(10) |
|
О(4) - С(47) |
1,229(3) |
С(11)Sb(1)С(31) |
93,27(9) |
|
Sb(2) ⋅⋅⋅ O(4) |
2,683(2) |
С(21)Sb(1)С(31) |
91,52(9) |
|
O(2) ⋅⋅⋅ O(3) |
2,491(3) |
С(51)Sb(2)С(61) |
99,19(10) |
|
H(3) ⋅⋅⋅ O(2) |
1,74 |
С(51)Sb(2)С(71) |
118,10(11) |
|
С(51)Sb(2)С(81) |
117,20(12) |
||
|
С(61)Sb(2)С(71) |
101,27(9) |
||
|
С(61)Sb(2)С(81) |
102,63(10) |
||
|
С(71)Sb(2)С(81) |
114,01(10) |
||
|
II |
|||
|
Sb(1) - О(3) |
2,256(5) |
О(3)Sb(1)C(31) |
174,5(2) |
|
Sb(1) - С(1) |
2,132(7) |
С(1)Sb(1)С(11) |
120,9(3) |
|
Sb(1) - С(11) |
2,136(7) |
С(1)Sb(1)С(21) |
116,2(3) |
|
Sb(1) - С(21) |
2,108(7) |
С(1)Sb(1)С(31) |
120,7(3) |
|
Sb(1) - С(31) |
2,174(7) |
N(1)Sb(2)С(81) |
164,0(2) |
|
Sb(2) - О(1) |
2,194(5) |
С(51)Sb(2)С(61) |
165,8(3) |
|
Sb(2) - С(51) |
2,176(7) |
О(1)Sb(2)С(71) |
164,6(2) |
|
Sb(2) - С(61) |
2,189(7) |
О(1)Sb(2)N(1) |
72,22(19) |
|
Sb(1) - С(1) |
2,132(7) |
С(1)Sb(1)С(11) |
120,9(3) |
|
Sb(1) - С(11) |
2,136(7) |
С(1)Sb(1)С(21) |
116,2(3) |
|
Sb(1) - С(21) |
2,108(7) |
С(1)Sb(1)С(31) |
120,7(3) |
|
Sb(1) - С(31) |
2,174(7) |
N(1)Sb(2)С(81) |
164,0(2) |
|
Sb(2) - О(1) |
2,194(5) |
С(51)Sb(2)С(61) |
165,8(3) |
|
Sb(2) - С(51) |
2,176(7) |
О(1)Sb(2)С(71) |
164,6(2) |
|
Sb(2) - С(61) |
2,189(7) |
О(1)Sb(2)N(1) |
72,22(19) |
|
Связь |
d, A |
Угол |
ω, град |
|
Sb(2) - С(71) |
2,165(7) |
N(1)Sb(2)С(51) |
86,6(2) |
|
Sb(2) - С(81) |
2,169(7) |
O(1)Sb(2)С(51) |
85,1(2) |
|
Sb(2) ⋅⋅⋅ N(1) |
2,402(6) |
O(1)Sb(2)С(81) |
91,9(2) |
|
O(3) - C(44) |
1,297(8) |
C(51)Sb(2)С(81) |
94,0(3) |
|
O(1) - C(46) |
1,292(8) |
C(61)Sb(2)С(81) |
95,4(3) |
|
O(2) - C(46) |
1,208(8) |
N(1)Sb(2)С(71) |
92,4(3) |
|
C(51)Sb(2)С(71) |
93,6(3) |
||
|
C(71)Sb(2)С(81) |
103,6(3) |
||
|
C(61)Sb(2)С(71) |
94,5(3) |
||
|
III |
|||
|
Sb(1) - О(1) |
2,5265(19) |
О(1)Sb(1)C(31) |
170,30(8) |
|
Sb(1) - С(1) |
2,066(2) |
С(1)Sb(1)С(11) |
117,63(10) |
|
Sb(1) - С(11) |
2,031(2) |
С(11)Sb(1)С(21) |
112,17(9) |
|
Sb(1) - С(21) |
2,258(3) |
С(1)Sb(1)С(21) |
122,09(9) |
|
Sb(1) - С(31) |
2,103(2) |
О(1)Sb(1)C(1) |
77,54(8) |
|
O(1) - C(47) |
1,282(3) |
О(1)Sb(1)C(11) |
79,30(8) |
|
O(2) - C(47) |
1,225(3) |
О(1)Sb(1)C(21) |
84,70(7) |
|
O(3) - C(42) |
1,317(3) |
С(1)Sb(1)С(31) |
92,80(9) |
|
O(4) - C(46) |
1,353(3) |
С(11)Sb(1)С(31) |
106,39(10) |
|
H(4) ⋅⋅⋅ O(1) |
1,77 |
С(21)Sb(1)С(31) |
99,99(9) |
|
H(3) ⋅⋅⋅ O(2) |
1,78 |
||
Обсуждение результатов
Дигидроксибензойные кислоты часто используют в химии комплексных соединений как лиганды, демонстрирующие амбидентатные свойства, т. е. возможность координировать на атомы металла различными способами [18 - 22]. Кроме того, известно, что дигидроксибензойные кислоты проявляют биологическую активность, в частности обладают анальгетическим и противовоспалительным действием, и применяются в фармакологии. Производные пиридина имеют широкое применение в качестве биологически активных веществ, в частности, многократно доказана их противоопухолевая активность на различных клеточных линиях [23 - 29]. Введение в соединения сурьмы таких лигандов позволит расширить спектр их практически значимых свойств. Помимо этого, производные сурьмы, в состав которых входит лиганд с гетероатомами, представляют интерес и с фундаментальной точки зрения в связи с возможностью дополнительной координации атома сурьмы на гетероатом (кислород, азот, серу) и повышения координационного числа атома сурьмы до 6 и более [30, 31].
Ранее нами выявлено, что взаимодействие пентафенилсурьмы с 2,4-дигидроксибензойной кислотой независимо от соотношения реагентов протекает с участием карбоксильной и пара- гидроксильной групп и приводит к образованию 2-гидрокси-4-тетрафенилстибоксибензоата тетрафенилсурьмы, в молекуле которого тригонально-бипирамидальная координация двух атомов сурьмы искажена в разной степени [14].
В настоящей работе установлено, что 2,3-дигидроксибензойная кислота при взаимодействии с пентафенилсурьмой проявляет свойства дигидроксибензола, при этом карбоксильная группа остается инертной даже при нагревании реакционной смеси, содержащей избыток пентафенил-сурьмы. Реакция протекает по схеме 1:
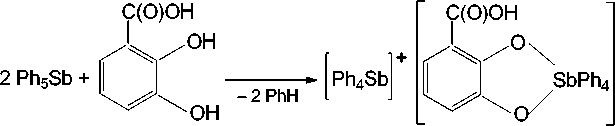
Схема 1. Синтез 3-карбоксикатехолато-О,О’-тетрафенилстиботат тетрафенилстибония ( I )
Кристаллографические данные, параметры эксперимента и уточнения структур I - III
Основные длины связей и валентные углы в соединениях I - III
Продуктом реакции является 3-карбоксикатехолато-О,О’-тетрафенилстиботат тетрафенилстибония ( I ) с выходом 89 %.
При взаимодействии пентафенилсурьмы с 2,3-дигидроксибензойной кислотой можно было ожидать образование и других продуктов, например 3-карбоксикатехолато-О,О’-трифенилсурьмы (схема 2) или 2,3-дигидроксибензоата тетрафенилсурьмы (схема 3).
Ph5Sb +
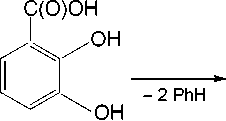
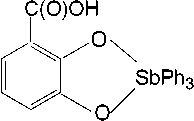
Схема 2. Одно из возможных направлений реакции, приводящее к образованию 3-карбоксикатехолато-О,О’-трифенилсурьмы
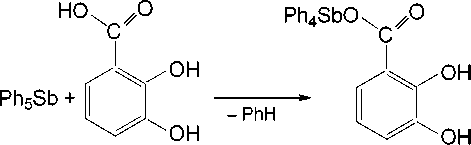
Схема 3. Одно из возможных направлений реакции, приводящее к образованию 2,3-дигидроксибензоата тетрафенилсурьмы
Разрыв двух связей Sb - C в молекуле пентафенилсурьмы при взаимодействии с Н-кислотами встречается крайне редко и в литературе описан на единичных реакциях, например [32], поэтому, как мы считаем, образование 3-карбоксикатехолато-О,О’-трифенилсурьмы является маловероятным.
Нам не удалось выделить, казалось бы, очевидный продукт - 2,3-дигидроксибензоат тетра-фенилсурьмы, даже при мольном соотношении пентафенилсуьмы и кислоты 1:1 без нагревания. Мы предполагаем, что реакция деарилирования начинается с замещения атома кислорода именно в карбоксильной группе: продукт 1 является наиболее энергетически выгодным среди трех возможных (схема 4), но разница в энергии их образования небольшая, что легко преодолевается в условиях нагревания в толуоле:
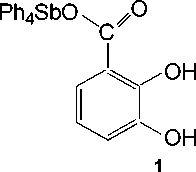
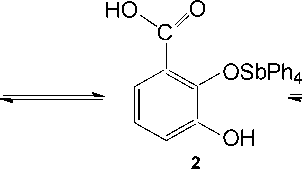
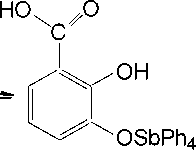
Схема 4. Продукты первой стадии реакции пентафенилсурьмы с 2,3-дигидроксибензойной кислотой
Изомеры 1 - 3 могут снова взаимодействовать с пентафенилсурьмой и продукт реакции перегруппировывается в наименее стерически загруженную форму (соединение I ), выделенную нами.
Согласно данным РСА, координационный полиэдр атома сурьмы Sb(1) в анионе I может быть рассмотрен как искаженный октаэдр (рис. 1). Экваториальная плоскость сформирована двумя атомами кислорода и двумя атомами углерода фенильных лигандов. Другие два атома углерода фенильных лигандов расположены в аксиальных позициях.
Аксиальный угол C(1)Sb(1)C(31) равен 169,51(10)°, в то время, как транс -углы О(1)Sb(1)С(21) и О(2)Sb(1)С(11) в экваторальной плоскости составляют 164,15(8)° и 169,07(8)°. Сумма углов в экваториальной плоскости атома Sb(1) равна 359,99°. Атом Sb(1) отклоняется от средней плоскости [O(1)O(2)C(11)C(21)] на 0,019 Å.
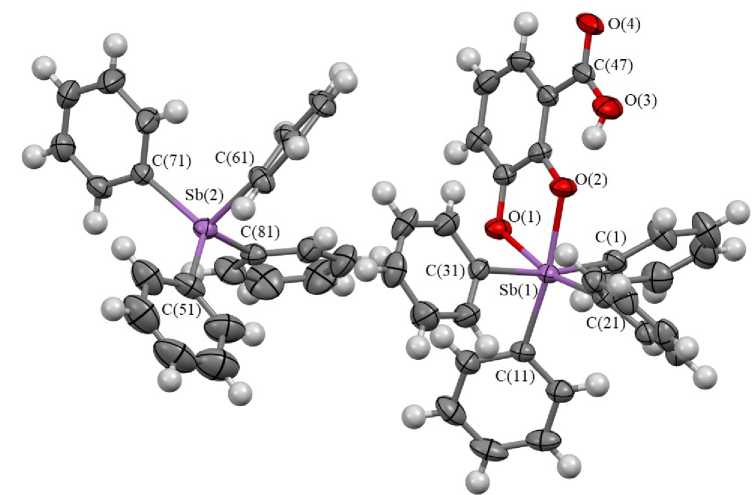
Рис. 1. Строение 3-карбоксикатехолато-О,О’-тетрафенилстиботат тетрафенилстибония (I)
Аксиальные связи Sb(1)-C(1), Sb(1)-C(31) составляют 2,188(3), 2,182(3) Å; экваториальные Sb(1)-C(11), Sb(1)-C(21) - 2,179(2), 2,176(3) А. Расстояния Sb(1)-O(1), Sb(1)-O(2) в катехолат-ном цикле значительно отличаются (2,1216(18), 2,2155(17) Å соответственно), что не характерно для подобных структур. Например, в анионе комплекса [Et 4 N]+[(Cat)SbPh 3 Br]- (Cat = 3,6-ди- трет -бутилкатехолат) длины связей Sb-O (2,036(4), 2,047(3) Å) практически одинаковы [33]. В молекуле 3,5-динитросалицилато-O,O’-тетрафенилстиботата тетрафенилстибония в металлоцикле расстояния Sb-O тоже мало различаются (2,240(4), 2,200(4) Å), несмотря на то, что атомы кислорода, связанные с атомом сурьмы, принадлежат разным функциональным группам - гидроксильной и карбоксильной) [34].
Пятичленный металлоцикл в I имеет практически плоское строение: атомы отклоняются от средней плоскости [Sb(1)O(1)O(2)C(41)C(42)] на 0,026-0,059 Å. Плоскости металлоцикла и ароматического кольца кислоты практически совпадают с экваториальной плоскостью [O(1)O(2)C(11)C(21)], в то время как плоскости фенильных групп [С(11) - С(16)] и [С(21) - С(26)] образуют с ней углы 51,09 ° и 55,85 ° соответственно.
В свободной карбоксильной группе двойная связь С(47)-О(4) (1,229(3) Å) короче одинарной С(47)-О(3) (1,301(4) Å); угол О(3)С(47)О(4) не отличается от теоретического значения 120°.
В анионе имеет место внутримолекулярная водородная связь О(3) - Н(3) --- О(2) со следующими параметрами: расстояния Н(3)∙∙∙О(2) 1,74 Å, О(1)∙∙∙О(2) 2,491(3) Å, Н(3)-О(3) 0.82 Å, угол О(3)-Н(3)-О(2) 150,9°, что обеспечивает дополнительную стабилизацию аниона.
Атом сурьмы Sb(2) в катионе имеет сильно искаженную тетраэдрическую координацию. Углы CSb(2)C отличны от тетраэдрических и составляют 99,19(10)-118,10(11)°. Длины связей Sb(2)-С лежат в интервале 2,093(3)-2,119(2) Å. Искажение тетраэдрической координации атома сурьмы Sb(2) обусловлено координацией на карбонильный атом кислорода: расстояние Sb(2)∙∙∙О(4) равно 2,683(2) Å.
Следует отметить, что в литературе имеются примеры комплексов, в которых 2,3- и 3,4-дигидроксибензойные кислоты связаны с центральным атомом как бидентатные хелатирующие лиганды через атомы кислорода гидроксигрупп [18 - 21 ].
Реакция пентафенилсурьмы с 5-гидроксипиридин-2-карбоновой кислотой протекает с замещением атомов водорода на фрагменты Ph4Sb в гидроксильной и карбоксильной группах и приводит к биядерному соединению – 5-тетрафенилстибокси-пиридин-2-карбоксилату тетрафенил-сурьмы ( II ) с выходом 72 % (схема 5).
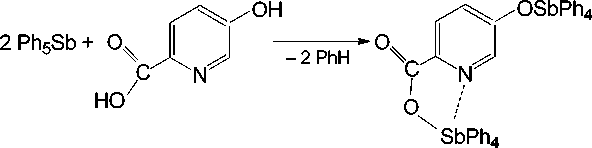
Схема 5. Синтез 5-тетрафенилстибокси-пиридин-2-карбоксилата тетрафенилсурьмы (II)
Карбоксилатный лиганд в молекуле II является мостиковым, связывающим два фрагмента Ph 4 Sb, в которых атомы сурьмы отличаются координационным числом (рис. 2). Атом Sb(1) пен-такоординирован, тригонально-бипирамидальная координация несколько искажена. Аксиальный угол C(31)Sb(1)O(3) равен 174,5(2) ° , сумма улов CSb(1)C в экваториальной плоскости составляет 357,8(3) ° (116,2(3) ° , 120,7(3) ° , 120,9(3) ° ). Углы между аксиальными и экваториальными связями C(31)Sb(1)C и O(3)Sb(1)C изменяются в интервалах 92,8(3) - 96,6(3) ° и 81,9(2) - 87,2(2) ° , поскольку атом сурьмы выходит из экваториальной плоскости в сторону аксиального атома С(31) на 0,183 Å, следствием чего является увеличение соответствующих углов по сравнению с идеальным значением. Аксиальная связь Sb(1) - C(31) (2,174(7) А) длиннее трех экваториальных связей Sb(1) - C(1,11,21) (2,132(7), 2,136(7), 2,108(7) А). Расстояние Sb(1) - O(3) равно 2,256(5) А.
Атомы Sb(2) имеют искаженную октаэдрическую координацию с окружением [С4ОN]. Повышение координационного числа обусловлено дополнительным взаимодействием Sb(2)∙∙∙N(1), где N – атом азота пиридинового цикла, приводящим к формированию пятичленного металло- цикла. В октаэдре транс-углы С(51)Sb(2)C(61), C(81)Sb(2)N(1) и С(71)Sb(2)O(1) равны 165,8(3)°, 164,0(2)° и 164,6(2)°. Сумма углов в плоскости [ONCC] равна 360°, атом сурьмы отклоняется от средней плоскости на 0,031 Å.
Длины связей Sb(2)-C лежит в диапазоне 2,165(7)-2,189(7) Å. Интересно отметить, что связи Sb(2)-С (среднее значение 2,174(7) Å) длиннее, чем Sb(1)-С (2,138(7) Å), а расстояние Sb(2)-O(1) (2,194(5) А) существенно короче Sb(1)-O(3). Связи С(46) - О(1) и С(46) - О(2) (1,292(8) и 1,208(8) Å) соответствуют значениям одинарной и двойной связей. Расстояние Sb(2)∙∙∙N равно 2,402(6) Å, что близко к аналогичному значению в молекуле 2,5-пиридиндикарбоксилата бис (тетрафенилсурьмы) (2,412(4) Å) [35], но значительно меньше аналогичных координационных связей в известных сурьмаорганичесих производных 2-пиридинкарбоновой кислоты (2,602(1) и 2,665(3) Å [36, 37]).
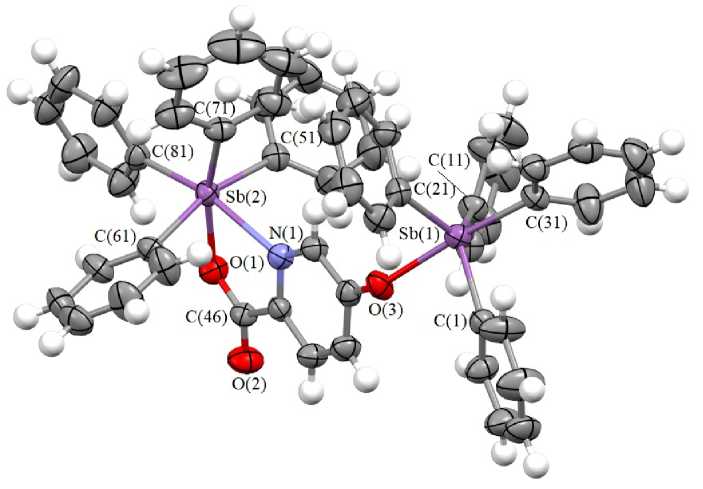
Рис. 2. Строение 5-тетрафенилстибокси-пиридин-2-карбоксилата тетрафенилсурьмы (II)
Установлено, что взаимодействие пента( пара- толил)сурьмы с 2,6-дигидроксибензойной кислотой протекает только по карбоксильной группе даже при избытке пента( пара- толил)сурьмы с образованием 2,6-дигидроксибензоата тетра( пара- толил)сурьмы ( III ) с выходом 81 % (схема 6).
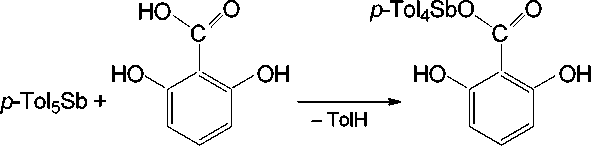
Схема 6. Синтез 2,6-дигидроксибензоата тетра( пара -толил)сурьмы (III)
Тригонально-бипирамидальная координация атома сурьмы в III сильно искажена, о чем свидетельствуют значения валентных углов (рис. 3). Так, углы СSbС в экваториальной плоскости изменяются в интервале 112,17(9) °- 122,09(9) ° , а их сумма (351,89 ° ) значительно меньше 360 ° . Углы между аксиальными и экваториальными связями C(31)SbC(1,11,21) больше 90 ° (92,80(9) ° , 106,39(10) ° , 99,99(9) ° , а углы O(1)SbC(1,11,21) меньше этого значения (77,54(8) ° , 79,30(8) ° , 84,70(7) ° ). Атом сурьмы выходит из экваториальной плоскости в сторону атома С(31) на 0,350 А.
Особенностью структуры можно считать наличие необычно длинной связи Sb-С(21) в экваториальном положении (2,258(3) Å) по сравнению с двумя другими экваториальными связями
Sb-С(1) и Sb-С(11) (2,066(2) и 2,031(2) Å), а также аксиальной связью Sb-С(31) (2,103(2) Å). Расстояние Sb-O(1) (2,5265(19) Å) значительно больше аналогичных связей в I и II . В карбоксильной группе связи С(47) - О(1) и С(47) - О(2) практически выровнены (1,282(3) и 1,225(3) Å), поскольку отличаются только на 0,057 Å, в то время как в I и II разница в значениях этих связей составляет 0,072 и 0,084 Å соответственно.
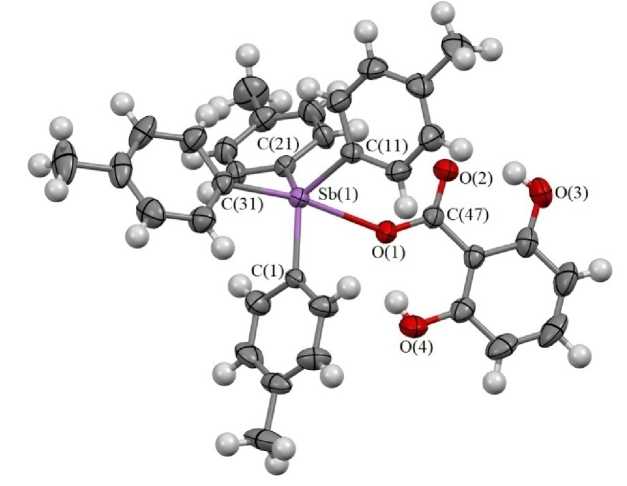
Рис. 3. Строение 2,6-дигидроксибензоата тетра( пара -толил)сурьмы (III)
Отметим, что расстояние Sb-O в 2,6-дигидрокисибензоате тетрафенилсурьмы равно 2,604(4) Å, а связи С - О в карбоксильной группе различаются только на 0,01 Å [38].
Учитывая сильное искажение координации атома сурьмы и большое расстояние Sb-O(1), структуру III можно рассматривать как тесную ионную пару катиона тетра( пара -толил)стибония и координированного через атом кислорода 2,6-дигидроксибензоат-аниона. Устойчивость 2,6-дигидроксибензоат-аниона обусловлена образованием двух внутримолекулярных водородных связей с участием гидроксильных групп (расстояния Н(4)∙∙∙О(1) 1,78 Å, О(4)∙∙∙О(1) 2,463(3) Å, Н(4)-О(4) 0,75 Å, угол О(4)-Н(4)-О(1) 153(4)°; Н(3)∙∙∙О(2) 1,78 Å, О(2)∙∙∙О(3) 2,492(3) Å, Н(3)-О(3) 0,82 Å, угол О(3)-Н(3)-О(2) 145(3)°), наличие которых способствует делокализации отрицательного заряда.
В ИК-спектрах производных карбоновых кислот наиболее информативными являются полосы поглощения карбонильной группы с частотами 1675 ( I ), 1643 ( II ), 1616 ( III) cм-1, при этом в спектрах II и III их положение смещено в область низкочастотных колебаний по сравнению со спектрами соответствующих кислот (1721, 1726 cм-1 соответственно), в то время как в спектре I положение полосы поглощения карбонильной группы практически не изменяется (в спектре 2,3-дигидроксибензойной кислоты указанная полоса расположена при 1682 см - 1). Также в спектрах присутствуют полосы, характеризующие колебания связей Sb-C и Sb-O: 498 и 613 см - 1 ( I ), 461 и 536 см - 1 ( II ), 482 и 534 см - 1 ( 3 ), что соответствует литературным данным [39, 40].
Заключение
Таким образом, установлено, что в реакциях пентарильных соединений сурьмы дигидрокси-бензойные кислоты реагируют либо как моно-, либо как бифункциональные соединения в зависимости от расположения функциональных групп в исходной кислоте, при этом участие в реакции могут принимать: а) только карбоксильная группа; б) две гидроксильных группы; в) карбоксильная и гидроксильная группы. При взаимодействии пентафенилсурьмы с 5-гидроксипиридин-2-карбоновой кислотой активными являются и карбоксильная, и гидроксильная группы. В синтезированных арильных производных сурьмы с полифункциональными лигандами координационное число атома металла изменяется от 4 до 6.
Список литературы Особенности строения продуктов реакций деарилирования пентаарилсурьмы полифункциональными кислотами
- Li J.-S., Ma Y.-Q., Cui J.-R. et al. // Appl. Organometal. Chem. 2001. V. 15. No. 7. P. 639. DOI: 10.1002/aoc.491.
- Ma Y., Li J., Xuan Z. et al. // J. Organometal. Chem. 2001. V. 620. No. 2. P. 235. DOI: 10.1016/S0022-328X(00)00799-3.
- Liu R.-C., Ma Y.-Q., Yu L. et al. // Appl. Organometal. Chem. 2003. V. 17. No. 9. P. 662. DOI: 10.1002/aoc.491.
- Artem'eva E.V., Duffin R., Munuganti S. et al. // J. Inorgan. Biochem. 2022. V. 234. 111864. DOI:10.1016/j.jinorgbio.2022.111864.
- Artem'eva E.V., Duffin R., Munuganti S. et al. // Polyhedron. 2022. V. 213. 115627. DOI:10.1016/j.poly.2021.115627.
- Mushtaqa R., Raufa M.K., Bond M. et al. // Appl. Organometal. Chem. 2016. V. 30. P. 465. DOI:10.1002/aoc.3456.
- Schmidbaur H., Mitschke К.Н. // Angew. Chem. 1971. Bd. 83. Р. 149. DOI: 10.1002/ange.19710830414.
- Sharutin V.V., Sharutina O.K., Gubanova Yu.O. et al. // J. Organometal. Chem. 2015. V. 798. P. 41. DOI:10.1016/j.jorganchem.2015.09.002.
- Галиуллина Д.Р., Ефремов А.Н. // Вестник ЮУрГУ. Сер. «Химия». 2022. Т. 14, № 3. С. 23. DOI: 10.14529/chem220303.
- Ефремов А.Н., Шарутин В.В. // Вестник ЮУрГУ. Сер. «Химия». 2021. Т. 13, №. 1. С. 47. DOI: 10.14529/chem210105.
- Шарутин В.В., Шарутина О.К., Панова Л.П. и др. // Коорд. химия. 1997. Т. 23, № 7. С. 513.
- Sharutin V.V., Sharutina O.K., Pakusina A.P. et al. // Russ. J. General Chem. 1997. V. 67, No. 9. С. 1443. EDN: LELBCF.
- Quan L., Yin H., Cui J. et al. // J. Organometal. Chem. 2009. V. 694. P. 3683. DOI: 10.1016/j.jorganchem.2009.07.041.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Вестник ЮУрГУ. Серия «Химия». 2017. Т. 9, № 4. С. 56. DOI: 10.14529/chem170409.
- Bruker, SMART and SAINT-plus. Versions 5.0. Data Collection and Processing Software for the SMART System, Bruker AXS Inc, Madison, Wisconsin, USA, 1998.
- Bruker, SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data, Bruker AXS Inc, Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI:10.1107/S0021889808042726.
- Anbalagan V., Srivastava T.S. // Polyhedron. 1994. V. 13. No. 13. P. 291. DOI: 10.1016/S0277-5387(00)86605-X.
- Bell C.F., Gallagher B.C., Lott K.A.K. et al. // Polyhedron. 1991. V. 10, No. 6. P. 613. DOI: 10.1016/S0277-5387(00)83620-7.
- Gerega K., Kozłowski H., Kiss T. et al. // Inorganica Chimica Acta. 1987. V. 138, No. 1 P. 31. DOI:10.1016/S0020-1693(00)81177-9.
- Griffith W.P., Nogueira H.1.S., Parkin B.C. et al. // J. Chem. Soc., Dalton Trans. 1995. No. 1. P. 1775. DOI: 10.1039/DT9950001775.
- Monteiro B., Gago S., Paz F.A.A. et al. // Inorgan. Chem. 2008. V. 47, No. 19. P. 8674. DOI: 10.1021/ic800420a.
- Marinescu M. // Int. J. Pharm. and Bio Sci. 2017. V. 8, No. 2. P. 338. DOI: 10.22376/ijpbs.2017.8.2.p338-355.
- Cai Z.W., Wei D., Schroeder G.M. et al. // Bioorg. Med. Chem. Lett. 2008. V. 18, No. 11.P. 3224. DOI:10.1016/j.bmcl.2008.04.047.
- Hranjec M., Sovic I., Ratkaj I. et al. // Eur. J. Med. Chem. 2013. V. 59. P. 111. DOI: 10.1016/j.ejmech.2012.11.009.
- Hu Y.-G., Zheng A.-H., Li G.-J. et al. // J. Heterocyclic Comp. 2014. V. 51, No. S1. P. E84. DOI:10.1002/chin.201509222.
- Shyyka O., Pokhodylo N., Finiuk N. et al. // Sci. Pharm. 2018. V. 86, No. 3. P. 28. DOI: 10.3390/scipharm86030028.
- Becan L., Wagner E. // Med Chem Res. 2013. V. 22. No. 5. P. 2376. DOI: 10.1007/s00044-012-0231-7.
- Shawali A.S., Sherif S.M., Darwish M.A.A. et al. // Arch. Pharm. Res. 2010. V. 33, No. 1. P. 55. DOI: 10.1007/s12272-010-2224-8.
- Ma C., Zhang Q., Sun J. et al. // J. Organomet. Chem. 2006. V. 691, No. 11. P. 2567. DOI: 10.1016/j.jorganchem.2006.01.049.
- Wang G., Lu Y., Yu L. // Acta Crystallogr. 2005. V. 61E, No. 4. P. m649. DOI: 10.1107/S1600536805006446.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Вестник ЮУрГУ. Серия «Химия». 2017. Т. 9, № 4. С. 56. DOI: 10.14529/chem170409.
- Шарутин В.В., Молокова О.В., Шарутина О.К. и др. // Коорд. химия. 2005. Т. 31, № 3. С. 172. EDN: HRZYND.
- Poddelґskii A.I., Ilyakina E.V., Smolyaninov I.V. et al. // Russ. Chem. Bull. 2014. V. 63, No. 4. Р. 923. DOI: 10.1007/s11172-014-0529-3.
- Pupkova Yu.O., Sharutin V.V., Sharutina O.K. et al. // Mendeleev Communications. 2022. V. 32, No. 3. P. 377. DOI: 10.1016/j.mencom.2022.05.028.
- Губанова Ю.О., Шарутин В.В., Шарутина О.К. и др. // Журн. общ. химии. 2020. Т. 90, № 9. С. 1407. DOI: 10.31857/S0044460X20090127.
- Domagala M., Huber F., Preut H. // Ztschr. Anorg. und Allg. Chem. 1990. V. 582, Nо. 1. P. 37. DOI:10.1002/zaac.19905820107.
- Chaudhari K.R., Jain V.K, Sagoria V.S. et al. // J. Organomet. Chem. 2007. V. 692, Nо. 15. P. 4928. DOI:10.1016/j.jorganchem.2007.07.033.
- Sharutin V.V., Sharutina O.K., Gubanova Yu.O. et al. // Inorg. Chim. Acta. 2019. V. 494. P. 211. DOI: 10.1016/j.ica.2019.05.029.
- Sharma P.K., Sharma R.K., Rai A.K. et al. // Main Group Metal Chemistry. 2011. V. 27, No. 1. P. 51. DOI: 10.1515/MGMC.2004.27.1.51.
- Singal K.S. // Heteroatom Chemistry. 2008. V. 19, No. 7. P. 688. DOI: 10.1002/hc/20498.


